不同牧草種子萌發酶活力研究
李興美 楊盼盼 何 勇* 陳 茜 鐘孟淮
(1.貴州農業職業學院,貴州 貴陽 551400;2.貴州師范學院,貴州 貴陽 550018)
酶在生物新陳代謝中參與催化物質轉化過程,不同環境對酶活性具有不同影響。如低溫對淀粉酶和過氧化物酶活性影響不大,高溫可使淀粉酶和過氧化物酶活性增強[1]。米槁種子通過不同溫度層積處理,其過氧化物酶(POD)、超氧化物歧化酶(SOD)、過氧化物酶(CAT)活性整體表現出先升后降的動態變化[2],耐高溫胞外酶可促進天麻種子酶活性升高,從而促進天麻種子萌發[3]。人工模擬干旱脅迫植物,在1~14 d,3種綠化植物酶活性呈上升趨勢,在14~20 d,3 種綠化植物酶活性呈下降趨勢[4]。不同植物中SOD、CAT、乙醇脫氫酶(ADH)活性呈規律性分布[5]。研究表明,重金屬不但影響土壤中酶活性,對植物酶活性也有較大影響,如低濃度鉻和銅可促進花生種子萌發,高濃度鉻和銅可抑制花生種子萌發[6]。土壤被鎘污染后,水稻土壤脲酶、過氧化氫酶以及土壤過氧化物酶活性均受到抑制,當采用超順磁性微納米Fe3O4-磷酸鹽功能化材料(MFH)修復后,3 種酶活性均提高,水稻機體中酶活性也受到影響[7],表明酶活性直接影響農作物生產效益。本研究主要研究紫花苜蓿、黑麥草、苦蕎、甜蕎等種子萌發過程中酶活力,探索種子萌發酶活性的最佳控制條件,從而提高牧草的生產力,為貴州省畜牧產業發展、生態農業的發展提供參考。
1 材料與方法
1.1 供試地點
試驗在貴州農業職業學院實驗室進行。
1.2 供試材料
紫花苜蓿和黑麥草的種子由貴州省畢節市畜牧局提供,甜蕎和苦蕎種子由貴州省紫云縣畜牧服務中心提供。
1.3 試驗儀器
恒溫水浴鍋(常州市億能實驗儀器廠)、TG1650-WS 臺式高速離心機(湖南凱達科學儀器有限公司)、恒溫培養箱(青島精誠儀器儀表有限公司)、紫外分光光度計(上海奧析科學儀器有限公司)、電子天平(上海元析儀器有限公司)。
1.4 試驗試劑
3,5-二硝基水楊酸(上海展云化工有限公司),麥芽糖、檸檬酸鈉、檸檬酸、可溶性淀粉(天津市致遠化學試劑有限公司),氫氧化鈉(川東化工集團),酒石酸鉀鈉(成都金山化學試劑有限公司)。
1.5 試驗方法
1.5.1 種子預處理
種子預處理采用5 種方式,即常溫浸泡10 h,冷卻2 h (對照組);初始水溫27 ℃浸種10 h,冷卻2 h(T1組);初始水溫30 ℃浸種10 h,冷卻2 h(T2組);初始水溫33 ℃浸種10 h,冷卻2 h(T3組);初始水溫36 ℃浸種10 h,冷卻2 h(T4組)[8]。采用恒溫箱進行種子萌發試驗,定時補加蒸餾水,保持濾紙濕潤[9],每種處理重復3次。
1.5.2 種子萌芽
培養皿內鋪兩層90 mm 濾紙,將不同溫度預處理的牧草種子取30粒均勻擺放,置于25 ℃的光照培養箱中進行發芽,每天光照12 h,相對濕度為(75±1)%。從第2 d開始計算種子發芽率。
1.5.3 麥芽糖標準曲線的制作
1.5.3.1 標準曲線的制作原理
種子萌發時淀粉酶水解后活性增強,將淀粉分解成小分子糖類。其中α-淀粉酶水解淀粉α-1,4-糖苷鍵,將淀粉分解為麥芽糖、麥芽三糖和糊精等還原性糖,β-淀粉酶水解非還原端第二個α-1,4-糖苷鍵,產物為麥芽糖和一部分糊精糖化,為種子幼苗生長提供能量來源。在測定酶的過程中將其中之一鈍化,測定α-淀粉酶活力,在非鈍化條件下測定總淀粉酶活力。
1.5.3.2 標準曲線的制作
取7 支帶有塞和刻度的試管(均消毒)進行編號,加入試劑,搖勻,放入沸水浴中煮沸5 min,取出,流水冷卻,加蒸餾水定容至20 mL。以1 號管作為空白調零點,在540 nm波長下比色測定吸光度。以麥芽糖含量為X軸,吸光度為Y軸,繪制標準曲線,見圖1。
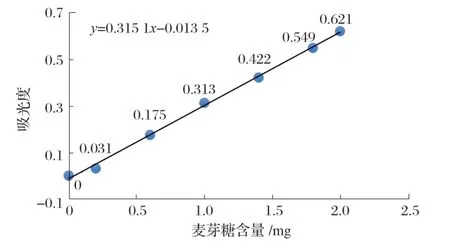
圖1 標準曲線
1.6 淀粉酶活力測定
在標準曲線上查出相應的麥芽糖含量(mg),計算酶活力[10]。
1.7 數據統計與分析
試驗數據采用SPSS 25.0軟件進行分析,一般線性單變量雙因素統計數據,LSD 法進行多重比較。結果以“平均值±標準差”,P<0.05表示差異顯著。
2 結果與分析
2.1 黑麥草種子萌發酶活力(見表1)
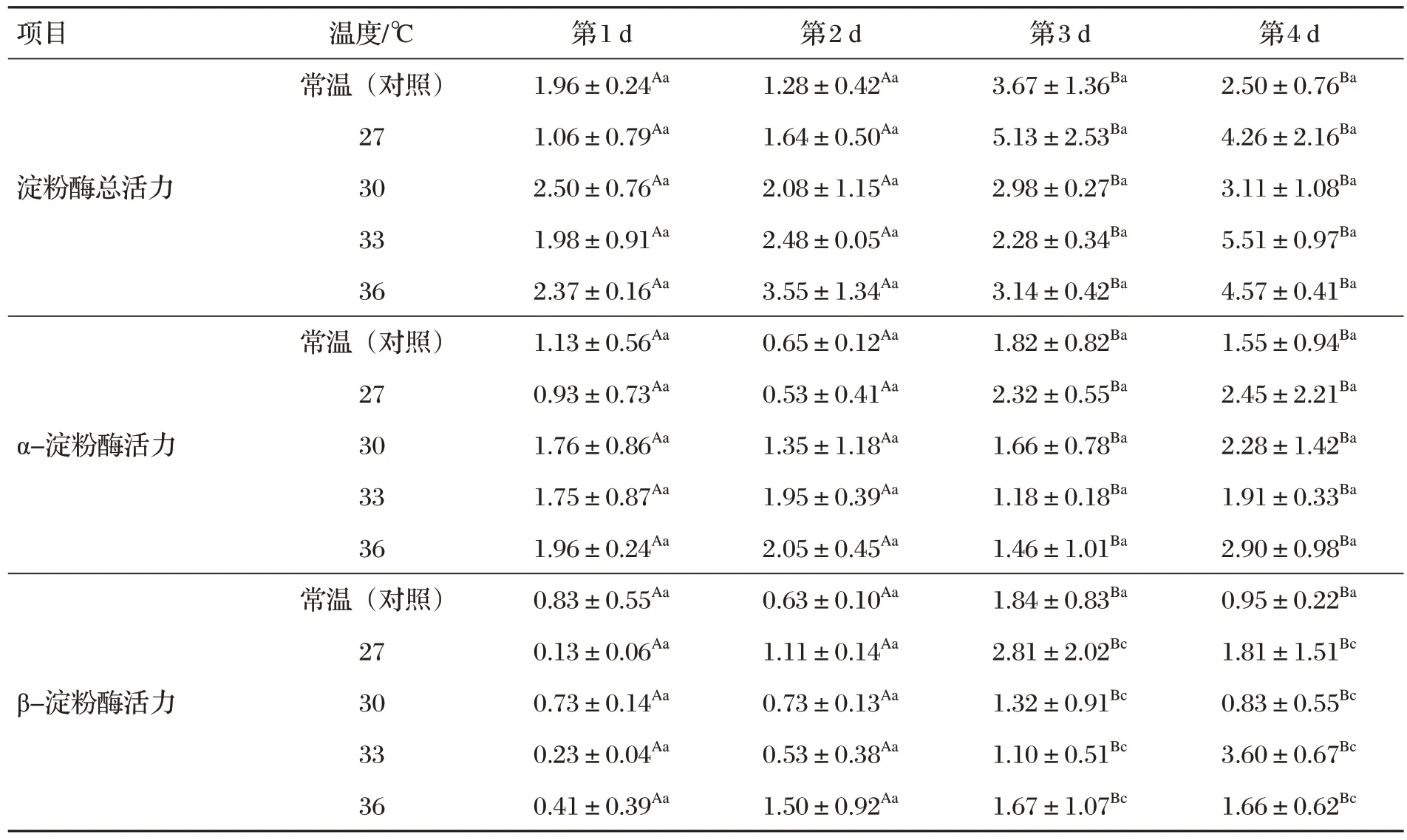
表1 黑麥草種子萌發酶活力 單位:U
由表1 可知,黑麥草種子酶淀粉酶總活力、α-淀粉酶活力和β-淀粉酶活力,萌發第1 d與第3、4 d之間酶活力變化顯著(P<0.05),第2 d 與第3、4 d 之間變化顯著(P<0.05);第1、2 d 之間變化不顯著(P>0.05),第3、4 d之間變化不顯著(P>0.05)。不同溫度對黑麥草種子酶總活力、α-淀粉酶活力、β-淀粉酶活力影響不顯著(P>0.05)。
2.2 紫花苜蓿種子萌發酶活力(見表2)

表2 紫花苜蓿種子萌發酶活力 單位:U
由表2可知,不同萌發天數、不同溫度處理,黑麥草種子淀粉酶總活力差異均不顯著(P>0.05)。不同萌發天數黑麥草種子的α-淀粉酶活力變化不顯著(P>0.05);不同萌發天數在30、33、36 ℃的α-淀粉酶活力均顯著高于27 ℃(P<0.05)。不同萌發天數黑麥草種子的β-淀粉酶活力變化不顯著(P>0.05);不同萌發天數黑麥草種子在30 ℃的β-淀粉酶活力均顯著高于27、33、36 ℃(P<0.05)。
2.3 苦蕎麥種子萌發酶活力(見表3)

表3 苦蕎麥種子萌發酶活力 單位:U
由表3 可知,不同萌發天數間苦蕎麥種子的淀粉酶總活力變化不顯著(P>0.05);萌發天數第1、3 d,苦蕎麥種子36 ℃淀粉酶總活力顯著低于27、30、33 ℃(P<0.05)。不同萌發天數的苦蕎麥種子α-淀粉酶活力變化不顯著(P>0.05)。不同溫度處理,27 ℃與36 ℃、30 ℃與33 ℃之間苦蕎麥種子α-淀粉酶活力的變化不顯著(P>0.05),萌發第1、2、3 d,36 ℃苦蕎麥種子α-淀粉酶活力顯著低于30、33 ℃(P<0.05)。不同萌發天數的苦蕎麥種子β-淀粉酶活力變化不顯著(P>0.05),萌發第2、3 d,33 ℃苦蕎麥種子β-淀粉酶活力顯著低于27、30 ℃(P<0.05)。
2.4 甜蕎麥種子萌發酶活力(見表4)
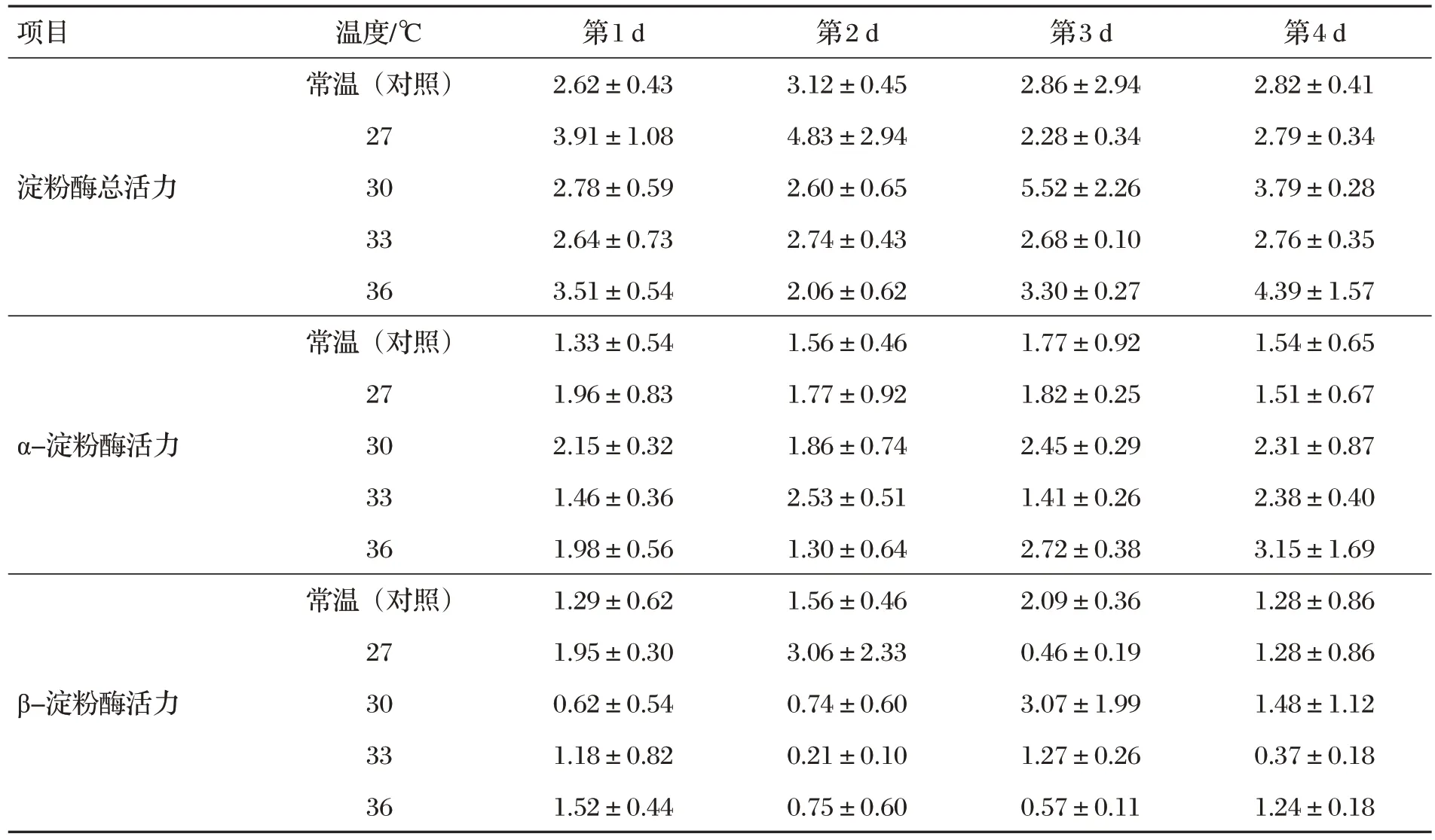
表4 甜蕎麥種子萌發酶活力 單位:U
由表4 可知,不同萌發天數和溫度甜蕎麥種子淀粉酶、α-淀粉酶和β-淀粉酶活力差異均不顯著(P>0.05)。
3 討論
牧草生產與種子萌發活力存在很大關系,豆科牧草種子酶活性較強,相同保存年限條件下,豆科牧草活力比禾本科種子強[11],可提高可溶性糖、蛋白質和脂肪含量[12]。隨著種子貯藏年限增加,種子中SOD 活性呈先升后降趨勢,POD 活性呈上升趨勢,CAT 活性呈下降趨勢[13],變劣種子可引起一系列酶活性變化,導致膜脂遭受破壞[14],直接影響牧草產值。鹽對種子萌發幼苗中SOD、POD、CAT 活性具有一定影響[15],為抗鹽脅迫。苔草中POD、CAT、PDC 活性出現規律性變化[5],牧草種子中SOD、POD、CAT 是保護系統,可防止脂質過氧化,種子健壯度、發芽率、出苗率、幼苗生長、植株抗逆能力、生產潛力與SOD、POD、CAT 密切相關[12],防御酶基因表達促進植物下表皮厚度、葉片組織疏松度和植株中氨基酸含量[16],酶制劑可促進水稻和小麥秸稈營養物質的消化和利用[17]。不同產區不同科屬種子,酶活性也存在一定差異性,如河南產區紫蘇種子發芽酶活高于其他產區[18]。pH值也可對發芽期作物種子CAT和POD活力影響。豆科作物種子中儲存脂肪、蛋白質和淀粉,種子萌發時脂肪酶、轉氨酶和淀粉酶起重要作用[19]。轉氨酶活力升高,蛋白質代謝加快,合成蛋白質增多,抗重金屬能力增強。酶活性促進了紫花苜蓿葉片中α-淀粉酶、β-淀粉酶基因表達,紫花苜蓿中淀粉積累增強抗寒耐凍能力,因此,α-淀粉酶和β-淀粉酶在優質牧草中抗逆性方面起重要作用[20]。接種AM 真菌可提高土壤多酚氧化酶及過氧化氫酶的活性,提高狗尾草、藎草及鬼針草堿性蛋白酶和堿性磷酸酶活性,促進牧草生物量積累[21]。
不同浸種方式也可改變種子活力,不同濃度高錳酸鉀和清水浸泡的華重樓種子種子酶活力存在一定差異[22],2,6-二叔丁基苯酚和外源激素具有提高作物種子萌發抗氧化酶活性能力[23-24]。種子萌發時水解酶被激活,淀粉被分解產生葡萄糖,為種子萌發提供能量,不同發芽天數酶活力存在一定差異[25]。不同浸種溫度可促進種子淀粉酶活性,增強種子生活力,提高種子發芽率。以50%種子正常發芽為最低、最高溫度界限,最高發芽率為最適溫度[26],種子萌發最適、最高和最低三基點溫度控制種子酶活性大小,適宜溫度為種子萌發酶活性關鍵,對提高種子發芽率具有促進作用[27]。酶活性對環境溫度較敏感,因此不同環境種子萌發酶活性存在差異[28-29]。
本試驗主要研究常見牧草即黑麥草、紫花苜蓿、苦蕎麥、甜蕎麥牧草種子萌發酶活力,通過不同溫度水浸種處理后進行種子萌發,測定4 種牧草種子不同萌發天數α-淀粉酶、β-淀粉酶和酶總活力的變化規律,探索貴州牧草發展的思路,為牧草產業發展提供一定參考。近年來,貴州省大力實施種草養畜項目,引進的外來牧草在生長過程中往往出現雜草多、抗逆性弱、易退化、利用年限短等現象[30]。因此,改變浸種水溫提高牧草的出芽率和質量,提高牧草種子萌發酶活力對改良天然草地和建植人工草地等具有重要意義[31]。
4 結論
本研究表明,隨著苦蕎麥、甜蕎麥種子萌發天數增加,其淀粉酶活性呈先升高后下降的趨勢。黑麥草、紫花苜蓿和苦蕎麥種子分別在36、33、30 ℃溫度處理后,種子酶活力較高;不同溫度處理對甜蕎麥種子萌發影響不明顯。

