血清TIMP-3預測惡性大腦中動脈梗死患者死亡的臨床價值研究
張鶯芳,葉民,尚羽,吳明鳳
缺血性卒中可造成患者殘疾、死亡風險和醫療費用增加[1]。MMP是一類具有重塑細胞外基質(extracellular matrix,ECM)功能的蛋白酶家族,受MMP組織抑制劑(tissue inhibitors of matrix metalloproteinase,TIMP)的調控[2]。MMP和TIMP之間的平衡對ECM的穩定性和正常功能起著關鍵作用。這種平衡的破壞可能導致基質纖維化、基質蛋白的過度積累或ECM退化[3-4]。目前,關于MMP與缺血性卒中關系的研究較多,有研究發現,神經功能預后更差的缺血性卒中患者入院時MMP-2、MMP-9水平更高[5-6]。然而,關于TIMP在缺血性疾病方面的研究較少。TIMP家族由4個成員組成,其中TIMP-3是唯一一種對ECM中的蛋白多糖具有高親和力的TIMP,并具有最廣泛的底物,包括所有MMP和多種去整合素金屬蛋白酶[7-9]。本研究旨在分析重度腦梗死患者血清TIMP水平變化,并確定其作為預測患者早期死亡生物標志物的潛力。
1 對象與方法
1.1 研究對象 本研究為2019年2月—2022年1月在南京醫科大學附屬明基醫院神經內科開展的一項前瞻性、觀察性研究。共納入了68例嚴重惡性大腦中動脈梗死(malignant middle cerebral artery infarction,MMCAI)患者。該研究通過明基醫院機構審查委員會批準(L2019-0288),每位患者的親屬均簽署了書面知情同意書。納入標準:①發病至入院時間<24 h;②有腦梗死相關癥狀,符合《中國急性缺血性腦卒中診治指南》和《各類腦血管疾病診斷要點》中的定義[10-11];③頭顱CT和CTA證實梗死最長徑>5 cm,或梗死體積>2/3大腦中動脈供血區;④入院48 h內臨床惡化(NIHSS評分的意識水平維度評分下降≥1分)、中線移位≥5 mm或腦疝;⑤神經功能損傷體征持續存在。排除標準:①年齡<18歲;②活動性炎癥、惡性疾病或妊娠;③頭顱CT提示大腦前動脈或大腦后動脈供血范圍內同時發生腦梗死;④既往有腦出血、腦外傷改變或同側半球占位性病變;⑤參加其他研究和接受實驗性藥物治療的患者。
1.2 資料收集 患者入院后收集一般資料,包括年齡、性別、既往史、急性生理學與慢性健康狀況評分系統Ⅱ(acute physiology and chronic health evaluation scoring systemⅡ,APACHEⅡ)、GCS評分、體溫、血壓、實驗室檢查結果、腦梗死體積、中線偏移、阿替普酶靜脈溶栓、去骨瓣減壓術以及出血性轉化等指標。
本研究中既往史包括糖尿病、高血壓、慢性腎功能衰竭、心力衰竭、接受溶栓治療或去骨瓣減壓術治療,實驗室檢查包括血清肌酐、血清鈉、膽紅素、血糖、乳酸、INR、纖維蛋白原、活化部分凝血活酶時間(activated partial thromboplastin time,APTT)、白細胞計數、血小板計數、血紅蛋白、動脈血氧分壓(arterial partial pressure of oxygen,PaO2)、吸入氧濃度(fraction of inspiration O2,FIO2)、PaO2/FIO2比值。出血轉化定義為血管再通后24 h內復查頭顱影像學發現顱內出血。入院后進行頭顱MRI DWI序列檢查,根據Pullicino公式(梗死區的最長徑×寬徑×梗死層面數×層厚×0.5)計算腦梗死體積[12]。根據入院時頭顱CT圖像,以雞冠至大腦鐮-小腦幕交匯處連線作為中線,以最遠偏移處作為測量點,使用Ruler工具測量中線偏移距離。
所有患者入院后第1天、第4天、第8天采集靜脈血,離心后吸取上清液,-80 ℃保存直至測定。根據BioRad在Bio-Plex Pro人TIMP檢測試劑盒中提供的說明書,使用Bio-Plex Data Pro軟件確定和量化血清TIMP水平(TIMP-1、TIMP-2、TIMP-3和TIMP-4)。構建標準品和對照品,并制備標準稀釋系列。使用的樣品是從儲存的血液樣品中獲得的血清等分試樣。將捕獲抗體與珠共價耦聯,形成的復合物與含有目標生物標記物的樣品反應。在洗滌去除未結合的蛋白后,加入生物素化檢測抗體以形成夾心復合物。添加鏈霉親和素-藻紅蛋白(phycoerythrin,PE)綴合物形成最終檢測復合物。PE用作熒光指示劑。來自反應的數據以熒光強度(money flow index,M FI)以及與每個樣品結合的分析物濃度(pg/mL)表示,該濃度與熒光指示劑信號的MFI成比例。
1.3 研究終點及分組 以30 d全因死亡為研究終點。比較存活組和死亡組臨床指標的差異,分析患者30 d死亡的獨立危險因素。另外,根據死亡時間點對樣本數據進行分層分析:對于入院第1天、第2~4天和第5~8天死亡的患者,取最后一次血清TIMP水平數據分別與存活組第1天、第4天和第8天的數據做比較。
1.4 統計方法 使用SPSS17.0進行統計分析。正態分布的連續變量用表示,組間比較采用t檢驗;非正態分布的連續變量用M(P25~P75)表示,通過Wilcoxon-Mann-Whitney檢驗進行比較。分類變量用例數和率(%)表示,組間比較采用卡方檢驗。使用ROC曲線評估MMCAI患者第1天、第4天和第8天的血清TIMP-3水平對30 d死亡的預測能力。以單因素分析中P<0.1的指標為自變量,以30 d死亡為因變量,進行多元logistic回歸分析,評估MMCAI患者死亡的獨立危險因素。繪制Kaplan-Meier生存曲線,并進行Log rank檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 一般資料 本研究納入68例符合入組標準的MMCAI患者,30 d內全因死亡34例,分別有16例、6例、12例在入院第2~4天、第5~8天和第9~30天死亡。死亡組患者的平均年齡為(62.09±7.72)歲,21例為男性,29例伴有其他并發癥,16例接受溶栓術或去骨瓣減壓術治療,入院時APACHEⅡ評分平均為(22.85±5.93)分,GCS評分平均為(5.82±1.64)分。死亡組GCS評分和血小板計數低于存活組,差異有統計學意義,其他基線資料與存活組的差異無統計學意義(表1)。
2.2 血清TIMP水平分析 死亡組患者在入院第1天、第4天、第8天時的血清TIMP-3水平均高于存活組,且死亡組患者入院第1天血清TIMP-1水平高于存活組,兩組各時間點血清TIMP-2和TIMP-4水平的差異無統計學意義(表2)。

表2 患者入院第1天、第4天、第8天時血清TIMP水平變化
2.3 ROC曲線分析 ROC曲線分析結果顯示,患者入院第1天、第4天、第8天血清TIMP-3水平(截斷值分別為179.33 ng/mL、333.41 ng/mL、266.56 ng/mL)預測30 d死亡率的AUC分別為0.751(95%CI0.636~0.866,P<0.001)、0.748(95%CI0.606~0.889,P<0.001)和0.840(95%CI0.726~0.955,P<0.001)(圖1,表3)。
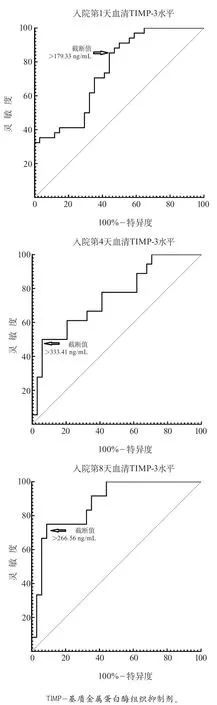
圖1 入院第1天、第4天、第8天血清TIMP-3水平預測惡性大腦中動脈梗死患者30 d死亡的ROC曲線分析結果
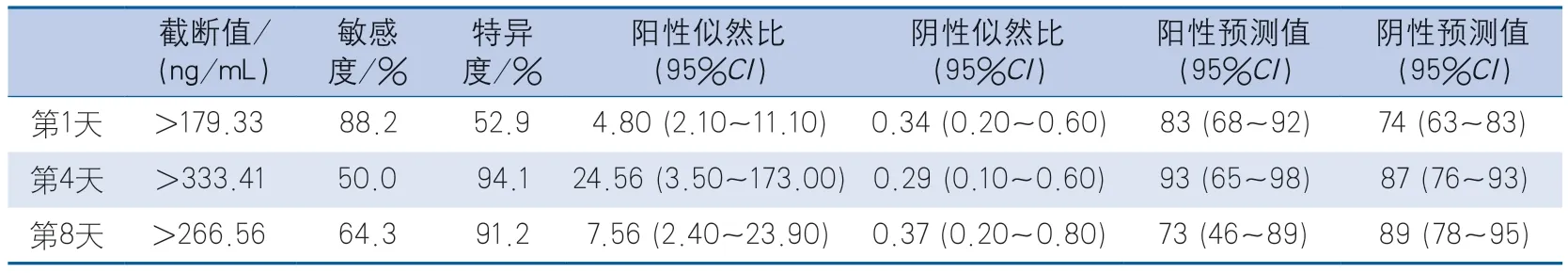
表3 入院第1天、第4天、第8天血清TIMP-3水平預測MMCAI患者30 d死亡的ROC曲線分析結果
2.4 多元logistic回歸分析 校正血小板計數、GCS評分和乳酸水平后,入院第1天血清TIMP-3水平升高仍是影響MMCAI患者30 d死亡的獨立危險因素(表4)。生存分析顯示,入院第1天血清TIMP-3水平>257.93 ng/mL的患者30 d死亡率更高(圖2)。
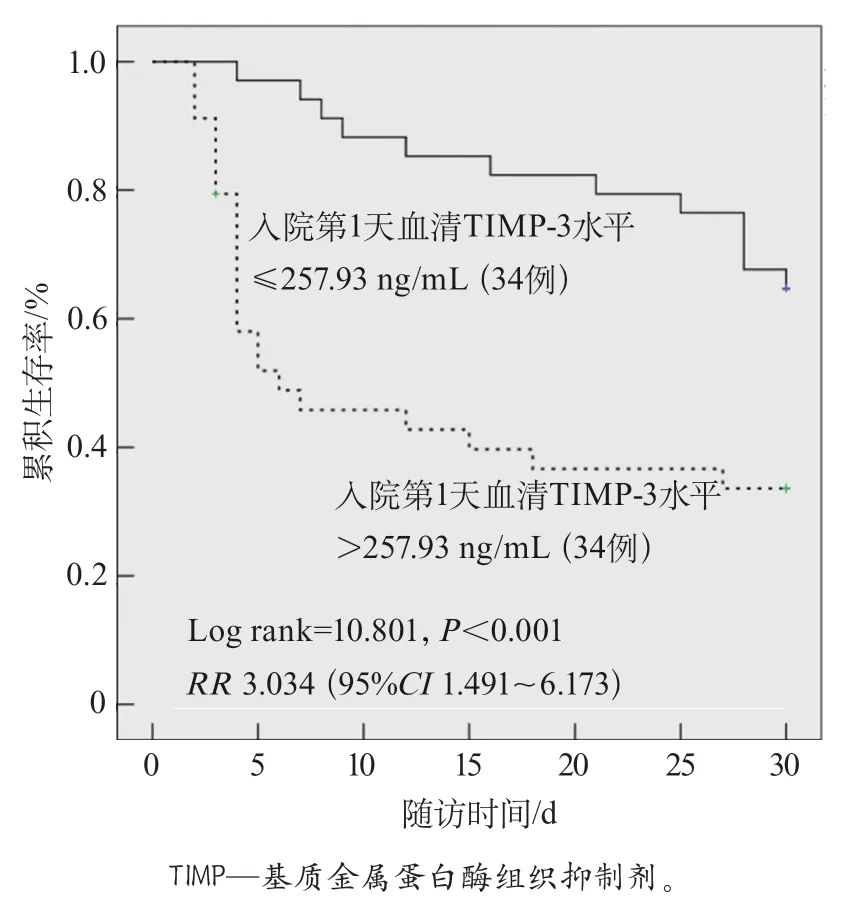
圖2 根據入院第1天血清TIMP-3水平分層分析患者累積死亡風險

表4 MMCAI患者30 d死亡影響因素的多元logistic回歸分析
3 討論
缺血性卒中是我國主要的心腦血管疾病死亡原因之一,只有12%~39%的幸存者可實現長期功能獨立,其較高的發病率增加了人群疾病負擔[1]。早期預防和治療是改善缺血性卒中患者臨床結局和減少患者家庭及社會醫療負擔的必要條件。卒中的首要病理變化為腦血管病,表現為血管受損、ECM降解和MMP破壞胞間連接,進而破壞血腦屏障。MMP的釋放及其對卒中的致病作用是由TIMP調節的[3,13-15]。其中TIMP-3被證實與動脈粥樣硬化、腦動脈瘤、高血壓、缺血后神經元損傷等密切相關[13-15],但其與MMCAI的預后關系尚未得到明確證實。本研究通過對MMCAI患者血清TIMP-3水平進行動態監測,首次證實了在MMCAI發病后第1周,MMCAI死亡患者血清TIMP-3水平普遍高于存活患者,尤其是入院第1天的血清TIMP-3水平可良好地預測患者30 d內死亡風險,有望成為短期預后的生物標志物。
TIMP在調節血管ECM重組中發揮重要的作用[3-4]。ECM結構依靠TIMP和MMP的動態平衡來維持,通過調節細胞因子和生長因子介導的轉錄或在轉錄水平干擾RNA來重組ECM[16]。分泌型MMP和TIMP之間的動態平衡受到低密度脂蛋白受體相關蛋白-1(lipoprotein receptor-associated protein-1,LRP-1)分子親和力的調節[17]。因此,LRP-1對MMP和TIMP的親和力是ECM動態結構的重要調節因子。有研究證實,在所有TIMP蛋白中,TIMP-3對LRP-1的親和力最強[17]。TIMP-3通過增強靶MMP與LRP-1的結合來促進LRP-1介導的內吞作用,表明LRP-1-TIMP/MMP通路可能參與了TIMP-3觸發的腦組織損傷機制[18]。此外,腦缺血會導致炎癥反應,包括小膠質細胞激活、膠質增生和細胞死亡。活化的小膠質細胞和反應性星形膠質細胞產生促炎細胞因子,如TNF-α和IL-6,這些因子與腦白質損傷有關[19]。同時炎性細胞向中樞神經系統的外滲由MMP的細胞外活性誘導,而MMP的細胞外活動部分受內源性TIMP-3調節。
TIMP-3是MMP-9最有效的內源性抑制劑之一,參與動脈粥樣硬化的發生和發展[7]。流行病學證據表明,TIMP-3升高與主要心血管危險因素以及更高的死亡和心血管事件風險相關[8]。TIMP-3被認為是冠心病和心肌梗死的潛在預后生物標志物[7]。據報道,血清TIMP-3水平升高與缺血性卒中的發病率呈正相關[9]。既往也有研究表明,缺血性卒中第1天較高的血清TIMP-1水平與較差的神經功能預后和較低的生存率有關[20]。在本研究中,重度MMCAI患者30 d死亡組入院第1天時血清TIMP-1和TIMP-3水平高于存活組,但是在入院第4天和第8天時只有血清TIMP-3水平仍然高于存活者,而且根據ROC分析結果,MMCAI患者第1天、第4天和第8天的血清TIMP-3水平都可用于預測患者30 d死亡風險。MMCAI患者入院第1天血清TIMP-3水平升高是影響30 d死亡的獨立危險因子。
本研究還存在一定的局限性。第一,本研究未檢測有關MMP數據;第二,本研究僅測定MMCAI患者第1天、第4天和第8天的血清TIMP-3水平,其他時期的血清TIMP-3水平可能也值得關注;第三,本研究為單中心研究,僅納入了病情嚴重的大腦中動脈供血區梗死患者,因此結論不能外推至一般的缺血性卒中患者。
綜上所述,本研究發現MMCAI死亡患者在發病第1周的血清TIMP-3水平普遍高于存活患者,且入院第1天時血清TIMP-3水平可以作為30 d內死亡的生物標志物。本研究結果有助于促進血清TIMP-3水平在死亡預測和MMP調節中的作用研究,以降低MMCAI患者的死亡風險。
【點睛】本研究證實MMCAI患者入院后早期血清TIMP-3水平變化與近期死亡具有相關性,TIMP-3水平可輔助性用于患者臨床早期治療和預防。

