BCL11A在神經細胞中穩定低表達對智能障礙風險基因的轉錄調控機制*
唐小涵,陳金蓉,蘇炳銀,李淑蓉△,解學敏△
1.成都醫學院 發育與再生四川省重點實驗室組織胚胎學教研室(成都 610500);2.成都醫學院 病理學與病理生理學教研室(成都 610500)
BCL11A基因座位于人類染色體2p16.1,編碼krüppel樣鋅指蛋白[1]。BCL11A在血液和神經組織中呈高表達,可調節血紅蛋白的轉化并介導B細胞惡性腫瘤的發生[2]。BCL11A是皮質發育所必需的關鍵因子[3],在皮質發育過程中,BCL11A調控神經元從多極形態到雙極形態的轉換,從而參與深層皮質中的投射神經元形成[4-5]。BCL11A缺陷的神經元表現為輻射遷移受損和Semac3c的過表達,進而參與調節智能障礙(intellectual disability,ID)關聯基因TBR1 在皮質中的表達,導致ID[6]。
ID的臨床表現為進行性的認知能力受損,伴隨適應社會環境能力的嚴重缺陷,其全球發病率高達2%~3%[7],病因多源于遺傳因素。遺傳性ID受蛋白表達、DNA堿基修飾、染色質共價和非共價變化等多種轉錄以及表觀遺傳調控[8]。臨床報道[9]顯示,BCL11A基因座的缺失會介導2p15-p16.1 缺失型ID發生,并伴有持續性胎兒血紅蛋白升高。2p15-p16.1 微缺失綜合征是一種特殊類型的遺傳性ID,其臨床表現為中至重度ID、自閉癥、小頭畸形以及包括皮質在內的大腦結構異常等特征[10]。然而,BCL11A在神經發育中的調控方式及參與2p15-p16.1 微缺失綜合征的具體機制尚需進一步闡釋。
前期研究[11]證實,BCL11A主要在小鼠胚胎13.5 d的大腦皮質表達,并通過設計siRNA瞬時敲降BCL11A,致使細胞轉錄活化水平整體下降,初步證明BCL11A在胚胎皮質發育過程中具有轉錄激活作用。為了進一步探索BCL11A如何參與神經組織的表觀遺傳調控,本課題組在此基礎上,首先通過慢病毒載體構建能長期、穩定敲降BCL11A的細胞株,并利用實時熒光定 量PCR(reverse-transcription quantitative PCR,RT-qPCR)和蛋白質印跡技術,探索BCL11A對皮質發育關鍵轉錄因子的表達影響,繼而轉錄組測序分析BCL11A敲降后差異基因的富集情況,最終通過染色質免疫共沉淀(chromatin immunoprecipitation,ChIP)驗證差異基因啟動子的染色質活性變化,從而初步揭示BCL11A在神經細胞中對ID風險基因的轉錄調控機制。
1 材料與方法
1.1 實驗細胞
293T細胞系(人腎上皮細胞系)來源于人胚腎細胞、SH-SY5Y細胞系(人神經母細胞瘤細胞系)來源于人神經母細胞,均為本實驗室凍存細胞。
1.2 試劑與儀器
1)主要試劑:蛋白質印跡技術整套試劑(上海碧云天)、蛋白酶抑制劑(北京擎科)、RIPA裂解液(上海碧云天)、anti-Ctip1 抗體(上海Abcam)、anti-β-actin抗體(上海Abcam)、anti-GAPDH抗體(上海Abcam)、anti-BCL11A 抗體(上海Abcam)、pPolⅡ(上海Abcam)、H3K9ac(上海Abcam);opti-MEM 培養基和達爾貝科極限必需培養液(Dulbecco minimum essential medium,DMEM)/F12(美國Gibco)、DMEM培養基(美國Gibco)、0.25%胰酶及胎牛血清(美國Gibco);抗生素-抗真菌(美國Thermo)、聚凝胺(北京Solarbio)、TRIzol(美國Thermo)、逆轉錄RT-qPCR試劑盒(北京Trans Gen Biotech)。2)主要儀器:Olympus SZX2-ILLT熒光顯微鏡(日本Olympus)、PCR核酸擴增儀(美國Bio-Rad)、CO2培養箱(美國Thermo)、倒置熒光顯微鏡(日本Nikon)、臺式低溫離心機(美國Thermo)、RT-qPCR儀及CFX96TMReal-time system(美國Bio-Rad)。
1.3 實驗方法
1.3.1 細胞的培養與傳代 細胞復蘇后,在37 ℃、5% CO2條件下,使用完全培養基(10% Gibico胎牛血清+1%抗真菌抗生素)培養HEK293T、SH-SY5Y細胞,每1~2 d采用1×PBS輕柔清洗后,更換1 次培養基,細胞匯合度達80%左右時進行傳代。
1.3.2 shRNA慢病毒質粒的構建及病毒收集 在NCBI網站上下載人源BCL11A基因的全長序列,設計5組慢病毒序列(表1)。PCR擴增目的片段后,引物退火連接目標片段,待感受態細胞為冰水混合狀態時進行轉化連接產物,然后在37 ℃培養箱中過夜培養。第2天挑選克隆于37 ℃培養箱中,220 r/min搖晃過夜培養后,提取質粒測序鑒定。

表1 慢病毒引物序列
1.3.3 慢病毒介導穩定敲降BCL11A的SHSY5Y細胞穩定株的構建 本研究部分設計并根據測序結果,篩選出測序結果正確的針對BCL11A的shRNA質粒: sh1a、sh2c、sh3d、sh4b。利用載體質粒pLKO.1-shRNA1a/2c/3d/4b以及HIV慢病毒包裝質粒psPAX2、pMD2.G(質量比例為10∶7.5∶3.5 )進行共轉染。以eGFP為對照,收集48、72、96 h的含有shRNA病毒上清,選擇72 h病毒感染SH-SY5Y細胞。細胞生長密度為80%時進行感染,病毒感染48 h后,每隔48 h向完全培養基里加入嘌呤霉素10 g/L Polybrene篩選,1 周后篩選出目的細胞株。
1.3.4 RT-qPCR 通過TRIzol法提取各組細胞的總RNA,然后使用超微量分光光度計檢測RNA 的濃度和純度,按說明書取2 μg總RNA進行逆轉錄,參照試劑盒TransScript All-in-One First-Stand cDNA Synthesis SuperMix for RT-qPCR說明書步驟操作,得到cDNA,以cDNA為模版進行RT-qPCR檢測目的基因表達情況。
1.3.5 蛋白質印跡技術驗證BCL11A蛋白表達水平收集細胞,用PBS緩沖液清洗2~3 次,用RIPA裂解液冰上裂解60 min后,將裂解液經12000 r/min,離心半徑9.6 cm,4 ℃,離心30 min。經濃度12%SDS-PAGE分離膠、5% SDS-PAGE濃縮膠、電泳電壓60~120 V垂直電泳、300 mA恒流120 min轉膜。PVDF膜用含5%脫脂奶粉的封閉液室溫封閉2 h后,分別與BCL11A一抗(1∶1000)和GAPDH一抗(1∶1000)在4 ℃搖床孵育過夜。含聚山梨酯-20 的Tris鹽酸緩沖液(Tris buffered saline with tween?20,TBST)清洗3 次后,再與辣根過氧化物酶標記的二抗(1∶5000)室溫孵育2 h,洗滌3 次后,將化學發光試劑(electrochemiluminescence,ECL)A 液和B 液1∶1比例混合,覆蓋到膜上,置于 Bio-Rad 成像系統進行拍攝,使用ImageJ軟件進行分析。
1.3.6 ChIP實驗分析神經元特異性因子的啟動子活性SH-SY5Y-sh細胞用終濃度1%甲醛固定,加入甘氨酸終止反應,PBS清洗后,離心收集固定好的細胞,Lysis buffer重懸細胞放冰上10 min,離心后用PBS漂洗。NCP bufferⅠ重懸,冰上放置10 min,ChIP Lysis buffer重懸,冰上放30 min 裂解細胞核膜,超聲儀使染色質碎裂,用等超聲體積的酚氯仿提取超聲樣品,取上清液,超聲樣品分為3 組,即抗體IP組、IgG組和input組。每個樣品加入IgG,再加入磁珠Invitrogen dynabeads protein A磁珠,4 ℃搖床慢速搖2.5 h,去除非特異性結合的雜質,磁架上靜置1 min。將管中清亮液體吸取到新EP管,加入dynabeads protein A,4 ℃搖床過夜。依次使用Wash bufferⅠ、Ⅱ、Ⅲ分別4 ℃搖床慢速清洗磁珠,棄去液體,向珠子中加入新鮮制備的提取緩沖液,置于磁架上提取染色質復合物。樣本提取液和input樣品中,加入RNase、NaCl、蛋白酶K,混勻,65 ℃水浴裂解過夜,第2天抽提DNA后,RT-qPCR定量分析。
1.4 統計學方法
采用ImageJ及Graphpad Prism 8.0 軟件進行統計學分析,定量資料采用()描述,兩組間比較采用t檢驗,3 組及以上表達水平差異采用ANOVA分析。檢驗水準α除特別說明外均設定為0.05。
2 結果
2.1 成功構建穩定敲降BCL11A 的SH-SY5Y 細胞株
成功構建4 株穩定敲降BCL11A的SH-SY5Y-sh細胞株,不同慢病毒細胞株的細胞生長速率存在明顯差異,SH-SY5Y-sh1a、SH-SY5Y-4b的生長密度較SH-SY5Y-2c、SH-SY5Y3d低(圖1)。
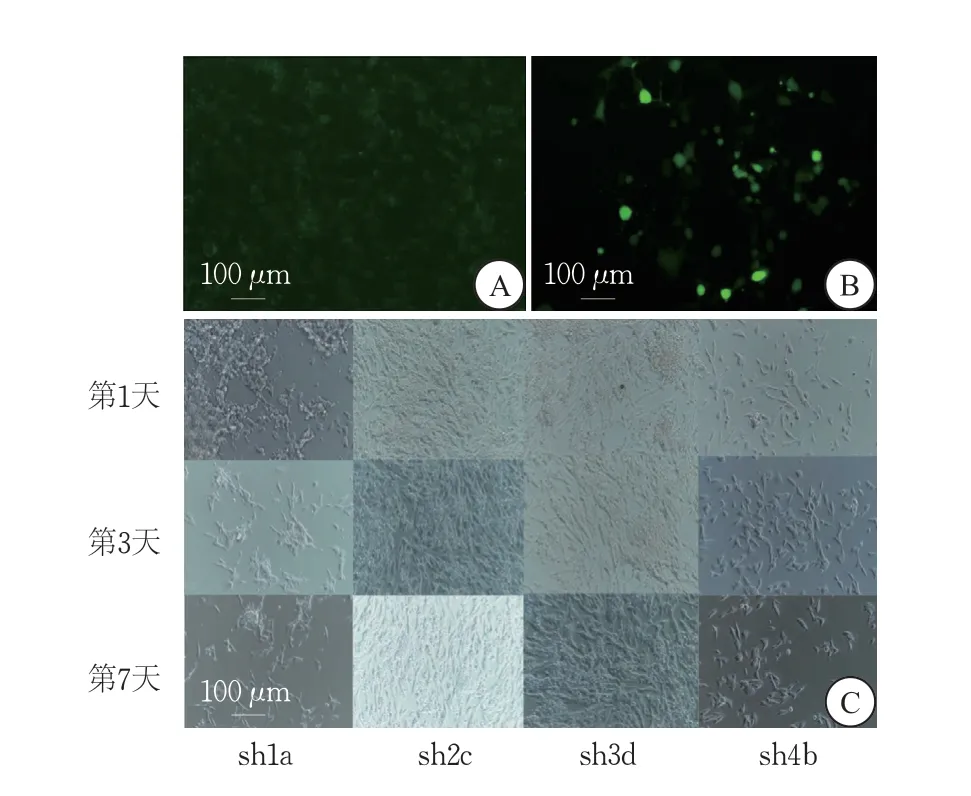
圖1 嘌呤霉素篩選后感染成功的SH-SY5Y細胞
2.2 SH-SY5Y-sh 細胞株中BCL11A 的mRNA 表達水平
SH -SY5Y- sh細胞株的RT-qPCR 實驗表明,SH-SY5Y-sh1a、SH-SY5Y-sh2c、SH-SY5Y-sh3d細胞株中BCL11A的mRNA干擾效果明顯,其中,SH-SY5Y-sh1a細胞株BCL11A的mRNA水平下調為對照組的73.5%(P<0.01),SH-SY5Y-sh2c的mRNA水平下調為43.0 %(P<0.001),SH-SY5Y-sh3d細胞株BCL11A的mRNA水平下調為39.0%(P<0.001)(圖2)。
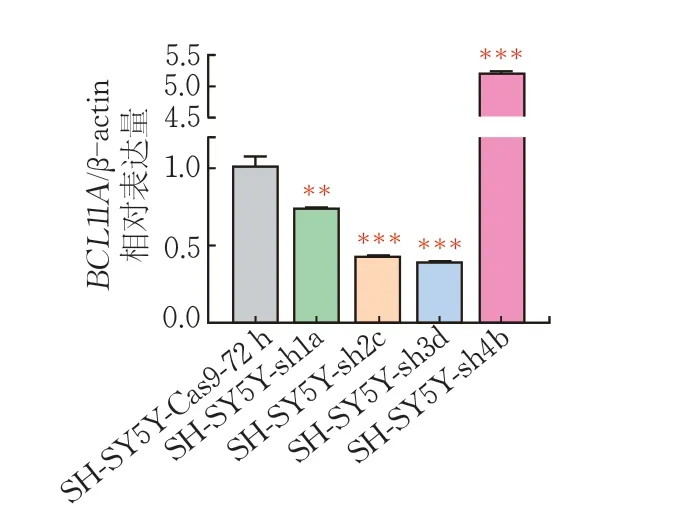
圖2 RT-qPCR檢測SH-SY5Y-sh細胞中BCL11A的干擾效率(,n=3)
2.3 SH-SY5Y-sh 細胞株中BCL11A 蛋白表達水平改變
通過蛋白質印跡技術檢測BCL11A蛋白的表達情況,可見在構建成功的4 組慢病毒細胞株中,SH-SY5Y-Sh1a、SH-SY5Y-Sh2c、SH-SY5Y-Sh4b細 胞中BCL11A蛋白表達量下降>80.0%(P<0.001),而SH-SY5Y-Sh3d細胞BCL11A蛋白表達量下調約20.0%(P<0.01);將慢病毒細胞株的蛋白表達量灰度值統計分析顯示,SH-SY5Y-Sh1a、SH-SY5Y-Sh2c 細胞的BCL11A蛋白表達量最低(圖3)。
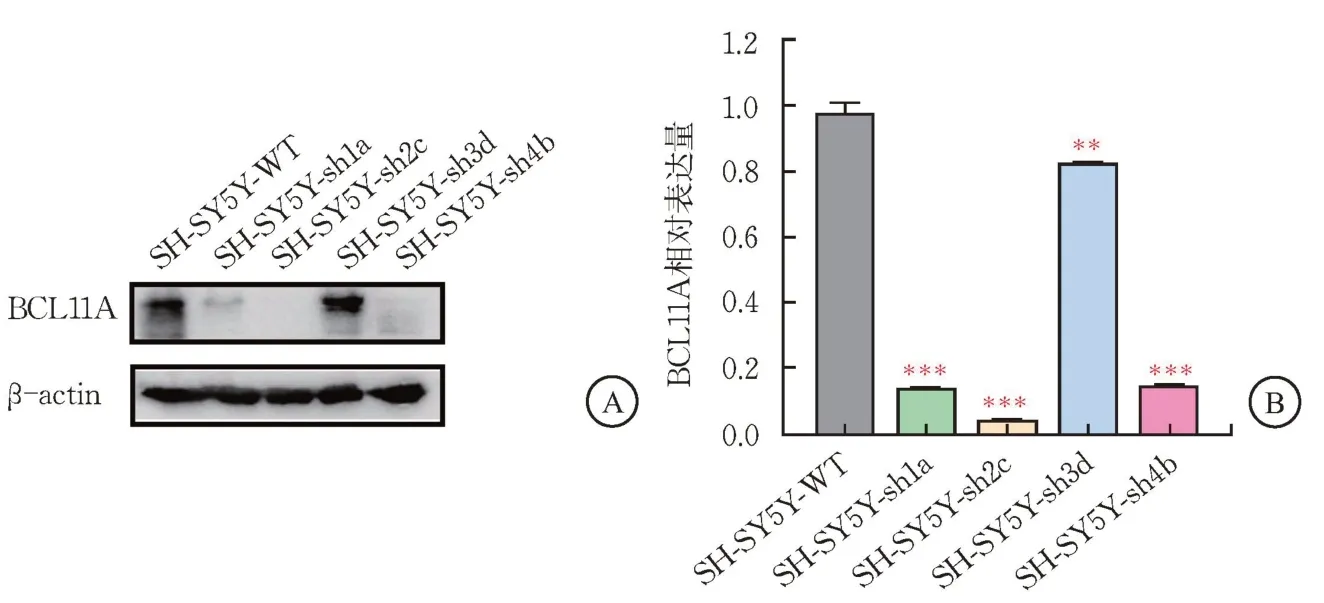
圖3 SH-SY5Y-sh細胞中BCL11A蛋白表達水平(,n=3)
2.4 BCL11A 敲降后調控皮質神經元發育關鍵基因TCF12、MEF2D 的表達
TCF12 參與調控RNA聚合酶Ⅱ啟動子、免疫應答、肌發育、調控轉錄等重要生物學過程[12];MEF2 是轉錄調節因子MADS-box家族成員之一,在脊椎動物中參與轉錄、調控RNA 聚合酶Ⅱ啟動子、肌發育等過程[13]。
RT-qPCR實驗顯示,BCL11A敲降后,SH-SY5Y-sh1a細胞株中皮質發育關鍵轉錄因子TCF12的mRNA表達上調至1.25倍(P<0.001)、MEF2D的mRNA表達量上調至3倍(P<0.001)。SH-SY5Y-sh2c細胞株中皮質發育關鍵轉錄因子TCF12的mRNA表達上調至1300倍(P<0.001),MEF2D的mRNA 表達量上調至3.8倍(P<0.001)。由此提示,BCL11A對于皮質神經元關鍵轉錄因子的表達具有負向調控作用,BCL11A對TCF12、MEF2D的抑制作用呈線性負相關(圖4)。
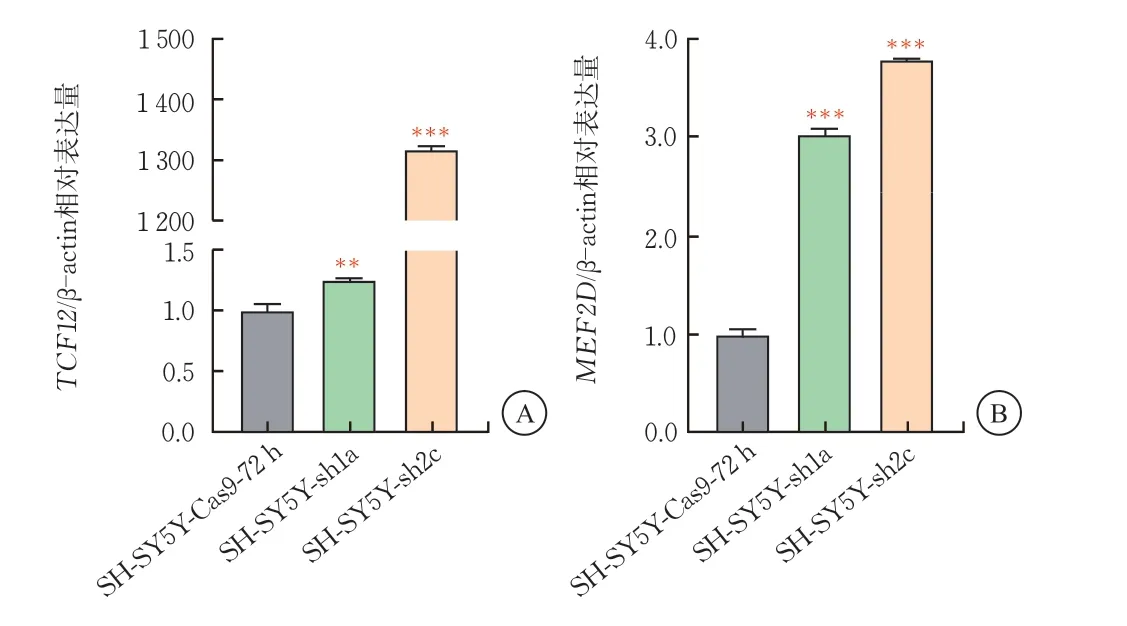
圖4 SH-SY5Y-sh細胞中皮質發育關鍵轉錄因子TCF12、MEF2D的mRNA表達水平(,n=3)
2.5 BCL11A 敲降后關鍵基因BCL11B、CTCF、ADCYAP1R1、NeuroD 1/2、PAX6、SATB 1/2 的表達水平
選取BCL11A蛋白水平敲降效果明顯的SH-SY5Y-sh1a、SH-SY5Y-sh2c細胞株進行RT-qPCR實驗,觀察皮質神經元發育關鍵轉錄因子的表達變化。轉錄因子BCL11B為參與神經系統及免疫系統發育的核內轉錄因子[14];CTCF廣泛存在于真核生物中,可阻斷增強子和啟動子的相互作用[15];ADCYAP1R1 在焦慮、恐懼認知和應激反應中發揮重要作用[16];NeuroD1/2 參與調控RNA聚合酶Ⅱ啟動子,在神經系統發育以及細胞形態分化中起重要作用[17];在胚胎發育過程中,PAX6 對調節神經系統起重要作用[18];SATB1/2 參與調節神經系統的分化和成熟[19]。
RT-qPCR 結果顯示,構建的SH-SY5Y-sh1a、SH-SY5Y-sh2c細胞株中,BCL11A的mRNA水平降至44.0%~70.0%(P<0.001),此時細胞株內皮質神經元發育關鍵基因BCL11B、CTCF、NeuroD1、NeuroD2、SATB1、ADCYAP1R1、PAX6、SATB2 的mRNA表 達降低。以上結果提示,BCL11A可正向調控以上皮質神經元關鍵轉錄因子的表達,且對胚胎發育關鍵轉錄因子ADCYAP1R1、PAX6、SATB2 的降低程度更明顯(圖5)。
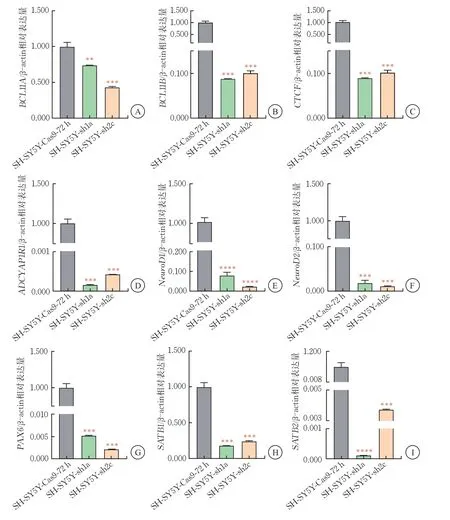
圖5 SH-SY5Y-sh細胞中皮質發育關鍵轉錄因子BCL11A、BCL11B、CTCF、ADCYAP1R1、NeuroD1/2、PAX6、SATB1/2的mRNA表達水平(,n=3)
2.6 轉錄組測序分析BCL11A 在神經細胞中參與調控的靶基因及相關啟動子染色質水平變化
轉錄組測序樣顯示,SH-SY5Y-sh細胞株組差異表達的246個基因進行基因本體論(gene ontology,GO)富集分析顯示,193個基因富集到人類疾病相關因素的GO條目(P<0.05),有約200個基因富集到生物系統及環境信息處理、細胞過程、代謝、遺傳信息處理等方面皆有參與(圖6A~B)。通過京都基因和基因組百科全書數據庫(kyoto encyclopedia of genes and genomes,KEGG)對BCL11A敲降后差異基因參與的基因組、化學和系統功能信息進行分析,結果顯示,BCL11A代謝通路分為多個分支,其中在組織系統異常富集數量排名第3 的為神經系統異常(圖6C)。在生物學功能中,BCL11A與免疫系統、內分泌系統以及神經系統高度相關,KEGG疾病富集柱狀圖分析結果顯示,BCL11A在神經系統疾病有高度富集(圖6D)。
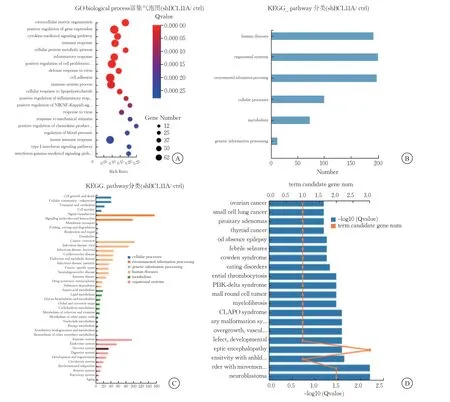
圖6 BCL11A參與的重要生物學過程
RNA測序結果顯示,SH-SY5Y-sh細胞株組差異表達基因共824 個差異有統計學意義(P<0.05),其中有649 個基因上調,175 個基因下調;與神經發育異常相關的差異表達基因有兩個,分別是下調基因GRM7 與上調基因GRIN1,都是ID風險基因(圖7)。GRM7 是一種抑制性異源三聚體G蛋白偶聯受體,它通過河馬信號通路影響腦發育,可調節哺乳動物中樞神經系統突觸前末端的神經遞質釋放和突觸可塑性,為神經發育障礙風險基因[20]。GRIN1 基因突變可影響NMDA受體的生理功能,引起神經元功能異常,最終導致大腦到腸道的各種神經、精神癥狀[21]。
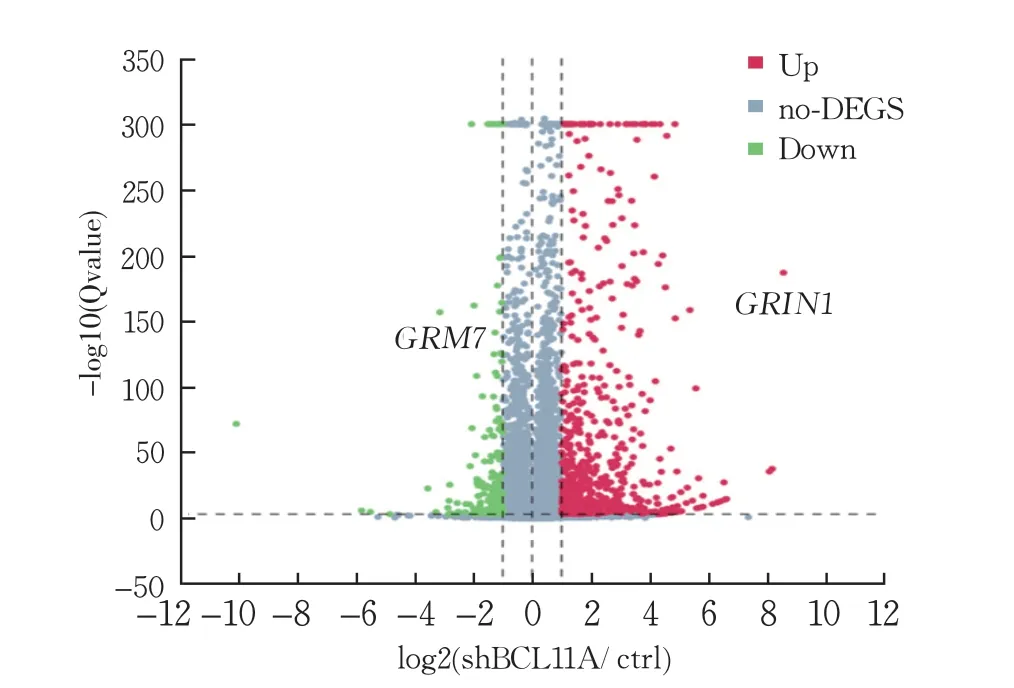
圖7 SH-SY5Y細胞差異基因表達水平的分布情況
2.7 BCL11A 敲降后神經元中GRM7 啟動子染色質富集情況
為探索神經細胞中BCL11A的上游差異表達基因GRM7的啟動子染色質活性,課題組針對GRM7的啟動子進行了ChIP-qPCR實驗,結果顯示,在SH-SY5Y-sh細胞中,ID基因GRM7 啟動子位點的轉錄活性標志pPolⅡ(抗Phospho-Rpb1 CTD)以及染色質活性修飾H3K9ac(抗H3K9ac)的富集都明顯降低;其中,mRNA水平和蛋白表達水平下調效果明顯的SH-SY5Y-sh1a、SH-SY5Y-sh2c細胞中pPolⅡ的富集度下調95%以上(P<0.001),較IgG下調92%以上(P<0.001)。GRM7啟動子染色質活性修飾H3K9ac的富集度降低50%以上(P<0.001),SH-SY5Y-sh1a細胞中H3K9ac的富集較對照組降低約25%(P<0.01),SH-SY5Y-sh2c細胞中H3K9ac的富集較對照組降低約90%(P<0.001)。以上結果表明,GRM7的啟動子染色質活性及染色質修飾活性在BCL11A敲降后明顯降低,且在SH-SY5Y-sh2c細胞中富集度降低明顯,提示神經發育異常相關基因GRM7 可能受到BCL11A的正向調控(圖8)。
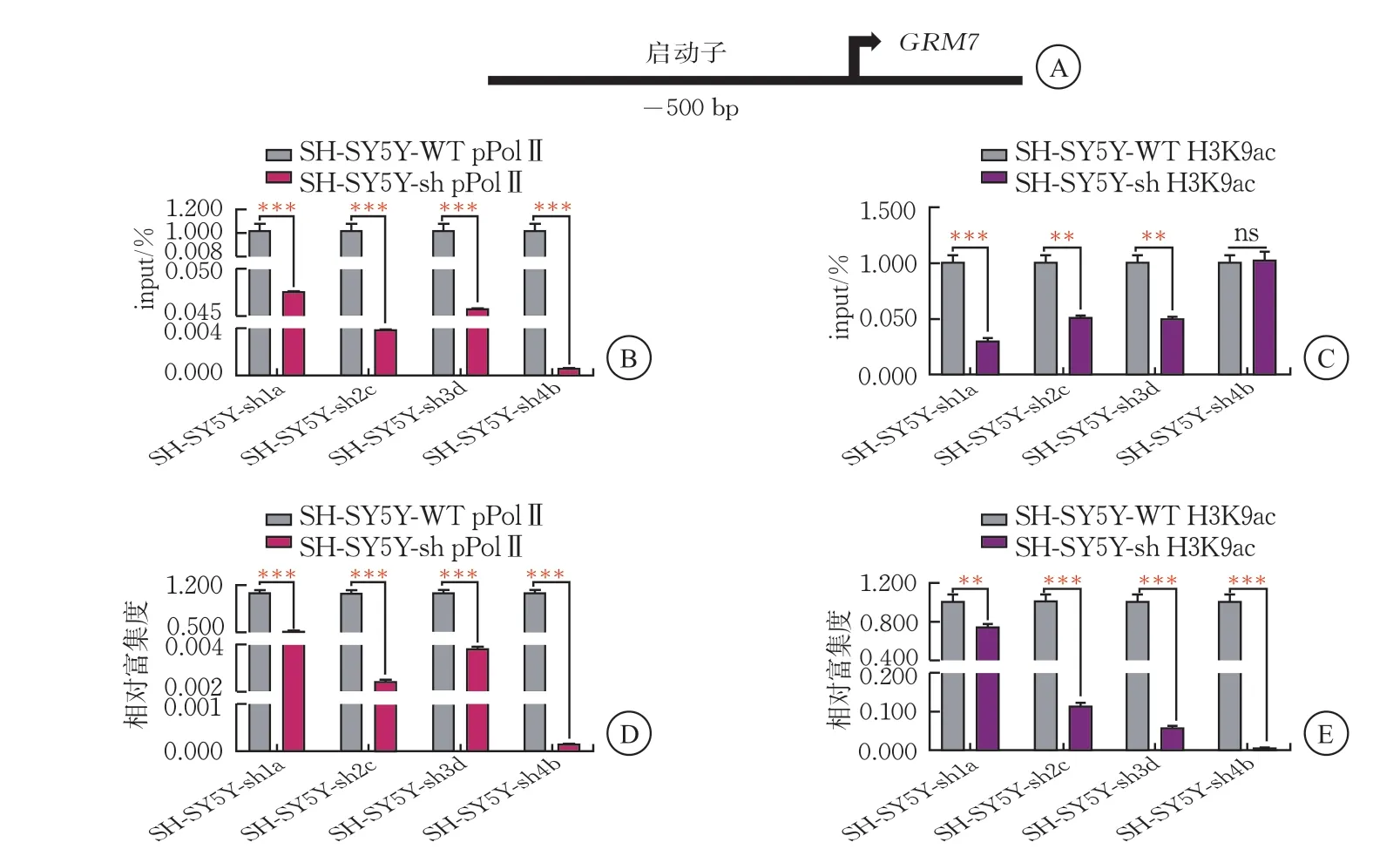
圖8 SH-SY5Y-sh1a/2c/3d/4b細胞中GRM7 啟動子染色質富集情況(,n=3)
2.8 BCL11A 敲降后神經元中GRIN1 啟動子染色質富集情況
RNA測序結果顯示,ID風險基因GRIN1 表達上調。課題組針對GRIN1 的啟動子進行了ChIP-qPCR實驗,以探索神經細胞BCL11A敲降后GRIN1 的啟動子染色質活性。SH-SY5Y-sh2c、SH-SY5Y-sh3d細胞中GRIN1 啟動子處pPolⅡ的富集度上調為140 倍,SH-SY5Y-sh4b的富集度上調為243 倍。GRIN1 啟動子處SH-SY5Y-sh1a細胞的pPolⅡ富集度為對照組的4.5倍,SH-SY5Y-sh2c細胞的pPolⅡ富集度為對照組的749倍,SH-SY5Y-sh3d細胞的pPolⅡ富集度為IgG的7.7 倍,SH-SY5Y-sh4b細胞的pPolⅡ富集度為IgG的2800 倍。
SH-SY5Y-sh2c細胞中GRIN1 啟動子染色質活性修飾H3K9ac的富集度上調為4倍,SH-SY5Y-sh3d的富集度上調為1.3倍。GRIN1啟動子處SH-SY5Y-sh1a細胞的H3K9ac富集度為對照組的11 倍,SH-SY5Y-sh2c細胞的H3K9ac富集度為對照組的21倍,SH-SY5Y-sh3d細胞的H3K9ac集度為對照組的7.8倍,SH-SY5Y-sh4b細胞的H3K9ac富集度為對照組的1.4 倍(圖9)。
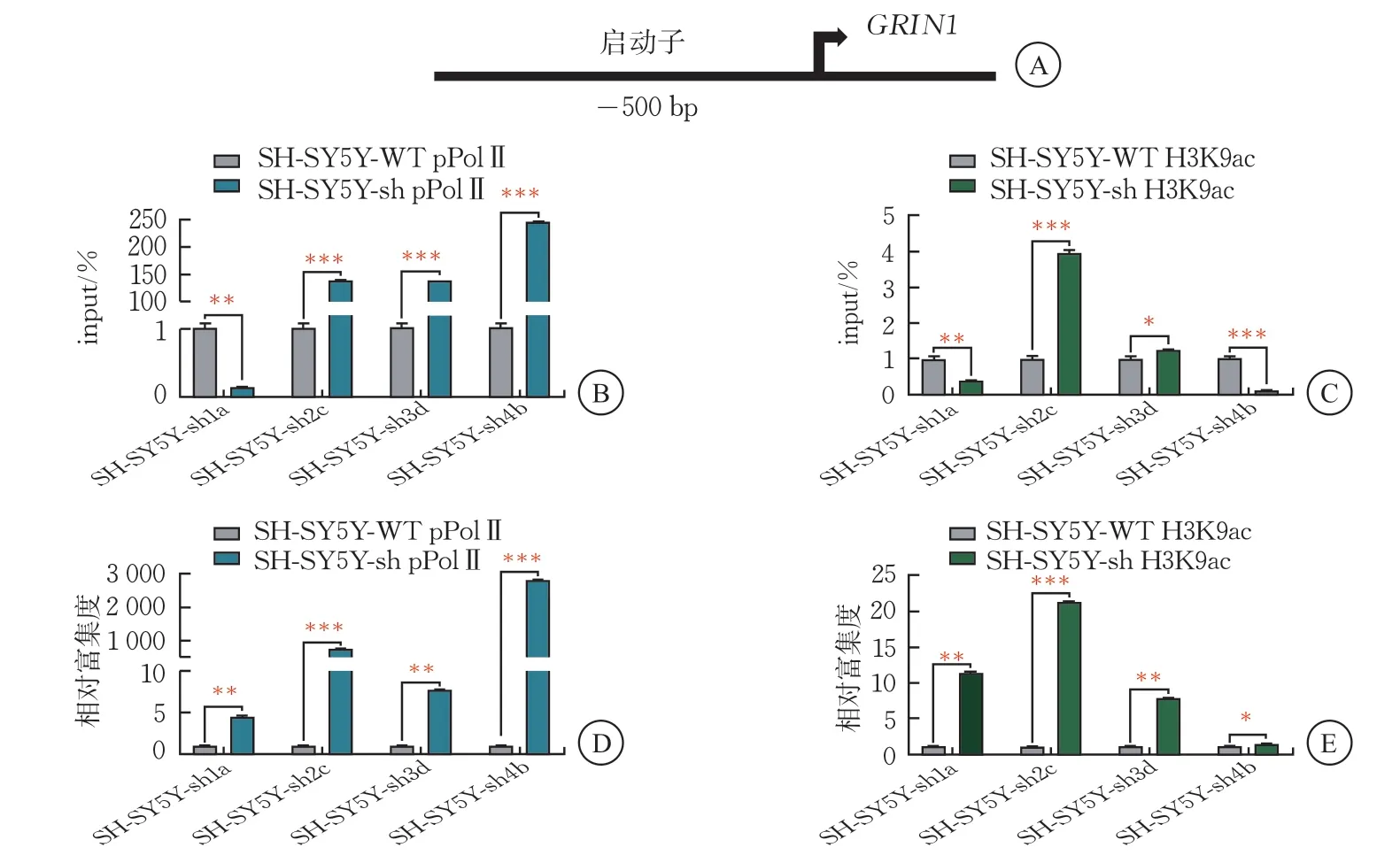
圖9 SH-SY5Y-sh1a/2c/3d/4b細胞中GRIN1 啟動子染色質富集情況(,n=3)
以上實驗結果表明,轉錄活性標志pPolⅡ以及染色質活性修飾H3K9ac在GRIN1啟動子的富集呈現升高趨勢,且在SH-SY5Y-sh2c細胞中的富集差異有統計學意義(P<0.05),提示ID風險基因GRIN1可能受到BCL11A的負向調控。
3 討論
BCL11A在腦組織中高表達,它參與調節大腦中的軸突分支[22],其基因座缺失可致2p15-p16.1 微缺失綜合征發生。前期研究[11]通過設計siRNA瞬時敲降BCL11A,初步證明BCL11A在神經元發育過程中具有轉錄激活作用。在此基礎上,課題組構建了可穩定敲降BCL11A的SH-SY5Y-sh細胞株作為工具來進一步探索BCL11A對神經系統的影響機制。本研究發現,BCL11A正向調控部分胚胎發育關鍵轉錄因子,其中BCL11A對焦慮癥狀、恐懼應激因子ADCYAP1R1、神經系統發育障礙因子PAX6 的降低程度更明顯。同時,在神經系統中,BCL11A負向調控神經元轉錄關鍵因子TCF12、MEF2D,且抑制作用呈線性負相關,由此提示,BCL11A除在胚胎皮質發育時期發揮重要作用外,還與ID及相關自閉癥譜系障礙疾病的發生有著緊密聯系。
GRM7 調節整個中樞神經系統的神經傳遞和突觸可塑性,其與抑制性G蛋白偶聯主要定位在突觸前活性區[22-23]。在發育退化的雷諾氏綜合征人類模型[24]中顯示,患者運動皮層的mGlu7 蛋白表達水平降低。GRM7 在神經元發育早期突變可導致軸突生長嚴重受損,進而引起成熟神經元突觸前末端數量缺陷[25]。在早期發育期間,使用mGlu7 激動劑可恢復誘導的軸突生長和突觸前末端發育缺陷[26],表明GRM7 在神經發育障礙發病機制中的穩定表達具有關鍵作用。GRIN1相關神經發育障礙(GRIN1-NDD)的所有受影響個體表現為輕度至重度發育遲緩及ID,其皮質發育畸形個體的雜合致病變異位于結構域S2 和M3 中,且可能存在基因型-表型相關性[27]。NMDAR是人類大腦學習與記憶的分子開關,在人類大腦皮質中廣泛分布,參與大腦發育及神經元活動[28]。GRIN1 編碼GluN1 亞基,交替剪接產生8 種亞型,GRIN1 通過影響NMDAR通道,在大腦發育、學習、記憶和其他高級認知功能中起著重要作用。
本研究構建的SH-SY5Y-sh細胞株轉錄組測序分析發現,BCL11A的缺失與人類神經系統疾病高度相關,BCL11A缺失顯示下游有兩個神經發育遲滯風險差異基因GRM7 與GRIN1,且GRM7 可能受到BCL11A的正向調控,GRIN1 可能受到BCL11A的負向調控,通過ChIP驗證其增強子活性同樣受BCL11A的表達影響。由此可以推論,BCL11A和其他神經元關鍵因子共同作用于皮質發育的重要環節,并與ID密切聯系,但相關的分子機制還有待進一步實驗證實。
綜上所述,BCL11A在神經元中功能重要且復雜,它參與多種神經系統發育關鍵因子的表達調控。BCL11A對胚胎神經元發育的功能及作為轉錄因子參與皮質發育的具體分子機制仍有待進一步研究,完善靶向轉錄因子BCL11A在皮質發育中的組織特異性,對研究和診治2p15-p16.1 微缺失綜合征至關重要。

