機器人輔助手術治療早期宮頸癌患者的臨床療效
萬齊鴻,王雨婷,王哲,韓沛林,朱曉旭,應俊,施瑾,胡京輝,錢建華
摘 要 目的:分析機器人輔助手術治療早期宮頸癌的圍手術期結果及腫瘤學結局。方法:回顧性分析2015年6月—2021年7月在浙江大學醫學院附屬第一醫院行機器人輔助手術的64例宮頸癌患者的臨床資料。結果:64例患者均順利完成手術,無中轉開腹病例。根據國際婦產科聯盟的臨床分期標準,其中ⅠA1期伴淋巴脈管間隙浸潤(Lymphovascular Space Invasion,LVSI)4例,ⅠA2期4例,ⅠB1期51例,ⅠB2期4例,ⅡA1期1例。所有患者平均手術時間為(310.56±71.22)min,平均術中失血量為(144.53±92.75)ml,平均切除淋巴結數量為(23.11±6.97)個,平均住院時間為(12.27±3.44)d,平均隨訪時間為(46.48±15.91)個月(3例失訪)。總計30例患者接受術后輔助治療,其中13例接受同步放化療,15例接受放療,2例接受化療。隨訪至今,共61例患者存活,其中僅1例患者復發。結論:機器人手術系統在宮頸癌手術中的應用有良好的臨床療效,可以作為治療早期宮頸癌的有效方法。
關鍵詞 機器人輔助手術;微創手術;宮頸癌;根治性宮頸切除術;根治性子宮切除術
中圖分類號 R608 R713.4 文獻標識碼 A 文章編號 2096-7721(2023)05-0407-06
Clinical efficacy of robot-assisted surgery on patients with early cervical cancer
WAN Qihong1, WANG Yuting2, WANG Zhe1, HAN Peilin1, ZHU Xiaoxu1, YING Jun1, SHI Jin1,
HU Jinghui1, QIAN Jianhua1
(1. Department of Gynecology, the First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310000, China;
2. Zhejiang University School of Medicine, Hangzhou 310000, China)
Abstract Objective: To analyze the perioperative and oncological outcomes of robot-assisted surgery for early cervical cancer. Methods: The clinical data of 64 patients with cervical cancer underwent robot-assisted surgery in the First Affiliated Hospital, Zhejiang University School of Medicine from June 2015 to July 2021 was retrospectively analyzed. Results: All the surgeries were successfully completed without conversion to open surgery. According to the clinical staging criteria of the International Federation of Gynecology and Obstetrics, there were 4 cases of stage I A1 with Lymphovascular Space Involvement (LVSI), 4 cases of stage I A2, 51 cases of stage I B1, 4 cases of stage I B2, and 1 case of stage II A1. The average operative time was (310.56±71.22) min, the average intraoperative blood loss was (144.53±92.75) ml, the average number of dissected lymph nodes was (23.11±6.97), and the average hospital stay was (12.27±3.44) d. 3 cases were lost to follow-up, and the mean follow-up time was (46.48±15.91) months. A total of 30 cases received postoperative adjuvant therapy, including 13 cases of concurrent chemoradiotherapy, 15 cases of radiotherapy, and 2 cases of chemotherapy. Up to now, 61 cases survived, including 1 case of recurrence. Conclusion: The application of robotic surgical system in cervical cancer has good clinical outcomes, which could be an effective way to treat early cervical cancer.
Key words Robot-assisted surgery; Minimally invasive surgery; Cervical cancer; Radical trachelectomy; Radical hysterectomy
微創技術(腹腔鏡和機器人)已被廣泛應用于早期宮頸癌的手術治療中,有多個回顧性研究均支持微創手術和開腹手術的腫瘤學結局相似,而且微創手術有更少的術中出血量,更短的住院時間,更少的術后并發癥[1-4]。自2005年美國食品藥品監督管理局批準達芬奇機器人手術系統應用于婦科手術以來,機器人手術已在婦科良惡性疾病手術治療中廣泛應用。相較于傳統腹腔鏡手術,機器人手術具有以下優勢:①三維立體圖像技術可以使術野更加清晰;②機械手腕可自由旋轉及過濾震顫,提高了手術操作的精準性和安全性;③術者控制鏡頭可避免助手扶鏡時造成的術野晃動,術者以坐姿進行手術可減輕疲勞。因此,機器人輔助手術在早期宮頸癌的手術治療中療效顯著。然而,2018年發表在《新英格蘭醫學雜志》的LACC研究[5]和美國哈佛醫學院的大型隊列研究[6]均表明,在早期宮頸癌的手術治療中,微創手術比開腹手術有更低的無病生存率(Disease Free Survival,DFS)和總體生存率(Overall Survival,OS)。NCCN指南也隨即更新,明確推薦開腹手術是早期宮頸癌手術治療的標準方法。根據2018國際婦產科聯盟(FIGO)臨床分期標準,早期宮頸癌定義為ⅠA1期~ⅠB2期(腫瘤直徑為2~4 cm)[7],這一結果對早期宮頸癌手術的治療具有重大意義。本研究回顧性分析2015年6月—2021年7月在浙江大學醫學院附屬第一醫院行機器人輔助手術治療早期宮頸癌患者的圍手術期相關數據及腫瘤學結局,旨在探討機器人輔助手術治療宮頸癌的安全性及有效性。
1 資料與方法
1.1 臨床資料
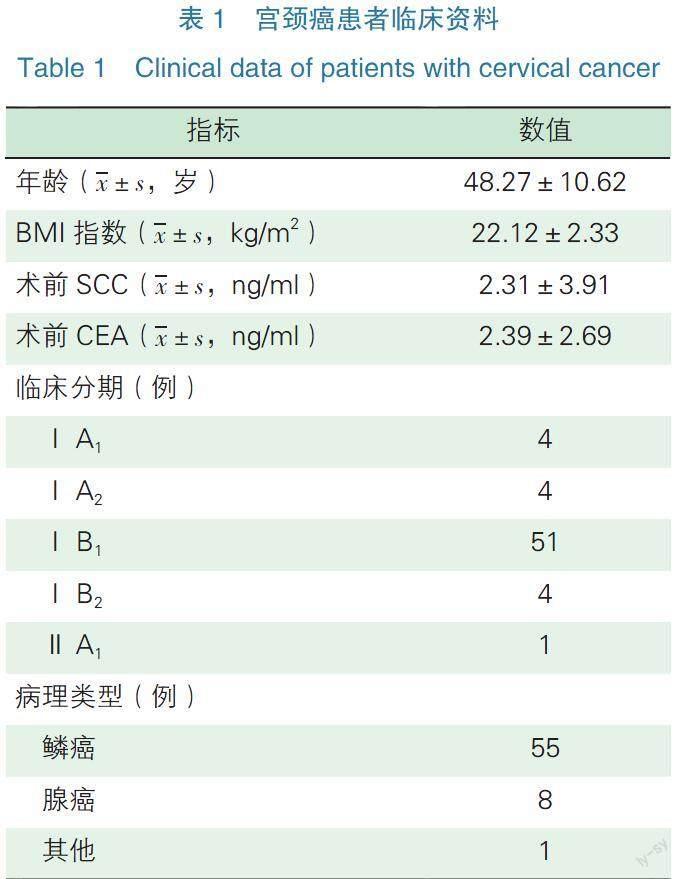
回顧性分析2015年6月—2021年7月浙江大學醫學院附屬第一醫院64例因宮頸癌ⅠA1期伴淋巴脈管間隙浸潤(Lymphovascular Space Invasion,LVSI)~ⅡA2期行機器人輔助腹腔鏡根治性子宮切除術或根治性宮頸切除術聯合系統性淋巴結清掃術的患者臨床資料。患者平均年齡為(48.27±10.62)歲,平均BMI指數為(22.12±2.33)kg/m2。2015年6月—2019年2月在本院進行手術的患者共49例,采用2009年國際婦產科聯盟臨床分期標準。其余15例患者采用2018年國際婦產科聯盟臨床分期標準,分別為ⅠA1期、ⅠA2期或ⅠB1期。
故總體的臨床分期分別為:ⅠA1期伴LVSI者4例(6.25%),ⅠA2期4例(6.25%),ⅠB1期51例(79.69%),ⅠB2期4例(6.25%),ⅡA1期1例(1.56%)。其中腺癌患者8例(12.50%),鱗癌患者55例(85.94%),神經內分泌癌患者1例(1.56%)。平均術前鱗狀細胞癌(Squamous?Cell Carcinoma,SCC)抗原值為(2.31±3.91)ng/ml,平均術前癌胚抗原(Carcinoembryonic Antigen,CEA)值為(2.39±2.69)ng/ml,見表1。10例患者伴淋巴結轉移,18例伴LVSI,13例患者存在>2/3宮頸全層浸潤,11例患者存在1/3~2/3宮頸全層浸潤,腫瘤直徑> 4 cm者4例。術前均與患者及家屬充分溝通,告知手術方式的選擇及相關風險,由患者及家屬決定手術方式。
1.2 方法
1.2.1 手術方法
患者取膀胱截石位,頭低臀高30°~45°,穿刺孔一般為5個,鏡頭孔在臍左上方30° 5 cm處;于鏡頭孔兩側角15°開2個8 mm穿刺孔(左側距離臍8 cm,右側距離臍12 cm),分別置入2號臂和1號臂;1號臂上下各打2個輔助孔,輔助孔的位置根據助手的身高和習慣而定。62例患者行達芬奇機器人輔助腹腔鏡根治性子宮切除術和系統性盆腔淋巴結清掃術,2例患者行達芬奇機器人輔助腹腔鏡根治性宮頸切除術和盆腔淋巴結切除術,手術的難點在于輸尿管隧道的處理和淋巴結清掃。
1.2.1.1 盆腔淋巴結清掃:打開側盆壁腹膜,沿腰大肌外側3 cm處打開圓韌帶附著處至髂總動脈上2 cm處側盆壁腹膜,清除腰大肌外側脂肪組織,充分顯露髂血管區域。清除淋巴結,沿髂外動、靜脈血管走行,自下而上切除腹股溝深淋巴結、髂外淋巴結、髂總淋巴結,游離輸尿管、髂內動脈,顯露閉孔神經,切除閉孔淋巴結及髂內淋巴結。
1.2.1.2 根治性子宮切除術:打開骨盆漏斗韌帶,避開下方輸尿管,切除卵巢者高位電凝切斷卵巢懸韌帶及血管。于兩側圓韌帶中外1/3處鉗夾、離斷圓韌帶,剪開膀胱反折腹膜,下推膀胱到宮頸外口下4 cm。打開闊韌帶后葉,游離輸尿管,超聲刀剪開子宮直腸腹膜反折,下推直腸,分離兩側直腸側窩,避開輸尿管離宮頸3 cm鉗夾、凝切斷兩側骶韌帶。分別游離雙側輸尿管隧道,凝切處理子宮動脈。進一步下推膀胱及兩側輸尿管,距宮頸3 cm分別凝切兩側主韌帶。距宮頸外口3 cm處切開陰道前后壁,取下標本。
1.2.1.3 根治性宮頸切除術:先切除盆腔淋巴結送術中快速冰凍病理檢查,確定有無轉移。打開闊韌帶前葉,打開膀胱反折腹膜,下推膀胱至宮頸外口4 cm。暴露分離輸尿管,打開闊韌帶后葉,游離子宮動脈,打通輸尿管隧道,將輸尿管向后外側下推,于子宮峽部結扎子宮動脈下行支。游離直腸宮頸間隙,于盆底處切斷子宮骶骨、主韌帶及宮頸旁3 cm組織,于陰道宮頸下3 cm處切開陰道前壁,剪開陰道,于子宮峽部完整切斷宮頸,將組織裝入標本袋經陰道取出,再次送冰凍病理檢查宮頸上切緣和陰道壁切緣。子宮下段予不可吸收線荷包縫扎,陰道斷端與子宮斷端連續縫合成形,宮內放置弓形節育器(帶膠管)。
1.2.2 術后輔助治療
術后根據病理結果是否具有高危因素或者中危因素進行個體化輔助治療。高危因素包括盆腔淋巴結陽性、陰道切緣陽性和宮旁浸潤,具有任何一個高危因素均行同步放化療。中危因素包括淋巴脈管間隙浸潤、深層間質浸潤和腫瘤病灶較大,按Sedlis標準行放療或者同步放化療。
1.2.3 隨訪
術后2年內每3個月隨訪1次,術后2~5年每6個月隨訪1次,術后第6年開始每年隨訪1次,隨訪時間截至2022年1月。隨訪內容:婦科檢查、陰道殘端人乳頭瘤病毒(Human Papilloma Virus,HPV)和液基薄層細胞學檢測(Thinprep Cytologic Test,TCT)、SCC、CA125、CEA、上腹部B超、盆腔B超。年度檢查同時行盆腔MRI平掃+彌散+增強、全腹CT平掃+增強。
1.2.4 觀察指標
術后觀察指標包括手術時間、術中出血量、住院時間、切除淋巴結數和術后輔助治療情況。
1.2.5 統計學方法
所有數據采用SPSS 24.0軟件進行分析。計量資料以均數±標準差(x±s)表示,計數資料采用“例”表示,P<0.05差異有統計學意義。
2 結果
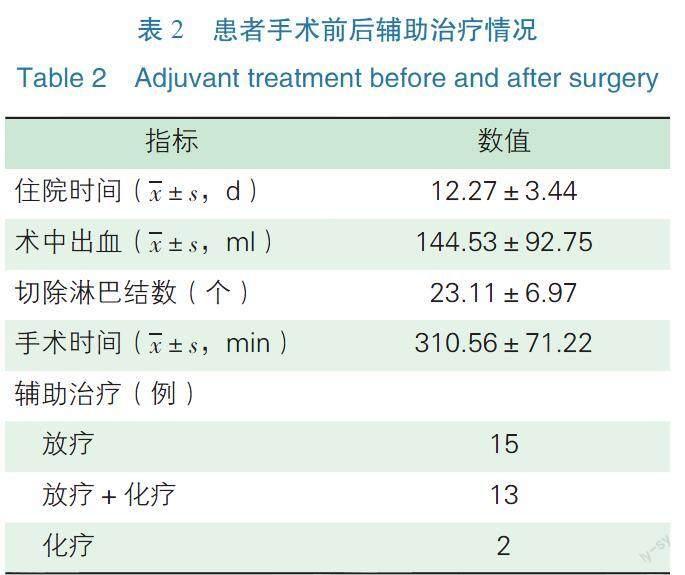
所有患者均順利完成機器人輔助手術,無中轉開腹。有4例患者給予新輔助化療。平均住院時間為(12.27±3.44)d,平均手術時間為(310.56±71.22)min,平均術中失血量為(144.53±92.75)ml,平均切除淋巴結數為(23.11±6.97)個。術后共有30例接受術后輔助治療,其中單純放療者15例,同步放化療者13例,化療者2例(見表2)。2例患者術后輔助化療的患者行保留生育功能手術,術后病理均存在淋巴脈管間隙浸潤。
隨訪結果:3例患者失訪,術后平均隨訪時間為(46.48±15.91)個月,最短隨訪時間為8個月,最長隨訪時間為81個月。61例患者全部存活,無死亡病例,其中僅1例患者復發,該例患者的病理類型為鱗癌,臨床分期為ⅠB1期,術前SCC為0.8 ng/ml,術后病理報告病灶大小為2.6 cm×1.5 cm×2.0 cm,浸潤至深肌層,深度約為1.4 cm,切除的28枚淋巴結均無轉移;術后接受輔助放療,于術后10個月發現盆腔轉移(恥骨),后續接受同步放化療,再口服阿帕替尼維持治療2年,目前仍然存活。其余60例患者隨訪至今未見復發。
3 討論
達芬奇機器人輔助手術在早期宮頸癌治療中的應用已有10余年。2005年,Marchal F等人[8]首先報道了機器人輔助手術治療婦科良惡性疾病。2006年,Sert B M等人[9]首先報道了1例ⅠB期宮頸癌患者行達芬奇機器人輔助Piver Ⅲ型根治性子宮切除。迄今已有多項回顧性研究將機器人輔助手術與傳統腹腔鏡手術、開腹手術對比,評價其圍手術期指標及腫瘤學結局。有回顧性研究報道,機器人輔助手術與傳統腹腔鏡相比,在圍手術期相關指標和生存率等方面均無明顯差別[10-11]。國內相對大樣本的回顧性研究報道表明,機器人輔助手術較傳統腹腔鏡手術有更短的手術時間和更少的術中失血量,但兩者在術后并發癥、OS和DFS等方面無明顯差異。有研究報道了關于216例機器人輔助手術和342例腹腔鏡手術的臨床資料,兩組患者的總體復發率(Total Recurrence Rate,TRR)分別為15.7%和12%,無進展生存時間(Progression-free Survival,PFS)分別為(28.91±15.68)個月和(28.34±15.13)個月,OS分別為92.13%和94.45%,以上差異均無統計學意義[12]。另有一篇Meta分析顯示,機器人輔助手術與腹腔鏡手術在手術時間、術中失血量、術中和術后并發癥、住院時間、腫瘤復發等方面比較,差異均無統計學意義(P>0.05)。而與開腹手術比較,機器人輔助手術有更少的術中失血量和更短的住院時間[13]。也有一些研究認為,機器人輔助手術的腫瘤學結局與開腹手術相似[2,14-16]。Shah C A等人[16]報道了109例機器人輔助手術和202例開腹手術的臨床資料,兩組患者的復發率(Recurrence Rate,RR)無明顯差別(10.1% Vs 10.4%,P=0.730)。據Alfonzo E等人[17]報道,機器人輔助手術和開腹手術在長期生存率和復發率方面比較,差異均無統計學意義(P>0.05)。該研究回顧性分析了628例機器人輔助手術患者與236 例開腹手術患者的臨床資料,結果顯示兩組患者的5年OS均為92%(HR=1.00,95% CI :0.5~2.01),DFS分別為84%和85%(HR=1.08,95% CI:0.66~1.78),而差異均無統計學意義(P>0.05)。以上研究均證明,機器人輔助手術是一個不亞于開腹手術的選擇。
在本研究中,64例患者的平均住院時間為(12.27±3.44) d,平均手術時間為(310.56±71.22) min,平均術中失血量為(144.53±92.75) ml。
除去失訪病例,其余患者中無死亡病例,僅1例出現復發。該患者術后病理提示有深間質浸潤且腫瘤直徑> 2 cm,術后行輔助放療,發現腫瘤復發后再次接受同步放化療,目前為帶瘤生存狀態。總體而言,圍手術期指標和腫瘤預后結局均獲得較滿意的結果。但是LACC研究的發表卻顛覆了之前的認知,該多中心隨機對照研究(Randomized Controlled Trial,RCT)報道,接受腹腔鏡或機器人輔助手術的宮頸癌患者,3年DFS和3年OS均低于開腹手術的宮頸癌患者。與其同期發表的另一篇大型流行病學回顧性研究分析了1225例微創手術患者及1236例開腹手術患者的臨床資料,中位隨訪時間為45個月,微創手術組 4年病死率為 9.1%,開腹組病死率為5.3%(HR=1.65,95% CI:1.22~2.22,P=0.002)。該結果也證實,微創手術組患者OS低于開腹手術組,且亞組分析顯示機器人輔助手術組病死率也明顯高于開腹手術組(HR=1.61,95% CI:1.18~2.21)。這兩項強有力的研究結果均提示微創手術(包括機器人手術系統)在治療早期宮頸癌方面劣于開腹手術,對微創手術方式(包括機器人輔助手術方式)治療早期宮頸癌提出了質疑。在統計學方面,LACC研究作為一個多中心前瞻性隨機對照試驗研究,再加上大型隊列研究數據的支持,其證據等級無疑是很高的,但是LACC研究是否也存在一定的偏倚呢?該研究團隊認為其研究結論不能完全類推到部分低風險患者,包括腫瘤直徑<2 cm、無淋巴脈管間隙浸潤、腫瘤浸潤深度<10 mm、無淋巴結轉移。也有學者認為,LACC 試驗結果中微創手術的OS和DFS低于開腹手術的原因,可能與CO2氣腹的使用及“無瘤原則”應用不當有關。嚴格執行“無瘤原則”,避免宮頸腫瘤組織顯露在CO2氣腹下可以減少腫瘤種植、轉移的風險。
開腹手術無疑是正確且標準的手術方式,但是徹底放棄微創手術,這種一刀切的做法對于婦瘤科醫生和患者也是不可取的。微創手術在縮短住院時間、減少手術出血量及術后疼痛等方面確實是有優勢的。目前,本團隊需要努力提高自身的手術操作技巧,時刻牢記“無瘤原則”,改進無瘤技術;避免直接鉗夾、切割腫瘤組織;避免使用舉宮器,減少對腫瘤組織的擠壓;切除陰道前先縫扎陰道,避免腫瘤組織脫落后形成種植;切除的淋巴結置入標本袋后再取出。同時,在術前應充分告知患者利弊,尊重患者的選擇。本團隊十分期待有更多的前瞻性RCT研究進一步評估機器人輔助手術的安全性和有效性。
參考文獻
[1] Nam J H, Park J Y, Kim D Y, et al. Laparoscopic versus open radical hysterectomy in early-stage cervical cancer: long-term survival outcomes in a matched cohort study[J]. Ann Oncol, 2012, 23(4): 903-911.
[2] Sert B M, Boggess J F, Ahmad S, et al. Robot-assisted versus open radical hysterectomy: a multi-institutional experience for early-stage cervical cancer[J]. Eur J Surg Oncol, 2016, 42(4): 513-522.
[3] Lee E J, Kang H, Kim D H. A comparative study of laparoscopic radical hysterectomy with radical abdominal hysterectomy for early-stage cervical cancer: a long-term follow-up study[J]. Eur J Obstet Gynecol Reprod Biol, 2011, 156(1): 83-86.
[4] Malzoni M, Tinelli R, Cosentino F, et al. Total laparoscopic radical hysterectomy versus abdominal radical hysterectomy with lymphadenectomy in patients with early cervical cancer: our experience[J]. Ann Surg Oncol, 2009, 16(5): 1316-1323.
[5] Ramirez P T, Frumovitz M, Pareja R, et al. Minimally invasive versus abdominal radical hysterectomy for cervical cancer[J]. N Engl J Med, 2018, 379(20): 1895-1904.
[6] Melamed A, Margul D J, Chen L, et al. Survival after minimally invasive radical hysterectomy for early-stage cervical cancer[J]. N Engl J Med, 2018, 379(20): 1905-1914.
[7] Bhatla N, Berek J S, Cuello Fredes M, et al. Revised FIGO staging for carcinoma of the cervix uteri[J]. Int J Gynaecol Obstet, 2019, 145(1): 129-135.
[8] Marchal F, Rauch P, Vandromme J, et al. Telerobotic-assisted laparoscopic hysterectomy for benign and oncologic pathologies: initial clinical experience with 30 patients[J]. Surg Endosc, 2005, 19(6): 826-831.
[9] Sert B M, Abeler V M. Robotic-assisted laparoscopic radical hysterectomy (Piver typeⅢ) with pelvic node dissection-case report[J]. Eur J Gynaecol Oncol, 2006, 27(5): 531-533.
[10] Corrado G, Vizza E, Legge F, et al. Comparison of different surgical approaches for stage IB1 cervical cancer patients: a multi-institution study and a review of the literature[J]. Int J Gynecol Cancer, 2018, 28(5): 1020-1028.
[11] Gallotta V, Conte C, Federico A, et al. Robotic versus laparoscopic radical hysterectomy in early cervical cancer: a case matched control study[J]. Eur J Surg Oncol, 2018, 44(6): 754-759.
[12] CHEN L, LIU L P, WEN N, et al. Comparative analysis of robotic vs laparoscopic radical hysterectomy for cervical cancer[J]. World J Clin Cases, 2019, 7(20): 3185-3193.
[13] ZHANG S S, DING T, CUI Z H, et al. Efficacy of robotic radical hysterectomy for cervical cancer compared with that of open and laparoscopic surgery: a separate meta-analysis of high-quality studies[J]. Medicine (Baltimore), 2019, 98(4): e14171.
[14] Mendivil A A, Rettenmaier M A, Abaid L N, et al. Survival rate comparisons amongst cervical cancer patients treated with an open, robotic-assisted or laparoscopic radical hysterectomy: a five year experience[J]. Surg Oncol, 2016, 25(1): 66-71.
[15] Diver E, Hinchcliff E, Gockley A, et al. Minimally invasive radical hysterectomy for cervical cancer is associated with reduced morbidity and similar survival outcomes compared with laparotomy[J]. Minim Invasive Gynecol, 2017, 24(3): 402-406.
[16] Shah C A, Beck T, Liao J B, et al. Surgical and oncologic outcomes after robotic radical hysterectomy as compared to open radical hysterectomy in the treatment of early cervical cancer[J]. Gynecol Oncol, 2017, 28(6): e82.
[17] Alfonzo E, Wallin E, Ekdahl L, et al. No survival difference between robotic and open radical hysterectomy for women with early-stage cervical cancer: results from a nationwide population-based cohort study[J]. Eur J Cancer, 2019. DOI: 10.1016/j.ejca.2019.05.016.

