大葉桉揮發物對蠶豆細胞毒性效應及信號調節
任雨敏 孟巧巧 王煜 馬丹煒


摘 要: 為探討大葉桉(Eucalyptus robusta)化感作用的細胞學機制,該研究以大葉桉揮發油及其主要成分α-蒎烯和桉油精為供體,以蠶豆(Vicia faba )的根細胞和葉保衛細胞為靶標,運用顯微技術、細胞化學技術和qRT-PCR技術,研究了大葉桉揮發物的毒性效應。結果表明:(1)在大葉桉揮發物作用下,蠶豆幼根生長受抑制并表現為時間-濃度依賴效應,其化感效應強弱由大到小依次為揮發油、α-蒎烯和桉油精。(2)蠶豆根邊緣細胞活性降低,分生區細胞微核率升高,有絲分裂指數下降且大部分細胞的細胞周期被阻滯在分裂前期。(3)蠶豆葉保衛細胞內NADPH氧化酶活性升高,活性氧(reactive oxygen species, ROS)爆發,微絲聚合,氣孔開度下降;葉保衛細胞的核畸變率升高,細胞活性降低甚至發生caspase依賴性細胞凋亡,而Ca2+通道阻斷劑(LaCl3)、活性氧清除劑(AsA)和硝酸還原酶抑制劑(NaN3)均可顯著提高保衛細胞存活率,說明大葉桉揮發物改變了信號分子Ca2+、ROS和NO的信號調節。綜上表明,大葉桉揮發物的細胞毒性和遺傳毒性改變了受體細胞的信號轉導途徑,誘發了細胞遺傳畸變,導致受體根邊緣細胞保護功能障礙和氣孔運動障礙,從而影響受體根系生長和光合作用,最終導致受體生長受阻。該研究結果為大葉桉種植區的科學種植和管理提供了理論依據。
關鍵詞: 大葉桉, 揮發物, 化感作用, 毒性效應, 信號調節
中圖分類號: Q942? 文獻標識碼: A? 文章編號: 1000-3142(2023)05-0947-13
Abstract: To understand the cytological mechanism of allelopathy of Eucalyptus robusta, the toxic effects of volatiles from E. robusta were studied by microscopic, cytochemical and qRT-PCR techniques, taking volatile oil from E. robusta and its main components α-pinene and eucalyptol as donors, and using root cells and leaf guard cells of Vicia faba as targets. The results were as follows: (1) The growth of radicle of V. faba were exhibited and showed a time-concentration dependent effects under the treatments of the volatiles of Eucalyptus robusta. The allelopathic effects were volatile oil, α-pinene and eucalyptol in descending order. (2) When Vicia faba roots were exposed to Eucalyptus robusta volatiles, the activity of root border cells decreased, the micronucleus rate of cells in the meristematic zone increased, mitotic index decreased, and the cell cycle of most cells was arrested in the prophase of division. (3) Under the action of the volatiles of E. robusta, the activity of NADPH oxidase increased, reactive oxygen species (ROS) burst in leaf guard cells of Vicia faba, microfilament polymerization, and stomatal aperture decreased. At the same time, the leaf epidermis strip of V. faba was treated with Eucalyptus robusta volatiles, the nuclear distortion rate of leaf guard cells increased. Moreover, the treatment of E. robusta volatiles led to the decrease of guard cell activity and caspase-dependent apoptosis in Vicia faba. However, the guard cell survival rates increased when the leaf epidermis strips of V. faba were exposed to volatiles from Eucalyptus robusta combined with different concentrations of Ca2+channel blocker (LaCl3), ROS scavenger ascorbic acid (AsA), and nitrate reductase inhibitors (NaN3), which indicated that the volatiles of E. robusta changed the signal regulation of Ca2+, ROS and NO. These results suggested that the cytotoxicity and genotoxicity of the volatiles of E. robusta altered the signal transduction pathway of the receptor cells, induced the genetic aberration of the root tip cells, then led to the dysfunction of protective function and stomatal movement of the receptor root border cells, which affected the root growth and photosynthesis of the receptor, and ultimately hindered the growth of receptor. The results provide a theoretical basis for scientific planting and management of E. robusta planting area.
Key words: Eucalyptus robusta, volatiles, allelopathy, toxic effects, signal regulation
大葉桉(Eucalyptus robusta)為桃金娘科(Myrtaceae)桉屬(Eucalyptus)喬木植物,原產于澳大利亞,因其適應性強、生長快而被稱為世界三大速生樹種之一(單體江等,2019)。大葉桉屬于藥源性植物,其葉和果實都有抗菌(Said et al., 2016)、抗氧化(Elansary et al., 2017)和抗腫瘤(Jian et al., 2017)等藥理活性,具有極其重要的社會價值、生態價值和經濟價值。近年來,因種植桉樹而引起的生物多樣性下降、生態系統功能和效益喪失、土壤肥力下降等問題受到了學術界和社會的高度關注(Bayle, 2019)。桉葉揮發油及其主要成分α-蒎烯、桉油精等具有明顯的化感毒性作用,可以通過誘導氧化損傷抑制受體種子萌發和幼苗生長 (Jamil et al., 2021;Ridaoui et al., 2022)。本項目組前期研究發現,大葉桉葉揮發油含α-蒎烯、β-蒎烯、桉油精、檸檬烯、松香芹醇和β-松油醇等化學成分,其中α-蒎烯和桉油精是含量較高的成分(孟巧巧等,2020)。
氣孔是CO2、水分和其他物質進出葉片的通道,保衛細胞通過膨壓變化控制氣孔開度,平衡光合作用所需的CO2和水分,從而影響植物的蒸騰和光合作用(陸雯蕓等,2016)。保衛細胞與表皮細胞形態差異較大且對化感脅迫反應靈敏,在鵝掌楸(Liriodendron chinense)(劉巧麗等,2021)、土荊芥(Dysphania ambrosioides)(翁可佳等,2018)和馬纓丹(Lantana camara)(Singh et al., 2014)、辣子草(Galinsoga parviflora)(周健等,2016)的化感脅迫下,受體的保衛細胞活性降低,并發生caspase 依賴性的細胞凋亡,信號分子ROS、NO和 Ca2+調節了細胞凋亡過程(周健等,2017)。此外,植物釋放的化感物質還能干擾受體根尖分生區細胞DNA復制、染色體分離以及紡錘體的功能(趙紅梅和王慧陽,2017;Li et al., 2018);根邊緣細胞(root border cells, RBCs)是從根冠表皮游離出來且聚集在根尖周圍的一群特殊細胞,與其胞外黏膠層在根際共同構筑了抵御外界脅迫的第一道防線(Driouich et al., 2021)。光合作用固定的碳部分通過根系分泌物的形式釋放到土壤中(Vives-Peris et al., 2020),其中 98%的根系分泌物為根邊緣細胞及其胞外物質(Hawes et al., 2016),在根與土壤微生物的相互作用中起主要作用(Ropitaux et al., 2020)。當植物受到生物或非生物脅迫時,根邊緣細胞基因表達改變,黏膠層厚度進一步增大,以吸附和排斥病原體或通過螯合有毒物質,以緩解脅迫對根的傷害,從而保護根尖分生組織(Driouich et al., 2021;何勝利等,2022)。因此,進入土壤的化感物質只有突破根邊緣細胞及其黏膠層構筑的防御屏障,才會傷害到根尖細胞,危及植物根系的健康生長。當揮發性化感物質釋放到環境后,大部分揮發到空氣中作用于植物的地上部分,小部分會通過土壤吸附、淋溶、根系分泌等途徑進入土壤。保衛細胞構成了物質進出植物體的門戶——氣孔,而根邊緣細胞則是根系和土壤之間的屏障,二者無疑是揮發性化感物質作用的首要靶標。受體如何響應化感物質是一個十分復雜的問題,高等植物機體由多細胞構成,每一種細胞的生命活動均會受機體其他細胞制約。顯然,以單細胞模式系統作為研究化感作用的對象,可以排除其他細胞生命活動的干擾。近年來,學者們逐漸關注到根邊緣細胞(Latif et al., 2017;Ma et al., 2020;Xie et al., 2021)和保衛細胞(周健等,2017)對化感脅迫的響應及其機制。與以整個植株作為受試靶標相比,保衛細胞和根邊緣細胞不僅具有反應靈敏、取材方便、易于控制試驗條件、耗費少、周期短等優勢(周健等,2017;Wang et al., 2019),而且能夠直觀地洞察到化感作用這一自然現象的本質。然而,保衛細胞和根邊緣細胞如何響應大葉桉揮發物的化感效應卻鮮有報道。
大葉桉功能多樣化可應用于醫藥(蘭宏偉等,2020)、生態(田雪晨和陳賢興,2014)、農業(劉紅芳和邸仕忠,2018)等領域,而現有研究偏重于大葉桉揮發性成分的藥理作用,極少關注其種植對生境內其他植物的毒害作用。為進一步挖掘大葉桉揮發性成分的化感作用,本研究以其揮發油及主要成分α-蒎烯和桉油精為供體,以中國大葉桉種植區廣泛分布的農作物蠶豆(Vicia faba)為受體,以葉保衛細胞、根邊緣細胞和根尖細胞為靶標,運用蠶豆根尖微核技術、光學顯微鏡技術、細胞化學技術和qRT-PCR技術,在評估大葉桉揮發物化感效應及其對根尖有絲分裂行為影響的基礎上,進一步分析蠶豆葉保衛細胞和根邊緣細胞對大葉桉揮發物的響應及其信號機制,以期從細胞學角度揭示大葉桉化感作用機制,為大葉桉種植區的科學種植和管理提供理論依據。
1 材料與方法
1.1 試驗材料
所用材料大葉桉的葉采自四川師范大學校區及其附近街道;蠶豆的種子(成胡14#)購自成都市龍泉驛區大面鎮街道種子市場;標準品α-蒎烯(≥99%)和桉油精(≥99%)購自科賽斯特(成都)科技有限公司。
1.2 試驗方法
A組:參照周健等(2017)的方法培養蠶豆幼苗,待幼苗生長3~4周時,取頂端第1~2對完全展開的葉片,用蒸餾水沖洗干凈,選取非葉脈部位用鑷子撕取1 cm × 0.5 cm的葉下表皮條,浸泡于盛有MES緩沖液的EP管中。
B組:選取大小均勻且飽滿的健康蠶豆種子(趙紅梅和王慧陽,2017),在0.5% KMnO4溶液中浸泡15 min,沖洗干凈后置于(25±1)℃培養箱中,黑暗條件下浸種24 h后均勻置于墊有濕潤紗布的瓷盤中,覆蓋一層浸濕的紗布,繼續培養至種子露白。選取長勢一致的露白種子,均勻置于墊有2層濾紙的培養瓶(直徑6.8 cm、高度9.2 cm)中,每瓶3顆。
處理母液的制備:參照孟巧巧等(2020)的水蒸氣蒸餾法提取大葉桉揮發油,得率為0.43%,質量濃度為836.667 mg·mL-1,采用GC-MS法確定揮發油主要成分α-蒎烯(≥99%)和桉油精(≥99%)的含量。用二甲基亞砜(DMSO)作助溶劑配制濃度為0.1 μL·μL-1的大葉桉葉揮發油母液;根據α-蒎烯和桉油精在揮發油中的含量,其處理母液濃度分別設置為0.419 1、0.076 8 μL·μL-1。
1.3 試驗處理及指標測定
1.3.1 遺傳毒性試驗 分別取處理母液1、2、3、4、5 μL,均勻涂抹在B組培養瓶蓋中部并旋緊瓶蓋,置于(25 ± 1)℃的培養箱中避光培養24、48、72 h,以未涂抹揮發物的處理作為對照,每處理重復5次,處理結束后測定參數。
根長測定:將根尖用蒸餾水洗凈,用濾紙吸干水分,用直尺測量根長,每個處理作15個平行測定。
有絲分裂指數和微核率測定:待處理結束后更換干凈的培養瓶蓋,繼續恢復培養24 h后,截取長約0.5 cm的根尖,用卡諾固定液固定24 h、1 mol·L-1 HCl 60 ℃ 解離8 min、改良苯酚品紅染液染色,壓片,用Nikon E200攝影顯微鏡鏡檢且拍照。每個根尖計數1 000個細胞,每個處理5個根尖。計算微核率(micronucleus frequency,MCN)和有絲分裂指數(mitotic index,MI)。計算公式如下:
MCN=(微核數/觀測細胞數)×1000‰;
MI=(M期細胞數/觀測細胞數)×100%。
1.3.2 葉表皮條試驗 將A組表皮條隨機分為3組:第1組,分別取2、4、6、8、10 μL處理母液,用DMSO補足體積為10 μL后,加入裝有表皮條的EP管中,以10 μL MES緩沖液為對照;第2組,分別加入10 μL泛caspase抑制劑Z-VAD-FMK(10、40 μmol·L-1)、Ca2+通道阻斷劑(0.1 mmol·L-1LaCl3)、活性氧清除劑抗壞血酸(0.1 mmol·L-1AsA)和硝酸還原酶抑制劑(0.1 mmol·L-1NaN3)處理5 min后,加入8 μL處理母液和2 μL DMSO,設置陰性對照(CK為MES緩沖液)和陽性對照(處理母液8 μL);第3組,置于25 ℃、4 000 lx的光照培養箱2 h后,用10 μL的微絲聚合抑制劑細胞松弛素B(CB,10、20 μmol·L-1)、NADPH氧化酶抑制劑二聯苯碘(DPI,1、2 μmol·L-1)和活性氧清除劑抗壞血酸(0.1 mmol·L-1)分別處理5 min后,加入8 μL處理母液和2 μL DMSO。以不加CB、DPI和AsA的MES緩沖液為CK陰性對照,以8 μL處理液單獨處理為陽性對照。3組處理混勻后均置于25 ℃、4 000 lx光照培養箱處理30 min,待處理結束后測定氣孔開度、細胞核形態、保衛細胞活性、胞內ROS、NO和Ca2+水平以及TUNEL(黃素等,2019)等指標。
qRT-PCR分析:取第1組葉表皮條,用液氮充分研磨,按照武漢塞維爾生物科技有限公司的植物總RNA提取試劑盒操作說明提取蠶豆葉表皮條的總RNA;用Primer Premier 5.0引物設計軟件,設計蠶豆NADPH氧化酶基因(Rboh)和內參基因(EF-1-alpha)特異性引物,序列如下:
Rboh F:5′-GGGTATTTGCTCTGTGGATTGG-3′;
Rboh R:5′-CCTGAGCCAAGTAATGGTGTTTC-3′;
EF-1-alpha F:5′-ACGAGGCTCTCACTGAGGCTCTTCC-3′;
EF-1-alpha R:5′-CCTTGGCAGGGTCATCCTTGGAGTTG-3′。
引物均由武漢塞維爾生物科技有限公司合成。使用熒光定量PCR儀(Stepone plus,ABI)進行qRT-PCR分析。反應體系為25 μL,含qPCR Mix 12.5 μL、7.5 μmol·L-1基因引物2.0 μL、反轉錄產物2.5 μL、ddH2O 8.0 μL。PCR擴增程序:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,40個循環;每處理重復3次,以MES緩沖液為CK對照;使用StepOne Software v2.3軟件分析PCR過程的CT(threshold cycle)值。
1.3.3 根邊緣細胞活性測定 將B組根培養至長約2 cm時,隨機截取 5個根尖,置于EP管中,向其中加入100 μL ddH2O,渦旋振蕩30 s,取出根尖用ddH2O沖洗2次,每次50 μL,移液槍吹打使細胞分散,得到根邊緣細胞懸液;分別取處理母液1、2、3、4、5 μL,用DMSO補足體積為5 μL后,分別加入200 μL細胞懸液,以DMSO為溶劑對照組、ddH2O為陰性對照組,置于(25±1)℃的培養箱中避光培養30 min,每處理重復3次;處理結束后,分別取10 μL細胞懸液,加入4 μL AO/EB染料,暗處染色2~3 s,熒光顯微鏡鏡檢,統計死細胞和活細胞的數量,并計算根邊緣細胞死亡率。計算公式如下:
死亡率=(死細胞/總細胞計數)×100%。
1.4 數據統計分析
使用Microsoft Excel 2019軟件進行數據統計和作圖,用SPSS 20.0軟件對數據進行ANOVA單因素方差分析和Tukey法進行多重比較分析。
2 結果與分析
2.1 大葉桉揮發物的化感效應及其遺傳毒性
2.1.1 大葉桉揮發物對蠶豆的化感效應 由圖1可知,大葉桉揮發油、α-蒎烯和桉油精對蠶豆幼根伸長具有顯著抑制效應(P<0.05),并表現為時間-濃度依賴效應。用最大濃度處理72 h后,大葉桉揮發油、α-蒎烯和桉油精處理組的蠶豆根長比對照組分別減少了80.62%、76.74%和75.19%。
2.1.2 大葉桉揮發物的遺傳毒性 在大葉桉揮發油、α-蒎烯和桉油精的作用下,蠶豆根尖分生區細胞的有絲分裂指數下降(圖2)。在1 μL處理母液作用下,有絲分裂指數升高,其中24 h處理組的變化最為顯著。當處理母液大于1 μL時,與對照組相比,隨著處理母液濃度增加和處理時間延長,有絲分裂指數顯著下降(P<0.05)。在各處理組M期(有絲分裂期)的各時相(前、中、后、末)細胞數目中大部分細胞的細胞周期被阻滯在分裂前期;當揮發油處理母液高于4 μL時,有絲分裂指數趨于平穩,表明該濃度下蠶豆根尖已嚴重受損。
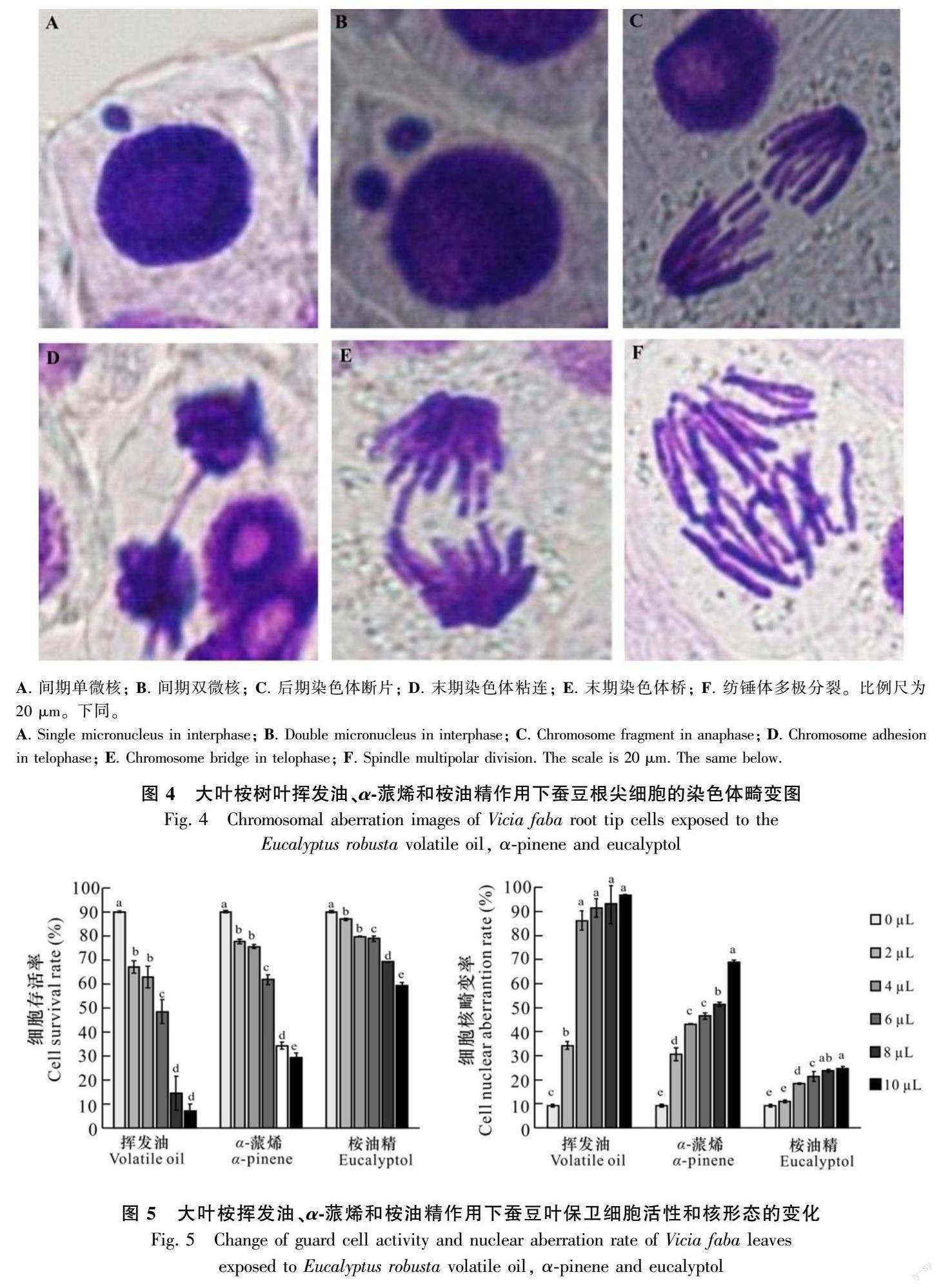
各處理組的微核率均顯著高于對照組(P<0.05),呈先升高后降低的趨勢(圖3),在處理母液為3 μL時微核率達到最大值,以48 h處理組的變化最顯著,其揮發油、α-蒎烯和桉油精微核率分別為12.24%、10.89%和7.48%。大葉桉揮發物誘導蠶豆根尖發生染色體畸變,如染色體斷片、粘連和出現染色橋、微核等現象(圖4)。
2.2 大葉桉揮發物對蠶豆葉保衛細胞活性的影響
由圖5可知,在大葉桉揮發油、α-蒎烯和桉油精作用下,蠶豆葉保衛細胞活性降低,細胞核畸變率升高,并表現為濃度依賴效應。其化感效應強弱由大到小依次為揮發油、α-蒎烯和桉油精。在最大處理濃度下,揮發油、α-蒎烯、桉油精3個處理組的保衛細胞活性為對照組的7.01%、29.48%、59.56%,細胞核形態異常率分別為96.96%、68.78%、24.74%。
半胱氨酸蛋白酶(caspase)是一組與細胞凋亡密切相關的蛋白水解酶,當用泛caspase抑制劑Z-VAD-FMK與大葉桉揮發物共處理后,各處理組保衛細胞活性均較揮發物處理組升高且與Z-VAD-FMK濃度呈正相關(圖6:B),表明大葉桉揮發物處理導致保衛細胞發生凋亡。TUNEL法檢測結果發現,揮發物處理組葉保衛細胞的綠色熒光強度大于caspase抑制劑+揮發物共處理組(圖6:A),表明大葉桉揮發物誘導蠶豆葉保衛細胞發生了caspase依賴性細胞凋亡。
應用ROS、NO和Ca2+熒光定位試驗和三者抑制劑+揮發物共處理試驗,驗證了大葉桉揮發物作用下蠶豆葉保衛細胞的ROS、NO和Ca2+水平的變化。由圖7可知,對照組保衛細胞具有較弱的綠色熒光,即胞內ROS、NO和Ca2+水平均較低;處理組保衛細胞內3種熒光信號均明顯高于對照組,說明大葉桉揮發物誘導保衛細胞內ROS、NO和Ca2+水平升高。NaN3+處理液、AsA+處理液2個共處理組中,ROS、Ca2+和NO水平低于揮發物處理組,而LaCl3+處理液共處理組保衛細胞內的Ca2+水平低于揮發物處理組(圖8),說明在大葉桉揮發物誘導的細胞死亡過程中,ROS和NO能調節胞內Ca2+水平。
由圖9可知,與揮發物處理組相比,用Ca2+通道阻斷劑(LaCl3)、活性氧清除劑抗壞血酸(AsA)和硝酸還原酶抑制劑(NaN3)分別與處理母液共同作用時,保衛細胞存活率顯著升高(P<0.05)。這進一步證明大葉桉揮發油、α-蒎烯和桉油精誘導的細胞死亡與細胞內ROS、NO和Ca2+有關。
2.3 大葉桉揮發物對蠶豆氣孔運動的影響
大葉桉揮發物導致蠶豆葉氣孔開度呈濃度依賴性逐漸下降(圖10),在最大濃度處理下,揮發油、α-蒎烯和桉油精3個處理組的氣孔開度分別較對照組下降了86.65%、78.31%和75.38%;當NADPH氧化酶抑制劑二聯苯碘(DPI)、活性氧清除劑抗壞血酸(AsA)和微絲聚合抑制劑細胞松弛素B(CB)分別與大葉桉揮發物共處理時,保衛細胞氣孔關閉現象顯著降低(P<0.05)(圖11),表明大葉桉揮發物誘導的ROS水平和NADPH氧化酶活性的升高以及微絲聚合是導致氣孔關閉的原因。qRT-PCR結果(圖12)顯示,在大葉桉揮發物作用下,蠶豆葉片內NADPH氧化酶基因Rboh表達顯著上調。
2.4 大葉桉揮發物對根邊緣細胞活性的影響
由圖13可知,蠶豆根邊緣細胞活性隨大葉桉揮發物處理濃度升高而降低,死亡率顯著增加(P<0.05)。與陰性對照組(0 μL)相比,溶劑對照組(DMSO)的根邊緣細胞活性差異不顯著(P>0.05),表明助溶劑DMSO對根邊緣細胞活性沒有顯著影響。當處理濃度達到5 μL時,揮發油、α-蒎烯、桉油精處理組根邊緣細胞死亡率分別比對照組(0 μL)增加了5.65、4.13、2.12倍。
3 討論
植物釋放到環境中的化感物質會影響其他植物的生長和生態功能(Oln & Koce, 2021),如降低植物吸收水分、無機鹽、有機質等養分的能力,降低對資源的利用率,從而影響該植物的生長發育(馬光宗等,2022)。桉葉中含有對植物有化感作用的揮發性成分,如α-松果醇,可以抑制種子萌發和植物生長(Li et al., 2020)。本研究結果表明,在大葉桉揮發物作用下,蠶豆幼根生長受抑制且表現為時間-濃度依賴效應,其中大葉桉葉揮發油的化感效應最強,α-蒎烯次之,桉油精最弱。植物根的生長與根尖細胞的分裂和伸長密切相關,當蠶豆幼根受到大葉桉揮發物作用時分生區細胞有絲分裂指數下降,表現出與根長相似的變化規律,表明大葉桉揮發性化感物質作為非生物脅迫對蠶豆根的抑制效應與其干擾根尖細胞有絲分裂行為有關。處理濃度較低時,絕大多數根尖細胞有絲分裂被阻滯在前期,但隨著處理濃度增大前期細胞比例逐漸減少,推測大葉桉揮發性化感物質可能抑制了細胞DNA的復制和蛋白質的合成,阻礙了細胞周期的進程,使細胞不能進入下一次的分裂期,從而導致分生區有絲分裂指數下降,根生長受到抑制(Vasconcelos et al., 2019)。同時,蠶豆根尖細胞內微核率上升并出現染色體斷片、紡錘體多極分裂、染色體粘連等多種染色體畸變現象,表明大葉桉樹揮發油、α-蒎烯和桉油精抑制了蠶豆根尖細胞紡錘體的形成并干擾了某些染色體運動而導致染色體斷裂和損傷,斷裂的染色體在機體免疫保護作用下形成染色體橋,無著絲粒的形成會引起微核的出現,造成不可逆的遺傳毒性效應。本研究結果與Aragao等(2015)研究發現大葉桉揮發油及其單萜烴類能夠導致萵苣(Lactuca sativa)根尖分生區細胞死亡,染色體變異這一結果相似。根邊緣細胞及其胞外黏膠層是植物根和土壤之間的保護屏障(Ropitaux et al., 2020;Driouich et al., 2021),在抵抗生物和非生物脅迫中對根尖起到一定的保護作用。何勝利等(2022)研究發現,土荊芥揮發油及其主要化感物質下根邊緣細胞活性下降,黏膠層厚度增加,在一定程度上抵御了揮發物化感脅迫對根尖的傷害。在大葉桉揮發物作用下,蠶豆根邊緣細胞活性呈濃度依賴性下降,由此降低且削弱其保護功能,進而干擾根尖細胞的有絲分裂,抑制根的伸長生長。
氣孔是植物氣體交換、水分蒸騰和病菌入侵的主要門戶(Qi et al., 2018;Ma & Bai, 2021),氣孔開度的調節通過保衛細胞的運動來實現。細胞骨架、Ca2+、ROS和NO等因子通過不同的方式、信號途徑調控氣孔運動, 使氣孔能靈活地響應各種環境(胡子英等,2017)。ROS在植物感知脅迫、整合各種環境信號、激活脅迫響應網絡中起著關鍵作用(Mittler et al., 2022),細胞內ROS的產生與NADPH氧化酶和微絲動態調控密切相關(Agurla et al., 2020)。微絲動態的變化會引起胞內NADPH氧化酶發生改變(Stanley et al., 2014)。本研究結果表明,在大葉桉揮發油及其主要成分作用下,蠶豆葉保衛細胞內NADPH氧化酶基因Rboh表達上調,酶活性增加,ROS爆發,保衛細胞核畸變率升高,保衛細胞發生caspase依賴性凋亡,氣孔開度下降,上述現象具有濃度依賴效應。這與黃素等(2019)對土荊芥揮發油作用于玉米保衛細胞的研究結果相似。當用微絲聚合抑制劑細胞松弛素B(CB)處理后,大葉桉揮發油及其主要成分誘導的氣孔關閉現象明顯阻滯,表明微絲可能通過調節NADPH氧化酶在保衛細胞質膜不同部位的分布,控制ROS在細胞壁上的產生部位,從而精確調控不同位置細胞壁的松弛而參與氣孔運動(胡子英等,2017)。當植物受到逆境脅迫時,通過NO、ROS、Ca2+等信號分子相互協調,調控不同的信號途徑使保衛細胞的膨壓變化來響應所受的逆境脅迫(Fichman & Mittler, 2020)。在逆境脅迫下,ROS和NO之間的平衡對調控細胞凋亡至關重要(Petrov et al., 2015)。NO能夠作為一種抗氧化劑直接淬滅ROS,減少膜脂過氧化,而高濃度的NO可以導致ROS爆發,引起細胞產生氧化損傷而凋亡(Hasanuzzaman et al., 2018;何勝利等,2022)。Ca2+通道能夠被ROS激活,引起胞外Ca2+內流,胞內Ca2+水平升高,從而導致DNA 在核小體的連接點被激活了的Ca2+依賴性核酸內切酶切割,繼而引發細胞凋亡(Pei et al., 2000)。本研究結果發現,在大葉桉揮發油及其主要成分α-蒎烯和桉油精誘導的保衛細胞死亡過程中,保衛細胞內ROS、NO和Ca2+水平明顯升高,加入AsA、NaN3和LaCl3時,保衛細胞存活率顯著上升,表明在大葉桉揮發油、α-蒎烯和桉油精處理下保衛細胞內ROS的爆發引起胞內Ca2+水平升高,誘發了蠶豆保衛細胞的死亡。此外,NO 參與了大葉桉揮發油、α-蒎烯和桉油精誘導蠶豆保衛細胞的死亡。ROS、NO和Ca2+信號系統調控程序性細胞死亡是植物抵御逆境脅迫的一種基本機制(周健等,2017)。以上結果表明,大葉桉揮發油、α-蒎烯和桉油精誘導的保衛細胞死亡,可能是通過ROS 和 NO 調控保衛細胞內 Ca2+水平的變化而引起的。
4 結論
綜上所述,大葉桉揮發性化感物質具有細胞毒性和遺傳毒性。一方面,通過降低蠶豆根邊緣細胞活性削弱受體保護屏障,干擾分生區細胞有絲分裂行為并引起遺傳畸變,從而抑制根的生長;另一方面,誘導蠶豆葉保衛細胞ROS爆發,干擾細胞骨架功能而改變氣孔運動,引起保衛細胞核畸變并發生caspase依賴性凋亡,在此過程中,胞內ROS和NO的水平上調引起胞內Ca2+水平增加。
參考文獻:
AGURLA S, SUNITHA V, RAGHAVENDRA AS, 2020. Methyl salicylate is the most effective natural salicylic acid ester to close stomata while raising reactive oxygen species and nitric oxide in Arabidopsis guard cells [J]. Plant Physiol Biochem, 57: 276-283.
ARAGAO FB, PALMIERI MJ, FERREIRA A,et al., 2015. Phytotoxic and cytotoxic effects of Eucalyptus essential oil on lettuce (Lactuca sativa L.) [J]. Allelopathy J, 35(2): 259-272.
BAYLE GK, 2019. Ecological and social impacts of Eucalyptus tree plantation on the environment [J]. J Biodivers Conserv Bioresour Manage, 5(1): 93-104.
DRIOUICH A, GAUDRY A, PAWLAK B, et al., 2021. Root cap-derived cells and mucilage: a protective network at the root tip [J]. Protoplasma, 258(6): 1179-1185.
ELANSARY HO, SALEM MZM, ASHMAWY NA, et al., 2017. In vitro antibacterial, antifungal and antioxidant activities of Eucalyptus spp. leaf extracts related to phenolic composition [J]. Nat Prod Res, 31(24): 2927-2930.
FICHMAN Y, MITTLER R, 2020. Rapid systemic signaling during abiotic and biotic stresses: is the ROS wave master of all trades? [J]. Plant J, 102(5): 887-896.
HASANUZZAMAN M, OKU H, NAHAR K, et al., 2018. Nitric oxide-induced salt stress tolerance in plants: ROS metabolism, signaling, and molecular interactions [J]. Plant Biotechnol Rep, 12(2): 77-92.
HAWES M, ALLEN C, TURGEON BG, et al., 2016. Root border cells and their role in plant defense [J]. Annu Rev Phytopathol, 54(1): 143-161.
HE SL, GU CJ, MA DW, et al., 2022. Regulation of signaling molecules reactive oxygen species and NO in the allelopathic stress-induced cell death of Vicia faba root margin cells in Dysphania ambrosioides [J]. Acta Ecol Sin, 42(2): 818-827. [何勝利, 谷從璟, 馬丹煒, 等, 2022. 信號分子活性氧和NO在土荊芥化感脅迫誘導蠶豆根邊緣細胞死亡中的調控 [J]. 生態學報, 42(2): 818-827.]
HU ZY, REN JJ, YU Q, et al., 2017. The role and mechanism of microfilament skeleton and reactive oxygen species in regulating stomatal movement [J]. Chin J Cell Biol, 39(4): 510-514. [ 胡子英, 任靜靜, 余琴, 等, 2017. 微絲骨架和活性氧在調節氣孔運動中的作用及機制 [J]. 中國細胞生物學學報, 39(4): 510-514.]
HUANG S, LI J, MA DW, et al., 2019. Caspase-dependent apoptosis and signal regulation of Zea mays guard cells induced by volatile oil of Dysphania ambrosioides [J]. SW Chin J Agric Sci, 32(5): 1023-1027. [ 黃素, 李潔, 馬丹煒, 等, 2019. 土荊芥揮發油誘導玉米保衛細胞Caspase依賴性凋亡及信號調節 [J]. 西南農業學報, 32(5): 1023-1027.]
JAMIL MA, AHMAD A, NAEEM S, et al., 2021. Role of allelopathy for suppression of Parthenium hysterophorus: a review [J]. Int J Food Sci Agric, 5(3): 376-380.
JIAN KL, ZHANG C, SHANG ZC, et al., 2017. Eucalrobusone C suppresses cell proliferation and induces ROS-dependent mitochondrial apoptosis via the p38 MAPK pathway in hepatocellular carcinoma cells [J]. Phytomedicine, 25: 71-82.
LAN HW , ZHOU ZZ, ZOU ML, et al., 2020. Effects of Eucalyptus robusta globulin decoction combined with shortwave ultraviolet irradiation on residual wound healing and serum IL-1β, TNF-α and IL-6 expression in deep burn [J]. Chin J Aesthetic Med, 29(8): 88-92. [蘭宏偉, 周忠志, 鄒梅林, 等, 2020. 大葉桉煎劑浸浴聯合短波紫外線照射對深度燒傷殘余創面愈合及血清IL-1β、TNF-α、IL-6表達的影響 [J]. 中國美容醫學, 29(8): 88-92.]
LI AX, WU HW, FENG YJ, et al., 2020. A strategy of rapidly screening out herbicidal chemicals from Eucalyptus essential oils [J]. Pest Manage Sci, 76(3): 917-927.
LI J, HE YQ, MA DW, et al., 2018. Volatile allelochemicals of Chenopodium ambrosioides L. induced mitochondrion-mediated Ca2+-dependent and caspase-dependent apoptosis signaling pathways in receptor plant cells [J]. Plant Soil, 425(1/2): 297-308.
LIU HF, DI SZ, 2018. Analysis of bioactivity and active components of ethanol extract of Eucalyptus robusta against stemoma mustard downy mildew [J]. Bull Agric Sci Technol, (2): 141-144. [劉紅芳, 邸仕忠, 2018. 大葉桉乙醇提取物對莖瘤芥霜霉病的生物活性及其活性成分分析 [J]. 農業科技通訊, (2): 141-144.]
LIU QL, WU ZX, LI HH, et al., 2021. Effects of water extract from Liriodendron chinense leaves on seed germination and seedling growth of Salvia miltiorrhiza [J]. Jiangxi Sci, 39(5): 820-825. [劉巧麗, 吳照祥, 李輝虎, 等, 2021. 雜交鵝掌楸葉水提液對丹參種子萌發及幼苗生長的影響 [J]. 江西科學, 39(5): 820-825.]
LU WY, FANG K, BIAN HW, et al., 2016. Research progress on stomatal development and its regulatory factors [J]. Plant Physiol J, 52(6): 782-788. [陸雯蕓, 房克, 邊紅武, 等, 2016. 氣孔發育及其調控因素的研究進展 [J]. 植物生理學報, 52(6): 782-788.]
MA GZ, XU GF, YANG SS, et al., 2022. Allelopathic effects of Dioscorea esculenta extracts on seed germination and seedling growth of three weeds [J]. SW Chin J Agric Sci, 35(6): 1295-1302. [馬光宗, 徐高峰, 楊韶松, 等, 2022. 甘薯提取物對3種雜草種子萌發和幼苗生長的化感作用 [J]. 西南農業學報, 35(6): 1295-1302.]
MA JH, FENG XX, YANG XH, et al., 2020. The leaf extract of crofton weed (Eupatorium adenophorum) inhibits primary root growth by inducing cell death in maize root border cells [J]. Plant Divers, 42(3): 174-180.
MA X, BAI L, 2021. Elevated CO2 and reactive oxygen species in stomatal closure [J]. Plants, 10(2): 410.
MENG QQ, YUE HY, ZHANG YQ, et al., 2020. Preliminary study on the constituents of volatile oils from three Eucalyptus leaves in Chengdu and their antitumor activity in vitro [J]. SW Chin J Agric Sci, 33(3): 540-546. [ 孟巧巧, 岳海燕, 張玉琴, 等, 2020. 成都地區3種桉樹葉揮發油成分與體外抗腫瘤活性的初步研究 [J]. 西南農業學報, 33(3): 540-546.]
MITTLER R, ZANDALINAS SI, FICHMAN Y, et al., 2022. Reactive oxygen species signalling in plant stress responses [J]. Nat Rev Mol Cell Biol, 23(10): 1-17.
OLN K, KOCE JD, 2021. Allelopathic root inhibition and its mechanisms [J]. Allelopathy J, 52(2): 181-198.
PEI ZM, MURATA Y, BENNING G, et al., 2000. Calcium channels activated by hydrogen peroxide mediate abscisic acid signalling in guard cells [J]. Nature, 406(6797): 731-734.
PETROV V, HILLE J, MUELLER-ROEBER B, et al., 2015. ROS-mediated abiotic stress-induced programmed cell death in plants [J]. Front In Plant Sci, 6: 69.
QI J, SONG CP, WANG B, et al., 2018. Reactive oxygen species signaling and stomatal movement in plant responses to drought stress and pathogen attack [J]. J Integr Plant Biol, 60(9): 805-826.
RIDAOUI K, GUENAOU I, TAOUAM I, et al., 2022. Comparative study of the antioxidant activity of the essential oils of five plants against the H2O2 induced stress in Saccharomyces cerevisiae [J]. Saudi J Biol Sci, 29(3): 1842-1852.
ROPITAUX M, BERNARD S, SCHAPMAN D, et al., 2020. Root border cells and mucilage secretions of soybean, Glycine max (Merr) L.: characterization and role in interactions with the oomycete Phytophthora parasitica [J]. Cells, 9(10): 2215.
SAID ZBOS, HADDADI-GUEMGHAR H, BOULEKBACHE-MAKHLOUF L,et al., 2016. Essential oils composition, antibacterial and antioxidant activities of hydrodistillated extract of Eucalyptus globulus fruits [J]. Ind Crops Prod, 89: 167-175.
SHAN TJ, FENG H, XIE YY, et al., 2019. Isolation of endophytic fungi from Eucalyptus citriodora the antibacterial activity of their extracts [J]. Acta Phytophy Sin, 45(6): 149-155. [單體江, 馮皓, 謝銀燕, 等, 2019. 檸檬桉內生真菌的分離及其提取物的抗細菌活性 [J]. 植物保護, 45(6): 149-155.]
SINGH R, CHAURASIA S, GUPTA AD, et al.,2014. Comparative study of transpiration rate in Mangifera indica and Psidium guajawa affect by Lantana camara aqueous extract [J]. J Environ Sci Comput Sci Eng Technol, 3(3): 1228-1234.
STANLEY A, THOMPSON K, HYNES A, et al., 2014. NADPH oxidase complex-derived reactive oxygen species, the actin cytoskeleton, and Rho GTPases in cell migration [J]. Antioxid Redox Signal, 20(13): 2026-2042.
TIAN XC, CHEN XX, 2014. Allelopathic effects of Eucalyptus robusta macrophylla on several crops and weeds [J]. J Zhejiang Agric Sci, (4): 530-532. [田雪晨, 陳賢興, 2014. 大葉桉樹對幾種農作物和雜草的化感作用 [J]. 浙江農業科學, (4): 530-532.]
VASCONCELOS LC, DE SOUZA SANTOS E, DE OLIVEIRA BERNARDES C, et al., 2019. Phytochemical analysis and effect of the essential oil of Psidium L. species on the initial development and mitotic activity of plants [J]. Environ Sci Pollut Res Int, 26(25): 26216-26228.
VIVES-PERIS V, DE OLLAS C, GMEZ-CADENAS A, et al., 2020. Root exudates: from plant to rhizosphere and beyond [J]. Plant Cell Rep, 39(1): 3-17.
WANG YN, HU ZL, HAO JM, et al., 2019. Allelopathic effects of volatile oil and its two main components from Chenopodium ambrosioides L. on maize (Zea mays) root border cells [J]. Allelopathy J, 46(2): 215-228.
WENG KJ, ER G, SHAMA MWN, et al., 2018. Effects of Dysphania ambrosioides solution on photosynthetic characteristics and guard cell activity of Vicia faba [J]. J S Agric, 49(3): 530-535. [翁可佳, 爾格, 沙馬五牛, 等, 2018. 土荊芥腐解液對蠶豆幼苗光合特性和保衛細胞活性的影響 [J]. 南方農業學報, 49(3): 530-535.]
XIE YY, YAO LX, WEI S , et al., 2021. Allelopathic effects of weed spp on the root border cells of Fagopyrum tataricum (L.) Gaertn [J]. Allelopathy J, 52(1): 83-100.
ZHAO HM, WANG HY, 2017. Research on the effect of Allium fistulosum L. extract on root tip cells of Vicia faba [J]. Bull Biol, 52(4): 53-55. [趙紅梅, 王慧陽, 2017. 大蔥提取液對蠶豆根尖細胞的致突作用研究 [J]. 生物學通報, 52(4): 53-55.]
ZHOU J, LUAN W , HUANG XT, et al., 2016. Effects of aueous etract of Galinsoga parviflora Cav. on leaf guard cells of Vicia faba [J]. SW Chin J Agric Sci, 29(4): 800-804. [周健, 欒威, 黃雪婷, 等, 2016. 辣子草水浸提液對蠶豆葉保衛細胞的影響 [J]. 西南農業學報, 29(4): 800-804.]
ZHOU J, WANG YN, MA DW, et al., 2017. Volatile allelochemicals from Dysphania ambrosioides L. induce guard cell death and signal regulation in Vicia faba [J]. Acta Ecol Sin, 37(17): 5713-5721. [周健, 王亞男, 馬丹煒, 等, 2017. 土荊芥揮發性化感物質誘導蠶豆保衛細胞死亡及信號調節 [J]. 生態學報, 37(17): 5713-5721.]
(責任編輯 蔣巧媛)

