適用于單細胞測序的腎臟消化及CD45+單細胞分離方法
賈 建,譚睿陟,王 麗
西南醫科大學附屬中醫醫院中西醫結合研究中心(瀘州 646000)
單細胞測序(single-cell sequencing,SCS)是指在單個細胞水平上對其攜帶的遺傳信息進行測序,可深層次了解同類細胞不同亞群的分布狀態、作用過程及協作機制等[1-2]。由于單細胞測序的特殊性,要求單細胞懸液中有活性的細胞總數大于10萬個,此外單細胞懸液中細胞成團率、細胞活性狀態及細胞內RNA 的完整性也直接決定了研究結果的準確性[3-4],不同組織解離單細胞所需要的消化酶、消化時間、溫度和濃度不同[5]。然而腎臟組織結構復雜,腎臟細胞線粒體比例高,因此腎臟組織消化程度難以把控,目前尚沒有成熟的腎臟單細胞懸液制備方法,導致腎臟CD45+單細胞分離更加困難。胰蛋白酶和Ⅳ型膠原酶是目前研究中的兩種動物組織消化的常用試劑,包括小鼠的腦、肝臟組織等[6-7]。本文旨在比較胰蛋白酶和Ⅳ型膠原酶在不同消化條件下對小鼠腎臟組織的消化效果,以確定最佳消化方案,然后對最佳消化方案消化所得腎臟細胞懸液中的CD45+細胞進行磁珠分離后送單細胞測序并評估測序結果,為今后腎臟組織消化或腎臟其它重要細胞的單細胞測序前處理提供技術參考。
1 實驗與方法
1.1 實驗材料
1.1.1實驗動物 實驗動物選用雄性6~8 周齡SPF 級C57BL/6小鼠,體重約為18~20 g,共6只,購于成都達碩實驗動物有限公司[SCXK(川)2020-030],飼養于西南醫科大學實驗動物中心[SYXK(川)2020-065],飼養溫度20~24 ℃,飼養相對濕度50%~60%,12 h 光照12 h黑暗循環交替。本研究通過西南醫科大學動物倫理委員會審核同意(審批號:2021DW027)。
1.1.2主要試劑與儀器 抗體生物素化試劑盒(Thermo Fisher Scientific,11060D)、磁珠分選試劑盒(Thermo Fisher Scientific,2232848)、Ⅳ型膠原酶(Worthington Biodchemical Corporation,LS004188)、胰蛋白酶(Beyptime,C0201)、DMEM 培養基(Gibico,812044)、CD45 抗體(Biolegend,103101)、恒溫水浴鍋(HHS-11,中國)、離心機(Eppendorf,美國)、倒置顯微鏡(Nikon,日本)。
1.2 方法
1.2.1實驗分組 實驗分為胰蛋白酶消化組和Ⅳ型膠原酶消化組,每種消化酶作用時間分別設置15、30 min和先消化15 min收集上清液后再加入新的消化液繼續消化15 min(15min+15min組)。
1.2.2取材及前處理 按照50 mg/kg 腹腔注射濃度為10 mg/mL 的戊巴比妥鈉溶液麻醉小鼠,75%酒精消毒小鼠皮膚,心臟采血法抽凈小鼠血液,沿腹腔中線剖開小鼠腹腔,鈍性分離雙腎并去除腎臟包膜,將6只小鼠腎臟取出后,統一在冰上用手術刀片剁碎至肉泥狀,最后將其平均分成6份待消化處理。
1.2.3腎臟組織消化 將剁碎后的腎臟組織用10 mL PBS 重懸,隨后在50 g 離心力作用下離心5 min 后棄去上清液以除去紅細胞,隨后將組織用10 mL DMEM 培養基(含5% FBS)重懸,各組分別加入Ⅳ型膠原酶(10μ/mL)和胰蛋白酶(30μ/mL)于37 ℃水浴消化,消化過程中均加入50U脫氧核糖核酸酶Ⅰ以去除死亡細胞釋放的DNA減少細胞聚集。消化完成后用70 μm細胞篩過濾去除未消化完全組織,1200 rpm/min 離心5 min后收集上清液,加入紅細胞裂解液重懸細胞沉淀破除紅細胞,40 μm細胞篩過濾去除紅細胞碎片,1 200 rpm/min 離心5 min 棄去上清,加入1 ml PBS 重懸洗滌細胞沉淀并重復兩次。最終將細胞沉淀重懸收集于500 μl DMEM培養基中。
1.2.4形態學觀察 各組分別取消化完成的細胞懸液10 uL 涂于載玻片上,在Nikon 倒置光學顯微鏡下采集圖片,觀察組織消化后所得細胞混懸液狀態,比較組織消化完全度、單細胞數量、細胞成團情況和細胞狀態。
1.2.5消化效果比較 取各組消化完成后的腎臟單細胞懸液稀釋10倍,后取稀釋后的細胞懸液9 μL與1μL 0.4%濃度的臺盼藍溶液混勻,再取1 μL混合液加到細胞計數板上,在倒置顯微鏡下計數4 個大方格內的細胞數和臺盼藍著色細胞數,各組單細胞總數目=(4 個大方格細胞數之和/4)×104×細胞原液量(mL)×10;細胞活力=4 個大方格臺盼藍著色細胞總數/4 個大方格細胞總數;細胞成團率=4個大方格成團細胞總數/4個大方格細胞總數。比較各組細胞計數差異性。
1.2.6CD45+單細胞分選 根據腎臟消化效果比較結果,選擇消化所得細胞存活率高、細胞總數多和成團率低的消化方案進行消化,并對腎臟細胞懸液中的CD45+細胞進行分離。提前參照DSB-X?Biotin Protein Labeling Kit 使用說明將CD45+抗體生物素化,再根據Dynabeads?FlowComp?Flexi 試劑盒將生物素化后的抗體與磁珠結合,然后將消化所得腎臟細胞懸液與結合了CD45+抗體的磁珠共同孵育30 min 使腎臟CD45+細胞與磁珠結合,最后在磁力作用下可將結合了磁珠的CD45+細胞分離。分離完成后500 rpm/min 離心1 min收集上清液以去除較大細胞團。
1.2.7分離后的CD45+細胞計數、活力及成團率測定選擇消化效果最好的消化方案所得腎臟細胞懸液CD45+單細胞懸液9 uL與1 μL 0.4%濃度的臺盼藍溶液混勻,再取1 μL混合液加到細胞計數板上,在倒置顯微鏡下計數4 個大方格內的細胞數、成團細胞數以及臺盼藍著色細胞數。
1.2.8單細胞測序結果質控 根據單細胞測序結果分析各組細胞線粒體基因表達量,CD45+細胞陽性率以及各種免疫細胞亞群分群情況評價細胞狀態。
1.3 統計學分析
使用GraphPad Prism 9軟件進行數據統計學分析,組間比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 細胞狀態觀察
隨消化時間的增加,腎臟組織消化程度越明顯,在消化時間達30 min時,所有組織均已被消化完全,溶液呈懸濁液狀。光鏡下,相同消化時間內胰蛋白酶消化能力明顯弱于Ⅳ型膠原酶,并且消化過程中產生大量細胞碎片,不利于后續分選及測序。Ⅳ型膠原酶消化能有效減少細胞碎片的產生,并且優化后的15 min+15 min消化法與30 min直接消化法相比所得細胞數量多、產生的細胞碎片少、細胞形態更完整(見圖1)。

圖1 不同消化條件消化所得腎臟細胞懸液(×100)Figure 1 The suspension of kidney cells was digested under different digestive conditions(×100)
2.2 不同消化方法所得細胞差異性比較
各組消化所得單細胞數量見圖2 所示:不論胰蛋白酶還是Ⅳ型膠原酶組,消化時間為30 min 所得單細胞數量均明顯高于15 min,消化更為完全,Ⅳ型膠原酶在各時間段消化所得單細胞數均高于胰蛋白酶,而15 min+15 min的消化方式相對直接消化30 min所得細胞總數顯著增加(P<0.001),所得死亡細胞數明顯減少(P<0.05),并且單細胞懸液中成團細胞數顯著降低(P<0.01),為后續CD45+細胞的進一步分選提供了足夠的細胞數量和質量保障。
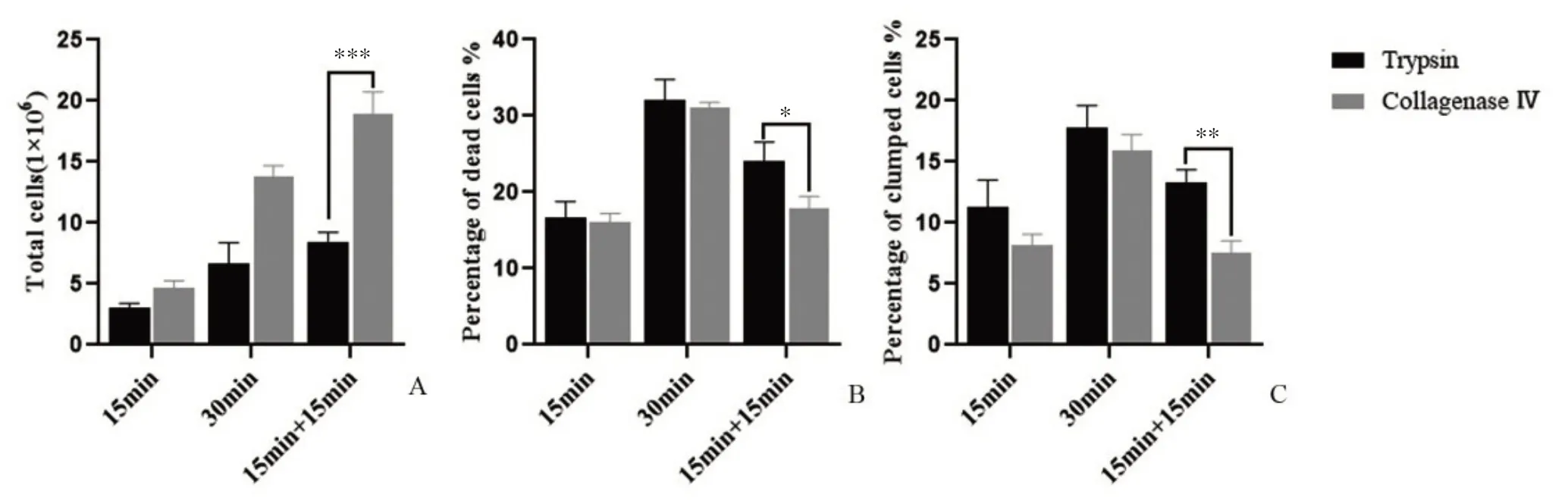
圖2 不同消化方式所得細胞狀態比較Figure 2 Comparison of cell states obtained by different digestion methods
2.3 CD45+單細胞分離
經磁珠分選后所得CD45+單細胞懸液細胞形態完整,但混有很多體積較大細胞碎片和細胞團(見圖3A),通過300 rpm/min離心1 min棄沉淀取上清液能夠有效去除較大的組織碎片和成團細胞(見圖3B),可防止測序過程中對儀器設備造成損害,和提高測序結果的準確性,最終所得單細胞懸液各項指標均符合單細胞測序標準(見表1)。

表1 磁珠分選細胞后細胞狀態Table 1 Cell status after magnetic beads sorting
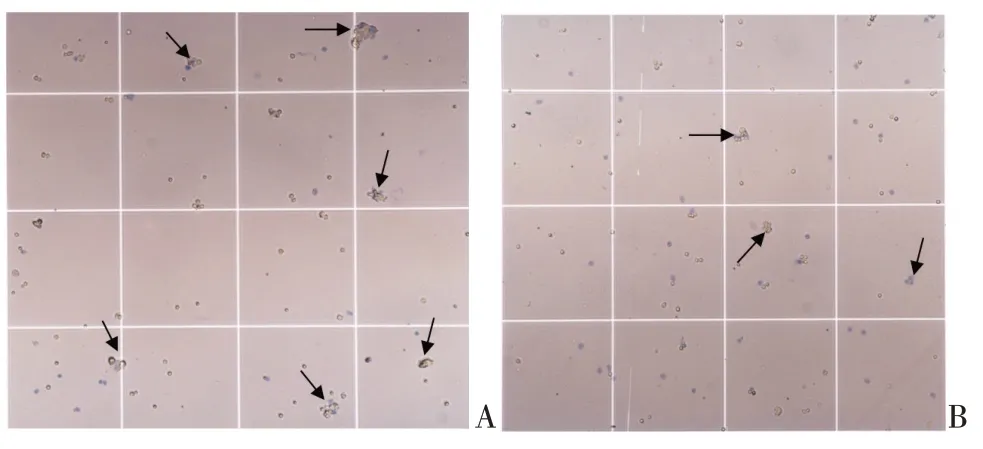
圖3 CD45+單細胞懸液細胞狀態Figure 3 Cell state of CD45+single cell
2.4 單細胞測序結果
線粒體基因表達量通常反應了細胞狀態的好壞,由單細胞測序報告我們發現各組測序所用細胞的線粒體基因表達量大部分處于5%左右(見圖4A)。將各組用于測序細胞共計85 924 個統一納入分析,結果顯示CD45+細胞為81 254 個,陽性率為94.56%(見圖4B,綠色即為CD+細胞),并且其中的T 細胞、B 細胞、巨噬細胞等重要免疫細胞均能夠根據細胞的種類分為明顯的亞群,對后續單細胞結果分析有利(見圖4C)。
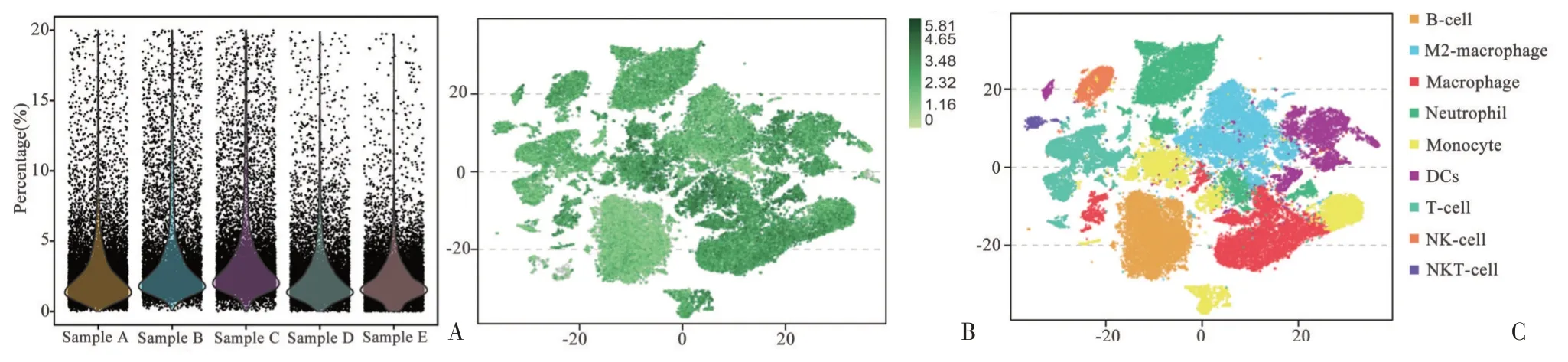
圖4 CD45+單細胞懸液細胞狀態Figure 4 Cell state of CD45+single cell
3 討論
近年來腎臟疾病已成為全球公共衛生問題,越來越受到研究者的關注,通過單細胞測序技術對其進行研究能夠讓我們更深層次了解腎臟中同類細胞不同亞群的分布及狀態,作用過程及協作機制等,對挖掘新的研究思路和尋找新的藥物作用靶點起到積極的作用[8-10]。FUJ[11]等構建糖尿病小鼠模型開展單細胞測序,比較模型組與正常組巨噬細胞細胞表型變化的差異性發現M1型巨噬細胞比例明顯增加,揭示了M1型巨噬細胞在糖尿病炎癥反應過程中起重要作用,此外研究者們還在急性腎損傷和纖維化、狼瘡腎炎和腎臟腫瘤反應等方面開展單細胞測序,均揭示了重要的研究價值[12-15]。腎臟疾病發生過程中大多伴隨著炎癥反應的發生,通過單細胞測序研究CD45+細胞在疾病中遺傳信息的變化情況有助于更深入了解其發病機理和開發新的藥物治療作用靶點[16-20]。單細胞懸液制備情況的好壞直接影響單細胞測序結果,由于腎臟結構復雜,消化存在一定難度,并且腎臟組織內所含細胞種類繁多,導致CD45+陽性細胞分離更為困難,目前尚無用于單細胞測序的腎臟單細胞懸液制備方法的報道,更無有效的腎臟CD45+細胞分離方法,因此在目前腎臟單細胞測序需求日益增加的情況下,摸索腎臟單細胞懸液制備方法尤為重要。
不同種酶對不同組織消化效果不盡相同,常用的組織消化酶有胰蛋白酶、膠原酶、彈力蛋白酶等[21-22],胰蛋白酶是目前使用最廣泛的消化試劑,通過作用于與賴氨酸或精氨酸相連接的肽鍵,除去細胞間粘蛋白及糖蛋白,影響細胞骨架,從而使細胞分離[23-24],膠原酶通過水解細胞間質的脯氨酸使細胞離散,對于細胞間質膠原的消化作用很強,消化能力不受血清蛋白影響[25]。本研究發現在相同消化時間內Ⅳ型膠原酶對腎臟組織的消化效率優于胰蛋白酶,腎臟組織結構的復雜性,胰蛋白酶單一的消化機理是其消化能力不如Ⅳ型膠原酶的重要原因,所以選用Ⅳ型膠原酶對腎臟進行消化有利于提高所得單細胞數量及細胞狀態。消化前將剁碎后的腎臟組織用PBS洗滌再低速離心棄掉上清液能除去大量紅細胞,從而減少細胞碎片的產生。采用15 min+15 min 的消化方式能夠減少消化酶對已經消化下來的細胞的作用時間,對細胞狀態起保護作用,并且能夠減少細胞碎片的產生。在組織消化過程中難免有細胞死亡,死亡細胞裂解釋放的DNA 具有較強粘附性,是導致細胞聚集成團的主要原因,通過在消化液中加入脫氧核糖核酸酶Ⅰ后能夠有效減少單細胞懸液細胞成團現象[26-27]。消化完成后用PBS 重懸洗滌細胞沉淀兩次能夠有效去除消化產生的組織、細胞碎片,有助于排除對單細胞測序結果的影響。
在組織消化或細胞分離過程中細胞常因外界刺激導致出現應急反應和線粒體基因的大量釋放,線粒體基因表達量常用于評價細胞狀態好壞的標準,一般線粒體基因表達量低于20% 的細胞可視為正常細胞[28-30]。所以單細胞懸液的制備要求快速準確,以避免RNA 降解或細胞相關基因活化導致測序結果出現偏差[31],盡可能縮短單細胞懸液制備時間尤為重要。免疫磁珠分選法是一種通過磁珠從細胞群中分離目的細胞的技術,通過抗體、生物素或親和素與目標細胞上特定的細胞表面蛋白結合后在磁力的作用下起到將目標細胞與非目標細胞分離的目的[32-34],分離完成后通過300 rpm/min 離心1min 棄掉沉淀取上清能夠有效去掉較大的細胞團,能夠有效降低細胞成團率。該方法相對流式分選法操作更為簡單,所需時間短,并且能夠避免儀器對細胞造成的損傷。由單細胞測序結果可以看出磁珠分離法分離所得CD45+細胞純度高且細胞狀態好,各重要免疫細胞亞群分布明顯,說明磁珠分離法不僅操作簡單,并且能夠有利于保護細胞狀態,分離所得細胞適用于單細胞測序。
4 結論
在相同消化時間條件下,Ⅳ型膠原酶相對胰蛋白酶消化所得細胞懸液中細胞數量更多,細胞存活率更高,更適合應用于腎臟組織消化,所得細胞懸液通過磁珠分離法所得CD45+單細胞懸液各項指標均符合單細胞測序要求,表明本腎臟單細胞懸液制備方法適用于單細胞測序。

