腰腿痛寧膠囊通過調控炎癥因子途徑對兔膝骨關節炎的影響
金美英,張偉冬,王婉霖,李泉鋒,趙文海,沙里泉*,崔鎮海*
(1.長春中醫藥大學附屬第三臨床醫院,長春 130117;2.長春中醫藥大學,長春 130017;3.長春中醫藥大學附屬醫院,長春 130021)
膝骨關節炎(knee osteoarthritis,KOA)是以關節軟骨退變、軟骨下骨硬化、骨贅形成和滑膜增生為特征的骨疾病[1]。研究[2-3]發現炎癥機制在介導生物力學失調的影響方面起著核心作用,會造成關節組織生物力學的紊亂。在KOA 炎癥的過程中,巨噬細胞會釋放出IL-1β、IL-6 和TNF-α 等細胞因子子[4]。這些細胞因子會誘導基質金屬蛋白酶(matrix metalloproteinases,MMPs)表達,干擾細胞外基質(extracellular matrix,ECM),促使II 型膠原蛋白(collagen type II)降解,進而損傷關節軟骨,加劇KOA 的發展[5]。目前,KOA 的治療可大致分為減少誘發的危險因素、物理方式、關節內治療、手術治療和替代治療[6]。非甾體抗炎藥(NSAIDs)和對乙酰氨基酚(Paracetamol)通常被認為是治療骨關節炎的首選藥物[7]。然而非甾體抗炎藥應謹慎用于胃腸道疾病患者,有造成消化道出血、穿孔等風險[8]。因此,安全性高、副作用小的中草藥是防治骨性關節炎的較好選擇。本團隊在前期臨床試驗中已經驗證腰腿痛寧膠囊治療KOA 的確切療效。此次研究旨在觀察木瓜蛋白酶(papain)誘導的兔早期 KOA 模型中炎癥因子的水平,研究腰腿痛寧膠囊對木瓜蛋白酶誘導的兔早期 KOA 的保護作用。
1 動物與材料
1.1 動物
新西蘭大白兔20 只,體質量(2.01±0.15)kg,購于哈爾濱市道里區駿琦養殖場[生產許可證編號:SCXK(黑)2021-004]。由黑龍江省實驗動物質量監督檢驗單位檢測,實驗場地在長春中醫藥大學動物實驗中心。飼養室條件:溫度16 ~26℃,濕度40%~70%。飼養時間:上午8:30,下午3:30。實驗過程中嚴格遵守善待動物規定,最大限度減少動物的痛苦,減少動物使用數量。本實驗經過長春中醫藥大學動物倫理委員會審核批準(動物倫理審批號:2020226)。
1.2 藥物及試劑
腰腿痛寧膠囊(吉藥制備字:Z20200131000,長春中醫藥大學附屬醫院),處方成分:熟地黃、雞血藤、乳香、狗脊、薏苡仁、烏梢蛇、骨碎補、黃芪、牡蠣、鹿角霜、伸筋草、龍骨1、五靈脂、延胡索、地龍、冰片、當歸、蜈蚣、天麻、牛膝。木瓜蛋白酶(BS190-25g,Biosharp),L- 半胱氨酸(BS181-25g,Biosharp),速眠新Ⅱ[ 獸藥字(2010)070031582,圣達動物藥品有限公司],舒泰50[(2015)外獸藥證號43 號,Virbac China],仙靈骨葆膠囊(國藥準字:Z20025337,同濟堂制藥有限公司),ELISA 試劑盒 :IL-1β(SP25549,Saipei Biotech Co)、IL-6(SP25495,Saipei Biotech Co)、TNF-α(SP25520,Saipei Biotech Co)。
1.3 主要儀器
動物跑步機(宇晟YS-J100),電子秤(Electronic SF-400),恒溫搖床(BLabotery ZHPW-250),染色機(DIAPATH Giotto),X 射線攝像系統(蘇州唯特銳醫療器械有限公司 VDR-1800),脫水機(DIAPATH Donatello),組織包埋中心 (Tissue-Tek TEL),正置光學顯微鏡(Nikon Eclipse E100)。
2 實驗方法
2.1 分組及模型制備
20 只實驗兔隨機分為空白組、模型組、仙靈骨葆組和腰腿痛寧組,每組5 只。模型組、仙靈骨葆組和腰腿痛寧組進行KOA 造摸。具體操作步驟:兔子保定后,剔除左膝關節局部兔毛,碘伏消毒液和75%酒精依次進行消毒,屈曲膝關節75°,定位外膝眼為進針點,誘導劑由Papain(4%)和L-Cysteine(0.03 mol·L-1)配伍,注射量0.5 mL·kg-1。在造模第1 天、第3 天、第7 天各注射1 次。同時,每日定時強迫兔在跑步機活動,早晚各1 次,每次時長為15 min,連續驅趕14 d。造模21 d 后,出現左膝關節腫脹,屈伸障礙,X 線提示膝關節結構改變,判定為KOA 模型成功。
2.2 干預方法
按照以往實驗方案進行等量換算,腰腿痛寧膠囊劑量為0.177 g·kg-1,仙靈骨葆膠囊劑量為0.099 g·kg-1。腰腿痛寧膠囊和仙靈骨葆膠囊去除膠囊外衣后,所得藥粉均用10 mL 的純凈水配成溶液,每日1 次,連續灌胃28 d。空白組和模型組無需特殊處理,常規飼養即可。
2.3 標本采集
實驗結束后,兔右后肢肌肉注射麻醉,麻醉劑(舒泰50 和速眠新Ⅱ,配比 6:1),0.35 mL·kg-1。關節腔內注入0.8 mL 無菌生理鹽水,屈伸關節15 次,抽取膝關節液 0.5 mL,耳緣靜脈處取血 5 mL,均注入無菌 EP 管中離心,設置參數為3000 r·min-1,運轉10 min,吸取上清液后置于-20 ℃ 冰箱中待測。采用空氣栓塞法進行安樂死,打開左膝關節腔,用咬骨鉗夾取股骨遠端和脛骨近端,放入4%多聚甲醛固定液中保存。
2.4 檢測指標
2.4.1 兔左膝關節活動度測量 觀察各組治療前后左膝關節活動度改變情況。在治療前(OA 模型建立后)和治療結束后,用量角器測量兔左后肢膝關節活動角度,評估關節被動活動范圍。量角器的軸心放置在膝關節的中心,量角器的靜止臂與股骨平行固定,移動臂跟蹤脛骨的運動。分別記錄膝關節處于最大伸展和屈曲狀態時的角度(°)。膝關節活動范圍的計算方法是最大伸展角度減去最大屈曲角度。
2.4.2 X 線片影像 觀察各組拍攝X 線片,觀察膝關節情況。兔置于固定器上,用眼罩遮住雙目,待到呼吸平順,被動延展兔雙后肢,保持在適度拍攝體位。正位片拍攝方法:1)兔取仰臥位,被動屈髖30°,髖外展15°,盡量伸直膝關節,保持髕骨位于正前方,放射球管距離拍攝部位110 mm;2)拍攝側位片時取側臥位,左后肢伸直置于前側,右后肢被動屈髖70°、屈膝30°置于后側,放射球管距離拍攝部位110 mm;3)設置檢驗參數:工作電壓45 kVP,照射電流160 mA,照射量為5.02 mAs,曝光時間31 ms。
2.4.3 軟骨組織病理觀察 所有實驗兔左側脛骨關節面處進行軟骨取材,用鋒利骨鑿鑿至深達軟骨下骨層,軟骨獲取后需要修剪成大小合適組織塊,放入4%多聚甲醛固定液中保存。經過脫水脫鈣等一系列處理后,用光學顯微鏡對軟骨組織情況觀察拍照。
2.4.4 軟骨損傷程度評價 采用Mankin 評分標準判定軟骨的損傷程度。
2.4.5 血清和關節液中炎癥因子水平測定 采用ELISA 法測定血清和關節液中 IL-1β、IL-6、TNF-α的水平,具體檢測操作方法嚴格按照ELISA 試劑盒說明書上進行。
2.5 統計學方法
應用GraphPad Prism 9.00 對數據進行處理,用One-Way ANOVA 檢驗方差齊性的數據,采用配對t檢驗法進行組內比較,LSD-t 法進行組間比較。以P<0.05 為差異有統計學意義。
3 結果
3.1 各組左膝關節活動度變化比較
見表1。
表1 各組左膝關節活動度變化比較(±s,n = 5) °
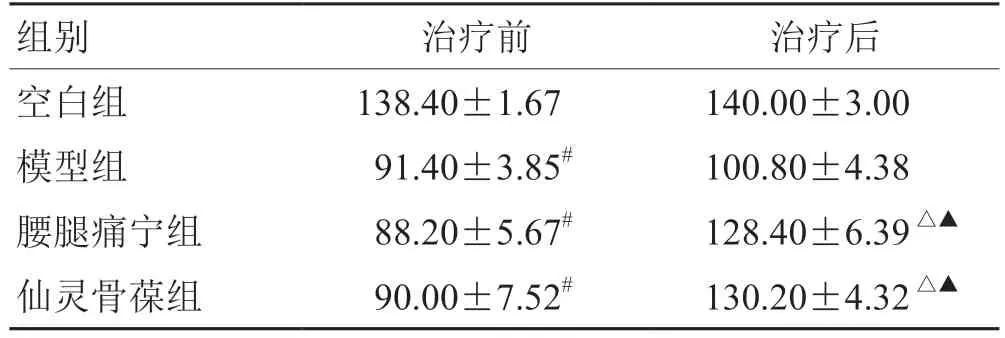
表1 各組左膝關節活動度變化比較(±s,n = 5) °
注:與空白組比較,# P <0.05;與模型組比較,△P <0.05;與治療前比較,▲P <0.05
組別治療前治療后空白組138.40±1.67140.00±3.00模型組 91.40±3.85#100.80±4.38腰腿痛寧組 88.20±5.67#128.40±6.39△▲仙靈骨葆組 90.00±7.52#130.20±4.32△▲
3.2 各組左膝關節X線影像學比較
各組X 線片結果顯示,空白組兔膝關節雙側髁間隙距離等寬,脛骨平臺輪廓清晰,未見骨贅;模型組外側髁間隙明顯變窄,脛骨平臺關節面粗糙不平,可見髁間隆起變銳,軟骨下骨骨質硬化,骨贅形成;仙靈骨葆組外側髁間隙窄于內側,髁間隆起變銳,骨贅形成;腰腿痛寧組關節間隙未見明顯異常,髁間隆起稍變銳,骨贅形成。見圖1。
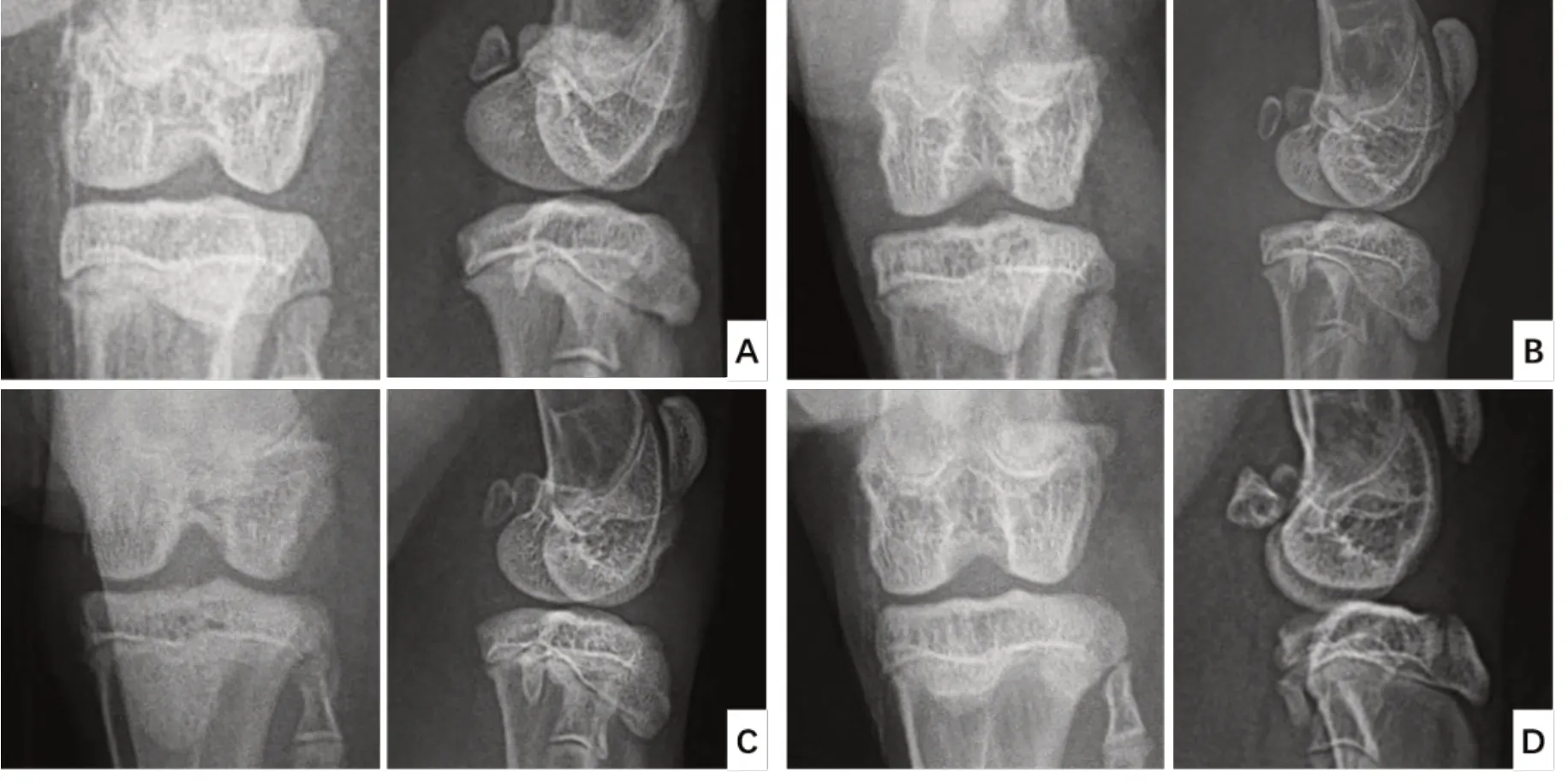
圖1 各組左膝關節X線影像學比較
3.3 各組病理組織HE 染色結果
HE 結果顯示,空白組軟骨組織染色均勻,表面光滑,細胞形態結構正常、排列規則,潮線完整;與空白組比較,模型組軟骨組織顯示局部軟骨細胞排列不規則,有多處裂隙,出現陷窩,符合骨關節炎病理改變,提示造模成功;仙靈骨葆組關節軟骨中可見裂隙,軟骨欠光澤,關節面稍不平整,但情況好于模型組;腰腿痛寧組顯示關節軟骨中可見少量裂隙,關節表面較光滑平整,結構改善。見圖2。
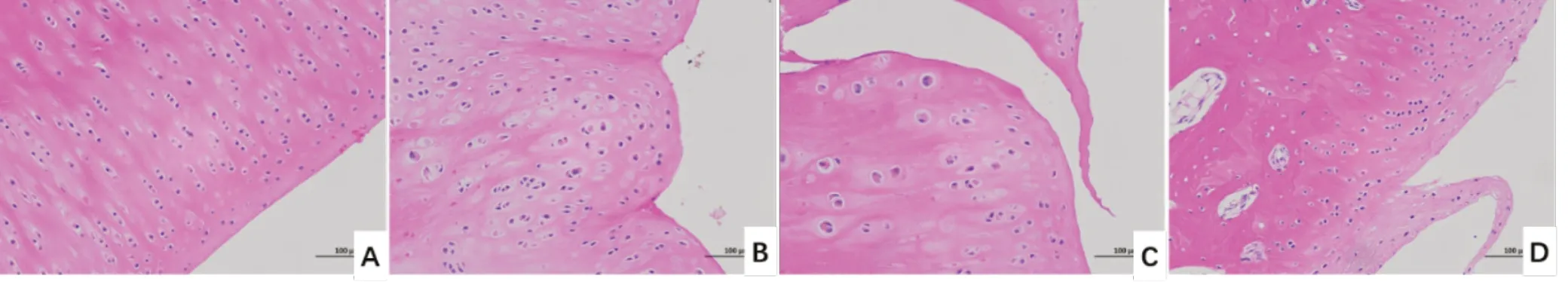
圖2 各組病理組織HE 染色結果
3.4 各組治療后左膝關節軟骨Mankin 評分比較
見表2。
表2 各組治療后左膝關節軟骨Mankin 評分比較(±s,n = 5) 分

表2 各組治療后左膝關節軟骨Mankin 評分比較(±s,n = 5) 分
注:與空白組比較,# P <0.05;與模型組比較,△P <0.05
組別評分空白組0.00±0.00模型組5.00±0.71#腰腿痛寧組2.20±0.84△仙靈骨葆組2.40±1.14△
3.5 各組治療后血清中炎癥因子水平比較
見表3、圖3。
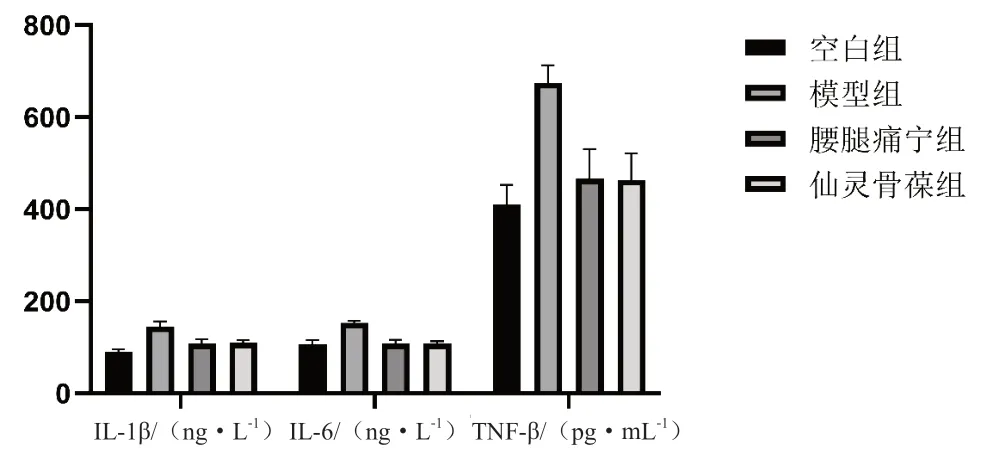
圖3 各組治療后血清中炎癥因子水平比較
表3 各組治療后血清中炎癥因子水平比較(±s,n= 5)

表3 各組治療后血清中炎癥因子水平比較(±s,n= 5)
注:與空白組比較,# P <0.05;與模型組比較,△P <0.05
組別IL-1β/(ng·L-1)IL-6/(ng·L-1)TNF-α/(pg·mL-1)空白組106.18±9.80 106.18±9.80410.25±43.05模型組152.75±4.03# 152.75±4.03# 674.42±38.30#腰腿痛寧組108.09±8.50△108.09±8.50△ 466.57±64.49△仙靈骨葆組108.64±4.19△108.64±4.19△ 463.47±57.85△
3.6 各組治療后關節液中炎癥因子水平比較
見表4、圖4。
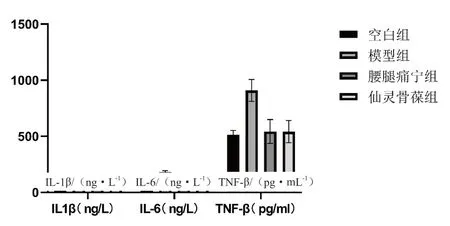
圖4 各組治療后關節液中炎癥因子水平比較
表4 各組治療后關節液中炎癥因子水平比較(±s,n= 5)
表4 各組治療后關節液中炎癥因子水平比較(±s,n= 5)
注:與空白組比較,# P <0.05;與模型組比較,△P <0.05
組別IL-1β/(ng·L-1)IL-6/(ng·L-1)TNF-α/(pg·mL-1)空白組 67.29±6.55 513.18±39.01113.36±24.54模型組100.63±11.29# 909.05±98.42# 179.67±13.27#腰腿痛寧組 74.02±9.44△542.71±106.08△132.60±30.20△仙靈骨葆組 76.62±9.75△542.02±99.51△ 124.46±28.15△
4 討論
骨關節炎與腎氣虧損致血瘀痹阻有關,患者伴有膝部疼痛,關節屈伸不利,甚則僵硬。本人經過數十載的臨床經驗總結出了“益腎填精、活血除痹”的獨特診治思路,研制出腰腿痛寧膠囊。此方藥具有益腎填精之效,可濡養骨骼強健經筋。方中選用鹿角霜,取其補腎陽亦強筋骨之用,在配伍熟地黃滋陰,益精填髓,二者同用平調陰陽,壯其筋骨。骨碎補能活瘀血,續斷傷,傳統中醫藥在治療骨折疾病時大量應用,有破血止血,補傷折之說。當歸可活血、亦補血;狗脊強筋骨,能止痛;黃芪補氣血,驅病邪。地龍,烏蛇,蜈蚣配伍,增強活血通絡之功,氣血聚處,祛邪以無痕。諸藥共用,周流氣血,通暢經脈,其病可愈。仙靈骨葆膠囊在診療指南(2020年版)[9]中為膝關節炎推薦用藥,臨床證實能有效改善膝骨性關節炎患者的各項指標[10]。將其作為陽性對照組藥物,能與腰腿痛寧膠囊組形成良好對照。
團隊前期實踐證明腰腿痛寧膠囊在治療 KOA 臨床療效顯著[11],此次研究設計動物實驗主要探討其作用機制。木瓜蛋白酶能直接作用于兔關節軟骨,引起細胞外基質中蛋白多糖的降解[12]。蛋白多糖的缺失會相對增加膠原蛋白的暴露,促炎因子和基質金屬蛋白酶對基質的破壞也會加強,導致軟骨基質的大量流失[13]。然而,軟骨細胞新分泌的膠原蛋白等基質成分的性能較差,軟骨基質的生物和機械性能發生變化,軟骨失去正常的彈性和抗壓能力,最終導致骨關節退化[14]。這種方法可以避免手術引起的關節腔內出血、結構破壞等并發癥的干擾,適用于研究軟骨的病理變化和藥物對早期KOA 的治療效果。兔造摸后,左下肢均出現不同程度腫脹,皮溫升高情況。驅使兔被迫運動,可見兔左后肢因疼痛無法觸及地面,出現跛行。同時,抽取患肢關節液時,呈渾濁狀態,以上改變與早期KOA 病理發展基本一致,說明兔KOA 模型建立成功。
研究[15]發現,軟骨組織中IL-1β、IL-6、TNF-α等細胞因子的增加是骨關節炎的主要特征,炎癥在骨關節炎的發生發展中起核心作用。在骨關節炎的早期階段,分解代謝活性增加,這與炎癥介質、軟骨降解蛋白和應激反應因子的表達增加有關[16]。這些改變導致軟骨細胞丟失,從淺層的纖顫到更復雜和更深的裂隙[17]。IL-6 可以促進成纖維細胞的產生,并通過增強KOA 中IL-1β 和TNF-α 等細胞因子的破壞作用而加速軟骨基質的降解[18-19]。同時,TNF-α也可誘導 IL-1、IL-6 等的釋放,它們之間相互影響,共同作用于骨關節炎發生、發展的各個環節[20]。給藥28 d 后,藥物治療組脛骨軟骨表面粗糙度減弱,軟骨細胞排列更加整齊,同時血清和關節液中的炎癥因子明顯減少。驅趕兔被迫運動時,治療組后肢蹬地有力,而模型組仍有不同程度跛行。實驗中兔關節損傷程度基本與炎癥因子水平呈正相關,說明通過抑制血清和關節液中1L-1β、IL-6、TNF-α 水平可以延緩KOA 病情發展。
本研究結果顯示,經腰腿痛寧膠囊干預后,兔早期KOA 模型血清和關節液中1L-1β、IL-6、TNF-α 的水平均明顯降低。說明腰腿痛寧膠囊能延緩軟骨的退化,其作用機制可能與降低炎癥因子水平有關。由于腰腿痛寧膠囊是中藥復方制劑,且KOA 發病機制復雜,所以其藥物有效成分和作用靶點需進一步深入研究。

