澳洲堅果種植地土壤固氮微生物群落結構和多樣性
王瑞麗 施蕊 雷娥 李雕益 包書軍 熊智
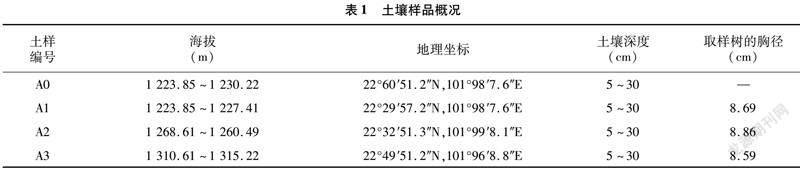
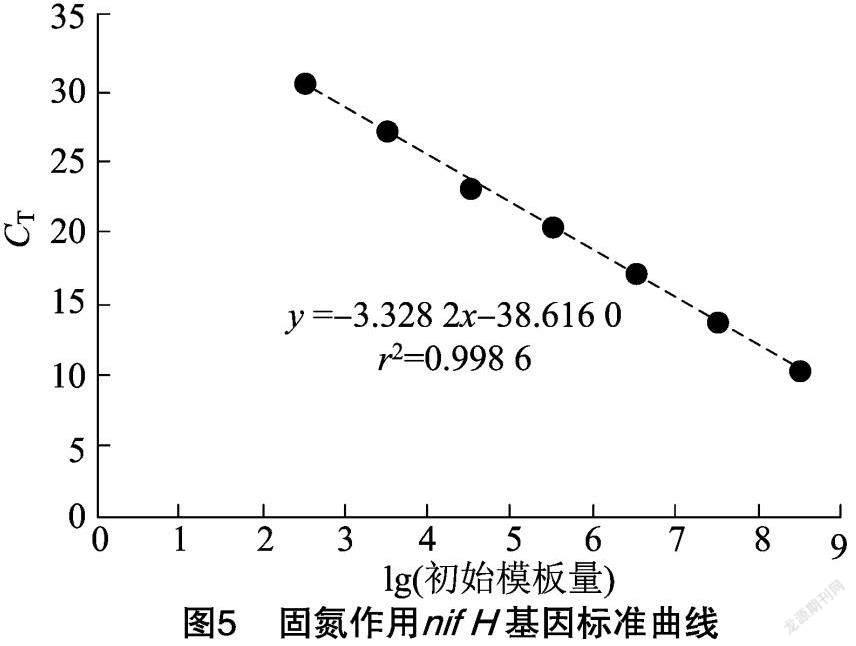
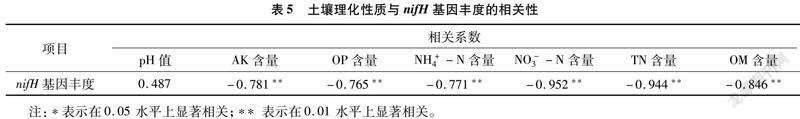

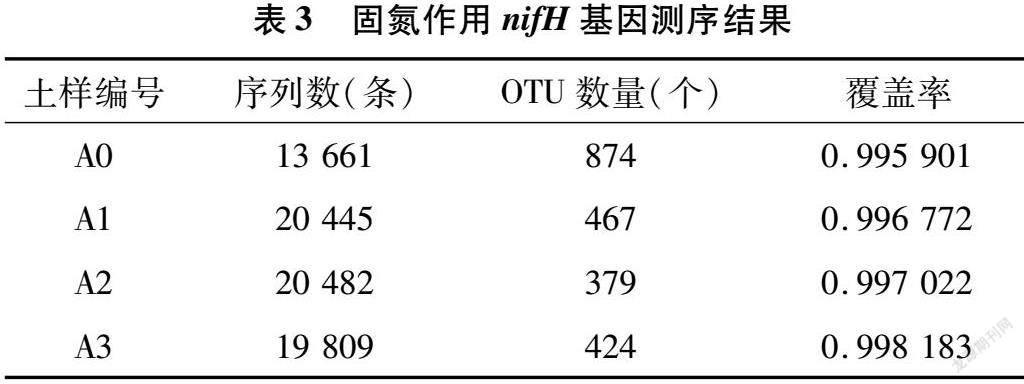

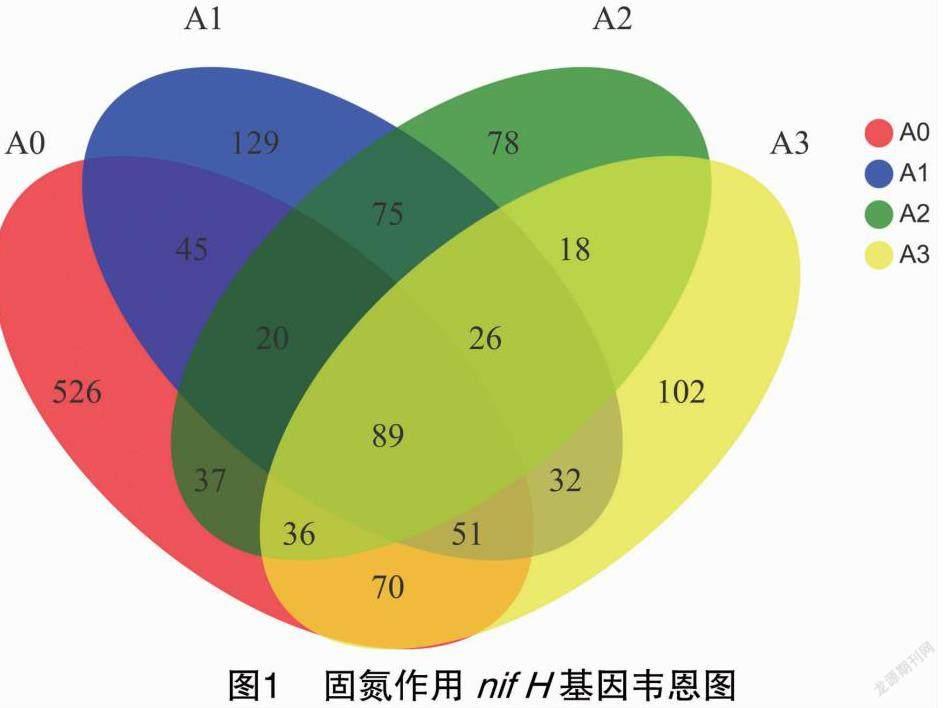

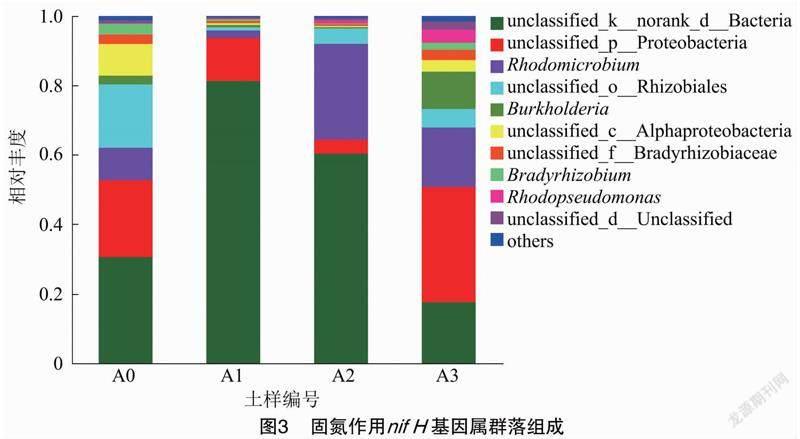
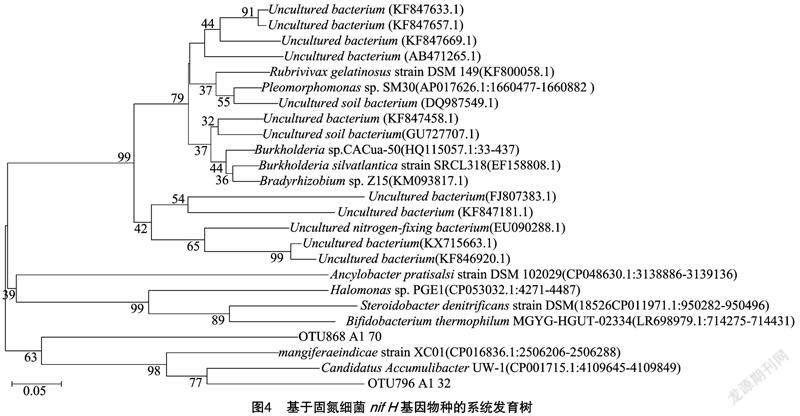
摘要:采用qPCR和高通量測序技術對固氮相關基因(nifH)進行檢測,探究農業果園經營形式下土壤固氮微生物的群落結構、多樣性及其影響因素。結果表明,種植地pH值在5.0左右,屬于典型的酸性土。綜合分析發現,澳洲堅果園種植地帶養分含量明顯升高,并且種植區域養分含量也存在較大差異,說明土壤肥力分布不均。與未種植區域相比,種植區域固氮細菌(相關基因nifH)群落豐富度和多樣性指數均呈下降趨勢。變形菌門(Proteobacteria)為含nifH基因的固氮細菌群落優勢菌門,相對豐度為18.21%~79.69%,并且種植使土壤固氮菌群落結構發生了改變。實時熒光定量PCR結果表明,固氮相關基因(nifH)拷貝數在7.325×106~5.120×107之間。土壤理化因素與功能基因拷貝數相關性結果表明,nifH基因拷貝數與AK、OP、NH+4-N、NO-3-N、TN、OM等的含量均呈極顯著負相關。澳洲堅果種植地中固氮細菌以變形菌門(Proteobacteria)為最優勢的菌群,這為澳洲堅果種植地土壤肥力恢復和固氮微生物的開發利用提供了理論支持。
關鍵詞:澳洲堅果園;qPCR;高通量測序;固氮細菌;nifH;群落結構;多樣性
中圖分類號: S154.3 文獻標志碼: A
文章編號:1002-1302(2023)08-0211-06
基金項目:國家自然科學基金(編號:3166010405);云南省重大科技專項(編號:202002AA1007)。
作者簡介:王瑞麗(1995—),女,貴州安順人,碩士研究生,主要從事澳洲堅果功能微生物研究。E-mail:1393384429@qq.com。
通信作者:熊 智,博士,教授,主要從事微生物學和分子生物學研究。E-mail:zhix-swfu@qq.com。
氮元素是植物生長的必需營養元素之一,對植物光合作用和增產起關鍵作用[1]。土壤固氮微生物是一類能將大氣中游離氮轉化為含氮有機物的原核微生物,其數量和群落結構的變化與土壤氮素循環密切相關[2-3]。……

