外源鈣與甜菜堿對干旱脅迫下絲瓜幼苗的緩解效應
任曉雪 王紅軍 楊洪霞

摘要:為探討外源鈣與甜菜堿提高絲瓜幼苗干旱脅迫抗逆性的作用機理,以絲瓜品種綠鉆88為試材,在水培條件下借助PEG-6000模擬干旱脅迫環境,研究其對干旱脅迫下絲瓜幼苗的形態建成、光合色素、光合能力、保護酶活性、膜透性和活性氧積累的影響。結果表明:干旱脅迫能夠抑制絲瓜幼苗的形態建成,外源鈣與甜菜堿可在一定程度上緩解干旱脅迫對絲瓜幼苗生長的抑制作用,且以二者配施效果更佳。干旱脅迫能夠顯著降低絲瓜幼苗的葉綠素a、葉綠素b、葉綠素a+b、類胡蘿卜素含量和光合特性,且降低程度隨脅迫時間的后移而加劇,而外源鈣與甜菜堿可在一定水平上緩解這種抑制作用,且以二者配施效果更佳。外源鈣與甜菜堿能夠提高干旱脅迫下絲瓜幼苗的葉綠素a/b值,且以二者配施的PCG處理下值最大。干旱脅迫能夠顯著降低絲瓜幼苗的保護酶活性,降低幅度隨脅迫時間的后延而提高,而外源鈣和甜菜堿能夠減少干旱脅迫下保護酶活性的降低幅度,且這種減緩作用隨脅迫時間的后延而更加顯著,同時以二者配施效果更佳。干旱脅迫顯著增加了絲瓜幼苗葉片MDA、O-2·、H2O2含量,提高葉片相對電導率,且隨脅迫時間的后移呈升高趨勢,引發氧化脅迫,而外源鈣、甜菜堿能夠緩解干旱逆境對絲瓜幼苗葉片細胞膜的氧化傷害,且以二者配施效果更佳。鈣離子通道抑制劑LaCl3的施用表明,缺鈣能夠加重干旱脅迫對絲瓜幼苗形態建成和生理特性的抑制作用,鈣對甜菜堿在增強植株抗旱性方面有正向促進作用。可見,外源鈣與甜菜堿配施能夠在一定水平上有效緩解干旱脅迫對絲瓜幼苗在生長、光合色素含量、光合能力、保護酶活性方面的抑制作用,減少干旱脅迫下絲瓜幼苗活性氧的積累,降低細胞膜膜脂過氧化水平,從而增強絲瓜幼苗的抗逆性。
關鍵詞:外源鈣;甜菜堿;干旱脅迫;絲瓜;緩解效應
中圖分類號:S642.401 文獻標志碼:A
文章編號:1002-1302(2023)08-0131-08
基金項目:河南省“四優四化”科技支撐行動計劃(編號:SYSH20200503004);中原學者工作站資助項目(編號:214400510023);2022年度河南省重點研發專項(編號:221111110100)。
作者簡介:任曉雪(1982—),女,河南商丘人,助理研究員,主要從事植物逆境生理生態研究。E-mail:yguangwode@163.com。
通信作者:楊洪霞,高級農藝師,主要從事植物逆境生理生態研究。E-mail:yguangwode@163.com。
干旱作為一種極端天氣時常出現,嚴重制約作物的正常生長和產量增加,是諸多農業發展所面臨的主要瓶頸之一。全世界有約1/3的陸地面積為干旱或半干旱地區,而我國則有約51%的國土面積為干旱或半干旱地區[1]。植物在干旱條件下會表現出一系列表型和生理生化層面的變化,表型層面表現為生長變慢、生物量降低、葉片卷曲黃化[2],生理生化層面表現為葉綠素合成受阻、光系統Ⅱ(PSⅡ)反應中心對光能捕獲和電子傳遞效率降低[3]、光合能力減弱、活性氧(ROS)代謝平衡紊亂[4]、膜結構損傷,最終導致作物產量和品質的下降。絲瓜富含維生素和礦物質,具有較高的食用和藥用價值,具有廣闊的消費市場。絲瓜的根系相對發達,但仍會遭受水分脅迫的危害。在育苗期,人為管理不當、斷水斷電等原因造成的水分脅迫,會嚴重威脅穴盤內絲瓜幼苗的生長。若移栽后遭遇水分脅迫,植株會因生長勢的降低而變得瘦弱矮小。結果期受到水分脅迫,則會使絲瓜果實過早老化、纖維增加、品質降低、商品果減少。因此,研究絲瓜在干旱逆境下的響應機理,提高絲瓜抵御干旱逆境的能力,對減少生產損失有重要意義,對提高其他作物的抗逆性也有一定的參考價值。
鈣是植物生長發育所必需的中量元素,同時是偶聯胞外刺激和胞內生理生化反應的第二信使[5],對植物生長發育和生理代謝活動有重要調控作用[6]。在逆境條件下,鈣參與逆境信號的響應與表達,對穩定細胞膜結構、阻止膜脂過氧化反應、提高抗氧化保護酶系統的酶活性、改善光合性能等方面有重要作用[7]。研究表明,葉片噴施或根灌外源鈣均能夠有效改善干旱脅迫下黃芩幼苗葉綠素的含量和保護酶的活性[8]。鈣可促進水分脅迫下小麥幼苗的生長和養分吸收,緩解水分脅迫的抑制效應[9]。甜菜堿(glycine betaine,GB)廣泛存在于動植物和微生物體內,是一種季胺型水溶性生物堿,能夠減緩高溫、干旱、鹽害等逆境脅迫對植物造成的傷害[10]。在逆境條件下,甜菜堿可通過降低細胞滲透壓、清除機體活性氧、維持生物膜結構的穩定性和生物體內大分子結構的完整性等方式,增強植株的抗逆性[11]。研究表明,甜菜堿能夠維持干旱脅迫下茄幼苗的生長,并使MDA含量保持較低水平[12]。甜菜堿可提高干旱脅迫下甜茶的相對含水量和滲透調節物質含量,調節抗氧化酶保護系統的酶活性[13]。可見,外源鈣和甜菜堿對提高作物抗旱性均有一定正向作用,而有關外源鈣、甜菜堿單施或配施在絲瓜幼苗抗旱性方面的研究尚未見報道。為此,本試驗以絲瓜品種綠鉆88為試材,在水培條件下借助PEG-6000模擬干旱脅迫環境,研究外源鈣、甜菜堿對干旱脅迫下絲瓜幼苗形態建成、光合色素、光合能力、保護酶活性、膜透性、活性氧積累的影響,探討外源鈣與甜菜堿提高絲瓜幼苗干旱脅迫抗逆性的作用機理,以期為絲瓜生產中緩解干旱逆境傷害和進行抗旱節水栽培提供理論依據。
1 材料與方法
1.1 供試材料
供試絲瓜品種為從瑞克斯旺公司引進的綠鉆88。
1.2 試驗設計
試驗于2022年2月17日至5月20日,在河南省商丘市農林科學院雙八試驗站(115°64′E,34°50′N)智能溫室內進行。將絲瓜種子放入55 ℃水中,用玻璃棒不斷攪拌至常溫,浸泡12 h,再用10%磷酸三鈉溶液浸泡15~20 min消毒,然后用清水沖洗2~3遍,放置于催芽箱內進行催芽,待2/3的種子露白即可播種。將種子芽尖向下播種于32孔穴盤內,每穴1粒,上覆1~1.5 cm的基質。基質裝盤前用800~1 000倍液的72.2%霜霉威水劑均勻噴灑1遍,以預防猝倒病、立枯病等苗期病害。待幼苗長至2葉1心時,選取長勢基本一致的幼苗,洗去根部基質,移栽到裝有1/2 Hoagland 營養液的栽培筐內,每筐栽培6株。栽培筐長×寬×高為40 cm×25 cm×15 cm。移栽至栽培筐2 d后,開始進行干旱脅迫試驗。
在前期預備試驗的基礎上,篩選CaCl2濃度 14 mmol/L、甜菜堿(glycine betaine,GB)濃度1.2 mmol/L,選用10% PEG-6000模擬干旱脅迫。試驗共設置6個處理:對照(CK):1/2 Hoagland 營養液+0葉面處理;P:10% PEG-6000+葉面噴施純凈水;PC:10% PEG-6000+14 mmol/L CaCl2;PG:10% PEG-6000+1.2 mmol/L甜菜堿;PCG:10% PEG-6000+14 mmol/L CaCl2+1.2 mmol/L甜菜堿;PLG:10% PEG-6000+1.0 mmol/L LaCl3(鈣離子通道抑制劑)+1.2 mmol/L甜菜堿。每處理重復3次,每3框記作1次重復,共54框。在干旱試驗開始前連續噴施3 d CaCl2,每天噴施1次,P處理在干旱試驗開始前連續噴施3 d純凈水,甜菜堿、LaCl3(鈣離子通道抑制劑)在干旱試驗開始前 1 d 噴施,噴施時間均為上午08:00—09:00。在干旱脅迫試驗的第3天測定絲瓜幼苗生理指標,在第10天測定形態指標和生理指標。
1.3 測定指標與方法
用直尺測量株高和根長,游標卡尺測量莖粗,葉面積儀測量葉面積,LA-S2400根系掃描儀測量根尖數,千分之一電子天平稱量干鮮質量。采用乙醇丙酮浸提法[14]測定葉綠素含量。使用便攜式光合儀Li-6400(美國,LI-COR公司生產)測定第2張真葉凈光合速率(Pn)、蒸騰速率(Tr)、氣孔導度(Gs)和胞間CO2濃度(Ci)。參照王學奎等的方法[15]測定超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)活性。采用沈文飚等的方法[16]測定抗壞血酸過氧化物酶(APX)活性。參照趙世杰等的方法[17]測定MDA含量、相對電導率。采用郭允娜等的方法測定超氧陰離子(O-2·)和過氧化氫(H2O2)含量[18]。
1.4 數據處理
使用Microsoft Excel 2007進行數據處理和作圖,利用SPSS 26.0軟件對數據進行方差分析及差異性檢驗(Duncans法,α=0.05)。
2 結果與分析
2.1 外源鈣與甜菜堿對干旱脅迫下絲瓜幼苗形態建成的影響
由表1可知,與CK相比,干旱脅迫能夠顯著降低西瓜幼苗的株高、莖粗、葉面積、根長、根尖數、鮮質量、干質量,這說明干旱脅迫能夠抑制絲瓜幼苗形態建成。與單純的干旱脅迫P處理相比,PC、PG處理顯著提高了絲瓜幼苗的株高、莖粗、葉面積、根長、根尖數、鮮質量和干質量,這表明外源鈣和甜菜堿葉面噴施均能夠有效緩解干旱逆境脅迫對絲瓜幼苗生長的抑制作用。PCG處理下絲瓜幼苗各形態指標均高于PC、PG處理,其中在株高、根尖數、鮮質量指標上與PC、PG處理差異顯著(P<0.05),PCG較PC處理分別增加9.98%、12.47%、8.25%,PCG較PG處理分別增加8.09%、23.62%、9.95%。添加有鈣離子通道抑制劑和甜菜堿的PLG處理,其各指標均顯著低于PG處理,且在株高、葉面積、根長、鮮質量、干質量指標上與P處理差異顯著(P<0.05)。說明在鈣缺乏的前提下,甜菜堿對增強植株抗旱性的促進作用會受到抑制。
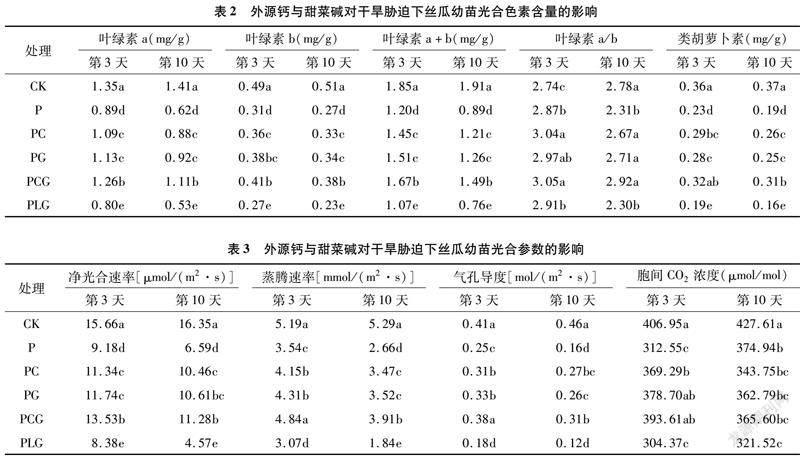
2.2 外源鈣與甜菜堿對干旱脅迫下絲瓜幼苗光合色素含量的影響
由表2可知,干旱脅迫能夠顯著降低絲瓜幼苗葉片的葉綠素a、葉綠素b、葉綠素a+b、類胡蘿卜素含量,其含量隨脅迫時間的延長呈下降趨勢。在干旱脅迫3 d時,PC、PG、PCG處理的絲瓜幼苗葉片的葉綠素a、葉綠素b、葉綠素a+b、類胡蘿卜素含量均高于P處理;其中以PCG處理下值最大,較P處理分別增加41.57%、32.26%、39.17%、39.13%。表明葉面噴施外源鈣、甜菜堿能夠在一定水平上阻止干旱脅迫下絲瓜葉片光合色素含量的降低幅度,且外源鈣與甜菜堿復配效果更佳。PC、PG、PCG處理的絲瓜幼苗各指標在第10天時的變化規律與第3天時一致,且均低于第3天,但PCG處理的葉綠素a、葉綠素b、葉綠素a+b、類胡蘿卜素降幅均低于PC、PG處理,分別比第3天降低11.90%、7.32%、10.78%、3.13%,表明PCG處理更有利于延緩長時間干旱脅迫環境下光合色素含量的降低速率。PLG處理下各色素指標均低于PG、PLG處理,這同時也說明鈣的添加能夠促進甜菜堿對干旱脅迫的緩解效應。另外,在5個干旱處理下,以PCG處理下的葉綠素a/b值最大。
2.3 外源鈣與甜菜堿對干旱脅迫下絲瓜幼苗光合參數的影響
由表3可知,5個干旱處理的凈光合速率、蒸騰速率、氣孔導度、胞間CO2濃度均低于對照,其中凈光合速率以P、PLG處理的降幅相對較大,PC、PG、PCG降幅相對較小,說明外源鈣、甜菜堿單施或配施均能減輕干旱脅迫對絲瓜幼苗光合能力的抑制作用。PC、PG處理的凈光合速率均高于P處理,雖然PG高于PC,但二者差異不顯著;PCG處理在脅迫第3天時顯著高于PC、PG處理,在脅迫第10天顯著高于PC處理,高于PG處理但與其差異不顯著,表現出一定的補償效應,這說明外源鈣和甜菜堿復配較單一外源物質效果更佳,且隨著時間的推移,能夠更好地延緩絲瓜幼苗光合能力的降低速率。另外,在脅迫第3天和第10 天,PCG處理的凈光合速率較P處理分別增加47.39%、71.17%,與P處理差異顯著(P<0.05)。PLG處理的凈光合速率不僅低于PG處理,還低于P處理,說明鈣的缺乏能夠顯著抑制絲瓜幼苗光合能力的提高。從脅迫第3天至第10天,PC、PG、PCG處理的凈光合速率、蒸騰速率、氣孔導度均表現為下降趨勢,而胞間CO2濃度亦表現為下降趨勢;在P、PLG處理下,凈光合速率、蒸騰速率、氣孔導度表現為下降趨勢,而胞間CO2濃度卻呈現升高趨勢。
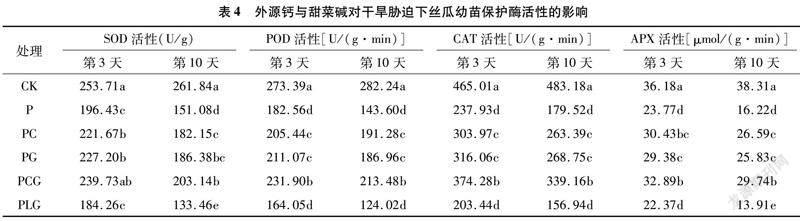
2.4 外源鈣與甜菜堿對干旱脅迫下絲瓜幼苗保護酶活性的影響
由表4可以得出,單純的干旱脅迫P處理顯著降低了絲瓜幼苗葉片抗氧化保護酶的活性,其中SOD、POD、CAT、APX活性在脅迫第3天較CK分別降低22.58%、33.22%、48.83%、34.30%,脅迫第10天較CK分別降低42.30%、49.12%、62.85%、57.66%。外源鈣、甜菜堿單施或復配施用均能夠有效緩解干旱脅迫對絲瓜幼苗葉片保護酶活性的抑制作用,PC、PG、PCG處理在干旱脅迫第3天和第10天,其保護酶活性均顯著高于P處理,且以PCG處理的保護酶活性相對較高。PCG處理的SOD、POD、CAT、APX活性在脅迫第3天較P處理分別增加22.04%、27.03%、57.31%、38.37%,而在第10天較P處理分別增加34.46%、48.66%、88.93%、83.35%,增加幅度明顯高于第3天,表明隨著時間的后移,外源鈣和甜菜堿復配對干旱脅迫下保護酶活性降低幅度的緩解作用更加顯著。在脅迫第3天和第10天,PLG處理保護酶活性均低于PG、PCG,說明外源鈣對甜菜堿緩解干旱脅迫有正向促進作用。
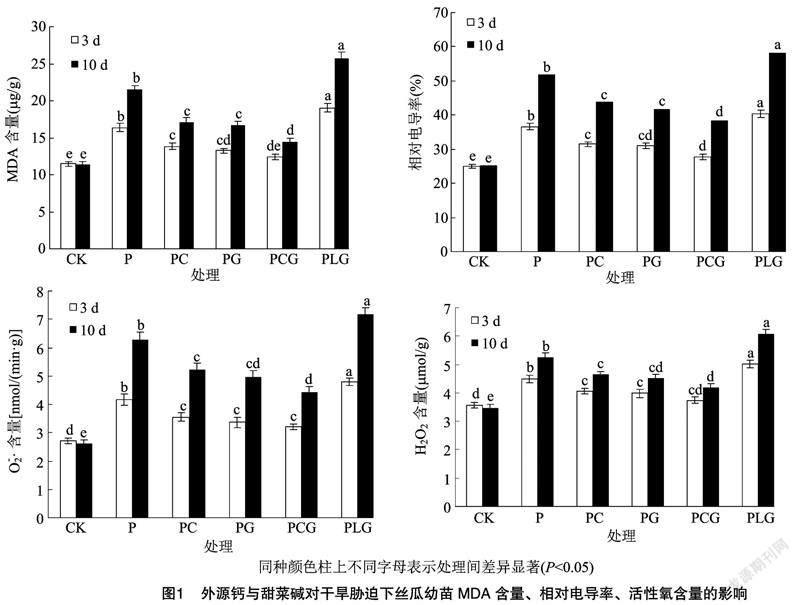
2.5 外源鈣與甜菜堿對干旱脅迫下絲瓜幼苗MDA、相對電導率和活性氧含量的影響
由圖1可以看出,P處理下的MDA含量、相對電導率、O-2·含量、H2O2含量均顯著高于對照,且隨著干旱時間的后移呈升高趨勢,表明干旱脅迫對絲瓜幼苗細胞造成一定程度的傷害,且傷害程度隨脅迫時間的增加而加重。與P處理相比,PC、PG、PCG處理下MDA含量、相對電導率、O-2·含量、H2O2含量均顯著降低,且以PCG處理的降低幅度最大,說明外源鈣、甜菜堿能夠緩解干旱逆境對絲瓜幼苗的傷害,且以二者復配效果更佳。而PC、PG、PCG處理的MDA含量、相對電導率、O-2·含量、H2O2含量仍高于對照,說明外源鈣、甜菜堿對干旱脅迫的緩解效應存在一定的限度。PLG處理的MDA含量、相對電導率、O-2·含量、H2O2含量顯著高于PC、PCG處理,說明鈣對甜菜堿緩解干旱脅迫方面有促進作用。
3 討論與結論
干旱是影響植物生長發育的主要非生物脅迫因子之一。干旱脅迫下植株生長速度放緩、株形矮小、葉面積減小、生物量積累減少、產量降低。本研究結果表明,與對照CK相比,干旱脅迫能夠顯著降低絲瓜幼苗的株高、莖粗、葉面積、根長、根尖數、鮮質量、干質量。這是因為,植物生長依賴細胞的分裂分化,但在干旱脅迫下,細胞失水膨壓降低,分生組織細胞有絲分裂速度變慢、細胞生長受到抑制,使得植物表現為生長減弱[19]。鈣是植物代謝發育的主要調控者,對生長發育的各個時期均有調控作用。研究也表明,外源鈣的施用能夠緩解干旱、冷害等逆境脅迫對植株的傷害[20]。高向陽等研究發現,在0~14 mmol/L范圍內,Ca2+濃度的增加能夠促進植株根系生長及干物質積累[21]。山侖等研究得出,添加外源鈣能促進小麥根莖葉的生長,并使小麥增長速度保持在較高水平[22]。本試驗結果表明,在添加外源鈣的PC處理下,絲瓜幼苗各形態指標雖低于CK,但均顯著高于單純的干旱脅迫P處理,說明噴施外源鈣能夠有效消弱干旱對絲瓜幼苗生長的抑制作用,這應該與鈣是細胞信號轉導的第二信使有關,鈣與鈣調蛋白(CaM)結合后,將感受到的外界干旱脅迫信號傳遞下去;同時,鈣參與信號的響應和表達,降低逆境脅迫給細胞膜帶來的傷害,進而增加植株的抗旱能力[23]。另外,鈣是構成細胞壁的重要元素,外源鈣的添加能夠促進細胞壁的形成,促進細胞分裂生長。甜菜堿是重要的滲透調節物質,并在生物界廣泛存在,而外源甜菜堿易被植株吸收并能夠在植物體內長時間存在。研究也表明,甜菜堿能夠提高植物的抗逆性[24]。本試驗結果表明,添加有甜菜堿的PG處理絲瓜幼苗各形態指標均高于P處理,這應該是因為滲透脅迫引起的細胞膨壓降低,對植株生長不利,而外源甜菜堿的添加能夠在一定水平上通過滲透調節提高植株生長所需要的膨壓,促進植株生長[25]。PCG處理下絲瓜幼苗各形態指標均高于單施外源鈣或甜菜堿的干旱處理,這說明外源鈣與甜菜堿配施效果更佳。PCG處理各指標均高于單施甜菜堿的PG處理,而含有鈣離子通道抑制劑和甜菜堿的PLG處理各指標均低于PG處理,說明鈣的缺失會制約甜菜堿在增強植株抗旱性方面的作用,而外源鈣的添加能夠提高甜菜堿對絲瓜幼苗干旱脅迫的緩解作用,同時也從側面說明外源鈣與甜菜堿配施更有利于提高植株的抗旱能力。
葉綠素是綠色植物進行光合作用的主要場所,其含量與葉片光合速率、碳同化能力密切相關,但葉綠素對干旱逆境反應敏感,因此是表征植株抗逆性的重要指標[26]。本試驗結果表明,在單純的干旱脅迫下,葉片葉綠素含量較對照均顯著降低,這是因為葉綠素在缺水條件下合成受到抑制,同時加速已有葉綠素的分解[27]。在干旱條件下,添加外源鈣或甜菜堿能夠提高光合色素含量,試驗結果與郭郁頻等在苜蓿[28]、范春麗等在石榴[29]上的研究結論一致。一方面是因為,Ca2+對葉綠體雙層膜的穩定有保護作用,甜菜堿能夠減輕逆境脅迫對葉綠體類囊體膜的傷害,對光合色素有一定的保護作用[30];另一方面是因為,活性氧(ROS)不但能夠對細胞結構造成傷害,還可能參與對葉綠素4-吡咯環結構的破壞[31]。而在本試驗條件下,外源鈣或甜菜堿的添加降低了干旱脅迫處理超氧陰離子等ROS含量,這在一定水平上減少了ROS對葉綠素的破壞。外源鈣和甜菜堿復配后,較外源鈣和甜菜堿單施更能夠提高干旱脅迫下絲瓜幼苗葉綠素的含量,說明二者配施效果更佳。PC、PG、PCG處理下,葉綠素a/b值均高于P處理,且以PCG處理下值最大,這應該是因為超氧陰離子能夠對葉綠素造成傷害,并特異性地對葉綠素a造成破壞[32],而PCG處理下超氧陰離子含量較其他干旱處理低,葉綠素a受到的破壞程度相對較輕。
光合作用是植物進行物質代謝和能量代謝的前提,光合能力的高低除受自身遺傳因素影響外,還受干旱、高溫、低溫等外界環境因素的制約,因此常被作為衡量植株抗逆性的重要參考指標。植物在遭受干旱逆境脅迫時,氣孔阻力增加,CO2交換速率和光合酶活性下降,凈光合速率降低,干物質積累減少,植物生長受到抑制[33]。在干旱脅迫下,植物光合速率的降低受氣孔因素和非氣孔因素的影響。本試驗條件下,P處理和PLG處理在干旱脅迫第3天時,凈光合速率、氣孔導度、胞間CO2濃度均顯著低于對照,表現為凈光合速率隨氣孔導度、胞間CO2濃度的降低而降低,說明在脅迫第3天,P、PLG處理光合速率的降低主要是由氣孔因素限制引起。與脅迫第3天相比,脅迫第10天的P、PLG處理凈光合速率、氣孔導度雖有所降低,但胞間CO2濃度卻呈不降反升的趨勢,這說明在干旱脅迫的后期,P、PLG處理凈光合速率的降低已由氣孔因素限制為主轉變為非氣孔因素限制為主,試驗結果與郭愛霞等在蘋果砧木上的研究結論[34]一致。這應該是因為,干旱脅迫時間的延長導致活性氧大量積累,使細胞膜受到破壞,最終引起光合細胞機構與功能的損傷。從脅迫第3天至第10天,PC、PG、PCG處理下凈光合速率、氣孔導度、胞間CO2濃度均呈下降趨勢,且顯著低于對照,說明氣孔因素限制是引起凈光合速率降低的主要因素;同時,還表明外源鈣、甜菜堿的葉面噴施,能夠延緩干旱脅迫下光合作用由氣孔因素限制向非氣孔因素限制轉變的過程,增強植株的抗旱性。外源鈣提高絲瓜幼苗的凈光合速率,應該是因為鈣有利于細胞膜結構的完整性,提高膜上酶的活性和葉肉細胞CO2羧化效率;同時,鈣能增加氣孔反應的靈敏性和自我調節能力,使葉片保持相對較高的含水量[35],有利于光合作用的提高。另外,植物遭受干旱逆境時,外源鈣可通過調控 PSⅡ中心活性來優化細胞葉綠素熒光能量分配,從而改善植物的光合性能[36]。甜菜堿可通過保持PSⅡ反應中心結構的完整性和1,5-二磷酸核酮糖羧化/加氧酶(Rubisco)活性,提高葉片的光合速率[37],有利于緩解逆境條件下葉片光合能力的降低幅度。
SOD、POD、CAT、APX是抗氧化保護酶系統中的主要酶類,這些酶相互協同,使機體活性氧的產生與消除保持動態平衡,其中SOD可有效清除破壞性較強的超氧陰離子自由基,并將其轉化成H2O2,POD、CAT、APX可將由超氧陰離子轉化而來的H2O2分解成完全無害的水[38]。另外,APX還能催化抗壞血酸AsA的氧化,減輕自由基對機體的危害。本試驗結果表明,干旱脅迫顯著降低了絲瓜幼苗葉片保護酶的活性,這是因為保護酶系統對細胞內活性氧的清除存在一定的閾值,當活性氧的積累超出這一閾值時,細胞受到活性氧傷害,保護酶活性降低[39]。鈣信使系統與抗氧化保護酶系統關系密切。本試驗條件下,外源鈣的添加提高了干旱脅迫下絲瓜葉片保護酶的活性,試驗結果與謝詩在結縷草上的研究結論[40]一致。這應該是因為鈣離子與CAM等受體結合后,通過對信號的放大和傳遞,降低活性氧的積累,增強了抗氧化酶活性[41]。甜菜堿同樣提高了干旱條件下絲瓜葉片保護酶的活性,試驗結果與馬千全等在小麥上的研究結論[42]一致。這可能與3個方面原因有關:一是甜菜堿通過調控抗氧化酶相關基因在逆境條件下的表達,減輕抗氧化酶保護系統遭受的逆境損傷[43];二是甜菜堿在逆境條件下能夠穩定保護酶的結構和功能,減輕滲透脅迫對蛋白質結構和功能的傷害,從而維持酶的活性;三是甜菜堿的親水性可將植物組織間的水分聚集在蛋白質表面,提高了其表面的水合程度,從而減輕逆境脅迫引起的酶失活[44]。PCG處理下絲瓜幼苗葉片保護酶活性高于PC、PG處理,說明外源鈣與甜菜堿具有一定的互作效應,二者配施比單一施用更有利于增強絲瓜幼苗的抗旱能力。
氧化脅迫是干旱脅迫引發的最主要的次級脅迫,它通過活性氧代謝的失衡在細胞水平上對植物造成傷害。MDA含量和相對電導率常用于反映逆境脅迫對細胞的傷害程度,是植物應激反應的重要指標。本試驗結果表明,單純的干旱脅迫顯著提高了絲瓜幼苗MDA含量和相對電導率,數值隨脅迫時間的延長而增大,這是因為干旱條件下,O-2·、H2O2在絲瓜幼苗細胞內大量積累,活性氧(ROS)積累達到一定閾值,使細胞膜發生膜脂過氧化反應,而MDA是該反應的最終產物之一,因此表現出干旱脅迫下MDA含量隨ROS的增加而增加的現象。膜脂過氧化反應發生后,細胞膜透性增大,相對電導率隨之增加。增施外源鈣后,絲瓜幼苗MDA含量和相對電導率比單純干旱脅迫處理顯著降低,這應該是因為鈣是植物細胞膜的重要組成成分,是生物膜的穩定劑,鈣與膜磷脂的極性頭部發生交聯作用,使膜蛋白與磷脂結合更加緊密,這也使得膜的透性降低[45],從而降低了干旱條件下絲瓜幼苗MDA含量和相對電導率。甜菜堿的施用同樣能夠降低絲瓜幼苗MDA含量和相對電導率,這應該是因為甜菜堿能夠抑制膜脂過氧化反應,有利于維持細胞膜結構的完整性,從而提高機體的抗逆性,進而降低了O-2·、H2O2等活性氧的過量積累[46]。外源鈣與甜菜堿配施較單一施用更加降低了絲瓜幼苗MDA含量、相對電導率、O-2·含量、H2O2含量,說明二者配施對增強植物抗逆性有正向促進作用。
參考文獻:
[1]李承業,王燕飛,黃 潤,等. 我國甜菜抗逆性研究進展[J]. 中國糖料,2010,32(1):56-58.
[2]王 齊,孫吉雄,安 淵. 水分脅迫對結縷草種群特征和生理特性的影響[J]. 草業學報,2009,18(2):33-38.
[3]張會慧,張秀麗,許 楠,等. 外源鈣對干旱脅迫下烤煙幼苗光系統Ⅱ功能的影響[J]. 應用生態學報,2011,22(5):1195-1200.
[4]安玉艷,梁宗鎖. 植物應對干旱脅迫的階段性策略[J]. 應用生態學報,2012,23(10):2907-2915.
[5]姜義寶,李建華,方麗云,等. 鈣處理對苜蓿幼苗抗旱性的影響[J]. 中國草地學報,2008,30(1):117-120.
[6]周雙云,蔣 晶,高龍燕,等. 不同濃度CaCl2對鹽脅迫下巴西蕉幼苗生理的影響[J]. 應用與環境生物學報,2014,20(3):449-454.
[7]陳立松,劉星輝. 滲透脅迫下Ca2+對龍眼葉片光合色素及膜脂過氧化的影響[J]. 園藝學報,1998,25(1):87-88.
[8]李小玲,華智銳,何嬌嬌.干旱條件下外源鈣對商洛黃芩生理特性的影響[J]. 江西農業學報,2019,31(4):31-35.
[9]周 芳,趙玉霞,王文巖,等. 局部根區水分脅迫下鈣對冬小麥生長及養分吸收的影響[J]. 干旱地區農業研究,2015,33(1):14-19,71.
[10]張紅敏,李姣姣,黑剛剛,等. 外源甜菜堿處理對干旱脅迫下半夏氮代謝及相關酶活性的影響[J]. 草業學報,2014,23(4):229-236.
[11]Robinson S P,Jones G P. Accumulation of glycinebetaine in chloroplasts provides osmotic adjustment during salt stress[J]. Functional Plant Biology,1986,13(5):659.
[12]柴文臣,閻世江. 甜菜堿對干旱脅迫下茄子幼苗生長及生理指標的影響[J]. 中國瓜菜,2021,34(8):78-83.
[13]李愛梅,張 玲,張 超,等. 黃腐酸和甜菜堿預處理對干旱脅迫下平邑甜茶生理特性及光合的影響[J]. 西北植物學報,2017,37(2):307-314.
[14]白寶璋. 植物生理學(上):理論教程[M]. 北京:中國農業科技出版社,1996:65-67.
[15]王學奎,黃見良. 植物生理生化試驗原理與技術[M]. 3版.北京:高等教育出版社,2015:168-181.
[16]沈文飚,徐朗萊,葉茂炳,等. 抗壞血酸過氧化物酶活性測定的探討[J]. 植物生理學通訊,1996,32(3):203-205.
[17]趙世杰. 植物生理學試驗指導[M]. 北京:中國農業科技出版社,1998:84-85,98-99.
[18]郭允娜,李衍素,賀超興,等. 亞適宜溫光下萘乙酸鈉對番茄幼苗生長與生理特性的影響[J]. 應用生態學報,2015,26(10):3053-3058.
[19]Hussain M,Malik M A,Farooq M,et al. Improving drought tolerance by exogenous application of glycinebetaine and salicylic acid in sunflower[J]. Journal of Agronomy and Crop Science,2008,194(3):193-199.
[20]Kudla J,Batistic O,Hashimoto K.Calcium signals:the lead currency of plant information processing[J]. The Plant Cell,2010,22(3):541-563.
[21]高向陽,許志強,徐鳳彩. 水分脅迫下鈣對大豆葉片膜脂過氧化程度的影響[J]. 華南農業大學學報,1999,20(3):67-71.
[22]山 侖,郭禮坤,徐 萌,等. 干旱條件下鈣與赤霉素混合處理種子的生理效應及增產效果[J]. 干旱地區農業研究,1994,12(1):85-91.
[23]Males J,Griffiths H. Stomatal biology of CAM plants[J]. Plant Physiology,2017,174(2):550-560.
[24]景蕊蓮,昌小平,胡榮海. 外源甜菜堿對小麥幼苗抗旱性的影響[J]. 干旱地區農業研究,1998,16(2):1-5.
[25]Okazaki Y,Tazawa M. Calcium ion and turgor regulation in plant cells[J]. The Journal of Membrane Biology,1990,114(3):189-194.
[26]倪 鋒,謝鵬飛,褚榮浩,等. 利用日光誘導葉綠素熒光估算高溫干旱復合脅迫下夏玉米生理生態參數[J]. 江蘇農業學報,2022,38(3):587-596.
[27]薛 崧,汪沛洪,許大全,等. 水分脅迫對冬小麥CO2同化作用的影響[J]. 植物生理學報,1992,18(1):1-7.
[28]郭郁頻,任永霞,劉貴河,等. 外源鈣和赤霉素對干旱脅迫下苜蓿幼苗生理特性的影響[J]. 草業學報,2015,24(7):89-96.
[29]范春麗,羅 青. 干旱脅迫下外源甜菜堿對石榴光合作用、滲透調節及保護酶活性的影響[J]. 江蘇農業科學,2016,44(11):229-232.
[30]趙新西,馬千全,楊興洪,等. 根施甜菜堿對干旱脅迫下小麥幼苗類囊體膜組分和功能的影響[J]. 植物生理與分子生物學學報,2005,31(2):135-142.
[31]蔣明義,楊文英,徐 江,等. 滲透脅迫下水稻幼苗中葉綠素降解的活性氧損傷作用[J]. 植物學報,1994,36(4):289-295.
[32]伍澤堂. 超氧自由基與葉片衰老時葉綠素破壞的關系(簡報)[J]. 植物生理學通訊,1991,27(4):277-279.
[33]楊肖華,郭圣茂,馮美玲,等. 干旱脅迫及復水對射干光合作用和葉綠素熒光特性的影響[J]. 江西農業大學學報,2018,40(3):525-532.
[34]郭愛霞,石曉昀,王延秀,等. 干旱脅迫對3種蘋果砧木葉片光合、葉綠體超微結構和抗氧化系統的影響[J]. 干旱地區農業研究,2019,37(1):178-186.
[35]任麗花,翁伯琦,方金梅. 施鈣增強作物抗旱力的研究進展[J]. 亞熱帶農業研究,2005,1(3):19-25.
[36]李海霞,米銀法,陳雙臣. 外源鈣對干旱脅迫下不同抗性牡丹PSⅡ功能和光能分配的影響[J]. 江蘇農業科學,2022,50(16):120-127.
[37]Xing W B,Rajashekar C B. Alleviation of water stress in beans by exogenous glycine betaine[J]. Plant Science,1999,148(2):185-192.
[38]姜義寶,楊玉榮,鄭秋紅. 外源一氧化氮對干旱脅迫下苜蓿幼苗抗氧化酶活性和葉綠素熒光特性的影響[J]. 干旱地區農業研究,2008,26(2):65-68.
[39]何 瑋,蔣 安,王 琳,等. PEG干旱脅迫對紅三葉抗性生理生化指標的影響研究[J]. 中國農學通報,2013,29(5):5-10.
[40]謝 詩. 外源鈣對干旱脅迫下結縷草生長的緩解作用[D]. 沈陽:遼寧大學,2013:1-49.
[41]Grlach A,Bertram K,Hudecova S,et al. Calcium and ROS:a mutual interplay[J]. Redox Biology,2015,6:260-271.
[42]馬千全. 外源甜菜堿提高小麥抗旱性的研究[D]. 泰安:山東農業大學,2003.
[43]Einset J,Nielsen E,Connolly E L,et al. Membrane-trafficking RabA4c involved in the effect of glycine betaine on recovery from chilling stress in Arabidopsis[J]. Physiologia Plantarum,2007,130(4):511-518.
[44]郭啟芳,馬千全,孫 燦,等. 外源甜菜堿提高小麥幼苗抗鹽性的研究[J]. 西北植物學報,2004,24(9):1680-1686.
[45]Abdel-Basset R. Calcium channels and membrane disorders induced by drought stress in Vicia faba plants supplemented with calcium[J]. Acta Physiologiae Plantarum,1998,20(2):149-153.
[46]劉金蘭. 外源鈣和甜菜堿提高小麥抗旱性研究[D]. 泰安:山東農業大學,2009:1-73.

