犬乳腺上皮細胞的分離鑒定及培養方法優化
馮子建 孫 娜 郝志立 孫盼盼 張 華 范闊海 尹 偉 楊惠珍 鐘 佳 張振彪 王建中 孫耀貴 李宏全*
(1.山西農業大學 動物醫學學院/中獸醫藥現代化山西省重點實驗室,山西 太谷 030801;2.吉林大學 動物醫學學院,長春 130015;3.山西農業大學 實驗動物管理中心,山西 太谷 030801)
犬乳腺腫瘤是母犬中最常見的腫瘤,發病初期會出現嗜睡,體重減輕,咳嗽,淋巴水腫等癥狀[1-2]。根據調查發現,犬乳腺腫瘤占犬腫瘤疾病的50%左右,且多數為惡性腫瘤[3-5]。應用手術對病變部位切割是最保守的治療方法[6],但病灶復發的可能性高[7];化療在臨床上常以輔助治療,但治療過程中多伴有腹瀉,嘔吐,中性粒細胞減少等癥狀,甚至會導致病犬死亡[8-9]。近年來,越來越多的研究人員開始聚焦犬乳腺腫瘤細胞,探討抗腫瘤新藥的作用效果和作用機制,為后期體內研究提供理論基礎[10-11]。為保護正常細胞免受藥物帶來的毒性作用,首應將藥物應用于犬乳腺上皮細胞進行安全評價。原代乳腺上皮細胞直接來自動物新鮮組織或乳汁,分離的細胞適應體內到體外的環境變化后,恢復原有的增殖分裂能力,保留原有組織的特性,后續可用于藥物的毒性研究[12]。目前,尚沒有犬乳腺上皮細胞系可代替原代細胞進行上述研究。因此,對犬乳腺上皮細胞進行簡單便捷的分離及尋找適宜的培養方法至關重要。
體外獲得乳腺上皮細胞的方法包括組織塊貼壁法、酶消化法和乳汁分離法。孫培皓等[13]利用改進的酶消化法從乳腺分離得到奶牛的原代乳腺上皮細胞,為進一步探討奶牛乳腺細胞的功能與泌乳機制提供技術支持;宣超瑩等[14]采用組織塊貼壁法成功分離綿羊乳腺上皮細胞,利用LPS刺激乳腺上皮細胞成功建立炎癥模型,為后續研究綿羊乳房炎的機制提供扎實基礎。但這兩種方法分離得到的乳腺上皮細胞多有成纖維細胞摻雜,需用差時消化法多次進行純化,操作繁瑣,耗時過長,容易使乳腺細胞活力降低且易受到污染[15]。相比前者,乳汁分離法分離得到的乳腺上皮細胞純度高,可以快速擴增,但對乳汁質量要求較高,否則難以成功。胡靜思等[16]曾利用乳汁分離法成功分離出犬乳腺上皮細胞,但對細胞的生長條件沒有系統概述;Bakirel等[17]利用組織塊貼壁法成功分離出犬乳腺上皮細胞,但分離出的細胞包含大量成纖維細胞,需進一步純化才能得到純度高的乳腺上皮細胞。研究發現,前人在培養不同動物的乳腺上皮細胞時所使用的培養基有差異(表1),發現同一種屬的乳腺上皮細胞在有無培養添加物(EGF、轉鐵蛋白等)的情況下均可以增殖分裂。因此,本研究在前人分離犬乳腺上皮細胞的基礎上進行了優化,并將其接種于常用的兩種培養基,對比兩者的成活率和生長情況,為后期分離犬乳腺上皮細胞得出一個較優的培養方案。

表1 不同動物的乳腺上皮細胞培養基Table 1 Mammary epithelial cell culture medium for different animals
1 材料與方法
1.1 主要試劑與儀器
DMEM/F12購自美國Gibco公司,表皮生長因子、轉鐵蛋白、氫化考的松、青鏈霉素混合液、胰蛋白酶、DMSO、羊抗兔IgG-FITC和山羊封閉血清購自中國Solarbio公司,胎牛血清購自以色列Biological Industries公司,角蛋白8(Cytokeratin 8)抗體購自武漢proteintech公司;熒光倒置顯微鏡(日本Olympus公司)。
基礎培養基:DMEM/F12+10%FBS+1%青鏈霉素混合液。
完全培養基:DMEM/F12+10%FBS+1%青鏈霉素混合液+10 ng/mL EGF+5 μg/mL轉鐵蛋白+1 μg/mL氫化考的松。
1.2 試驗方法
1.2.1乳汁的采集與乳腺上皮細胞的分離
試驗取材自飼養于山西晉中小型犬舍健康泌乳一周的金毛犬。使用生理鹽水將乳房沖洗干凈,隨后用75%酒精對乳頭進行消毒,在無菌條件下采集乳汁并放于保溫盒帶回實驗室。將乳汁與含有1%青鏈霉素混合液的PBS按2∶1的比例混勻,1 500 r/min 離心5 min,棄去上層乳脂層和中間渾濁液體,加入等體積的PBS,再次離心重復上述步驟,直至離心結束液體澄清[18-19]。分別加入完全培養基和基礎培養基重懸細胞并轉移到適宜的培養瓶,5% CO237 ℃條件下培養。每3 d換液1次,長滿瓶底后傳代。
1.2.2細胞凍存后復蘇活力檢測
將完全培養基培養的第6代細胞進行凍存(凍存液:FBS∶DMSO=9∶1),提前配置好凍存液后放入4 ℃冰箱預冷備用,細胞以1×106個/mL進行凍存,每管1 mL移入細胞凍存管,放入梯度凍存盒并轉到-80 ℃冰箱,過夜后轉移至液氮保存。3 d 后取出細胞,迅速在37 ℃恒溫水浴鍋解凍,隨后1 000 r/min離心5 min,將細胞接種于六孔板觀察。
1.2.3間接免疫熒光法鑒定犬乳腺上皮細胞
取長至單層的犬乳腺上皮細胞,消化后接種至48孔板,過夜培養,隨后棄去培養液,4%多聚甲醛固定30 min,PBS清洗3次,加入0.2%的TritonX-100處理細胞5 min,PBS清洗3次,加入10%山羊血清封閉30 min,PBS清洗3次。按1∶100配置兔Cytokeratin 8一抗溶液加入48孔板,同時設立陰性對照組,每孔加入等量PBS。4 ℃過夜孵育后洗滌,按1∶200比例配置FITC標記的羊抗兔二抗溶液,加入48孔板,常溫孵育1 h,PBS清洗3次,加入DAPI染液染色3 min,隨后倒置熒光顯微鏡觀察。
1.2.4CCK-8法繪制細胞生長曲線
取基礎培養基和完全培養基培養的第3代細胞,消化處理后制備成細胞懸液,以每孔3~5×103個細胞量接種于96孔板,同時設置3個重復孔,5% CO237 ℃條件下培養7 d,每24 h取一個96孔板,每孔加入10 μL CCK-8溶液,恒溫放置1 h,450 nm測量每孔的OD值,并以培養天數為橫坐標,細胞OD值為縱坐標繪制細胞生長曲線。
2 結果與分析
2.1 細胞形態學觀察
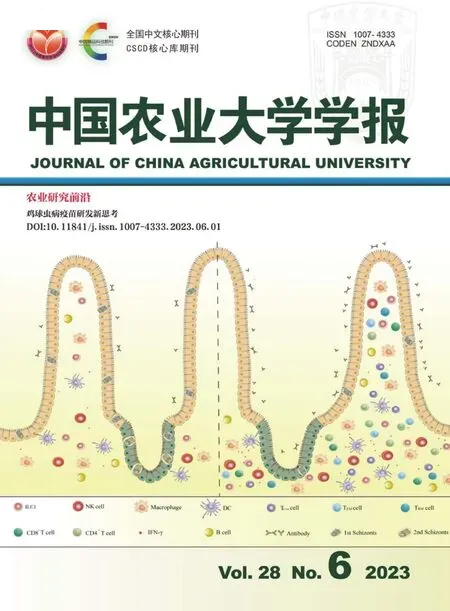
將細胞離心處理后分別使用基礎培養基和完全培養基重懸細胞,接種到6孔板,兩種培養基接種的原代細胞生長情況見表2。基礎培養基接種的細胞長滿后每4 d進行一次傳代,隨著傳代次數的增加,細胞狀態逐漸變差,死亡細胞明顯增多,在傳至第4代時細胞僅有少部分能夠貼壁,這說明基礎培養基并不能滿足細胞生長所需的條件(圖1(f));完全培養基接種的細胞每3 d進行一次傳代,細胞呈“鵝卵石鋪路樣”成片生長(圖1(h)箭頭所指)。隨著傳代次數的增加,細胞狀態穩定,死細胞并沒有明顯增多,但要將長滿的細胞及時傳代,否則部分細胞會有“空泡化”現象(圖1(i)箭頭所指)。在消化時間上兩者差異較大,基礎培養基培養的細胞消化2 min完全脫離瓶底,以聚集在一起的團塊為主漂浮在培養基中,離心重懸后使用移液槍反復吹吸可將細胞吹散;完全培養基培養的細胞消化8~10 min可將胞間偽足完全消化,細胞沒有大量聚集,零散分布在培養基。綜上所述,兩種培養基下細胞的形態不一,基礎培養基只能維持4代以內細胞生長,完全培養基可進行多次傳代且細胞沒有衰老跡象。

表2 兩種培養基接種細胞的生長情況Table 2 Growth of cells seeded with two types of media
2.2 凍存后復蘇細胞狀態
將第6代完全培養基培養的細胞復蘇并接種24 h后,已有大量細胞貼壁并增殖分裂(貼壁細胞占細胞總量的80%),細胞狀態良好,隨后的48 h細胞平鋪滿整個板底(圖2)。
2.3 間接免疫熒光法鑒定犬乳腺上皮細胞
將兩種培養基培養的第3代細胞接種于48孔板,過夜培養后間接免疫熒光檢測細胞角蛋白8表達,同時設置陰性對照孔,結果如圖3所示,兩種培養基培養的細胞間接免疫熒光結果均為陽性,同時陰性對照組沒有綠色熒光,證明分離的細胞均為犬乳腺上皮細胞。
2.4 CCK-8法繪制細胞生長曲線
將兩種培養基培養的第3代細胞以每孔5×103個的數量接種,繪制兩種培養基下的細胞生長曲線。基礎培養基下的細胞生長較為緩慢,在第3天細胞生長達到峰值,隨著培養時間的延長,死細胞增多,隨后分裂幾乎停止且狀態逐漸變差,可見在基礎培養基下,細胞并沒有大量增殖分裂(圖4(a));完全培養基培養的細胞在24 h內貼壁,并以偽足和其他細胞相連生長,前兩天細胞生長緩慢,處于穩定期,第3~5天呈指數生長,在第6天細胞增殖逐漸平穩,整體生長趨勢呈現“S”形,具有細胞分裂增殖的基本特征(圖4(b))。
3 討 論
目前乳腺上皮細胞的分離方法主要有酶消化法、組織塊貼壁法和乳汁分離法。楊玉瑩等[20]采用胰酶和Ⅰ型膠原酶分段消化牦牛乳腺組織塊,通過分子表型及功能鑒定純化后的細胞可陽性表達角蛋白18及β-酪蛋白,成功分離出牦牛乳腺上皮細胞;朝格圖[21]通過組織塊貼壁法成功分離到能表達β-酪蛋白的奶牛乳腺上皮細胞和成纖維細胞,但分離出來的上皮細胞多有成纖維細胞的混合,需經差速貼壁法、差時消化法等方法對細胞進行純化,經4~5次純化處理可以得到純度較高的乳腺上皮細胞[22-24]。

(a)乳汁離心分離細胞并接種(10×);(b)接種24 h后的“煎蛋樣”細胞(40×);(c)完全培養基接種4 d后出現的“島嶼狀”細胞(20×);(d)~(f)為基礎培養基接種的細胞:(d)細胞培養9 d出現的細胞單克隆(10×);(e)細胞培養12 d后出現大面積細胞(10×);(f)細胞消化傳代后貼壁較快,但生長速度較慢(10×);(g)~(i)為完全培養基接種的細胞:(g)細胞培養9 d出現大面積拉網現象(10×);(h)細胞長滿后消化傳代,呈“鵝卵石鋪路樣”生長(20×);(i)有“空泡化”現象的部分細胞(10×)。(a) Milk was centrifuged to separate cells and seeded (10×);(b) “Fried egg-like”cells 24 h after seeding (40×);(c) “Island-like”cells that appeared 4 d after complete medium seeding (20×);(d)-(f) are the cells inoculated in the basal medium:(d) The cell monoclonal appeared after 9 days of cell culture (10×);(e) The large area of cells appeared after 12 days of cell culture (10×);(f) After the cells were digested and passaged,the post-adherence is faster,but the growth rate is slower (10×);(g)-(i) are cells inoculated in complete medium:(g) The cells were cultured for 9 days with a large area of netting phenomenon (10×);(h) After the cells were overgrown digested and passaged,it grows like “cobblestone paving”(20×);(i) Some cells being “vacuolated”(10×).圖1 犬乳腺上皮細胞形態觀察Fig.1 Morphological observation of canine mammary epithelial cells
但要控制酶的消化時間,若控制不當易對上皮細胞造成損傷。
乳汁分離法在牛等大型動物應用校多[18-19],小動物與牛相比乳汁分泌量少,但也有成功分離出乳腺上皮細胞的研究。胡靜思等[16]從泌乳期比格犬的乳汁中分離出乳腺上皮細胞,比格犬作為試驗常用的動物模型,結果具有穩定性,可重復性的優點,但實驗性比格犬的飼養條件繁瑣且大多用于臨床毒理試驗[25],探討普通家養犬能否通過乳汁分離法分離出乳腺上皮細胞是本研究的目的之一。因此本研究取材自普通環境飼養的泌乳期金毛犬,金毛犬作為最常見的大型家犬之一,性格友好易于管理,泌乳期乳汁分泌多,為后期分離培養乳腺上皮細胞提供良好條件。
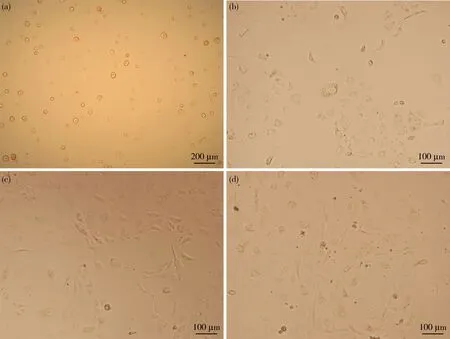
(a)復蘇后的細胞接種(10×);(b)細胞接種培養24 h(20×);(c)細胞接種培養48 h(20×);(d)細胞接種培養72 h(20×)。(a) Cell seeding after resuscitation (10×);(b) Cell seeding culture for 24 h (20×);(c) Cell seeding and culture for 48 h (20×);(d) Cell seeding culture for 72 h (20×).圖2 凍存后復蘇細胞狀態Fig.2 Recovery of cell status after cryopreservation
乳房上皮在妊娠期間會大量生成,妊娠晚期分化為可以泌乳的細胞[26],隨著哺乳的進行,大量乳腺上皮細胞會脫落到乳汁中并排出,且多數細胞具有活性[27],因此試驗取材需選擇處于泌乳早期的動物。本研究參照了前人乳汁分離乳腺上皮細胞的方法,將乳汁收集后加含有1%青鏈霉素混合液的PBS離心重懸[18-19],但培養不同種屬的乳腺上皮細胞時所使用的培養基并不完全相同,且細胞培養的過程沒有清晰闡述,因此本研究在已有的基礎上選取了兩種常用的乳腺上皮細胞培養基,同時接種犬原代乳腺上皮細胞于大小不同的培養皿,通過觀察細胞的形態,檢測細胞角蛋白8(Cytokeratin 8)的表達,觀察細胞凍存復蘇活力,繪制細胞的生長曲線來評估最適宜的培養方案。經研究發現,采集乳汁時盡量選擇泌乳早期的犬,這期間脫落的乳腺上皮細胞的活性較高,有利于細胞增殖;乳汁洗滌離心時,要盡量把乳汁中的乳脂去除干凈,否則細胞容易污染;接種時要注意細胞密度與培養皿大小的選擇,如果接種密度過小會影響細胞的增殖與細胞間偽足的產生,接種的培養皿過大會造成貼壁細胞密度不一,影響細胞后期的增殖分化,本研究最終將細胞接種至6孔板,便于細胞分布均一,有利于后期增殖與傳代;Cytokeratin 8作為上皮細胞的標志性蛋白可用來鑒定乳腺上皮細胞[28],本研究中兩種培養基下培養的第2代與第3代細胞均有Cytokeratin 8的大量表達,同時在細胞傳代過程中發現兩者分別在消化時間上一致,沒有差異性,證明所分離的細胞為犬乳腺上皮細胞。
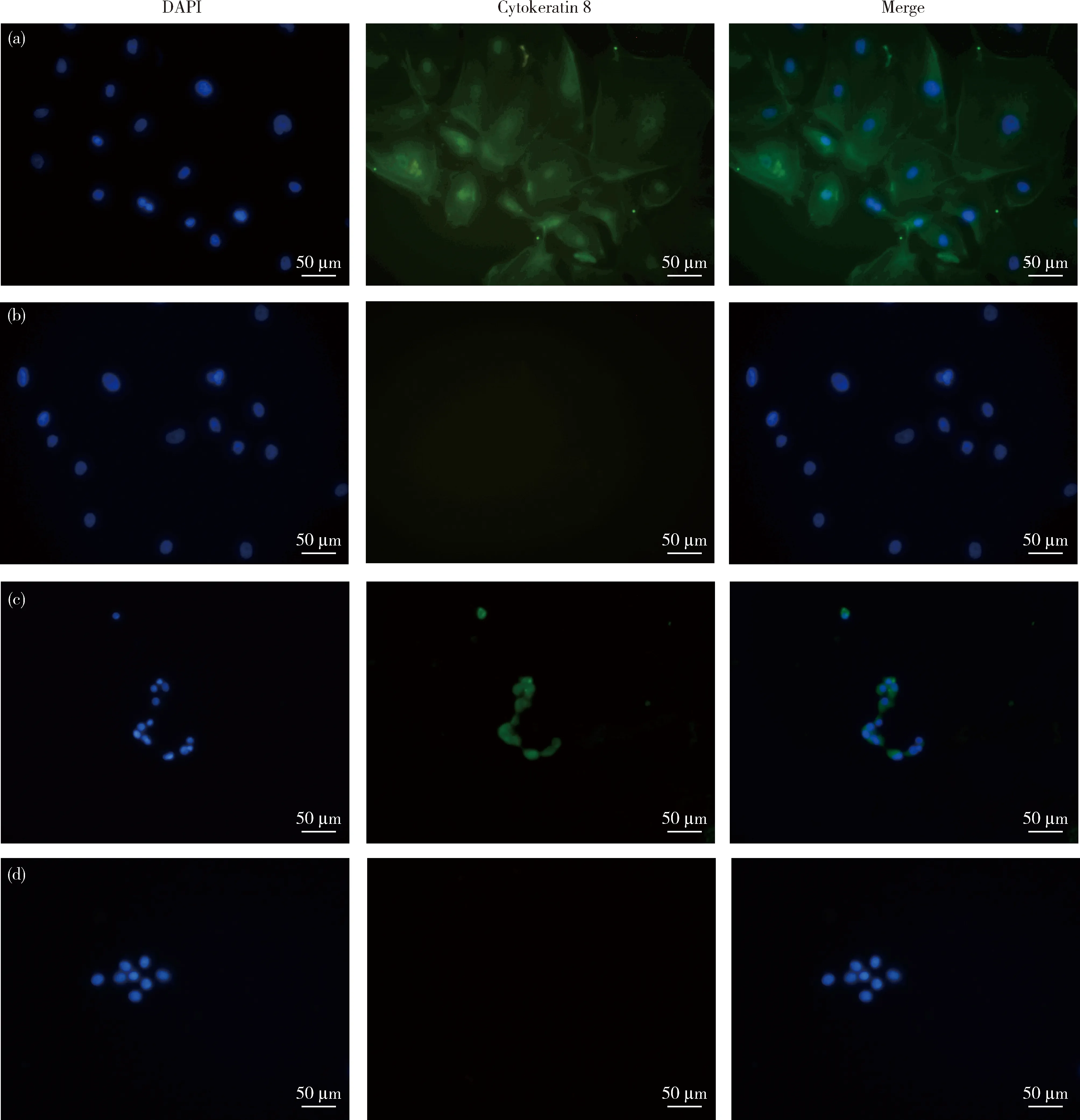
(a)完全培養基培養細胞Cytokeratin 8陽性(40×);(b)完全培養基培養細胞陰性對照(40×);(c)基礎培養基培養細胞Cytokeratin 8陽性(40×);(d)基礎培養基培養細胞陰性對照(40×)。(a) Cytokeratin 8 positive for cells cultured in complete medium (40×);(b) Negative control for cells cultured in complete medium (40×);(c) Cytokeratin 8 positive for cells cultured in basal medium (40×);(d) Negative control for cells cultured in basal medium (40×).圖3 間接免疫熒光法鑒定犬乳腺上皮細胞Fig.3 Identification of canine mammary epithelial cells by indirect immunofluorescence
體外培養犬乳腺上皮細胞時發現,基礎培養基培養前期單個貼壁細胞會分裂成細胞單克隆,但胞間沒有拉網大面積生長,消化傳代后沒有快速分裂增殖且隨著培養時間的延長而狀態變差;完全培養基培養的細胞生長迅速,胞間以偽足相連,細胞形態舒展為“鵝卵石鋪路樣”且大面積生長,消化傳代后3 d即可長滿,但要及時將長滿的細胞進行傳代,否則細胞會出現“空泡化”現象直至死亡,且細胞傳代后“空泡化”現象依舊沒有改善,同時消化時間控制在10 min左右,避免時間過長影響細胞活力;對2種培養基培養的細胞繪制生長曲線可以看出完全培養基符合細胞分裂的基本特征,以上表明在犬原代乳腺上皮細胞的培養過程中,單一的培養基跟胎牛血清并不能滿足細胞生長的營養要求,在培養基中添加表皮生長因子(EGF)、轉鐵蛋白和氫化考的松是犬乳腺上皮細胞快速增殖分裂的必然條件。

(a)基礎培養基所培養細胞的生長曲線;(b)完全培養基所培養細胞的生長曲線。(a) Growth curve of cells cultured in basal medium;(b) Growth curve of cells cultured in complete medium.圖4 犬乳腺上皮細胞生長曲線Fig.4 Growth curve of canine mammary epithelial cells
犬乳腺腫瘤作為母犬中最常見的腫瘤之一,對犬造成的危害巨大,傳統治療方法有局限性,治療不徹底還會復發[6-7],因此尋找能運用于臨床且副作用小的藥物是接下來的研究重點。乳腺上皮由外層的肌上皮細胞和內部的管腔細胞構成[29-30],而犬的乳腺腫瘤恰由管腔上皮細胞、肌上皮細胞、間質結締組織構成,說明犬乳腺癌的發生發展與乳腺上皮細胞有密切聯系[31-32],首先在細胞水平上觀察藥物的毒性作用是至關重要的。原代乳腺上皮細胞保留了乳腺的特異性功能和信號轉導,最能代表體內狀態,本研究從泌乳期金毛犬的乳汁中分離得到乳腺上皮細胞,可作為抗腫瘤藥物的細胞模型,初步篩選藥物的作用濃度,提高后續抗腫瘤研究的可靠性;也可同犬乳腺腫瘤細胞進行對比研究,探討抗腫瘤藥物在犬乳腺腫瘤細胞的作用靶點,為后期了解犬乳腺癌的發生發展與藥物對犬乳腺腫瘤的作用機制提供扎實基礎。因此掌握能夠快速分離犬原代乳腺上皮細胞的方法并選用合適的培養方案是極為重要的,為研究犬乳腺腫瘤的發病機制提供穩定的細胞模型與技術支持。
4 結 論
本研究利用乳汁分離法成功分離出犬原代乳腺上皮細胞,發現與基礎培養基相比,完全培養基可以更好地維持細胞活性,促進細胞增殖分裂,且不影響細胞凍存后復蘇的活力,為后期快速分離犬乳腺上皮細胞提供較優的培養方案。