呼吸系統腫瘤用藥的臨床應用
——2022 版新型抗腫瘤藥物臨床應用指導原則(一)
中華人民共和國國家衛生健康委員會
1 吉非替尼(gefitinib)
劑型:片劑;規格:0.25g;適應癥:表皮生長因 子 受 體(epidermal growth factor receptor,EGFR)基因具有敏感突變的局部晚期或轉移性非小細胞肺癌(non-small cell lung cancer,NSCLC)。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的EGFR基因檢測方法檢測到的EGFR敏感突變。
(2)腫瘤組織和血液均可用于EGFR基因突變檢測,但組織檢測優先。本標準也適用于其他EGFR 酪氨酸激酶抑制劑(EGFR tyrosine kinase inhibitors, EGFR-TKIs)。
(3)吉非替尼單藥推薦劑量為0.25g/次,每日1 次,口服,空腹或與食物同服,直至疾病進展或出現不能耐受的毒性。如果漏服本品一次,應在患者記起后盡快服用。
(4)治療期間因藥物毒性不可耐受時,可在同一代藥物之間替換,如疾病進展則不能在同一代藥物之間替換。
(5)治療過程中影像學顯示緩慢進展但臨床癥狀未發生惡化的患者,可繼續使用原藥物;顯示寡進展或中樞神經系統進展的患者,可繼續使用原藥物加局部治療;對于廣泛進展的患者,建議改換為其他治療方案。本條標準也適用于其他EGFRTKIs。
(6)用藥期間必須注意常見的皮膚黏膜反應和腹瀉;應特別注意間質性肺炎、肝臟毒性和眼部癥狀的發生。
(7)如確診藥物相關性間質性肺炎,建議永久停用。本條標準也適用于其他EGFR-TKIs。
(8)藥物相互作用劑量調整。①與CYP3A4 強效誘導劑聯用。如聯用后未出現重度藥物不良反應,吉非替尼日劑量可增加至0.5g,中斷CYP3A4 強效誘導劑給藥7 天后,可重新開始吉非替尼日劑量0.25g 給藥方案。②與CYP3A4 強效抑制劑聯用。CYP3A4 強效抑制劑能降低吉非替尼代謝速率,增加其血漿濃度,二者聯合使用時,應監測不良反應。
* (9)對于某些腫瘤急癥(如腦轉移昏迷或呼吸衰竭),在充分知情的情況下,對不吸煙的肺腺癌患者,可考慮在驅動基因不明的情況下盡快用藥。一旦病情緩解,必須補充進行EGFR突變的組織或血液檢測。本標準也適用于其他EGFR-TKIs。
2 厄洛替尼(erlotinib)
劑型:片劑;規格:100mg、150mg;適應癥:EGFR基因具有敏感突變的局部晚期或轉移性NSCLC。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的EGFR基因檢測方法檢測到的EGFR敏感突變。
(2)有腦轉移的EGFR基因突變的NSCLC 患者和21 外顯子L858R 置換突變陽性晚期NSCLC患者,可選擇厄洛替尼聯合貝伐珠單抗治療。
(3)厄洛替尼單藥用于NSCLC 的推薦劑量為150mg/次,每日1 次,口服,至少在飯前1h 或飯后2h 服用。
(4)用藥期間必須注意常見的皮膚黏膜反應和腹瀉。應特別注意間質性肺炎、肝功能損傷和眼部癥狀的發生。
(5)避免與CYP3A4 強效抑制劑或強效誘導劑聯合使用。避免厄洛替尼與可顯著且持續升高胃液pH 的藥物聯合使用。
(6)吸煙會導致厄洛替尼的暴露量降低,建議患者戒煙。
*(7)美國食品藥品監督管理局(FDA)批準厄洛替尼與吉西他濱聯合用于局部晚期、無法切除或轉移性胰腺癌的一線治療。目前,國內尚未獲批此適應癥,可在與患者充分溝通的情況下使用。用法為100mg,每日1 次,口服。
3 埃克替尼(icotinib)
劑型:片劑;規格:125mg;適應癥:①EGFR基因具有敏感突變的局部晚期或轉移性NSCLC。②Ⅱ~ⅢA 期[國際抗癌聯盟(Union of International Cancer Control,UICC) /美國癌癥聯合委員會(American Joint Committee on Cancer,AJCC)肺癌分期系統第7 版]伴有EGFR基因敏感突變NSCLC 的術后輔助治療。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的EGFR基因檢測方法檢測到的EGFR敏感突變。
(2)EGFR基因敏感突變的Ⅱ~ⅢA 期NSCLC患者完全腫瘤切除術后推薦埃克替尼輔助治療。
(3)常規劑量為125mg/次,每日3 次,口服,空腹或與食物同服,高熱量食物可能明顯增加藥物吸收。對于21 外顯子L858R 置換突變陽性晚期NSCLC 患者,可使用250mg/次,每日3 次,口服。
(4)有腦轉移的EGFR基因突變的NSCLC 患者,可選擇埃克替尼。
(5)不良反應主要為常見的1~2 級皮疹和腹瀉,應特別注意間質性肺炎的發生。
(6)埃克替尼主要通過CYP2C19 和CYP3A4代謝,對CYP2C9 和CYP3A4 有明顯的抑制作用,與CYP2C19 和CYP3A4 強效誘導劑、CYP2C9 和CYP3A4 底物聯合使用時應注意藥物相互作用。
4 阿法替尼(afatinib)
劑型:片劑;規格:20mg、30mg、40mg;適應癥:①具有EGFR基因敏感突變的局部晚期或轉移性NSCLC,既往未接受過EGFR-TKIs 治療。②使用含鉑藥物化療期間或化療后疾病進展的局部晚期或轉移性鱗狀細胞組織學類型的NSCLC。
合理用藥要點:
(1)一線治療EGFR基因敏感突變的晚期NSCLC 患者時,用藥前必須明確有經國家藥品監督管理局批準的EGFR基因檢測方法檢測到的EGFR基因敏感突變。
(2)雖然藥品說明書顯示,阿法替尼無需進行基因檢測即可用于二線治療使用含鉑藥物化療期間或化療后進展的晚期肺鱗癌患者,但仍然不推薦本品用于EGFR基因突變陰性患者。
(3)對于非常見EGFR基因突變患者,優先使用阿法替尼。
(4)推薦劑量為40mg/次,每日1 次,口服,可根據患者耐受性調整劑量,劑量調整方案見表1。

表1 阿法替尼推薦劑量調整方案
(5)對于臨床醫師評價為耐受性差的患者,推薦劑量為30mg/次,每日1 次,口服。
(6)阿法替尼不應與食物同服,應當在進食后至少3h 或進食前至少1h 服用。
(7)用藥期間必須注意腹瀉、皮膚相關不良反應和間質性肺炎等不良事件。
(8)如需要使用P-糖蛋白抑制劑,應采用交錯劑量給藥,盡可能延長與阿法替尼給藥的間隔時間。P-糖蛋白抑制劑應在阿法替尼給藥后間隔6h(P-糖蛋白抑制劑每日2 次給藥)或12h(P 糖蛋白抑制劑每日1 次給藥)給藥。
(9)阿法替尼不通過CYP 酶系代謝,體外實驗研究顯示本品與CYP 抑制劑或誘導劑聯合使用時,對阿法替尼的血藥濃度無明顯影響。
(10)本品含有乳糖,患有罕見遺傳性半乳糖不耐受癥、乳糖酶缺乏癥或葡萄糖-半乳糖吸收不良的患者不應服用本品。
5 達可替尼(dacomitinib)
劑型:片劑;規格:15mg、45mg;適應癥:單藥用于EGFR19 外顯子缺失突變或21 外顯子L858R 置換突變的局部晚期或轉移性NSCLC 患者的一線治療。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的EGFR基因檢測方法檢測到的EGFR19 外顯子缺失突變或21 外顯子L858R 置換突變陽性患者。
(2)對于21 外顯子L858R 置換突變陽性患者,優先推薦達可替尼。
(3)推薦劑量為45mg/次,每日1 次,口服,可與食物同服或不同服。對于臨床醫師評價為耐受性差的年老體弱患者,起始劑量可為30mg/次,每日1 次,口服。
(4)達可替尼常見不良反應為腹瀉、皮疹、甲溝炎、口腔黏膜炎、皮膚干燥等,應特別注意間質性肺炎的發生。
(5)如果出現不良反應,應根據患者的耐受性,以每次減量15mg 的方式逐步降低本品的劑量:①首次減量至30mg/次,每日1 次,口服。②第2 次減量至15mg/次,每日1 次,口服。如果患者不耐受15mg/次,每日1 次的給藥劑量,應永久停用。
(6)不建議對輕、中、重度肝功能損傷或輕、中度腎功能損傷患者調整劑量。尚未確定重度腎功能損傷患者的本品推薦劑量。
(7)服用本品時,避免同時使用質子泵抑制劑。可使用局部作用的抗酸劑或組胺H2受體拮抗劑代替質子泵抑制劑;必須臨時服用組胺H2受體拮抗劑的情況下,至少提前6h 或滯10h 給予本品。
(8)達可替尼主要通過CYP2D6 代謝,服用本品時,避免同時使用CYP2D6 底物。
6 奧希替尼(osimertinib)
劑型:片劑;規格:40mg、80mg;適應癥:①用于ⅠB~ⅢA 期(國際抗癌聯盟/美國癌癥聯合會分期系統IASLC/AJCC 第7 版分期)EGFR19 外顯子缺失突變或21 外顯子L858R 置換突變的NSCLC 患者術后輔助治療,并由醫生決定接受或不接受輔助化療。②用于具有EGFR19 外顯子缺失突變或21 外顯子L858R 置換突變的局部晚期或轉移性NSCLC 成人患者的一線治療。③既往經EGFR-TKIs 治療時或治療后出現疾病進展,并且經檢測確認存在EGFRT790M 突變陽性的局部晚期或轉移性NSCLC 成人患者的治療。
合理用藥要點:
(1)術后輔助用藥或一線用藥前必須明確有經國家藥品監督管理局批準的EGFR基因檢測方法檢測到的EGFR19 外顯子缺失突變或21 外顯子L858R 置換突變陽性患者。
(2)對于既往經EGFR-TKIs 治療時或治療后出現疾病進展的局部晚期或轉移性患者,用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到的EGFRT790M 突變。
(3)EGFR基因敏感突變的ⅠB~ⅢA 期(國際抗癌聯盟/美國癌癥聯合會分期系統IASLC/AJCC第7 版分期)NSCLC 患者完全腫瘤切除術后推薦奧希替尼輔助治療。
(4)基于與第一代EGFR-TKIs 對比的隨機對照臨床試驗結果,EGFR突變陽性的腦轉移或腦膜轉移患者推薦優先使用第三代EGFR-TKIs。本條標準適用于奧希替尼、阿美替尼和伏美替尼。
(5)奧希替尼推薦劑量為80mg/次,每日1 次,口服,進餐或空腹時服用均可。根據患者個體的安全性和耐受性,可暫停用藥或減量。如果需要減量,則劑量應減至40mg/次,每日1 次,口服。
(6)用藥期間必須注意常見的皮膚反應和腹瀉,需注意心電圖QTc 間期延長,應特別注意間質性肺炎的發生。
(7)避免與CYP3A4 強效誘導劑、乳腺癌耐藥蛋白底物以及P-糖蛋白底物聯合使用。
*(8)2022 美國國家癌癥綜合網絡(NCCN)指南及2022 歐洲醫學腫瘤學會(ESMO)《EGFR突變型NSCLC 管理共識》推薦奧希替尼用于EGFR少見突變(S768I,L861Q 或G719X 突變)晚期或轉移性NSCLC 患者的治療。
7 阿美替尼(almonertinib)
劑型:片劑;規格:55mg;適應癥:①用于具有EGFR19 外顯子缺失突變或21 外顯子L858R 置換突變的局部晚期或轉移性NSCLC 成人患者的一線治療。②既往經EGFR-TKIs 治療時或治療后出現疾病進展,并且經檢測確認存在EGFRT790M突變陽性的局部晚期或轉移性NSCLC 成人患者的治療。
合理用藥要點:
(1)阿美替尼推薦劑量為110mg/次,每日1次,口服,空腹或餐后服用均可,整片吞服,不應咀嚼、壓碎或掰斷藥片。對于無法整片吞咽藥物和需經鼻胃管喂飼的患者,可將藥片直接溶于不含碳酸鹽的飲用水中完全分散后服用。
(2)一線用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到EGFR19 外顯子缺失突變或21 外顯子L858R 置換突變。
(3)對于既往經EGFR-TKIs 治療時或治療后出現疾病進展的局部晚期或轉移性患者,用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到EGFRT790M 突變。
(4)阿美替尼常見不良反應為皮疹、血肌酸激酶升高和瘙癢等,腹瀉的發生率相對較低。需警惕間質性肺炎的發生。
(5)避免與CYP3A4 強效誘導劑或抑制劑聯合使用,應慎用乳腺癌耐藥蛋白和P-糖蛋白敏感底物的窄治療窗藥物。避免與升高肌酸激酶的藥物(如他汀類藥物)聯合使用。
8 伏美替尼(furmonertinib)
劑型:片劑;規格:40mg;適應癥:①用于具有EGFR19 外顯子缺失突變或21 外顯子L858R置換突變的局部晚期或轉移性NSCLC 成人患者的一線治療。②用于既往經EGFR-TKIs 治療時或治療后出現疾病進展,并且經檢測確認存在EGFRT790M 突變陽性的局部晚期或轉移性NSCLC 成人患者的治療。
合理用藥要點:
(1)一線治療用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到的EGFR19 外顯子缺失突變或21 外顯子L858R 置換突變。
(2)對于既往經EGFR-TKIs 治療時或治療后出現疾病進展的局部晚期或轉移性患者,用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到EGFRT790M 突變。
(3)推薦劑量為80mg/次,每日1 次,空腹口服。使用本品過程中如出現不良事件,可根據具體情況暫停給藥、降低劑量或永久停用。如果需要減量,則可減至40mg/次,每日1 次。
(4)伏美替尼常見不良反應(超過20%)為谷丙轉氨酶(glutamic-pyruvic transaminase,GPT)/谷草轉氨酶(glutamic-oxaloacetic transaminase,GOT)升高。需警惕發生間質性肺炎。
(5)避免與CYP3A4 強效誘導劑或抑制劑聯合使用。
9 克唑替尼(crizotinib)
劑型:膠囊劑;規格:200mg、250mg;適應癥:①間變性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)陽性局部晚期或轉移性NSCLC患者的治療。②ROS1陽性晚期NSCLC 患者的治療。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到的ROS1陽性或ALK陽性。
(2)用藥期間必須注意常見的肝功能損傷和視覺異常。在治療開始的最初2 個月應每周檢測1 次,之后每月檢測1 次患者的肝功能,肝功能損傷患者應謹慎使用克唑替尼進行治療。
(3)推薦劑量為250mg/次,每日2 次,口服,與食物同服或不同服。如果出現CTCAE 5.0 版3級或4 級的不良事件,需按以下方法減少劑量:①第1 次減少劑量:200mg/次,每日2 次,口服。②第2 次減少劑量:250mg/次,每日1 次,口服;如果仍無法耐受,應永久停用。
(4)應避免聯合使用CYP3A 強效抑制劑或CYP3A 強效誘導劑,如果無法避免聯合使用CYP3A 強效抑制劑,應減少克唑替尼的劑量。應謹慎與CYP3A 中效抑制劑聯合使用。克唑替尼膠囊可延長QTc 間期,避免聯合使用可延長QTc 間期的藥物。克唑替尼膠囊可引起心動過緩,避免聯合使用可引起心動過緩的藥物。
*(5)2022 版NCCN 指南推薦克唑替尼作為可選藥物之一用于細胞間質上皮轉換因子(cellular mesenchymal-epithelial transition factor,c-MET)14 外顯子跳躍突變的晚期NSCLC 患者的一線/二線治療。美國FDA 批準的克唑替尼適應癥還包括:治療ALK陽性復發或難治性的系統性間變性大細胞淋巴瘤(anaplastic large cell lymphoma,ALCL)1 歲及以上的兒童患者及年輕成人患者。目前,本品在國內尚未獲批此適應癥,醫師可在與患者充分溝通的情況下按照美國FDA 批準的方法使用。根據體表面積,推薦劑量為280mg/m2,每日2 次,口服。
10 阿來替尼(alectinib)
劑型:膠囊劑;規格:150mg;適應癥:ALK陽性的局部晚期或轉移性NSCLC 患者的治療。
合理用藥要點:
(1)患者用藥前必須獲得經國家藥品監督管理局批準的檢測方法證實的ALK陽性結果。
(2)建議患者接受本藥物治療直至疾病進展或出現不可耐受的毒性。
(3)推薦劑量為600mg/次,每日2 次,隨餐口服。如出現不良事件,應根據患者耐受性,以每次減量150mg 的方式逐步降低本品劑量:①首次減量:450mg/次,每日2 次,口服。②第2 次減量:300mg/次,每日2 次,口服;如果患者仍不能耐受,應永久停用。
(4)基線時應監測肝功能,包括GPT、GOT和總膽紅素,在最初治療的3個月內每2周監測1次,之后定期進行監測。
(5)建議患者報告任何原因不明的肌痛、觸痛或虛弱,評估肌酸激酶水平,在第1 個月治療期間每2 周評估1 次,隨后在臨床上根據患者報告的癥狀按需進行評估。
(6)確診患有間質性肺炎/非感染性肺炎的患者應立即中斷本品治療,如果沒有發現其他間質性肺炎/非感染性肺炎的潛在病因,應永久停用本品。
(7)在服用阿來替尼時及治療停止后至少7 天內,應建議患者避免長時間陽光暴曬。此外,應建議患者使用防紫外線A(UVA)/紫外線B(UVB)的廣譜防曬霜和潤唇膏(SPF≥50),防止曬傷。
(8)應根據臨床指征監測心率和血壓。如果發生無癥狀心動過緩,則無需調整劑量;如果患者發生癥狀性心動過緩或危及生命的事件,應對已知引發心動過緩的聯用藥物(如降壓藥)進行評估,并依據說明書調整劑量。
(9)當阿來替尼與治療指數窄的P-糖蛋白或乳腺癌耐藥蛋白底物(如地高辛、達比加群酯、甲氨蝶呤)聯合使用時,建議進行適當監測。
(10)阿來替尼與CYP3A 誘導劑或抑制劑聯合使用時無需調整劑量。
*(11)日本厚生勞動省批準的阿來替尼適應癥還包括:治療復發性或難治性ALK融合基因陽性ALCL。目前,本品在國內尚未獲批此適應癥,醫師可在與患者充分溝通的情況下按照日本厚生勞動省批準的方法使用。推薦劑量為600mg/次,每日2 次,口服,與食物一起服用。
11 塞瑞替尼(ceritinib)
劑型:膠囊劑;規格:150mg;適應癥:ALK陽性的局部晚期或轉移性NSCLC 患者的治療。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到的ALK陽性。
(2)本品推薦劑量為450mg/次,每日1 次,每天在同一時間口服,隨餐服用。根據患者個體的安全性或耐受性,在治療過程中可能需要暫停用藥或降低劑量,應以150mg 的下調幅度逐漸減少本品的日劑量。應注意早期識別藥物不良反應并及時給予標準支持性治療。對于無法耐受每天隨餐服用150mg 劑量的患者,應停用本品。
(3)用藥期間出現胃腸道不良反應,應根據臨床指征,給予患者標準監測及管理,包括止瀉、止吐及補液治療。基于藥物不良反應的嚴重程度,根據說明書調整劑量。
(4)患者開始治療前應進行肝功能檢測(包括GPT、GOT 和總膽紅素),之后每月檢測1 次。
(5)排除間質性肺炎/非感染性肺炎的其他潛在病因,一旦診斷為治療相關的任何級別的間質性肺炎/非感染性肺炎,患者應永久停用本品。
(6)如發生不危及生命的癥狀性心動過緩,應暫停使用本品直到恢復至無癥狀性心動過緩或心率≥60 次/min,評估聯合使用藥物,并調整本品劑量。
(7)治療開始前監測空腹血糖,之后根據臨床指征定期監測,并根據指征開始使用或優化降糖藥物治療。
(8)本品治療期間應避免聯合使用CYP3A 強效抑制劑。如果必須同時使用CYP3A 強效抑制劑(包括但不限于利托那韋、沙奎那韋、泰利霉素、酮康唑、伊曲康唑、伏立康唑、泊沙康唑、奈法唑酮),則應將塞瑞替尼劑量減少約三分之一,并近似為150mg 劑量規格的倍數。當停止給予CYP3A 抑制劑后,恢復使用CYP3A 強效抑制劑之前的給藥劑量。
(9)體外研究數據顯示,本品是P-糖蛋白底物。如果本品與抑制P-糖蛋白的藥物聯合使用,可能導致本品濃度升高。聯合使用P-糖蛋白抑制劑時應謹慎,并監測不良反應。
*(10)2022 版NCCN 指南基于一項發表于《臨床腫瘤學雜志》(Journal of Clinical Oncology)的Ⅱ期臨床研究(NCT01964157)推薦塞瑞替尼用于ROS1重排NSCLC 一線治療,無論既往是否接受過克唑替尼治療。
12 恩沙替尼(ensartinib)
劑型:膠囊劑;規格:25mg、100mg;適應癥:適用于ALK陽性的局部晚期或轉移性NSCLC 患者的治療。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到的ALK陽性。
(2)推薦劑量為225mg/次,每日1 次,每天在同一時間口服,空腹或與食物同服。
(3)若本品應用中出現3~4 級不良反應,需要調整劑量可參考如下原則:本品起始劑量為225mg/次,每日1 次;首次減量調整為200mg/次,每日1 次;若仍不能耐受,再一次減量調整為150mg/次,每日1 次;150mg/次,每日1 次,若仍無法耐受,應停用本品。
(4)用藥期間主要不良反應為一過性藥疹,主要表現為1~2 級皮疹和瘙癢癥,患者發生皮疹中位持續時間為21.5 天。除皮疹外,其常見不良反應為1~2 級GPT/GOT 升高,以及1~2 級胃腸道不適。
(5)避免與CYP3A4 強效誘導劑或抑制劑聯合使用。
13 布格替尼(brigatinib)
劑型:片劑;規格:30mg、90mg、180mg;適應癥:適用于ALK陽性的局部晚期或轉移性NSCLC 患者的治療。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到的ALK陽性。
(2)推薦劑量:前7 天90mg/次,每日1 次,口服;后增加劑量至180mg/次,每日1 次,口服。
(3)如果因不良反應以外的原因中斷本品治療14 天或更長時間,則在增加至既往耐受劑量前,以90mg/次、每日1 次的劑量恢復治療,持續7 天。本品可與食物同服或不同服。應指導患者整片吞服,不應咀嚼、壓碎、溶解或掰斷藥片。
(4)根據患者個體的耐受性及安全性進行劑量調整,劑量調整方案如下:①若90mg/次,每日1 次,口服,無法耐受,首次劑量調整為60mg/次,每日1 次,口服;②若增至180mg/次,每日1 次,口服,無法耐受,首次劑量調整為120mg/次,每日1 次,口服;若仍不能耐受,第2 次減量為90mg/次,每日1 次,口服;若患者仍不能耐受,則第3 次減量為60mg/次,每日1 次,口服。③因不良反應減少劑量后,不要隨便增加劑量。如果患者不能耐受60mg/次、每日1 次的劑量,應永久停用。
(5)本品常見的不良反應為腹瀉、肌酸激酶升高、咳嗽、高血壓和惡心等。用藥期間應注意間質性肺炎/非感染性肺炎、肌酸激酶升高、高血壓、心動過緩、脂肪酶/淀粉酶升高和血糖升高等不良反應。
(6)應避免布格替尼與CYP3A 強效或中效抑制劑和誘導劑聯合使用,如必須聯合使用,需對藥物劑量進行調整。如果無法避免聯合使用CYP3A強效抑制劑,則降低本品每日劑量,即從180mg降至90mg、90mg 降至60mg。如果無法避免聯合使用CYP3A 中效抑制劑,則將本品每日劑量降低約30%(即從180mg 降至120mg、120mg 降至90mg 或從90mg 降至60mg)。停用CYP3A 強效或中效抑制劑后,恢復使用CYP3A 抑制劑前耐受的本品劑量。如果無法避免聯合使用CYP3A 中效誘導劑,則在接受當前本品劑量(如耐受)治療7 天后,以30mg/d 的增量增加本品每日劑量,最多增至開始聯用CYP3A 中效誘導劑前耐受本品劑量的2 倍。停用CYP3A 中效誘導劑后,恢復使用CYP3A 中效誘導劑前耐受的本品劑量。
14 洛拉替尼(lorlatinib)
劑型:片劑;規格:25mg、100mg;適應癥:適用于ALK陽性的局部晚期或轉移性NSCLC 患者的治療。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到的ALK陽性。
(2)推薦劑量為100mg/次,每日1 次,口服,與食物同服或不同服;應整片吞服,不應咀嚼、壓碎、溶解或掰斷藥片。若藥片出現破損、裂紋或其他不完整的情況,請勿服用。每日在大致相同時間服用本品。
(3)如出現不良事件,應根據患者耐受性,以每次減量25mg 的方式逐步降低劑量:①第1 次降低劑量:75mg/次,每日1 次,口服。②第2 次降低劑量:50mg/次,每日1 次,口服;對于仍不能耐受的患者,應永久停用。
(4)B7461006 研究(NCT03052608)顯示,所有等級的高甘油三酯血癥和高膽固醇血癥的發生率,分別為95%和91%;其中3 級或4 級高甘油三酯血癥和高膽固醇血癥的發生率,分別為22%和19%。在開始服用本品前,以及在開始服用本品后的前2 個月監測血清膽固醇和甘油三酯,并在此后定期監測。降脂藥物的選擇應避免CYP450 代謝途徑的他汀類藥物。他汀類藥物首選瑞舒伐他汀,其次為匹伐他汀或普伐他汀。對第1 次出現的血脂升高,可以暫停后以相同劑量恢復給藥;根據嚴重程度對復發情況以相同劑量或降低一個劑量水平繼續給藥。
(5)服用本品可能會對各種中樞神經系統產生影響,1 級、2 級和3 級認知影響的發生率分別為13%、6%和2%;1 級、2 級和3 級情緒影響的發生率分別為9%、5%和1%。無4 級或5 級中樞神經系統事件發生。可根據嚴重程度暫停用藥并以相同劑量或降低一個劑量水平恢復給藥,或永久停用。建議請精神科專科會診協助治療。
(6)禁止與CYP3A 強效誘導劑聯合使用,因為聯合使用可能發生嚴重肝臟毒性。避免本品與CYP3A 中效誘導劑、CYP3A 強效抑制劑聯合使用。
*(7)2022 版NCCN 指南基于一項發表于《柳葉刀-腫瘤學》(Lancet Oncology)的全球Ⅰ~Ⅱ期臨床研究結果,推薦洛拉替尼用于ROS1 TKI(克唑替尼或塞瑞替尼或恩曲替尼)進展后的ROS1陽性晚期NSCLC 患者的治療。
15 貝伐珠單抗(bevacizumab)
劑 型:注 射 劑;規 格:100mg(4ml)/瓶、400mg(16ml)/瓶;適應癥:貝伐珠單抗聯合以鉑類為基礎的化療用于不可切除的晚期、轉移性或復發性非鱗狀細胞NSCLC 患者的一線治療。
合理用藥要點:
(1)貝伐珠單抗不適用于晚期肺鱗癌的治療。
(2)有嚴重出血或近期曾有咯血、腫瘤侵犯大血管的患者不應接受貝伐珠單抗治療。
(3)貝伐珠單抗聯合以鉑類為基礎的化療最多6 個周期,隨后給予貝伐珠單抗單藥維持治療或與可用于維持治療的化療藥物如培美曲塞聯合維持治療,直至疾病進展或出現不可耐受的毒性。
(4)貝伐珠單抗推薦劑量為15mg/kg,每3周1 次。也可以使用7.5mg/kg,每3 周1 次,靜脈輸注。
(5)出現以下情況,停止使用貝伐珠單抗:①嚴重胃腸道不良反應(胃腸道穿孔、胃腸道瘺形成、腹腔膿腫),內臟瘺形成。②需要干預治療的傷口裂開以及傷口愈合并發癥。③重度出血(例如需要干預治療)。④重度動脈血栓事件。⑤危及生命(4 級)的靜脈血栓栓塞事件,包括肺栓塞。⑥高血壓危象或高血壓腦病。⑦可逆性后部腦病綜合征。⑧腎病綜合征。
(6)如果出現以下狀況,需暫停使用貝伐珠單抗:①擇期手術前4~6 周、手術后至少28 天及傷口完全恢復前。②藥物控制不良的重度高血壓。③中度至重度蛋白尿需進一步評估。④重度輸液反應。
*(7)在歐盟,貝伐珠單抗聯合厄洛替尼獲批用于EGFR基因具有敏感突變的、不可手術切除的晚期、轉移性或復發性非鱗狀細胞NSCLC 患者的一線治療。目前,國內尚未獲批此適應癥,可在與患者充分溝通的情況下使用。
16 重組人血管內皮抑制素(recombinant human endostatin)
劑型:注射劑;規格:15mg/2.4×105U/3ml/支;適應癥:本品聯合長春瑞濱/順鉑化療方案用于治療初治或復治的Ⅲ~Ⅳ期NSCLC 患者。
合理用藥要點:
(1)采用本品與長春瑞濱/順鉑聯用方案至4個周期結束,后采用本品進行維持治療。本品適用于初治或復治的Ⅲ~Ⅳ期NSCLC 患者。與NP 化療方案聯合給藥時,本品在治療周期的第1~14 天,7.5mg/m2(1.2×105U/m2),每日1 次,靜脈輸注,連續給藥14 天,休息1 周,再繼續下一周期治療。通常可進行2~4 個周期的治療。臨用時將本品加入250~500ml 生理鹽水中,勻速靜脈輸注,輸注時間為3~4h。臨床推薦醫師在患者耐受的情況下可適當延長本品的使用時間。臨床實踐中還可以采用210mg 持續靜脈泵注72h 或120h 的用法。
(2)如果出現以下狀況,需暫停使用重組人血管內皮抑制素:①出現相關心臟毒性反應時,如≥3級或≤2 級且毒性反應持續存在。②≥3 級皮膚過敏反應。
(3)基于Ⅳ期臨床研究結果,重組人血管內皮抑制素主要相關不良事件發生率為心律失常(0.7%)、心功能下降(0.2%)、出血(0.4%)、過敏反應(0.2%)。
(4)過敏體質或對蛋白類生物制品有過敏史者慎用。
(5)有嚴重心臟病或心臟病病史者慎用,本品臨床使用過程中應定期檢測心電圖。
17 安羅替尼(anlotinib)
劑型:膠囊劑;規格:8mg、10mg、12mg;適應癥:①本品單藥適用于既往至少接受過2 種系統化療后出現進展或復發的局部晚期或轉移性NSCLC患者的治療。對于存在EGFR基因突變或ALK陽性的患者,在開始本品治療前應曾接受相應的靶向藥物治療后進展且至少接受過2 種系統化療后出現進展或復發。②本品單藥適用于既往至少接受過2種化療方案治療后進展或復發的小細胞肺癌患者的治療。
合理用藥要點:
(1)使用安羅替尼前無需進行基因檢測,但對于存在EGFR基因突變或ALK融合陽性的患者,在開始安羅替尼治療前應曾接受相應的標準靶向藥物治療后進展且至少接受過2 種系統化療后出現進展或復發。
(2)中央型肺鱗癌或具有大咯血風險患者、重度肝腎功能損傷患者禁用。
(3)安羅替尼有增加出血事件和血栓/栓塞事件的發生風險,因此,具有出血風險、凝血功能異常的患者、具有血栓/卒中病史的患者以及服用抗凝藥物及相關疾病的患者應慎用。
(4)推薦劑量為12mg/次,每日1 次,早餐前口服,連續服藥2 周,停藥1 周,即3 周為1 個療程。使用過程中要密切監測不良反應,并根據不良反應程度,在醫師指導下調整劑量,第1 次調整劑量為10mg/次,第2 次調整劑量8mg/次,如8mg/次劑量仍無法耐受,則永久停用。關于劑量調整總原則請參考表2。對于出現2 級出血事件的患者應暫停安羅替尼治療,如2 周內恢復至<2 級,則下調一個劑量繼續用藥。如再次出血,應永久停用。一旦出現3 級或以上出血事件,則永久停用。

表2 安羅替尼根據不良反應級別的劑量調整總原則
(5)用藥期間應密切關注高血壓的發生,常規降壓藥物可有效控制患者血壓,如血管緊張素轉換酶抑制劑、血管緊張素Ⅱ受體阻滯劑、β受體阻滯劑、鈣通道阻滯劑均為可選擇的降壓藥物(鑒于藥物相互作用,對血管緊張素轉換酶抑制劑不能控制的高血壓可酌情選擇鈣通道阻滯劑)。
(6)避免與CYP1A2 和CYP3A4 強效誘導劑或抑制劑聯合使用。
18 依維莫司(everolimus)
劑型:片劑;規格:2.5mg、5mg、10mg;適應癥:無法手術切除的、局部晚期或轉移性的、分化良好的、進展期非功能性胃腸道或肺源神經內分泌瘤成人患者。
合理用藥要點:
(1)本品推薦劑量為10mg/次,每日1 次,口服,在每天同一時間服用。
(2)用一杯水整片送服本品,不應咀嚼、壓碎或掰斷藥片。對于無法吞咽片劑的患者,用藥前將本品放入一杯水中(約30ml)輕輕攪拌至完全溶解(大約需要7min)后立即服用。用相同容量的水清洗水杯并將清洗液全部服用,以確保服用了完整劑量。
(3)只要存在臨床獲益就應持續治療,或使用至出現不能耐受的毒性反應時。
(4)在腎功能損傷患者中未進行本品的臨床研究。預期腎功能損傷不會影響藥物暴露,在腎功能損傷患者中不推薦調整依維莫司劑量。
(5)本品具有免疫抑制性,在開始本品治療前應徹底治療已存在的侵入性真菌感染。
(6)對本品有效成份、其他雷帕霉素衍生物或本品中任何輔料過敏者禁用。在使用依維莫司和其他雷帕霉素衍生物患者中已觀察到的過敏反應表現包括但不限于:過敏、呼吸困難、潮紅、胸痛或血管性水腫(例如伴或不伴呼吸功能不全的氣道或舌腫脹)。
(7)口腔炎包括口腔潰瘍和口腔黏膜炎。在臨床試驗中,發生率為44%~86%;4%~9%的患者報告了3~4 級口腔炎。口腔炎大部分在治療的前8 周內發生。如果發生口腔炎,建議使用局部治療。
(8)避免聯合使用CYP3A4 強效誘導劑或抑制劑以及P-糖蛋白抑制劑。聯合使用CYP3A4 中效和/或P-糖蛋白抑制劑應將依維莫司劑量降低大約50%。
19 普拉替尼(pralsetinib)
劑型:膠囊劑;規格:100mg;適應癥:既往接受過含鉑化療的轉染重排(rearranged during transfection,RET)基因融合陽性的局部晚期或轉移性NSCLC 成人患者的治療。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到的RET基因融合陽性。
(2)推薦劑量為400mg/次,每日1 次,口服,直至疾病進展或出現不可耐受的毒性。應在每天相同的時間且空腹狀態服用,服用本品前至少2h 以及服用本品后至少1h 內請勿進食。
(3)如果出現不良反應,應根據患者耐受性,以每次減量100mg 的方式逐步降低本品劑量:①首次減量至300mg/次,每日1 次。②第2 次減量至200mg/次,每日1 次。③第3 次減量至100mg/次,每日1 次。如果患者不耐受100mg/次、每日1 次的給藥劑量,應永久停用。
(4)最常見的不良反應(發生率≥25%)為便秘、高血壓、疲乏、骨骼肌肉疼痛和腹瀉。最常見的3~4 級實驗室檢查結果異常(發生率≥2%)為淋巴細胞減少癥、中性粒細胞減少癥、血紅蛋白降低、磷酸鹽降低、鈣降低(校正)、血鈉降低、GOT升高、GPT 升高、血小板減少癥和堿性磷酸酶升高。應特別注意間質性肺炎/非感染性肺炎發生。
(5)避免與P-糖蛋白和CYP3A 共同強效抑制劑及CYP3A 抑制劑或誘導劑(如伏立康唑、苯妥英鈉、卡馬西平、利福平等)聯合使用。
20 賽沃替尼(savolitinib)
劑型:片劑;規格:100mg、200mg;適應癥:賽沃替尼用于含鉑化療后疾病進展或不耐受標準含鉑化療的、具有間質上皮轉化因子(mesenchymalepithelial transition,MET)外顯子14 跳躍突變的局部晚期或轉移性NSCLC 成人患者。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到的MET外顯子14 跳躍突變陽性。對于肺肉瘤樣癌,更應注意檢測MET外顯子14 跳躍突變。
(2)對于體重≥50kg 的患者,建議賽沃替尼起始劑量為600mg/次,每日1 次,口服;對于體重<50kg 的患者,建議起始劑量為400mg/次,每日1 次,口服。
(3)根據患者個體的安全性和耐受性調整用藥劑量。
(4)用藥期間需注意肝毒性、發熱、水腫以及超敏反應的發生。發生率≥10%的不良反應為惡心、水腫、疲乏/乏力、嘔吐、食欲減退、低白蛋白血癥、貧血、發熱、腹瀉,以及GOT 升高和GPT 升高。
(5)應避免和CYP3A4 強效誘導劑(如苯妥英鈉、利福平和卡馬西平)同時使用,應謹慎或盡可能避免與CYP3A4 中效誘導劑(如波生坦、依法韋侖、依曲韋林和莫達非尼)聯合使用。對于貫葉連翹(St.John'sWort)及其提取物,應在本品服用前3 周禁服。應慎用二甲雙胍,并監測由于二甲雙胍暴露量增加可能帶來的風險。
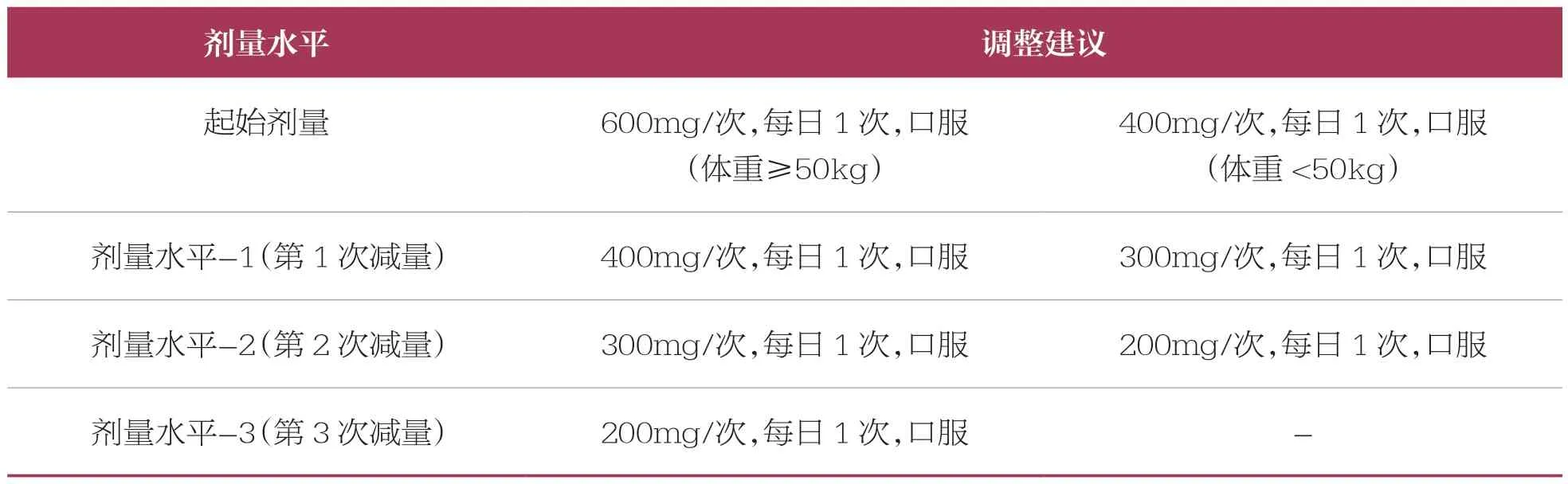
表3 賽沃替尼劑量調整建議
(6)避孕:必須告知育齡女性本品可能傷害胎兒。育齡女性服用本品前需做妊娠檢查以排除妊娠。育齡女性需在治療期間和治療后1 個月內確保有效避孕。男性患者需在治療期間和治療后6 個月內確保有效避孕。
21 達拉非尼(dabrafenib)
劑型:膠囊劑;規格:50mg、75mg;適應癥:本品聯合曲美替尼適用于治療BRAFV600 突變陽性轉移性NSCLC 患者。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到的BRAFV600 突變陽性。
(2)推薦劑量為150mg/次,每日2 次,口服,需聯合曲美替尼治療,直至疾病進展或出現不可耐受的毒性。應在餐前1h 或餐后至少2h 服用,給藥間隔12h,應在每天相同時間服用本品。
(3)在給予本品聯合應用曲美替尼治療時,如果出現治療相關毒性,則2 種藥物應同時減少劑量、中斷或停止給藥。對于主要與達拉非尼相關的不良反應如葡萄膜炎、非皮膚惡性腫瘤,則只需對達拉非尼調整劑量。
(4)針對不良反應,推薦的達拉非尼減量方法見表4。
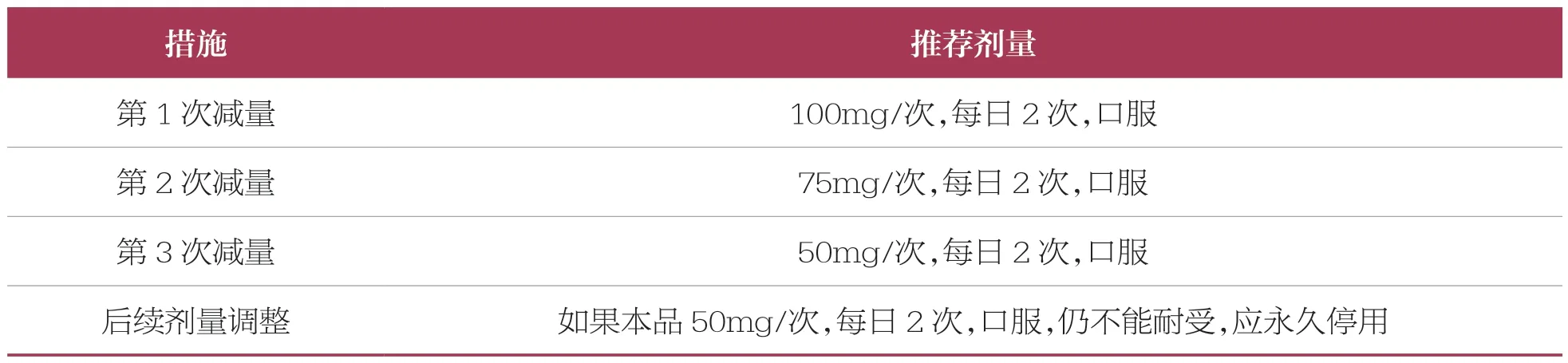
表4 達拉非尼劑量調整建議
(5)輕度肝功能損傷患者無需調整劑量,對于中重度肝功能損傷患者應謹慎使用。輕中度腎功能損傷患者無需調整劑量,對于重度腎功能損傷患者應謹慎使用。老年人無需調整初始劑量。
(6)用藥期間應注意發熱、疲乏、惡心、嘔吐、腹瀉、皮膚干燥、食欲下降、水腫、皮疹、寒顫、出血、咳嗽和呼吸困難。
(7)應避免和CYP3A4/CYP2C8 強效誘導劑(如苯妥英、利福平、卡馬西平、苯巴比妥、圣約翰草)同時使用。
*(8)美國FDA 批準達拉非尼聯合曲美替尼治療BRAFV600E/K 突變的局部晚期或轉移性甲狀腺未分化癌治療;美國FDA 還批準達拉非尼聯合曲美替尼治療在先前治療后進展且沒有令人滿意替代治療方案的6 歲及以上不可切除或轉移性實體瘤BRAFV600E 突變的成人和兒童患者。目前,在國內未獲批這些適應癥,可在與患者充分溝通的情況下使用。
22 曲美替尼(trametinib)
劑型:片劑;規格:0.5mg、1mg、2mg;適應癥:本品聯合達拉非尼適用于治療BRAFV600突變陽性轉移性NSCLC 患者。
合理用藥要點:
(1)用藥前必須明確有經國家藥品監督管理局批準的檢測方法檢測到的BRAFV600 突變陽性。
(2)推薦劑量為2mg/次,每日1 次,口服,需聯合達拉非尼治療,直至疾病進展或出現不可耐受的毒性。
(3)應在餐前1h 或餐后至少2h 服用,每天相同時間服用本品。
(4)本品聯合應用達拉非尼治療時,如果出現治療相關毒性,則2 種藥品應同時減少劑量、中斷或停止給藥。對于出現主要與曲美替尼相關的不良反應如視網膜靜脈阻塞(retinal vein obstruction,RVO)、視網膜色素上皮脫離、間質性肺炎/肺部炎癥和單純性靜脈血栓栓塞的情況,則只需調整曲美替尼劑量。
(5)針對不良反應,推薦的曲美替尼減量方法見表5。

表5 曲美替尼劑量調整建議
(6)用藥期間應注意發熱、疲乏、嘔吐、腹瀉、皮膚干燥、食欲下降、水腫、皮疹、寒戰、出血、咳嗽和呼吸困難。
(7)謹慎聯合使用P-糖蛋白強效抑制劑,如維拉帕米、環孢素、利托那韋、奎尼丁、伊曲康唑。
*(8)美國FDA 批準曲美替尼聯合達拉非尼治療BRAFV600E/K 突變的局部晚期或轉移性甲狀腺未分化癌治療;美國FDA 還批準曲美替尼聯合達拉非尼治療在先前治療后進展且沒有令人滿意替代治療方案的6 歲及以上不可切除或轉移性實體瘤BRAFV600E 突變的成人和兒童患者。目前,本品在國內未獲批這些適應癥,醫師可在與患者充分溝通的情況下使用。
23 恩曲替尼(entrectinib)
劑型:膠囊劑;規格:100mg、200mg;適應癥:①用于治療ROS1陽性的轉移性NSCLC 成人患者。②適用于符合下列條件的成人和12 歲及以上兒童實體瘤患者,經充分驗證的檢測方法診斷為攜帶神經營養酪氨酸受體激酶融合基因且不包括已知獲得性耐藥突變,患有局部晚期、轉移性疾病或手術切除可能導致嚴重并發癥的患者,無滿意替代治療或既往治療失敗的患者。
合理用藥要點:
(1)患者用藥前必須獲得經充分驗證的檢測方法診斷為攜帶神經營養酪氨酸受體激酶融合基因且不包括已知獲得性耐藥突變。對于NSCLC 患者,還可以是經國家藥品監督管理局批準的檢測方法檢測到的ROS1陽性。
(2)基線有腦轉移的ROS1陽性NSCLC 患者一線用藥優先推薦使用恩曲替尼。
(3)建議患者接受本品治療直至疾病進展或出現不可耐受的毒性。
(4)硬膠囊應整粒吞服,由于內容物較苦,因此不得打開膠囊或溶解后服藥。本品可與食物同服或不同服,但不應與葡萄柚或葡萄柚汁同服。成人推薦劑量為600mg/次,每日1 次,口服。年滿12 歲兒童患者推薦劑量為300mg/(m2·次),每日1 次,口服(表6)。

表6 兒童患者恩曲替尼的推薦給藥方案
(5)管理不良事件時,可能需要暫停用藥、降低劑量或永久停用,具體根據處方醫師對患者安全或耐受性的評估而定。
成人:根據耐受性,成人的恩曲替尼劑量可最多減量2 次。表7 提供了成人患者的通用劑量調整建議。
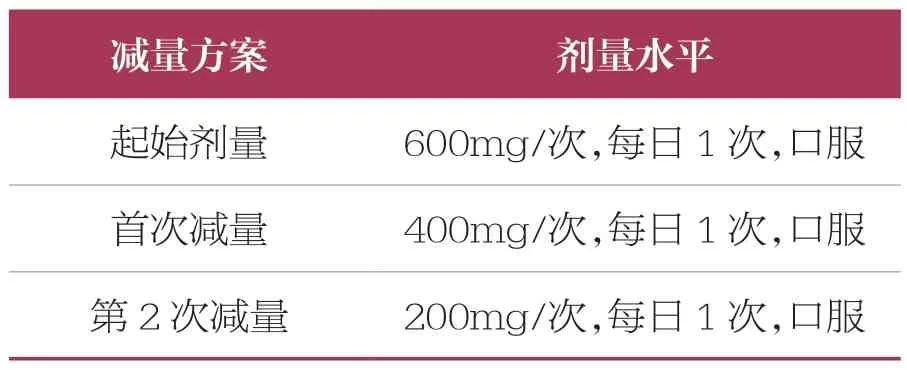
表7 成人患者恩曲替尼的劑量調整建議
兒童:表8 提供了兒童患者的特殊減量建議。根據耐受性,年滿12 歲的兒童患者可最多減量2次。某些兒童患者需采取間歇給藥方案才能達到推薦的減量后的1 周總劑量。如果患者不能耐受減量后的最低推薦劑量,應永久停用恩曲替尼治療。

表8 兒童患者恩曲替尼的劑量減量方案
(6)CYP3A 強效或中效抑制劑聯合使用。在成人患者中,應避免與CYP3A 強效或中效抑制劑聯合使用,或聯合使用時間應限制在14 天以內。如果聯合使用無法避免,則與CYP3A 強效抑制劑聯合使用時,應將恩曲替尼劑量降至100mg/次,每日1 次;與CYP3A 中效抑制劑聯合使用時,應將恩曲替尼劑量降至200mg/次,每日1 次。在停止聯合使用CYP3A 強效或中效抑制劑后,可恢復恩曲替尼至聯合使用前的劑量。半衰期長的CYP3A4抑制劑可能需要洗脫期。在兒童患者中,應避免聯合使用CYP3A 強效或中效抑制劑。CYP3A 誘導劑聯合使用:在成人和兒童患者中,應避免聯合使用CYP3A 誘導劑。
(7)輕中度腎功能損傷患者無需調整劑量。尚未在重度腎功能損傷患者中研究恩曲替尼的安全性與有效性。然而,由于恩曲替尼的腎臟消除率可忽略不計,重度腎功能損傷患者無需調整劑量。
(8)駕駛和操縱機械能力:恩曲替尼可能影響駕駛和操縱器械的能力。應告知患者,在恩曲替尼治療期間出現認知不良反應、暈厥、視物模糊或頭暈時避免駕駛或操縱機械,直至癥狀消退。
24 納武利尤單抗(nivolumab)
劑型:注射劑;規格:40mg(4ml)/瓶、100mg(10ml)/瓶;適應癥:①本品單藥適用于治療EGFR基因突變陰性和ALK陰性、既往接受過含鉑藥物化療方案后疾病進展或不可耐受的局部晚期或轉移性NSCLC 成人患者。②本品聯合伊匹木單抗用于不可手術切除的、初治的非上皮樣惡性胸膜間皮瘤成人患者。
合理用藥要點:
(1)局部晚期或轉移性NSCLC 成人患者,既往接受過含鉑方案化療后疾病進展或不可耐受。
(2)患者必須為EGFR陰性和ALK陰性。
(3)只要觀察到臨床獲益,應繼續納武利尤單抗治療,直至患者不能耐受,有可能觀察到非典型反應(例如最初幾個月內腫瘤暫時增大或出現新的小病灶,隨后腫瘤縮小)。如果患者臨床癥狀穩定或持續減輕,即使有疾病進展的初步證據,但基于總體臨床獲益判斷,可考慮繼續應用本品治療,直至證實疾病進展。
(4)納武利尤單抗在我國基于CheckMate 078研究,單藥使用獲批的劑量為3mg/kg 或240mg/次固定劑量,每2 周1 次,靜脈輸注30min。在歐美,基于群體藥動學(population pharmacokinetics,PPK)研究,納武利尤單抗已獲批固定劑量,480mg/次、每4 周1 次或240mg/次、每2 周1次,靜脈輸注30min。
(5)本品可采用10mg/ml 溶液直接輸注,或稀釋于0.9%氯化鈉溶液或5%葡萄糖溶液中,濃度可低至1mg/ml。總輸注量一定不能超過160ml。
(6)與伊匹木單抗聯合治療惡性胸膜間皮瘤推薦劑量為360mg/次,每3 周1 次,或3mg/kg,每2 周1 次,靜脈輸注30min,聯合伊匹木單抗1mg/kg,每6 周1 次,靜脈輸注30min。對于疾病未進展的患者,治療持續最長至24 個月。與伊匹木單抗聯合使用時,應先輸注本品,之后同一天輸注伊匹木單抗。每次輸注需使用單獨的輸液袋和過濾器,輸注結束時沖洗輸液管,請勿通過同一根輸液管同時給予其他藥物。
(7)根據個體患者的安全性和耐受性,可暫停給藥或永久停用。不建議增加或減少劑量。
(8)發生4 級或復發性3 級不良反應時,在進行治療調整但仍持續存在2 級或3 級不良反應的情況下,應永久停用納武利尤單抗。
(9)老年患者(≥65 歲)無需調整劑量。
(10)輕中度腎功能損傷患者無需調整劑量。重度腎功能損傷患者的數據有限。輕中度肝功能損傷患者無需調整劑量,沒有對重度肝功能損傷患者進行本品的相關研究,重度(總膽紅素、GPT 或GOT>3 倍正常值上限)肝功能損傷患者必須慎用本品。
(11)納武利尤單抗可引起免疫相關性不良反應。因不良反應可能在納武利尤單抗治療期間或納武利尤單抗治療停止后的任何時間發生,應持續進行患者監測(至少至末次給藥后5 個月)。
(12)對于疑似免疫相關性不良反應,應進行充分評估以確認病因或排除其他病因。根據不良反應的嚴重程度,應暫停納武利尤單抗治療并給予糖皮質激素。若使用糖皮質激素免疫抑制療法治療不良反應,癥狀改善后,需至少1 個月的時間逐漸減量至停藥。快速減量可能引起不良反應惡化或復發。如果使用了糖皮質激素仍惡化或無改善,則應增加非糖皮質激素性免疫抑制治療。
(13)在患者接受免疫抑制劑量的糖皮質激素或其他免疫抑制治療期間,不可重新使用納武利尤單抗治療。
(14)如果出現任何重度、復發的免疫相關性不良反應以及任何危及生命的免疫相關性不良反應,必須永久停用納武利尤單抗治療。
(15)納武利尤單抗注射劑每毫升含0.1mmol(或2.5mg)鈉,在對控制鈉攝入的患者進行治療時應考慮這一因素。
(16)納武利尤單抗是一種人單克隆抗體,因單克隆抗體不經CYP450 或其他藥物代謝酶代謝,因此,聯合使用的藥物對這些酶的抑制或誘導作用預期不會影響納武利尤單抗的藥動學。
(17)當本品與伊匹木單抗聯合治療時,若暫停一種藥物,則應同時暫停另一藥物。若在暫停后重新開始給藥,則應根據個體患者的評估情況重新開始聯合治療或本品單藥治療。
*(18)美國FDA 批準納武利尤單抗聯合伊匹木單抗用于一線治療腫瘤程序性死亡受體配體1(programmed death-ligand 1,PD-L1)表達陽性(定義為表達PD-L1 的腫瘤細胞≥1%)、EGFR基因突變陰性和ALK陰性、晚期或轉移性NSCLC。目前,本品在國內尚未獲批此適應癥,醫師可在與患者充分溝通的情況下使用。納武利尤單抗用法為3mg/kg,每2 周1 次;伊匹木單抗用法為1mg/kg,每6 周1 次。此外,美國FDA 和歐洲藥品監督管理局(European Medicines Agency,EMA)還批準納武利尤單抗聯合伊匹木單抗和2 周期含鉑雙藥化療用于一線治療EGFR基因突變陰性和ALK陰性、晚期或轉移性NSCLC,目前,本品在國內尚未獲批此適應癥,醫師可在與患者充分溝通的情況下使用。納武利尤單抗用法為360mg/次固定劑量,每3 周1 次;伊匹木單抗用法為1mg/kg,每6 周1次。美國FDA批準納武利尤單抗聯合含鉑藥物化療,每3 周1 次,共3 個周期,用于新輔助階段治療腫瘤(≥4cm)或淋巴結陽性可手術的NSCLC 患者。目前,本品在國內尚未獲批此適應癥,醫師可在與患者充分溝通的情況下使用。
25 帕博利珠單抗(pembrolizumab)
劑型:注射劑;規格:100mg(4ml)/瓶;適應癥:①帕博利珠單抗聯合培美曲塞和鉑類化療藥適用于EGFR基因突變陰性和ALK陰性的轉移性非鱗狀細胞NSCLC 的一線治療。②帕博利珠單抗適用于由國家藥品監督管理局批準的檢測評估為PD-L1 腫瘤比例分數≥1%的EGFR基因突變陰性和ALK陰性的局部晚期或轉移性NSCLC 一線單藥治療。③帕博利珠單抗聯合卡鉑和紫杉醇適用于轉移性鱗狀細胞NSCLC 患者的一線治療。
合理用藥要點:
(1)只要觀察到臨床獲益,應繼續使用帕博利珠單抗治療至疾病進展或出現不可耐受的毒性,有可能觀察到非典型反應。如果患者臨床癥狀穩定,即使有疾病進展的初步證據,但基于總體臨床獲益判斷,可考慮繼續應用本品治療,直至證實疾病進展。
(2)帕博利珠單抗經國家藥品監督管理局批準的首個一線肺癌適應癥是基于全球Ⅲ期臨床研究KEYNOTE-189 研究(NCT02578680)結果,在我國獲批的肺癌適應癥劑量為200mg/次,每3 周1 次,或400mg/次,每6 周1 次,靜脈輸注,每次持續至少30min。如果聯合化療給藥時,應首先給予帕博利珠單抗。
(3)在使用本品之前應避免使用全身性糖皮質激素或其他免疫抑制劑,因為這些藥物可能會影響本品的藥效學活性及療效。但在本品開始給藥后,可使用全身性糖皮質激素或其他免疫抑制劑治療免疫介導性不良反應。當帕博利珠單抗與化療聯合使用時,糖皮質激素也可以作為治療前用藥來預防嘔吐和/或緩解化療相關不良反應。
(4)根據患者個體的安全性和耐受性,可能需要暫停給藥或永久停用,不建議增加或減少劑量。
(5)發生4 級或復發性3 級免疫相關性不良反應,應永久停用帕博利珠單抗。
(6)老年患者(≥65 歲)無需調整劑量。
(7)輕中度腎功能損傷患者無需調整劑量,尚未在重度腎功能損傷患者中進行本品的相關研究。
(8)輕中度肝功能損傷患者無需調整劑量,尚未在重度肝功能損傷患者中進行本品的相關研究。
(9)對于疑似免疫相關性不良反應,應進行充分評估以確認病因或排除其他病因。根據不良反應的嚴重程度,應暫時停用帕博利珠單抗,并使用糖皮質激素治療。當免疫相關性不良反應改善至≤1級時,需至少1 個月的時間逐步減少糖皮質激素的用量直至停藥。基于有限的臨床研究數據,發生糖皮質激素無法控制的免疫相關性不良反應時可考慮使用其他全身性免疫抑制劑。如果不良反應改善至≤1 級,且糖皮質激素劑量已降至每天≤10mg 潑尼松或等效劑量,則可在帕博利珠單抗最后一次給藥后12 周內重新開始帕博利珠單抗治療。
(10)帕博利珠單抗尚未進行正式藥動學藥物相互作用研究。由于帕博利珠單抗通過分解代謝從血液循環中清除,預計不會發生代謝性藥物-藥物相互作用。
*(11)美國FDA、歐盟EMA 和日本PMDA批準帕博利珠單抗的適應癥還包括:在排除EGFR或ALK陽性基礎上,用于PD-L1 表達≥1%的晚期NSCLC 二線單藥治療。美國FDA 還批準帕博利珠單抗單藥用于治療成人和兒童不可切除或轉移性高度微衛星不穩定型或錯配修復基因缺陷型的實體瘤以及高腫瘤突變負荷(high tumor mutation burden,TMB-H)的無法切除或轉移性實體瘤(包括小細胞肺癌)。目前,本品在國內尚未獲批這些適應癥,醫師可在與患者充分溝通的情況下,按照美國FDA 批準的用法正確使用。
26 度伐利尤單抗(durvalumab)
劑型:注射劑;規格:120mg(2.4ml)/瓶、500mg(10ml)/瓶;適應癥:①度伐利尤單抗適用于在接受以鉑類藥物為基礎的化療同步放療后未出現疾病進展的不可切除、Ⅲ期NSCLC 患者的治療。②度伐利尤單抗聯合依托泊苷和卡鉑或順鉑,一線治療廣泛期小細胞肺癌(extensive-stage small cell lung cancer,ES-SCLC)成人患者。
合理用藥要點:
(1)對于不可切除的Ⅲ期NSCLC 患者,度伐利尤單抗的使用方法為10mg/kg,每2 周1 次,靜脈輸注,每次輸注需超過60min,直至疾病進展或出現不可耐受的毒性。最長使用不超過12 個月。
(2)對于ES-SCLC 患者,使用1500mg 度伐利尤單抗聯合依托泊苷和卡鉑或順鉑,每3 周1 次,持續4 個周期,繼之以1500mg、每4 周1 次作為單藥治療,直至疾病進展或出現不可耐受的毒性。體重≤30kg 的患者必須接受基于體重給藥,即度伐利尤單抗20mg/kg 聯合化療,每3 周1 次,持續4 個周期,繼之以20mg/kg 每4 周1 次單藥治療,直至體重增加至>30kg。
(3)對于疑似免疫相關性不良反應,應進行充分評估以確認病因或排除其他病因。根據免疫相關性不良反應的類型和嚴重程度,暫停給藥或永久停用,不建議增加或減少劑量。
(4)尚未確定度伐利尤單抗在18 歲以下兒童和青少年患者的安全性和有效性。老年患者(≥65歲)、輕度肝功能損傷患者和輕中度腎功能損傷患者均無需調整劑量。尚未明確在中重度肝功能損傷患者、重度腎功能損傷患者中使用的安全性及有效性,如經醫師評估使用本品預期獲益大于風險,需在醫師指導下謹慎使用。
27 阿替利珠單抗(atezolizumab)
劑型:注射劑;規格:1200mg(20ml)/瓶;適應癥:①阿替利珠單抗與卡鉑和依托泊苷聯合使用,用于ES-SCLC 患者的一線治療。②阿替利珠單抗用于經國家藥品監督管理局批準的檢測方法評估為≥50%腫瘤細胞(tumor cell,TC)PD-L1 染色陽性(TC≥50%)或腫瘤浸潤PD-L1 陽性免疫細胞(immune cell,IC)覆蓋≥10% 的腫瘤面積EGFR基因突變陰性和ALK陰性的轉移性NSCLC患者的一線單藥治療。③阿替利珠單抗聯合培美曲塞和鉑類化療用于EGFR基因突變陰性和ALK陰性的轉移性非鱗狀細胞NSCLC 患者的一線治療。④阿替利珠單抗單藥用于檢測評估為≥1%TC PD-L1 染色陽性、經手術切除、以鉑類為基礎化療之后的Ⅱ~ⅢA 期NSCLC 患者的輔助治療(國際抗癌聯盟/美國癌癥聯合會分期系統IASLC/AJCC 第7 版分期)。
合理用藥要點:
(1)阿替利珠單抗的用法為固定劑量1200mg/次,每3 周1 次,靜脈輸注,不得采用靜脈推注或快速靜脈輸注的方式給藥。不得與其他藥物使用同一輸液管給藥。首次給藥至少持續60min,若首次輸注患者耐受性良好,后續給藥至少30min。與其他藥品聯合使用時,也應同時參考聯合使用藥品的完整處方信息。如在同一天給藥,本品應在其聯合使用藥品前先行給藥。
(2)用于ES-SCLC 時,誘導期聯合卡鉑和依托泊苷方案每3 周1 次,治療4 個周期后進入無化療維持期。用于NSCLC 一線單藥治療,每3 周1 次。用于NSCLC 一線聯合化療時,誘導期聯合培美曲塞和鉑類方案每3 周1 次,治療4 個或6 個周期后進入聯合使用阿替利珠單抗和培美曲塞維持期。
(3)患者可接受阿替利珠單抗治療直至無臨床獲益或出現不可耐受的毒性。如果患者臨床癥狀穩定,即使有疾病進展的初步證據,但基于總體臨床獲益判斷,可考慮繼續應用本品治療。應對疾病進展后繼續使用阿替利珠單抗治療的患者開展密切監測,4~8 周內重復腫瘤療效評估。對于早期NSCLC術后輔助阿替利珠單抗治療,患者可接受本品治療1 年,除非疾病進展或出現不可耐受的毒性。
(4)對于疑似免疫相關性不良反應,應進行充分評估以確認病因或排除其他病因。根據免疫相關性不良反應的類型和嚴重程度,可能需要暫停給藥或永久停用,不建議增加或減少劑量。
(5)在使用本品之前應盡量避免使用全身性糖皮質激素或其他免疫抑制劑,因為這些藥物可能會影響本品的藥效學活性及療效。但在本品開始給藥后,可使用全身性糖皮質激素或其他免疫抑制劑治療免疫相關性不良反應。在患者接受達到免疫抑制劑量的糖皮質激素或其他免疫抑制劑治療期間,不建議重新使用阿替利珠單抗治療。
(6)尚未確定阿替利珠單抗在18 歲以下兒童和青少年患者的安全性和有效性。老年患者(≥65歲)、輕度肝功能損傷患者和輕中度腎功能損傷患者無需調整劑量。尚未建立在中重度肝功能損傷患者、重度腎功能損傷患者中使用的安全性及有效性,如經醫師評估使用本品預期獲益大于風險,需在醫師指導下謹慎使用。
*(7)美國FDA 批準阿替利珠單抗的適應癥還包括:阿替利珠單抗聯合白蛋白紫杉醇和卡鉑用于EGFR/ALK陰性的晚期非鱗狀細胞NSCLC 一線治療;聯合貝伐珠單抗和紫杉醇和卡鉑用于EGFR/ALK陰性的晚期非鱗狀細胞NSCLC 一線治療;阿替利珠單抗單藥用于晚期NSCLC 含鉑化療進展后的二線治療;聯合貝伐珠單抗治療既往接受過全身系統性治療的不可切除肝細胞癌;作為不適合含鉑化療的局部晚期或轉移性尿路上皮癌的一線治療;與卡比替尼和維莫非尼聯合使用于治療BRAFV600 突變陽性的不可切除或轉移性黑色素瘤。除肝細胞癌外,這些適應癥目前尚未在國內獲批,可在與患者充分溝通的情況下,按照美國FDA 批準的用法正確使用。
28 卡瑞利珠單抗(camrelizumab)
劑型:注射劑;規格:200mg/瓶;適應癥:①卡瑞利珠單抗聯合培美曲塞和卡鉑適用于EGFR基因突變陰性和ALK陰性的、不可手術切除的局部晚期或轉移性非鱗狀細胞NSCLC 患者的一線治療。②卡瑞利珠單抗聯合紫杉醇和卡鉑用于局部晚期或轉移性鱗狀細胞NSCLC 患者的一線治療。
合理用藥要點:
(1)對于非鱗狀細胞NSCLC 患者,用藥前必須明確診斷為EGFR突變陰性和ALK陰性。
(2)應按照相關疾病指南,治療前做基線評估,治療期間定期監測治療反應及毒性。
(3)本品推薦劑量為200mg/次,每3 周1 次,靜脈輸注,每次持續30~60min,直至疾病進展或出現不可耐受的毒性。當卡瑞利珠單抗聯合化療給藥時,應首先給予卡瑞利珠單抗靜脈輸注,間隔至少30min 后再給予化療。
(4)有可能觀察到非典型反應。如果患者臨床癥狀穩定或持續減輕,即使影像學有疾病進展的初步證據,但基于總體臨床獲益判斷,可考慮繼續應用本品治療,直至疾病進展或出現不可耐受的毒性。
(5)如出現免疫相關性不良反應,根據患者個體的安全性和耐受性,可能需要暫停給藥或永久停用。不建議增加或減少劑量。
(6)目前,本品尚無針對中重度肝功能損傷患者的研究數據,中重度肝功能損傷患者不推薦使用。輕度肝功能損傷患者應在醫師指導下慎用本品,如需使用,無需調整劑量。
(7)目前,本品尚無針對中重度腎功能損傷患者的研究數據,中重度腎功能損傷患者不推薦使用。輕度腎功能損傷患者應在醫師指導下慎用本品,如需使用,無需調整劑量。
(8)尚未確定本品在18 歲以下兒童和青少年患者的安全性和有效性。
(9)本品在老年患者(≥65 歲)中應用數據有限,建議在醫師的指導下慎用,如需使用,無需調整劑量。
(10)不建議在妊娠期使用本品治療。
(11)因可能干擾本品生物活性,應避免在開始本品治療前使用全身性糖皮質激素及其他免疫抑制劑。但如果是為了治療免疫相關性不良反應,可在開始本品治療后使用全身性糖皮質激素及其他免疫抑制劑。
(12)卡瑞利珠單抗是一種人源化單克隆抗體,尚未進行與其他藥物的藥動學相互作用研究。因單克隆抗體不經CYP450 酶或其他藥物代謝酶代謝,因此聯合使用的藥物對這些酶的抑制或誘導作用預期不會影響卡瑞利珠單抗的體內代謝。
(13)反應性毛細血管增生癥的處理。在接受本品治療的患者中,共1529 例(76.0%)發生反應性毛細血管增生癥,其中1 級為1240 例(61.7%),2 級為267 例(13.3%),3 級為22 例(1.1%)。所有反應性毛細血管增生癥均發生在體表,其中4.6%(93/2011)伴發于口腔、1.4%(29/2011)伴發于鼻黏膜、1.5%(31/2011)伴發于眼部;22.5%(453/2011)發生合并出血,1.8%(37/2011)發生合并感染。至反應性毛細血管增生癥發生的中位時間為1.1 個月(范圍:0 ~17.6 個月),持續中位時間為6.5 個月(范圍:0.1 ~45.5 個月)。發生于皮膚的反應性毛細血管增生,初始多表現為體表鮮紅色點狀物,直徑≤2mm,隨著用藥次數增加,病變范圍可逐漸增大,多為結節狀,也有斑片狀,顏色鮮紅或暗紅,需觀察臨床癥狀和體征。
當患者出現該不良反應時,應避免抓撓或摩擦,易摩擦部位可用紗布保護以避免出血,同時應聯系主管醫師,獲得恰當的處理建議。破潰出血者可采用局部壓迫止血,反復出現者可在止血后于皮膚科就診,或采取如激光或手術切除等局部治療;并發感染者應給予抗感染治療。反應性毛細血管增生癥可能在皮膚以外的其他組織發生(包括瞼結膜、內外眥、口腔黏膜、咽喉等消化道黏膜或其他臟器),必要時進行相應的醫學檢查,如大便潛血、內窺鏡及影像學檢查。
29 替雷利珠單抗(tislelizumab)
劑型:注射劑;規格:100mg(10ml)/瓶;適應癥:①替雷利珠單抗聯合紫杉醇和卡鉑或白蛋白紫杉醇和卡鉑用于局部晚期或轉移性鱗狀細胞NSCLC 的一線治療。②替雷利珠單抗聯合培美曲塞和鉑類化療用于EGFR基因突變陰性和ALK陰性、不可手術切除的局部晚期或轉移性非鱗狀細胞NSCLC 的一線治療。③替雷利珠單抗單藥適用于治療EGFR基因突變陰性和ALK陰性、既往接受過含鉑藥物化療方案后疾病進展或不可耐受的局部晚期或轉移性非鱗狀細胞NSCLC 的成人患者,以及EGFR和ALK陰性或未知的、既往接受過含鉑藥物化療方案后疾病進展或不可耐受的局部晚期或轉移性鱗狀細胞NSCLC 的成人患者。
合理用藥要點:
(1)推薦劑量為200mg/次,每3 周1 次,靜脈輸注,用藥直至疾病進展或出現不可耐受的毒性。
(2)與化療聯合使用時,若為同日給藥則先輸注替雷利珠單抗。
(3)有可能觀察到非典型反應。如果患者癥狀穩定或持續減輕,即使有初步的疾病進展表現,但基于總體臨床獲益判斷,可考慮繼續應用替雷利珠單抗治療,直至證實疾病進展。
(4)根據患者個體的安全性和耐受性,可能需要暫停給藥或永久停用,不建議增加或減少劑量。
(5)輕度肝功能損傷患者無需調整劑量,中重度肝功能損傷患者不推薦使用。
(6)輕中度腎功能損傷患者應在醫師指導下慎用,無需調整劑量,重度腎功能損傷患者不推薦使用。
30 信迪利單抗(sintilimab)
劑型:注射劑;規格:100mg(10ml)/瓶;適應癥:①信迪利單抗聯合培美曲塞和鉑類藥物化療,用于EGFR基因突變陰性和ALK陰性、不可手術切除的局部晚期或轉移性非鱗狀細胞NSCLC 的一線治療。②信迪利單抗聯合吉西他濱和鉑類藥物化療,用于不可手術切除的局部晚期或轉移性鱗狀細胞NSCLC 的一線治療。
合理用藥要點:
(1)推薦劑量為200mg/次,每3 周1 次,靜脈輸注,靜脈輸注時間應在30~60min 內,直至疾病進展或出現不可耐受的毒性。不得采用靜脈推注或單次快速靜脈注射給藥。
(2)有可能觀察到非典型反應。如果患者臨床癥狀穩定或持續減輕,即使有疾病進展的影像學初步證據,但基于總體臨床獲益判斷,可考慮繼續應用本品治療,直至證實疾病進展。
(3)根據患者個體的安全性和耐受性,可能需要暫停給藥或永久停用。不建議增加或減少劑量。
(4)輕中度肝功能損傷患者、輕中度腎功能損傷患者無需調整劑量。目前,尚無針對重度肝功能損傷或重度腎功能損傷患者的獨立研究數據。重度肝功能損傷或重度腎功能損傷患者應在醫師指導下慎用本品,如需使用,無需調整劑量。
(5)尚未確定本品在18 歲以下兒童和青少年患者的安全性和有效性。在老年患者(≥65 歲)與<65 歲患者中的安全性未顯示出顯著差異。建議在醫師的指導下慎用,如需使用,無需調整劑量。
(6)不建議在妊娠期間使用本品治療。建議哺乳期婦女在接受本品治療期間及末次給藥后至少5個月內停止哺乳。
(7)應避免在開始本品治療前使用全身性糖皮質激素及其他免疫抑制劑,但如果是為了治療免疫相關性不良反應,可在開始本品治療后使用全身性糖皮質激素及其他免疫抑制劑。
*(8)基于發表于《柳葉刀-腫瘤學》(LancetOncology)的Ⅲ期多中心臨床研究結果和2022 版中國臨床腫瘤學會(CSCO)非小細胞肺癌診療指南,對于EGFR敏感突變陽性的晚期非鱗狀細胞NSCLC、EGFR-TKIs 耐藥后、未接受過系統化療的患者,可采用信迪利單抗聯合貝伐珠單抗、培美曲塞、順鉑方案治療。
31 伊匹木單抗(ipilimumab)
劑型:注射劑;規格:50mg(10ml)/瓶;適應癥:本品聯合納武利尤單抗用于不可手術切除的、初治的非上皮樣惡性胸膜間皮瘤成人患者。
合理用藥要點:
(1)本品推薦劑量為1mg/kg,每6 周1 次,靜脈輸注30min,聯合360mg/次納武利尤單抗,每3 周1 次,或聯合3mg/kg 納武利尤單抗,每2周1 次,靜脈輸注30min,直至疾病進展或出現不可耐受的毒性,或至24 個月的患者未出現疾病進展。
(2)已觀察到非典型反應。對于臨床穩定且有疾病進展初步證據的患者,建議繼續使用本品聯合納武利尤單抗治療,直至證實疾病進展。
(3)應在基線時和每劑本品給藥之前評估肝功能和甲狀腺功能。此外,在使用本品治療期間,必須評估免疫相關性不良反應的任何體征或癥狀(包括腹瀉和結腸炎)。
(4)本品可不經稀釋用于靜脈輸注,或稀釋于0.9%氯化鈉溶液或5%葡萄糖溶液中,濃度至1~4mg/ml 后輸注使用。本品不得采用靜脈推注或單次快速靜脈注射給藥。
(5)當與納武利尤單抗聯合使用時,應先輸注納武利尤單抗,之后同一天輸注本品。每次輸注需使用單獨的輸液袋和過濾器。
(6)伊匹木單抗聯合納武利尤單抗最常見的不良反應為皮疹、疲乏、腹瀉、瘙癢、甲狀腺功能減退和惡心。大多數不良反應為輕中度。
(7)出現4 級或復發性3 級不良反應,或雖然進行治療調整但仍持續存在的2 級或3 級不良反應時,應永久停止本品與納武利尤單抗聯合治療。
(8)當本品與納武利尤單抗聯合使用時,若暫停一種藥物,則應同時暫停另一藥物。若在暫停后重新開始給藥,則應根據患者個體的評估情況重新開始聯合治療或納武利尤單抗單藥治療。
*(9)美國FDA 和歐盟EMA 批準伊匹木單抗聯合納武利尤單抗治療晚期和轉移性NSCLC,詳見納武利尤單抗合理用藥要點第18 條。
32 舒格利單抗(sugemalimab)
劑型:注射劑;規格:600mg(20ml)/瓶;適應癥:①舒格利單抗聯合培美曲塞和卡鉑用于EGFR基因突變陰性和ALK陰性的轉移性非鱗狀細胞NSCLC 患者的一線治療。舒格利單抗聯合紫杉醇和卡鉑用于轉移性鱗狀細胞NSCLC 患者的一線治療。②舒格利單抗用于在接受鉑類藥物為基礎的同步或序貫放化療后未出現疾病進展、不可切除、Ⅲ期NSCLC 患者的治療。
合理用藥要點:
(1)推薦劑量為1200mg/次,每3 周1 次,靜脈輸注,每次輸注時間為60min 或以上,禁止靜脈推注或快速注射,直至疾病進展或出現不可耐受的毒性。如用于鞏固治療,本品治療不超過24 個月。
(2)老年患者(≥65 歲)與<65 歲患者在安全性或有效性上未出現總體差異,無需在這一人群中調整劑量。
(3)本品尚無針對中重度肝功能損傷患者的研究數據,中重度肝功能損傷患者不推薦使用。輕度肝功能損傷患者無需調整劑量。
(4)本品尚無針對重度腎功能損傷患者的研究數據,重度腎功能損傷患者不推薦使用。輕中度腎功能損傷患者應在醫師指導下慎用本品,基于PPK結果,如需使用,無需調整劑量。
(5)不建議在妊娠期使用本品治療。
(6)根據患者個體的安全性和耐受性,可能需要暫停給藥或永久停用,不建議增加或減少劑量。對于疑似免疫相關性不良反應,應進行充分評估以確定病因或排除其他病因。大多數免疫相關性不良反應是可逆的,并且可通過中斷本品治療、給予糖皮質激素治療和/或支持治療來處理。
(7)本品是一種全人源單克隆抗體,由于單克隆抗體不通過CYP450 或其他藥物代謝酶代謝,也不主要以轉運體介導的方式攝取和外排,所以聯合使用對常見代謝酶或轉運體的抑制或誘導作用預期不會影響本品的藥動學特征。
(8)因可能影響本品的藥效學活性,應避免在開始本品治療前使用全身性糖皮質激素及其他免疫抑制劑。如果為治療免疫相關性不良反應,可在開始本品治療后使用全身性糖皮質激素及其他免疫抑制劑。

