中藥有效成分干預自身免疫性肝炎相關信號通路的研究進展
郝君玉 劉光偉 謝露 范文艷 陳虹秀
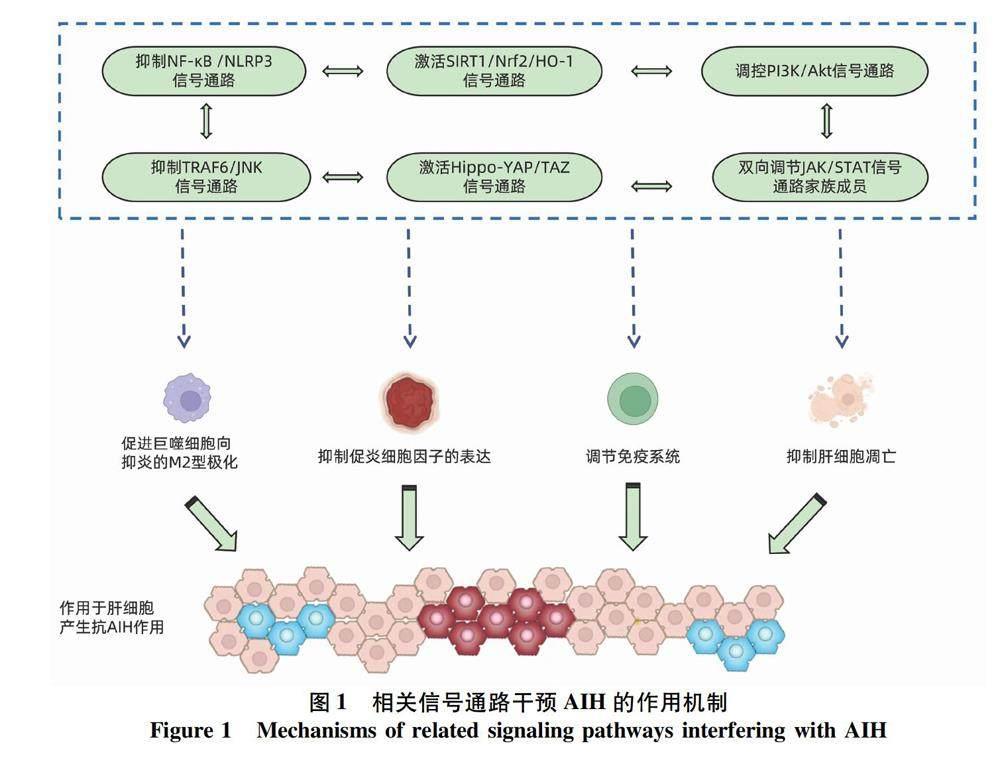

摘要:自身免疫性肝炎作為一種由免疫耐受缺失導致的慢性肝臟炎癥,其發病受多種信號通路的調控,例如NF-κB /NLRP3通路、SIRT1/Nrf2/HO-1通路、Hippo-YAP/TAZ通路、JAK/STAT通路、PI3K/Akt通路和TRAF6/JNK通路等,這些通路能夠通過參與細胞因子的增殖和凋亡、免疫反應以及氧化應激等過程來發揮抗免疫性肝炎的作用。針對臨床應用激素和免疫制劑治療自身免疫性肝炎出現的應答不佳、不良反應明顯及復發率高等問題,本文對自身免疫性肝炎相關信號傳導通路的研究文獻進行了總結,并梳理了苷類、萜類、黃酮類、醌類及酚類中藥有效成分通過以上信號通路干預自身免疫性肝炎疾病進程的機制,以期為科學有效地利用中藥有效成分研發抗自身免疫性肝炎藥物提供理論參考依據。
關鍵詞:肝炎, 自身免疫性; 中草藥; 信號傳導
基金項目:國家自然科學基金資助項目(81573933); 河南省自然科學基金(222300420490); 河南省特色骨干學科中醫學學科建設項目(STG-ZYXKY-2020017)
Research advances in effective constituents of traditional Chinese medicine in intervention of autoimmune hepatitis-related signaling pathways
HAO Junyu1, LIU Guangwei2, XIE Lu1, FAN Wenyan1, CHEN Hongxiu1. (1. The First Clinical Medical College of Henan University of Traditional Chinese Medicine, Zhengzhou 450000, China; 2. Department of Hepatology and Spleen-Stomach, The First Affiliated Hospital of Henan University of Traditional Chinese Medicine, Zhengzhou 450000, China)
Corresponding author:
LIU Guangwei, Liuguangwei1975@163.com (ORCID:0000-0002-6641-1625)
Abstract:
As a chronic liver inflammation disease caused by the lack of immune tolerance, autoimmune hepatitis is regulated by various signaling pathways, such as the NF-κB/NLRP3 pathway, the SIRT1/Nrf2/HO-1 pathway, the Hippo-YAP/TAZ pathway, the JAK/STAT pathway, the PI3K/Akt pathway, and the TRAF6/JNK pathway. These pathways can play a role against autoimmune hepatitis by participating in the processes including the proliferation and apoptosis of cytokines, immune response, and oxidative stress. In view of the problems of suboptimal response, obvious adverse reactions, and high recurrence rate in the clinical application of hormones and immune preparations for the treatment of autoimmune hepatitis, this article summarizes the research articles on autoimmune hepatitis-related signaling pathways and the mechanism of effective constituents (glycosides, terpenoids, flavonoids, quinones, and phenols) in traditional Chinese medicine intervening against the disease process of autoimmune hepatitis through the above signaling pathways, in order to provide a theoretical basis for scientific and effective utilization of effective constituents in traditional Chinese medicine to develop anti-autoimmune hepatitis drugs.
Key words:
Hepatitis, Autoimmune; Drugs, Chinese Herbal; Signal Transduction
Research funding:
National Natural Science Foundation of China (81573933); Natural Science Foundation of Henan Province(222300420490); Traditional Chinese Medicine Discipline Construction Project of Henan Province Characteristic Backbone Discipline(STG-ZYXKY-2020017)
自身免疫性肝炎(AIH)的臨床特點包括血清氨基轉移酶水平升高、高免疫球蛋白G血癥、血清自身抗體陽性,肝組織學上存在中重度界面性肝炎等[1]。遺傳易感性、免疫調節失衡和環境因素可能與其發病機制有關[2],后期可能會進展為肝硬化、肝衰竭和終末期肝病等。針對目前治療中單獨使用糖皮質激素或與免疫抑制劑聯合所導致的副作用或不能耐受等情況,急需尋求新療法和新途徑。現代醫學認為中藥有效成分是中藥發揮藥物作用的物質基礎,能參與疾病發病進程的諸多方面,可以作為治療AIH的潛在藥物。信號傳導通路是疾病發生發展的重要分子機制,近年來研究發現,中藥有效成分靶向作用于不同信號通路可以干預AIH的疾病進展,故本文對中藥有效成分干預AIH相關信號通路的研究進行綜述,以期為防治AIH提供新思路。
1 AIH相關信號通路
1.1 NF-κB/NLRP3信號通路 NF-κB調節免疫和炎癥反應的基因轉錄主要通過以下3種途徑。(1)經典途徑:由TNFα或IL-1等細胞因子和Toll樣受體激動劑觸發,當刺激物到達細胞時,會發生磷酸化,然后以蛋白酶體依賴的方式泛素化和降解其抑制蛋白,從而釋放NF-κB,然后轉移到細胞核,通過啟動基因轉錄發揮作用;(2)非經典途徑:在B淋巴細胞中,信號因子引發前體蛋白p100裂解產生p52亞基,從而釋放p52/RelB二聚體并發生核易位,隨后啟動基因轉錄;(3)由DNA損傷誘導的NF-κB活化途徑[3]。Tan等[4]發現NF-κB信號通路對細胞極化和焦亡過程具有重要的調控作用,其啟動后能夠促進巨噬細胞向M1型極化,進而誘導炎癥反應的發生。NLRP3炎癥小體是一種多蛋白復合物,由受體蛋白NLRP3、銜接蛋白ASC、效應蛋白pro-caspase-1組成,在先天免疫系統的炎癥途徑中發揮關鍵作用[5]。胱天蛋白酶原-1能介導啟動半胱天冬酶-1和分泌參與先天免疫防御的IL-1家族成員,以回應感染和細胞應激的免疫反應。抑制NF-κB下游促炎介質信號的啟動以及減弱NLRP3和其相關基因的mRNA表達有益于AIH的治療。
1.2 SIRT1/Nrf2/HO-1信號通路 SIRT1是煙酰胺腺苷二核苷酸依賴的脫乙酰化酶,屬于Sirtuins家族[6]。SIRT1對細胞氧化還原狀態高度敏感,在細胞對炎癥、代謝和氧化應激源的反應中發揮作用。研究[7]表明,SIRT1不僅能通過調控某些轉錄因子(如STAT3、PTEN、PDK1等)來控制炎癥,還是一種重要的免疫調節劑。Nrf2屬亮氨酸-拉鏈轉錄啟動因子家族,可被機體的氧化應激反應所啟動。通過調節Nrf2可以控制刀豆蛋白(Con A)誘導的肝炎,在氧化應激條件下,Nrf2被啟動并引發抗氧化基因和抗氧化酶的轉錄,從而控制細胞氧化性炎癥損傷的進展[8]。血紅素氧化酶是血紅素代謝的限速酶,劉會敏[9]發現,增加Nrf2/HO-1的表達能夠改變巨噬細胞的極化狀態,刺激巨噬細胞由促炎的M1型轉化為抑炎的M2型,從而降低了肝細胞凋亡和炎癥水平。
1.3 Hippo-YAP/TAZ信號通路 Hippo通路由絲/蘇氨酸激酶MST1/2、腫瘤抑制激酶1/2、支架蛋白sav、YAP及YAP/TAZ組成[10]。MST1/2已被證明是T淋巴細胞發育、分化和凋亡的重要調節因子,該基因敲除時會導致T淋巴細胞凋亡增加[11]。而YAP是T淋巴細胞免疫應答反應的負性調節因子,特異性YAP缺乏的T淋巴細胞中,參與T淋巴細胞活化、遷移的基因表達水平顯著升高。研究[12]表明,調節Hippo-YAP/TAZ信號通路可以啟動先天免疫,促進髓源性抑制細胞(MDSC)的積累及T淋巴細胞的增殖與分化,進而擴大功能性MDSC并上調免疫抑制細胞的產生,同時還抑制促炎細胞因子的生成。Zhang等[13]通過YAP啟動劑對MDSC和T淋巴細胞共培養系統的干預發現MDSC比例增加,相關下游分子的表達增加,炎性細胞因子的分化下降。諸多研究證明Hippo-YAP/TAZ通路可以通過調節MDSC和T淋巴細胞的免疫微環境平衡從而可能成為AIH治療的一個關鍵通路。
1.4 JAK/STAT信號通路 JAK激酶是一類胞質酪氨酸激酶,STAT蛋白家族是存在于胞漿內的轉錄啟動因子,該家族成員包括STAT1、STAT2、STAT3、STAT4、STAT5α、STAT5β及STAT6,許多干擾素和白細胞介素家族成員可以與Ⅰ/Ⅱ型細胞因子受體結合,再與JAK選擇性結合,啟動下游相應的STAT家族中的特定成員,進而參與免疫應答的諸多方面[14],產生不同的調節趨勢。詳細來說,STAT1可以誘導多種趨化因子和黏附分子的產生,通過促進中性粒細胞和嗜酸性粒細胞的浸潤進而產生促炎作用。Hong等[15]發現,破壞STAT1基因可抑制自然殺傷T淋巴細胞的活化,并下調干擾素調節因子1和細胞因子信號抑制物1的表達,從而減輕肝損傷。STAT6能通過強化嗜酸細胞活化趨化因子的表達,促進中性粒細胞和嗜酸性粒細胞的募集,引起廣泛肝組織壞死[16]。STAT3減輕免疫相關性肝炎的機制之一可能是因為抑制了可溶性二聚體細胞因子IFNγ的生成;另外,活化的STAT3可以上調抗凋亡蛋白B淋巴細胞淋巴瘤/白血病-2基因和抗凋亡蛋白Bcl-XL的水平,還能上調對肝臟有保護作用的血清淀粉樣蛋白A2和KC蛋白在肝內的表達[17],這些蛋白質能有效抑制Con A誘導的肝炎。特別強調的是,STAT4對AIH存在著雙向調控作用。一方面,STAT4被啟動后通過誘導Th1和Th2細胞因子促進炎癥反應;另一方面,這種啟動還能下調自然殺傷T淋巴細胞中凋亡相關因子配體的表達,從而減少肝細胞損傷[18]。總之,STAT4的凈效應啟動對肝損傷進展的影響取決于抑制凋亡相關因子配體表達和上調促炎細胞因子之間的平衡。由此可見,若想利用JAK/STAT信號通路干預AIH的疾病進展,需進一步明確該通路各家族成員之間的相互影響,將其各自的作用路線細化后分別進行干預。
1.5 PI3K/Akt信號通路 PI3K屬于磷酸化的脂質激酶家族磷脂酰肌醇,通過調控PI3K能調節體內抗炎細胞因子和促炎細胞因子的表達,從而抑制肝細胞的炎癥反應,并抑制肝星狀細胞的增殖和侵襲[19]。作為信號轉導分子,被啟動的PI3K可促進第二信使磷脂酰肌(3,4,5)-三磷酸的形成,再通過磷酸化進一步啟動Akt,并導致其從細胞質轉移到細胞膜。Akt是一種絲氨酸/蘇氨酸激酶,被啟動的Akt磷酸化下游因子GSK-3β上的絲氨酸殘基,Akt p-GSK-3β會抑制細胞色素C的釋放以及Caspase-3的活性,引起一系列與細胞凋亡相關的細胞因子變化,從而調節細胞的增殖、分化、凋亡、遷移等重要過程[20]。Wang等[21]發現甲基丁香酚可以通過調控 PI3K/Akt 信號通路抑制炎癥因子的表達,降低肝細胞凋亡率。Shen等[22]認為調控PI3K/Akt通路可以降低IL-1β和TNFα的表達,減輕肝臟炎癥反應。Zheng等[23]揭示出可以通過調控PI3K/Akt通路抑制免疫炎癥級聯反應并減少炎癥所引起的肝細胞壞死。
1.6 TRAF6/JNK信號通路 腫瘤壞死因子受體相關因子6(TRAF6)是一種細胞質銜接蛋白,通過抑制TRAF6的表達可以阻斷Toll樣受體4所誘導的JNK磷酸化,從而減輕肝損傷[24]。Yu等[25]通過對左旋四氫巴馬汀的研究發現,左旋四氫巴馬汀的肝保護功能依賴于下調TRAF6/JNK信號,抑制肝細胞凋亡和自噬,抑制炎癥因子(如TNFα和IL-6)的表達,進而減輕AIH引起的急性肝損傷。以上信號通路對AIH的干預作用機制見圖1。
2 中藥有效成分對AIH相關信號通路的干預作用
2.1 苷類
2.1.1 金線蓮苷 金線蓮苷為金線蓮水提物中分離出的單體糖苷,具有抗氧化、抗炎、保肝等作用[26]。劉婷婷[27]研究發現,金線蓮苷發揮免疫抑制作用的分子學機制主要包括兩方面。首先,金線蓮苷能靶向作用于免疫細胞的血管內皮細胞生長因子受體2,抑制其受體后代謝相關PI3K/AKT信號通路的啟動,進而協同抑制炎癥相關JAK/STAT通路的活化;另外,還可以通過抑制PI3K/AKT信號通路,下調該通路下游關鍵信號分子叉頭轉錄因子O1對樹突狀細胞(DC)內趨化因子受體7轉錄因子的啟動,促進叉頭轉錄因子O1對程序性死亡因子配體1基因的啟動,影響DC的遷移和抗原遞呈功能。Deng等[28]通過動物模型研究發現,金線蓮苷能通過抑制NF-κB/NLRP3信號通路改善血清轉移酶和促炎因子水平,減輕小鼠肝臟炎癥。談婉月[29]發現金線蓮苷能抑制JAK/STAT通路的啟動,進而抑制機體的氧化應激反應,減少炎癥相關因子的產生,減少DC的成熟,降低其抗原遞呈能力,下調CD8+T淋巴細胞的分化和殺傷能力,上調調節性T淋巴細胞的分化,增強免疫耐受,保護肝組織免受過強的免疫反應的損傷,起到抗AIH的效果。
2.1.2 人參皂苷 人參皂苷根據化學結構的不同可分為原人參二醇型人參皂苷、原人參三醇型人參皂苷和齊墩果酸型皂苷三類,具有抗炎、抗氧化、抗細胞凋亡、免疫調節、保肝護肝等作用[30]。有研究[31]表明,人參皂苷不僅可以通過調節先天免疫和適應性T淋巴細胞免疫來減輕AIH引起的肝損傷,還可以啟動糖皮質激素受體,并進一步上調YAP/TAZ-TEAD 復合物的表達,從而調節MDSC以及T淋巴細胞的增殖和分化,例如擴大功能性MDSC,增加抗炎細胞因子IL-10、轉化生長因子與調節性T淋巴細胞比例,降低IL-17和干擾素的表達,以及抑制活性氧和IL-6的產生,從而產生免疫抑制作用[30]。另有實驗[32]證實,人參皂苷可以調控Hippo-YAP通路,上調YAP表達,高表達的YAP可促進MDSC浸潤,通過糖皮質激素受體-Hippo-YAP-MDSC軸重塑肝臟免疫微環境發揮免疫抑制作用,從而降低AIH模型鼠的肝酶水平及炎癥反應。人參皂苷Rh1可以抑制脂多糖和NF-κB介導的絲裂原活化蛋白激酶磷酸化,并增加環磷酸腺苷反應元件結合蛋白啟動以達到抗炎作用,而人參皂苷Rk1可以通過阻斷脂多糖介導的JAK/STAT和NF-κB途徑來抑制炎癥介質的表達,并進一步抑制炎癥[33]。
2.2 萜類
2.2.1 葫蘆素E 葫蘆素E是從一種葫蘆科西瓜屬植物藥西瓜的果實中分離出來的四環三萜類化合物,具有廣泛的藥理作用,如抗增殖、抗氧化活性、免疫調節、抗炎和抗纖維化等作用[34]。Mohamed等[35]在實驗中證明了葫蘆素E對抗肝臟炎性病變的能力是通過抑制氧化應激、增強SIRT1/Nrf2/HO-1信號通路和抑制NF-κB /NLRP3 通路介導的;該研究還發現葫蘆素E的保肝作用與其抗氧化及抗炎活性有關,葫蘆素E能夠抑制肝組織中CD4+ T淋巴細胞的增加,其抗氧化活性也通過降低氧化應激標志物的水平以及增強肝組織中的抗氧化劑的能力而得到證實。
2.2.2 雷公藤紅素 雷公藤紅素是雷公藤的主要活性成分之一,屬五環三萜類化合物,具有良好的抗炎、抗氧化、免疫抑制等藥理活性[36],另有研究[37]表明,雷公藤紅素可通過調節NF-κB、PI3K/Akt、NLRP3等多種信號通路和誘導不同反應發揮對多種炎癥和自身免疫性疾病的治療作用。國外學者[38]發現,雷公藤紅素不僅能通過調節NF-κB通路抗炎,還能通過抑制NLRP3炎癥小體、控制IL-1β釋放達到抗炎目的。對于免疫學方面,雷公藤紅素能抑制Th17中葡萄糖轉運蛋白1、雷帕霉素靶蛋白、缺氧誘導因子-1的表達,產生免疫抑制活性;還能抑制NF-κB信號通路啟動,產生免疫抑制作用[39]。說明雷公藤紅素主要通過調節NF-κB/NLRP3和PI3K/Akt信號通路實現干預AIH的疾病進展。
2.3 黃酮類 柚皮素是二氫黃酮類化合物,已有研究[40]證明,柚皮素具有顯著的抗炎和抗氧化活性,對
肝損傷具有保護作用,并通過抑制NF-κB信號通路,發揮抗肝細胞凋亡作用。張露露等[41]的研究提示柚皮素可能通過抑制TRAF6的表達,從而抑制JNK的磷酸化,減輕Con A誘導的AIH小鼠模型的肝臟炎癥,抑制肝細胞凋亡,發揮肝臟保護作用。
2.4 醌類 丹參酮為丹參根部的乙醚或乙醇提取物,根據其不同的化學結構可分為丹參酮 Ⅰ、丹參酮 Ⅱ A、丹參酮 Ⅱ B等15種化學成分,其中丹參酮 Ⅱ A活性最為突出[42]。研究[43]發現,丹參酮 Ⅱ A可以通過抑制NF-κB信號傳導,降低IL-1、IL-6、TNFα等促炎細胞因子的釋放,從而減輕肝臟炎癥的發生。另外,郝健亨等[19]通過動物實驗驗證丹參酮ⅡA可能通過調節PI3K/AKT信號通路改善AIH小鼠肝臟炎癥反應。
2.5 酚類 姜黃素是從姜黃屬藥用植物根莖中提取的一種酚類物質,具有良好的體內外抗炎活性,可在多種炎癥疾病中發揮治療效果,這與它能夠調節多種免疫細胞和炎癥介質有關。Zhong等[44]發現姜黃素治療可抑制 PI3K/AKT信號的傳導和細胞凋亡,減輕肝損傷。董玲等[45]在AIH小鼠模型實驗中發現,二至丸+姜黃素組小鼠能明顯阻礙NF-κB和Nrf2信號通路的啟動,抑制NF-κB的磷酸化和Nrf2蛋白水平的下調,從而抑制血清和肝臟中炎性細胞因子的釋放;同時減少Caspase-3的活化以降低肝細胞凋亡率,減少肝細胞壞死;另外還能通過抑制肝臟自由基的氧化損傷增強抗氧化能力,緩解Con A誘導的肝臟炎癥和損傷。以上中藥有效成分對AIH相關信號通路的干預作用總結見表1。
3 總結與展望
隨著新型科學技術的不斷涌現,中藥有效成分抗AIH的機制成為國內外學者研究的熱點。本文分析歸納可知:(1)金線蓮苷、雷公藤紅素和丹參酮ⅡA可通過抑制NF-κB/NLRP3或JAK/STAT通路及調控PI3K/AKT通路的活化,改善血清轉移酶和促炎因子水平,抑制氧化應激反應,減輕肝臟炎癥;(2)葫蘆素E和姜黃素通過啟動SIRT1/Nrf2/HO-1通路并抑制NF-κB /NLRP3通路成員,能擁有較強的抗氧化及抗炎活性,降低肝內炎性介質的分泌和肝細胞凋亡率;(3)人參皂苷可以調控糖皮質激素受體-Hippo-YAP-MDSC軸,上調YAP/TAZ-TEAD 復合物的表達,同時阻斷JAK/STAT和NF-κB途徑,達到重塑肝臟免疫微環境和抗炎的作用;(4)柚皮素能通過抑制NF-κB和TRAF6的表達及JNK的磷酸化,發揮抗肝細胞凋亡和抗免疫性肝炎的作用。總的來說,中藥通過多種信號通路治療AIH安全有效,但目前研究也存在以下問題:(1)中藥有效成分復雜,作用靶點不一,較難闡明是單一成分還是多成分的協同作用,按照中醫傳統的君臣佐使配伍規范,其相互促進、相互監制作用或增效,或解毒,抑或使毒性增加,故針對中藥信號通路的研究任重而道遠;(2)某些中藥有效成分雖然已經被證實能夠延緩AIH的發生發展進程,例如白藜蘆醇、雷公藤甲素、白芍多糖等,但是具體信號轉導機制不明,有待進一步研究歸納;(3)臨床實踐應用與動物實驗、細胞學研究有較大的差異,故不能僅停留在體內外實驗水平,而是要以此研究思路為基石,嘗試開展臨床試驗,將其運用于臨床診治中。因此,今后需要更深入挖掘中藥有效成分中的特異性作用靶點并進行梳理歸類,尋找不同種類中藥有效成分全方位、多靶點共同作用抗免疫性肝炎的可能,為應用中藥有效成分研發出更科學有效的抗AIH藥物提供理論依據。
利益沖突聲明:所有作者均聲明不存在利益沖突。
作者貢獻聲明:郝君玉負責文獻檢索,撰寫論文;謝露、范文艷、陳虹秀負責資料分析;劉光偉負責指導撰寫文章并最終定稿。
參考文獻:
[1]Chinese Society of Hepatology, Chinese Medical Association.? Guidelines on the diagnosis and management of autoimmune hepatitis(2021)[J]. J Clin Hepatol, 2022, 38(1): 42-49. DOI: 10.3969/j.issn.1001-5256.2022.01.008.
中華醫學會肝病學分會. 自身免疫性肝炎診斷和治療指南(2021)[J]. 臨床肝膽病雜志, 2022, 38(1): 42-49. DOI: 10.3969/j.issn.1001-5256.2022.01.008.
[2]HU ML, WANG QX, MA X. Advances in the pathogenesis of autoimmune hepatitis and new targets for clinical intervention[J]. J Clin Hepatol, 2022, 38(4): 743-747. DOI: 10.3969/j.issn.1001-5256.2022.04.002.
胡明禮, 王綺夏, 馬雄. 自身免疫性肝炎發病機制進展與臨床干預新靶點[J]. 臨床肝膽病雜志, 2022, 38(4): 743-747. DOI: 10.3969/j.issn.1001-5256.2022.04.002.
[3]ROBINSON SM, MANN DA. Role of nuclear factor kappaB in liver health and disease[J]. Clin Sci (Lond), 2010, 118(12): 691-705. DOI: 10.1042/CS20090549.
[4]TAN P, DONG X, MAI K, et al. Vegetable oil induced inflammatory response by altering TLR-NF-κB signalling, macrophages infiltration and polarization in adipose tissue of large yellow croaker (Larimichthys crocea)[J]. Fish Shellfish Immunol, 2016, 59: 398-405. DOI: 10.1016/j.fsi.2016.11.009.
[5]ZAHID A, LI B, KOMBE A, et al. Pharmacological inhibitors of the NLRP3 inflammasome[J]. Front Immunol, 2019, 10: 2538. DOI: 10.3389/fimmu.2019.02538.
[6]HE M, TAN B, VASAN K, et al. SIRT1 and AMPK pathways are essential for the proliferation and survival of primary effusion lymphoma cells[J]. J Pathol, 2017, 242(3): 309-321. DOI: 10.1002/path.4905.
[7]VILLALBA JM, ALCAN FJ. Sirtuin activators and inhibitors[J]. Biofactors, 2012, 38(5): 349-359. DOI: 10.1002/biof.1032.
[8]
TANG HH, LI HL, LI YX, et al. Protective effects of a traditional Chinese herbal formula Jiang-Xian HuGan on Concanavalin A-induced mouse hepatitis via NF-κB and Nrf2 signaling pathways[J]. J Ethnopharmacol, 2018, 217: 118-125. DOI: 10.1016/j.jep.2018.02.003.
[9]LIU HM. Study on MSCs treatment of AIH by change the polarization state of macrophages in mice[D]. Tianjing: Tianjin Medical University, 2019.
劉會敏. MSCs通過改變巨噬細胞極化狀態治療AIH小鼠的實驗研究[D]. 天津: 天津醫科大學, 2019.
[10]KIM W, KHAN SK, GVOZDENOVIC-JEREMIC J, et al. Hippo signaling interactions with Wnt/β-catenin and Notch signaling repress liver tumorigenesis[J]. J Clin Invest, 2017, 127(1): 137-152. DOI: 10.1172/JCI88486.
[11]GUO P, WANG Z, ZHOU Z, et al. Immuno-hippo: Research progress of the hippo pathway in autoimmune disease[J]. Immunol Lett, 2021, 230: 11-20. DOI: 10.1016/j.imlet.2020.12.006.
[12]MURAKAMI S, SHAHBAZIAN D, SURANA R, et al. Yes-associated protein mediates immune reprogramming in pancreatic ductal adenocarcinoma[J]. Oncogene, 2017, 36(9): 1232-1244. DOI: 10.1038/onc.2016.288.
[13]ZHANG K, LI J, SHI Z, et al. Ginsenosides regulates innate immunity to affect immune microenvironment of AIH through Hippo-YAP/TAZ signaling pathway[J]. Front Immunol, 2022, 13: 851560. DOI: 10.3389/fimmu.2022.851560.
[14]LI S, MA LJ. Role of JAK/STAT signal pathway in Con A-induced autoimmune hepatitis[J]. Progress in Biochemistry and Biophysics, 2016, 43(12): 1139-1145. DOI: 10.16476/j.pibb.2016.0204.
李莎, 馬麗杰. JAK/STAT信號通路在刀豆蛋白A誘導的自身免疫性肝炎中的作用[J]. 生物化學與生物物理進展, 2016, 43(12): 1139-1145. DOI: 10.16476/j.pibb.2016.0204.
[15]HONG F, JARUGA B, KIM WH, et al. Opposing roles of STAT1 and STAT3 in T cell-mediated hepatitis: regulation by SOCS[J]. J Clin Invest, 2002, 110(10): 1503-1513. DOI: 10.1172/JCI15841.
[16]JARUGA B, HONG F, SUN R, et al. Crucial role of IL-4/STAT6 in T cell-mediated hepatitis: up-regulating eotaxins and IL-5 and recruiting leukocytes[J]. J Immunol, 2003, 171(6): 3233-3244. DOI: 10.4049/jimmunol.171.6.3233.
[17]
ERTA M, QUINTANA A, HIDALGO J. Interleukin-6, a major cytokine in the central nervous system[J]. Int J Biol Sci, 2012, 8(9): 1254-1266. DOI: 10.7150/ijbs.4679.
[18]HANADA M, FENG J, HEMMINGS BA. Structure, regulation and function of PKB/AKT—a major therapeutic target[J]. Biochim Biophys Acta, 2004, 1697(1-2): 3-16. DOI: 10.1016/j.bbapap.2003.11.009.
[19]HAO JH, LI ZC, SUN WL. Network analysis and experimental verification of tanshinone ⅡA in treatment of autoimmune hepatitis[J]. J Army Med Univ, 2022, 44(10): 1033-1040. DOI: 10.16016/j.2097-0927.202111049.
郝健亨, 李振城, 孫薇麗. 丹參酮ⅡA治療自身免疫性肝炎的網絡分析及實驗驗證[J]. 陸軍軍醫大學學報, 2022, 44(10): 1033-1040. DOI: 10.16016/j.2097-0927.202111049.
[20]LIU P, CHENG H, ROBERTS TM, et al. Targeting the phosphoinositide 3-kinase pathway in cancer[J]. Nat Rev Drug Discov, 2009, 8(8): 627-644. DOI: 10.1038/nrd2926.
[21]
WANG M, ZHANG J, ZHANG J, et al. Methyl eugenol attenuates liver ischemia reperfusion injury via activating PI3K/Akt signaling[J]. Int Immunopharmacol, 2021, 99: 108023. DOI: 10.1016/j.intimp.2021.108023.
[22]SHEN Y, SHEN X, CHENG Y, et al. Myricitrin pretreatment ameliorates mouse liver ischemia reperfusion injury[J]. Int Immunopharmacol, 2020, 89(Pt A): 107005. DOI: 10.1016/j.intimp.2020.107005.
[23]ZHENG L, LI Z, LING W, et al. Exosomes derived from dendritic cells attenuate liver injury by modulating the balance of treg and Th17 cells after ischemia reperfusion[J]. Cell Physiol Biochem, 2018, 46(2): 740-756. DOI: 10.1159/000488733.
[24]WANG C, KONG X, ZHU C, et al. Wu-tou decoction attenuates neuropathic pain via suppressing spinal astrocytic IL-1R1/TRAF6/JNK signaling[J]. Oncotarget, 2017, 8(54): 92864-92879. DOI: 10.18632/oncotarget.21638.
[25]YU Q, LIU T, LI S, et al. The protective effects of levo-tetrahydropalmatine on ConA-induced liver injury are via TRAF6/JNK signaling[J]. Mediators Inflamm, 2018, 2018: 4032484. DOI: 10.1155/2018/4032484.
[26]WANG JD, WANG HZ, ZHANG AL, et al. Recent advances in kinsenoside studies[J]. Chin Hosp Pharm J, 2015, 35(19): 1795-1798, 1802. DOI: 10.13286/j.cnki.chinhosppharmacyj.2015.19.22.
王建棟, 王紅珍, 張愛蓮, 等. 金線蓮苷研究進展[J]. 中國醫院藥學雜志, 2015, 35(19): 1795-1798, 1802. DOI: 10.13286/j.cnki.chinhosppharmacyj.2015.19.22.
[27]LIU TT. Immunosuppressive drug for autoimmune hepatitis, on dendritic cells/CD8+T cells communication[D]. Wuhan: Huazhong University of Science and Technology, 2017.
劉婷婷. 金線蓮苷靶向樹突狀細胞與CD8+T細胞的相互作用抗自身免疫性肝炎作用機制研究[D]. 武漢: 華中科技大學, 2017.
[28]DENG YF, XU QQ, CHEN TQ, et al. Kinsenoside alleviates inflammation and fibrosis in experimental NASH mice by suppressing the NF-κB/NLRP3 signaling pathway[J]. Phytomedicine, 2022, 104: 154241. DOI: 10.1016/j.phymed.2022.154241.
[29]TAN WY. Effect and molecular mechanisms of kinsenoside against autoimmune hepatitis[D]. Wuhan: Huazhong University of Science and Technology, 2016.
談婉月. 金線蓮苷治療自身免疫性肝炎的作用和分子機制研究[D]. 武漢: 華中科技大學, 2016.
[30]LI GM, LI Y. Research status of pharmacological effects of ginsenosides[J]. Chin J Clin Pharmacol, 2020, 36(8): 1024-1027. DOI: 10.13699/j.cnki.1001-6821.2020.08.024.
李貴明, 李燕. 人參皂苷藥理作用研究現狀[J]. 中國臨床藥理學雜志, 2020, 36(8): 1024-1027. DOI: 10.13699/j.cnki.1001-6821.2020.08.024.
[31]LING C, LI Y, ZHU X, et al. Ginsenosides may reverse the dexamethasone-induced down-regulation of glucocorticoid receptor[J]. Gen Comp Endocrinol, 2005, 140(3): 203-209. DOI: 10.1016/j.ygcen.2004.11.003.
[32]ZHANG KH, ZHOU ME, LI Y. Prospecting the therapeutic value of ginsenosides based on the relevant knowledge of autoimmune hepatitis[J]. J Med Res, 2021, 50(4): 137-139. DOI: 10.11969/j.issn.1673-548X.2021.04.032.
張克慧, 周蒙恩, 李勇. 基于自身免疫性肝炎的相關認識展望人參皂苷的治療價值[J]. 醫學研究雜志, 2021, 50(4): 137-139. DOI: 10.11969/j.issn.1673-548X.2021.04.032.
[33]YU Q, ZENG KW, MA XL, et al. Ginsenoside Rk1 suppresses pro-inflammatory responses in lipopolysaccharide-stimulated RAW264.7 cells by inhibiting the Jak2/Stat3 pathway[J]. Chin J Nat Med, 2017, 15(10): 751-757. DOI: 10.1016/S1875-5364(17)30106-1.
[34]SHANG J, LIU W, YIN C, et al. Cucurbitacin E ameliorates lipopolysaccharide-evoked injury, inflammation and MUC5AC expression in bronchial epithelial cells by restraining the HMGB1-TLR4-NF-κB signaling[J]. Mol Immunol, 2019, 114: 571-577. DOI: 10.1016/j.molimm.2019.09.008.
[35]MOHAMED GA, IBRAHIM S, EL-AGAMY DS, et al. Cucurbitacin E glucoside alleviates concanavalin A-induced hepatitis through enhancing SIRT1/Nrf2/HO-1 and inhibiting NF-κB/NLRP3 signaling pathways[J]. J Ethnopharmacol, 2022, 292: 115223. DOI: 10.1016/j.jep.2022.115223.
[36]JIANG HX, WU QS, LIU L, et al. Research progress on triterpenoids and their pharmacological activities of Tripterygium wilfordii[J]. Chin Tradit Patent Med, 2022, 44(4): 1223-1231. DOI: 10.3969/j.issn.1001-1528.2022.04.033.
蔣紅霞, 伍秋珊, 劉莉, 等. 雷公藤三萜類成分及其藥理活性研究進展[J]. 中成藥, 2022, 44(4): 1223-1231. DOI: 10.3969/j.issn.1001-1528.2022.04.033.
[37]ZHANG X, ZHAO W, LIU X, et al. Celastrol ameliorates inflammatory pain and modulates HMGB1/NF-κB signaling pathway in dorsal root ganglion[J]. Neurosci Lett, 2019, 692: 83-89. DOI: 10.1016/j.neulet.2018.11.002.
[38]ZHANG M, CHEN Y, YANG MJ, et al. Celastrol attenuates renal injury in diabetic rats via MAPK/NF-κB pathway[J]. Phytother Res, 2019, 33(4): 1191-1198. DOI: 10.1002/ptr.6314.
[39]WANG S, HUANG Z, LEI Y, et al. Celastrol alleviates autoimmune hepatitis through the PI3K/AKT signaling pathway based on network pharmacology and experiments[J]. Front Pharmacol, 2022, 13: 816350. DOI: 10.3389/fphar.2022.816350.
[40]PAN HH, CAO Y, HU SY, et al. Protective effect of inclusion complex of naringenin and β-cyclodextrin in acute liver injury lnduced by acetaminophen in mice[J]. J Hubei Univ Sci Technol (Med Sci), 2018, 32(1): 1-4, 6. DOI: 10.16751/j.cnki.2095-4646.2018.01.0001.
潘海華, 曹宇, 胡少洋, 等. 柚皮素-β-環糊精包合物對乙酰氨基酚致小鼠急性肝損傷的保護作用[J]. 湖北科技學院學報(醫學版), 2018, 32(1): 1-4, 6. DOI: 10.16751/j.cnki.2095-4646.2018.01.0001.
[41]ZHANG LL, YU ZJ, HE BZ. Protective effect of naringenin on a mouse model of autoimmune hepatitis by the regulation of TRAF6/JNK signaling[J]. Zhejiang J Integr Tradit Chin West Med, 2021, 31(9): 792-797, 809. DOI: 10.3969/j.issn.1005-4561.2021.09.002.
張露露, 余真君, 何寶澤. 柚皮素對自身免疫性肝炎模型小鼠保護作用及TRAF6/JNK信號通路的影響[J]. 浙江中西醫結合雜志, 2021, 31(9): 792-797, 809. DOI: 10.3969/j.issn.1005-4561.2021.09.002.
[42]LIU HY, JIANG CT, FENG J, et al. Research progress of Tanshinones[J]. Chin Pharmacol Bull, 2016, 32(12): 1643-1647. DOI: 10.3969/j.issn.1001-1978.2016.12.004.
劉慧穎, 姜長濤, 馮娟, 等. 丹參酮類化合物研究進展[J]. 中國藥理學通報, 2016, 32(12): 1643-1647. DOI: 10.3969/j.issn.1001-1978.2016.12.004.
[43]YUE S, HU B, WANG Z, et al. Salvia miltiorrhiza compounds protect the liver from acute injury by regulation of p38 and NF-κB signaling in Kupffer cells[J]. Pharm Biol, 2014, 52(10): 1278-1285. DOI: 10.3109/13880209.2014.889720.
[44]
ZHONG W, QIAN K, XIONG J, et al. Curcumin alleviates lipopolysaccharide induced sepsis and liver failure by suppression of oxidative stress-related inflammation via PI3K/AKT and NF-κB related signaling[J]. Biomed Pharmacother, 2016, 83: 302-313. DOI: 10.1016/j.biopha.2016.06.036.
[45]DONG L, TANG HH, SHEN XY, et al. Study on the mechanism of curcumin combined with Erzhi pill inhibiting concanavalin A inducing immune hepatitis in mice[J]. Lishizhen Med Mater Med Res, 2020, 31(3): 532-536. DOI: 10.3969/j.issn.1008-0805.2020.03.007.
董玲, 唐煥煥, 沈曉燕, 等. 姜黃素聯合二至丸抑制刀豆蛋白A誘導小鼠免疫性肝炎機制的研究[J]. 時珍國醫國藥, 2020, 31(3): 532-536. DOI: 10.3969/j.issn.1008-0805.2020.03.007.
收稿日期:
2022-07-15;錄用日期:2022-08-26
本文編輯:林姣

