急性乙型肝炎合并一過性再生障礙性貧血1例報告
張玉 田雨 董美麗 張瑞華 王陽 溫曉玉

關鍵詞:乙型肝炎,? 慢性; 貧血,? 再生障礙性; 膽汁淤積,? 肝內
基金項目:吉林省科技計劃項目基金(20190201065JC)
Transient aplastic anemia associated with acute hepatitis B: A case report
ZHANG Yu, TIAN Yu, DONG Meili, ZHANG Ruihua, WANG Yang, WEN Xiaoyu. (Department of Hepatology, The First Hospital of Jilin University, Changchun 130021, China)
Corresponding author:
WEN Xiaoyu, xywen@jlu.edu.cn (ORCID:0000-0003-2109-1557)
Key words:
Hepatitis B, Chronic; Anemia, Aplastic; Cholestasis, Intrahepatic
Research funding:
Foundation of Science and Technology Commission of Jilin Province(20190201065JC)
再生障礙性貧血(aplastic anemia,AA)是一組骨髓造血組織減少,造血功能衰竭,導致全血細胞減少的綜合病征[1]。目前研究[2]顯示,其發生的可能機制中T淋巴細胞介導的免疫機制占重要地位,其次遺傳因素,如端粒酶基因突變等也發揮了一定作用。可繼發于多種情況,如病毒感染、妊娠、藥物、放療或毒素等。肝炎相關再生障礙性貧血(hepatitis-associated aplastic anemia, HAAA)是AA的一種罕見的繼發原因,通常在肝炎急性發作的3個月內發生[3]。現報告1例罕見的急性乙型肝炎合并AA病例,通過抗病毒治療,病毒得到抑制后,骨髓抑制得以緩解,進一步支持了HBV感染和AA之間罕見的假定因果關系,可加深臨床醫生對HBV感染合并AA或骨髓抑制的認識。
1 病例資料
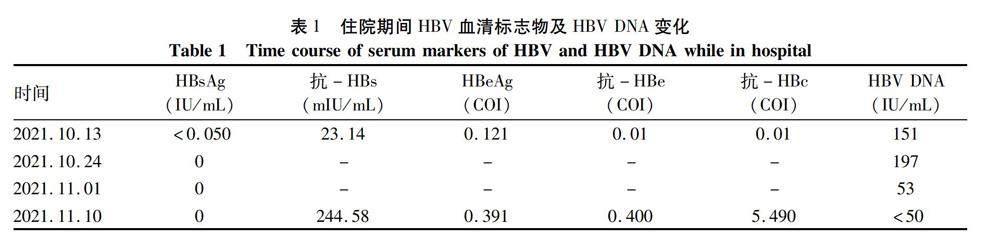
患者男性,58歲,主因“間斷發熱10天,皮膚黃染、目黃8天”于2021年10月13日入本院。10天前無誘因出現發熱、惡心,體溫最高達38.5 ℃,自行服用“撲熱息痛、快克、藿香正氣液”退熱,8天前出現皮膚黃染、目黃,于當地醫院檢查提示HBV DNA 9.46×105 IU/mL,HBsAg 5.36 IU/mL,抗-HBs 0.005 mIU/mL,HBeAg 23.9 COI,抗-HBe 59 Inh%,抗-HBc 566.7 COI;肝功能:ALT 1554 U/L,AST 344 U/L,GGT 101 U/L,TBil 309.38 μmol/L,DBil 173.77 μmol/L,Alb 29 g/L;凝血常規:PTA 27.8%,PT 30.1 s。行替諾福韋抗病毒、保肝、退黃治療7天未見好轉遂轉入本院。既往:糖尿病史10年余,未用藥。否認病毒性肝炎病史及接觸史,否認輸血史,個人史、家族史等無特殊。查體:體溫36.4 ℃,皮膚、鞏膜黃染,未見肝掌、蜘蛛痣,心肺查體正常,腹飽滿,未見腹壁靜脈曲張,肝脾肋下未觸及,移動性濁音陰性。入院后檢查示,肝功能:AST 145.1 U/L,ALT 779.4 U/L,GGT 94.0 U/L,Alb 34.4 g/L,TBil 294.6 μmol/L,DBil 167.8 μmol/L;凝血常規:PT 18.8 s,PTA 44%;血常規見圖1,HBV DNA及乙型肝炎兩對半見表1。CRP 8.89 mg/L,PCT 0.900 ng/mL。腹部MR示:肝臟形態改變,肝內信號不均。余血培養,甲、丙、戊型肝炎抗體,呼吸道感染病原體,EB病毒,巨細胞病毒抗體及核酸,細小病毒B19核酸,HIV抗原抗體,布
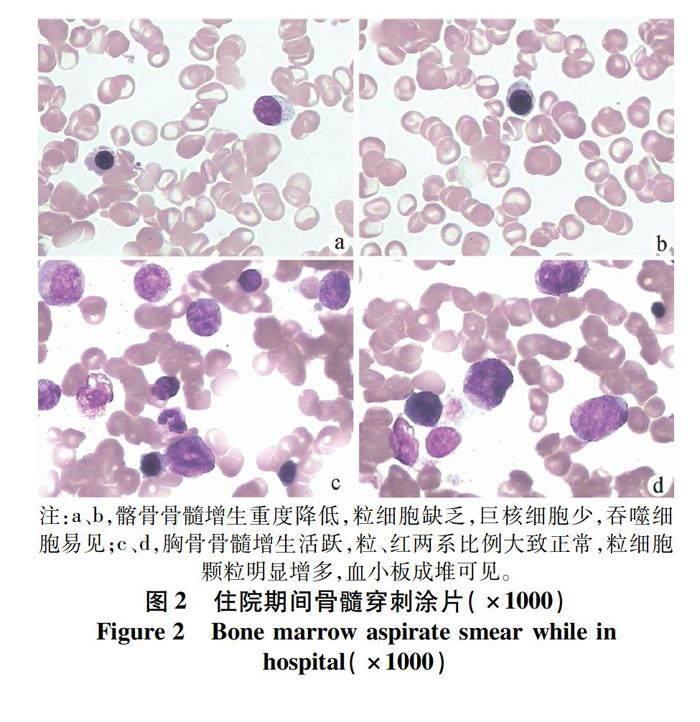
魯氏菌抗體,免疫五項,IgG4及自身免疫性肝病檢測,肺CT均未見異常。臨床診斷:病毒性肝炎,乙型,急性黃疸型。予以抗病毒、保肝、降酶、退黃等治療后,轉氨酶明顯下降,膽紅素仍進行性上升。10月20日查細胞因子示IFNγ 7 576.11 pg/mL。10月21日考慮患者存在肝內膽汁淤積,加用地塞米松磷酸鈉3 mg/d,應用7天后膽紅素明顯下降。11月4日,患者出現發熱,最高體溫38 ℃,血常規出現骨髓抑制改變(圖1)。髂后骨穿刺示骨髓增生重度減低,粒細胞缺乏,巨核細胞少,吞噬細胞易見(圖2)。血清鐵、葉酸、維生素B12、自身免疫相關檢查均未見異常。請血液科會診,考慮繼發性因素所致AA可能性大,對癥予以人粒細胞刺激因子皮下注射。11月9日之后患者無發熱,復查示IFNγ 171.07 pg/mL;復查血細胞數量、肝功能、凝血功能較前改善。胸骨骨穿刺示骨髓增生活躍(圖2)。繼續抗病毒、保肝、降酶、退黃治療后病情穩定。后續隨訪6個月,患者血象、肝功能大致正常。
2 討論
HAAA多見于男童或青年男性,在AA患者中發生率1%~5%,多發生于亞洲國家,病死率高達85%[4]。HAAA的臨床診斷需要同時滿足肝炎及AA的診斷(排除原發性AA及其他病因引起的血細胞減少癥)。此病例起病急,臨床表現為具備典型肝炎相關消化道癥狀后出現黃疸,既往無肝炎病史及家族史,發病初期基線高肝酶水平,病程中HBsAg、HBeAg、HBV DNA迅速陰轉,抗-HBs逐漸產生,滴度呈進行性升高,表明該病例為急性乙型肝炎過程[5]。患者起病1個月后,出現發熱、全血細胞減少,骨髓穿刺示骨髓增生重度減低。排除其他引起全血細胞減少的疾病,包括巨幼細胞性貧血、骨髓浸潤(由各種癌癥或骨髓纖維化引起)和骨髓增生異常綜合征或急性白血病等。根據《再生障礙性貧血診斷與治療中國專家共識(2017年版)》[6]診斷為AA。考慮到AA出現的時間,認為是繼發于急性乙型肝炎。至此,考慮該病例為在急性乙型肝炎后發生了一過性HAAA。
HAAA的病因尚不明確,回顧既往病例報道,多認為HAAA與微小B19病毒、巨細胞病毒、EB病毒等其他非嗜肝病毒有關,鮮有乙型肝炎相關HAAA的病例。Hendren等[7]描述了1例急性乙型肝炎相關HAAA的患者,在持續的抗病毒治療及免疫治療后,病情得到控制。然而作者在后續總結發現,患者白細胞及中性粒細胞升高發生在抗病毒治療后,且造血功能的恢復與免疫治療的療效并不相符。Bozkaya等[8]描述了1例乙型肝炎相關HAAA患者,該患者對免疫治療有部分反應;然而在停止免疫治療后,患者出現了復發性急性肝炎和骨髓衰竭;隨后通過抗病毒治療治愈了AA和肝炎。本例患者通過替諾福韋治療及短暫的人粒細胞刺激因子治療后,病毒性肝炎及AA均得到明顯且長期穩定的緩解。這些散在的病例支持了急性乙型肝炎與AA之間的可能的因果關系。HBV可能不是導致HAAA發病的直接因素,但確有可能加重了疾病的免疫異常和骨髓抑制,治療中兼顧抗病毒治療可能有利于造血功能恢復。
HAAA的發病機制暫不明確,目前文獻對其機制的探討如下:(1)免疫功能障礙:AA的造血干細胞損傷是由細胞毒性T淋巴細胞介導的。與非肝炎AA相比,HAAA患者外周血CD8+T淋巴細胞比例升高,CD4+/CD8+比值降低,導致分泌造血負反饋因子,誘導造血干細胞凋亡[9]。本例患者HBV急性感染活化的T淋巴細胞產生過度免疫反應,IFNγ在疾病早期呈高水平,而IFNγ本身就具有骨髓抑制作用。這也驗證了HBV感染與骨髓抑制間可能的關系。(2)遺傳因素:遺傳因素在AA的發病機制中起重要作用,如端粒酶基因突變和遺傳易感性等[10-11]。(3)病毒損傷作用:既往有試驗[12]證明,HBV可以直接侵犯骨髓造血干細胞,并且可以隨造血干細胞的增殖不斷復制,從而影響造血干細胞的增殖。(4)解毒能力下降:肝臟解毒能力下降,容易引起藥物的蓄積,藥物蓄積可能會引起骨髓抑制。結合本例患者特點,考慮骨髓抑制與HBV消除過程中的免疫反應相關,如IFNγ的升高。
降鈣素原(procalcition,PCT)已被證明是一種可靠且快速診斷早期細菌感染的指標,但在肝病患者中,PCT診斷感染的可靠性仍存在爭議。有研究[13]表明,無感染灶的肝病患者出現PCT升高是識別細胞損傷,而非細菌感染。在細菌感染的炎癥反應中,微生物表面的病原相關分子模式(PAMP)通過與被感染細胞膜或細胞質的模式識別受體結合,激活免疫反應[14],在肝細胞死亡時會釋放一系列具有免疫活性的內源性危險信號即疾病相關分子模式(DAMP)[15]。而DAMP與PAMP共享相同的傳感器和效應細胞,通過傳感器和效應細胞釋放IL-6、IL-8、TNFα,誘導免疫炎癥反應,這些細胞因子還可以誘導其他器官釋放PCT[16]。本例患者在HBV感染后PCT持續高于正常值,且未發現感染的證據,也證實PCT的升高與大量肝細胞損傷有關。
HAAA是乙型肝炎罕見且嚴重的并發癥之一,本病例與既往相關報道[7,17]相似,在乙型肝炎發病過程中出現了發熱,全血細胞減少,淋巴細胞比例增高,骨髓增生抑制的情況。本病例的診治過程進一步支持了HBV感染和AA之間假定的因果關系,對臨床具有重要意義。
倫理學聲明:本例報告已獲得患者知情同意。
利益沖突聲明:所有作者均聲明不存在利益沖突。
作者貢獻聲明:張玉負責資料分析,撰寫論文;田雨、董美麗、張瑞華參與收集并分析數據;王陽負責撰寫文章并修改文章;溫曉玉指導撰寫文章并最后定稿。
參考文獻:
[1]KILLICK SB, BOWN N, CAVENAGH J, et al. Guidelines for the diagnosis and management of adult aplastic anaemia[J]. Br J Haematol, 2016, 172(2): 187-207. DOI: 10.1111/bjh.13853.
[2]WANG L, LIU H. Pathogenesis of aplastic anemia[J]. Hematology, 2019, 24(1): 559-566. DOI: 10.1080/16078454.2019.1642548.
[3]BROWN KE, TISDALE J, BARRETT AJ, et al. Hepatitis-associated aplastic anemia[J]. N Engl J Med, 1997, 336(15): 1059-1064. DOI: 10.1056/NEJM199704103361504.
[4]MORI T, ONISHI Y, OZAWA Y, et al. Outcome of allogeneic hematopoietic stem cell transplantation in adult patients with hepatitis-associated aplastic anemia[J]. Int J Hematol, 2019, 109(6): 711-717. DOI: 10.1007/s12185-019-02644-8.
[5]ZAHNG YT, YE D, LI XY, et al. Baseline HBsAg quantitative level,dynamic changes and clinical signifi-cance of adult acute hepatitis B[J]. China Mod Doct, 2021, 59(12): 1-4, 15, 193.
張雨婷, 葉棟, 李欣予, 等. 成人急性乙型肝炎基線HBsAg定量水平、動態變化及臨床意義[J]. 中國現代醫生, 2021, 59(12): 1-4, 15, 193.
[6]Red Cell Disease (Anemia) Group, Hematology Branch, Chinese Medical Association. Chinese expert consensus on the diagnosis and treatment of aplastic anemia (2017)[J]. Chin J Hematol, 2017, 38(1): 1-5. DOI: 10.3760/cma.j.issn.0253-2727.2017.01.001.
中華醫學會血液學分會紅細胞疾病(貧血)學組. 再生障礙性貧血診斷與治療中國專家共識(2017年版)[J]. 中華血液學雜志, 2017, 38(1): 1-5. DOI: 10.3760/cma.j.issn.0253-2727.2017.01.001.
[7]HENDREN N, MOORE J, HOFMANN S, et al. Resolution of acute hepatitis B-associated aplastic anaemia with antiviral therapy[J]. BMJ Case Rep, 2017, 2017: bcr2017221503. DOI: 10.1136/bcr-2017-221503.
[8]BOZKAYA H, YURDAYDIN C, TRNER M, et al. Remission of severe aplastic anemia associated with hepatitis B virus infection after viral clearance: potential role of lamivudine[J]. Dig Dis Sci, 2002, 47(8): 1782-1785. DOI: 10.1023/a:1016444611997.
[9]IKEDA T, MORIMOTO A, NAKAMURA S, et al. A marked decrease in CD4-positive lymphocytes at the onset of hepatitis in a patient with hepatitis-associated aplastic anemia[J]. J Pediatr Hematol Oncol, 2012, 34(5): 375-377. DOI: 10.1097/MPH.0b013e31822bf699.
[10]AKRAM Z, AHMED P, KAJIGAYA S, et al. Epidemiological, clinical and genetic characterization of aplastic anemia patients in Pakistan[J]. Ann Hematol, 2019, 98(2): 301-312. DOI: 10.1007/s00277-018-3542-z.
[11]BR C, POVEDANO JM, SERRANO R, et al. Telomerase gene therapy rescues telomere length, bone marrow aplasia, and survival in mice with aplastic anemia[J]. Blood, 2016, 127(14): 1770-1779. DOI: 10.1182/blood-2015-08-667485.
[12]SHI YM, LAN YH, SHAN L, et al. The relationship between of hematopoietic stem cells and hepatitis B virus infection[J]. J Clin Hepatol, 2010, 26(4): 377-380. DOI: 10.3969/j.issn.1001-5256.2010.04.012.
石雁梅, 蘭英華, 單蕾, 等. 乙型肝炎病毒感染時的骨髓造血干細胞[J]. 臨床肝膽病雜志, 2010, 26(4): 377-380. DOI: 10.3969/j.issn.1001-5256.2010.04.012.
[13]RULE JA, HYNAN LS, ATTAR N, et al. Procalcitonin identifies cell injury, not bacterial infection, in acute liver failure[J]. PLoS One, 2015, 10(9): e0138566. DOI: 10.1371/journal.pone.0138566.
[14]ZHANG Q, RAOOF M, CHEN Y, et al. Circulating mitochondrial DAMPs cause inflammatory responses to injury[J]. Nature, 2010, 464(7285): 104-107. DOI: 10.1038/nature08780.
[15]ROH JS, SOHN DH. Damage-associated molecular patterns in inflammatory diseases[J]. Immune Netw, 2018, 18(4): e27. DOI: 10.4110/in.2018.18.e27.
[16]MATWIYOFF GN, PRAHL JD, MILLER RJ, et al. Immune regulation of procalcitonin: a biomarker and mediator of infection[J]. Inflamm Res, 2012, 61(5): 401-409. DOI: 10.1007/s00011-012-0439-5.
[17]
LAI ZX, WANG F, WANG S, et al. Acute-on-chronic liver failure with severe bone marrow suppression: A case report[J]. J Clin Hepatol, 2019, 35(9): 2050-2053. DOI: 10.3969/j.issn.1001-5256.2019.09.034.
賴長祥, 王方, 王松, 等. 慢加急性肝衰竭合并嚴重骨髓抑制1例報告[J]. 臨床肝膽病雜志, 2019, 35(9): 2050-2053. DOI: 10.3969/j.issn.1001-5256.2019.09.034.
收稿日期:
2022-08-03;錄用日期:2022-09-20
本文編輯:林姣

