慢性乙型肝炎與HBV相關慢加急性肝衰竭患者血漿外泌體差異miRNA的生物信息學分析
張舒陽 畢研貞 劉守勝 柳盛 辛永寧
摘要:目的探討慢性乙型肝炎(CHB)患者與HBV相關慢加急性肝衰竭(HBV-ACLF)患者血漿外泌體microRNA(miRNA)表達譜差異,分析其功能及生物學過程,以期獲得可用于HBV-ACLF臨床診斷的參考依據。方法選取2021年10月—2022年6月青島市市立醫院感染科住院的6例CHB患者及青島市第六人民醫院血液凈化中心接受治療的6例HBV-ACLF患者。運用Illumina高通量測序技術對這些患者的血漿外泌體miRNA進行檢測,篩選差異miRNA并進行功能富集分析,分析其參與的生物學過程。檢測得到的外泌體差異miRNA以倍數上調>2倍或下調>2倍且P<0.05為標準篩選。計量資料兩組間比較采用Mann-Whitney U秩和檢驗。計數資料兩組間比較采用χ2檢驗。結果篩選差異miRNA共249種,與CHB組相比,HBV-ACLF組上調miRNA 126種,下調miRNA 123種。生物信息學分析結果顯示,這些差異表達miRNA主要參與了性腺發育、調控蛋白質穩定性、細胞對外界刺激反應等生物學過程,并與乙型肝炎、蛋白多糖在癌癥中的作用、調節干細胞多能性、MAPK、Hippo、TNF、脂質代謝等信號通路密切相關。結論通過Illumina高通量測序技術篩選出的差異miRNA可能作為HBV-ACLF早期診斷及預后判斷的生物標志物。
關鍵詞:乙型肝炎, 慢性; 慢加急性肝功能衰竭; 外泌體; 微RNAs
基金項目:國家自然科學基金(82202416);北京肝膽相照公益基金會人工肝專項基金(RGGJJ-2021-030)
Differentially expressed microRNAs in plasma exosomes from patients with chronic hepatitis B or hepatitis B virus-related acute-on-chronic liver failure: A bioinformatics analysis
ZHANG ShuyangBI Yanzhen LIU Shousheng LIU Sheng XIN Yongning(1. Qingdao Clinical Medical College of Nanjing Medical University, Qingdao, Shandong 266011, China; 2. Department of Infectious Diseases, Qingdao Municipal Hospital, Qingdao, Shandong 266011, China; 3. Clinical Research Center, Qingdao Municipal Hospital, Qingdao, Shandong 266071, China; 4. Department of Blood Purification, Qingdao Sixth Peoples Hospital, Qingdao, Shandong 266033, China)
Corresponding authors:XIN Yongning, xinyongning@163.com (ORCID:0000-0002-3692-7655); LIU Sheng, lius123@163.com (ORCID:0000-0002-9485-0211)
Abstract:ObjectiveTo investigate the differences in plasma exosomal microRNA (miRNA) expression profile between patients with chronic hepatitis B (CHB) and those with hepatitis B virus-related acute-on-chronic liver failure (HBV-ACLF), as well as their functions and biological processes, and to provide a reference for the clinical diagnosis of HBV-ACLF. MethodsSix patients with CHB who were hospitalized in Department of Infectious Diseases, Qingdao Municipal Hospital, and six patients with HBV-ACLF who were treated in Blood Purification Center of Qingdao Sixth Peoples Hospital from October 2021 to June 2022 were enrolled. Illumina high-throughput sequencing was used to analyze the plasma exosomal miRNAs of these patients to obtain the differentially expressed miRNAs between the two groups. The differentially expressed miRNAs were screened, and a functional enrichment analysis was performed to identify the biological processes involving such miRNAs. The Mann-Whitney U rank sum test was used for comparison of continuous data between two groups, and the chi-square test was used for comparison of categorical data between groups. ResultsA total of 249 differentially expressed exosomal miRNAs were obtained according to the criteria of upregulation >2-fold or downregulation >2-fold, with P<0.05, and compared with the CHB group, there were 126 upregulated miRNAs and 123 downregulated miRNAs. The bioinformatics analysis showed that these differentially expressed miRNAs were mainly involved in the biological processes such as gonadal development, regulation of protein stability, and cellular response to external stimuli, and they were closely associated with the signaling pathways such as hepatitis B, the role of proteoglycans in cancer, regulation of stem cell pluripotency, MAPK, Hippo, TNF, and lipid metabolism. ConclusionThe differentially expressed miRNAs identified by Illumina high-throughput sequencing may be used as biomarkers for the early diagnosis and prognostic evaluation of HBV-ACLF.
Key words:Hepatitis B, Chronic; Acute-On-Chronic Liver Failure; Exosomes; MicroRNAs
Research funding:National Natural Science Foundation of China(82202416); Special Fund for Artificial Liver of Beijing Public Welfare Foundation(RGGJJ-2021-030)
據估計,中國HBV感染者占總人口的5%~6%,而感染者中有2 000萬~3 000萬例慢性乙型肝炎(CHB)患者[1]。亞太和非洲地區肝臟疾病的主要病因即為HBV感染,HBV相關慢加急性肝衰竭(HBV-ACLF)作為一種常見的復雜綜合征,因其高病死率、預后差的特點而備受關注,但HBV-ACLF臨床特征和發生發展機制尚不清楚[2],如能早期診斷便可使患者及時接受強化管理,從而降低發病率和病死率。有資料[3]顯示,外泌體中包含的miRNA在疾病狀態下的改變使其可作為多種疾病的生物標志物,且在腫瘤、感染性疾病、自身免疫性疾病等方面已取得較大進展,因此本研究探索CHB與HBV-ACLF患者血漿外泌體源性的miRNA表達譜差異,通過生物信息學分析差異表達miRNA的功能和生物學過程,以探尋可能作為HBV-ACLF早期診斷及表征預后的生物標志物,并為進一步研究發病機制提供參考依據。
1資料與方法
1.1研究對象選取2021年10月—2022年6月青島市市立醫院感染科住院的CHB患者6例及青島市第六人民醫院血液凈化中心接受治療的HBV-ACLF患者6例,診斷符合《慢性乙型肝炎防治指南(2019年版)》[4]及《肝衰竭診治指南(2018年版)》[5]。排除標準:(1)未成年人及妊娠患者;(2)HBV以外其他病因所致的肝衰竭,如自身免疫性、酒精性、藥物性及其他不明原因;(3)合并其他類型肝炎病毒感染;(4)合并惡性腫瘤或活動性消化道出血;(5)合并嚴重心、腦、腎臟疾病及其他系統性疾病。
1.2一般資料收集與標本采集及保存收集患者住院期間臨床資料及肝病相關化驗指標。采集CHB組及HBV-ACLF組研究對象空腹靜脈血標本8 mL,于4? ? ℃下3 000 r/min離心10 min,上層淡黃色透明液體則為血漿,收集后分裝到EP管中,于-80 ℃冰箱冷凍備用。
1.3血漿外泌體的提取、鑒定將500 μL血漿樣本-80 ℃取出,25 ℃水浴解凍,13 000×g、4 ℃離心10 min;按照1∶1的樣本體積加入Buffer XBP,樣本與Buffer XBP混合液轉移至 exoEasy spin column,500×g、4 ℃離心1 min,棄除底部廢液;加入3.5 mL的Buffer XWP到 exoEasy spin column中,5 000×g、4 ℃離心5 min,棄除底部廢液;轉移spin column到新的收集管中,加入200 μL Buffer XE,5 000×g、4 ℃離心5 min收集底部外泌體到1.5 mL離心管中,將提取到的外泌體沉淀分裝保存于-80 ℃冰箱。利用透射電鏡檢測外泌體的形態及大小,取外泌體樣本5 μL滴加在銅網上,室溫孵育并吸干多余液體后,于銅網上滴加一滴2%的乙酸雙氧鈾,室溫干燥后上機觀察。利用Western blot檢測外泌體表面蛋白標志物CD63、CD81、TSG101的表達和內質網蛋白Calnexin的表達。利用納米顆粒示蹤分析(NTA)進行外泌體粒子檢測,測定外泌體粒徑大小。
1.4miRNA特異文庫構建及測序分析應用TRIzol試劑提取外泌體總RNA,由上海華盈生物醫藥科技有限公司進行文庫構建及測序分析。采用The QIAseq miRNA Library Kit試劑盒通過二代測序實現穩定的miRNA特異文庫構建。通過Illumina高通量測序得到原始測序結果,使用軟件Cutadapt(version 2.7)、perl5(version 26)完成數據質控,使用軟件bowtie(version 1.3.0)將數據比對到miRBase數據庫,最終完成miRNA定量。采用R包edgeR對2組間miRNA信息進行表達差異計算,以倍數上調>2倍或下調>2倍且P<0.05為標準篩選差異miRNA。
1.5生物信息學分析使用miRTarBase數據庫對差異表達的miRNA進行靶基因預測注釋,通過Fisher精確檢驗,使用R包對得到的差異miRNA靶基因進行GO富集分析及KEGG通路富集分析。
1.6統計學方法應用SPSS 26.0軟件進行統計學分析。計量資料以M(P25~P75)表示,兩組間比較采用Mann-Whitney U秩和檢驗。計數資料兩組間比較采用χ2檢驗。P<0.05為差異有統計學意義。
2結果
2.1一般資料12例患者一般情況見表1。兩組患者間ALT、AST、TBil、DBil、PLT、PT、APTT比較差異均有統計學意義(P值均<0.05)。
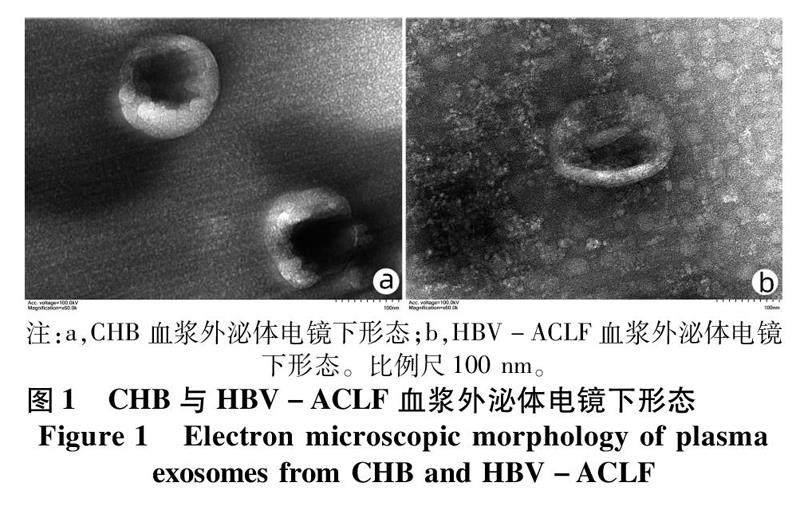
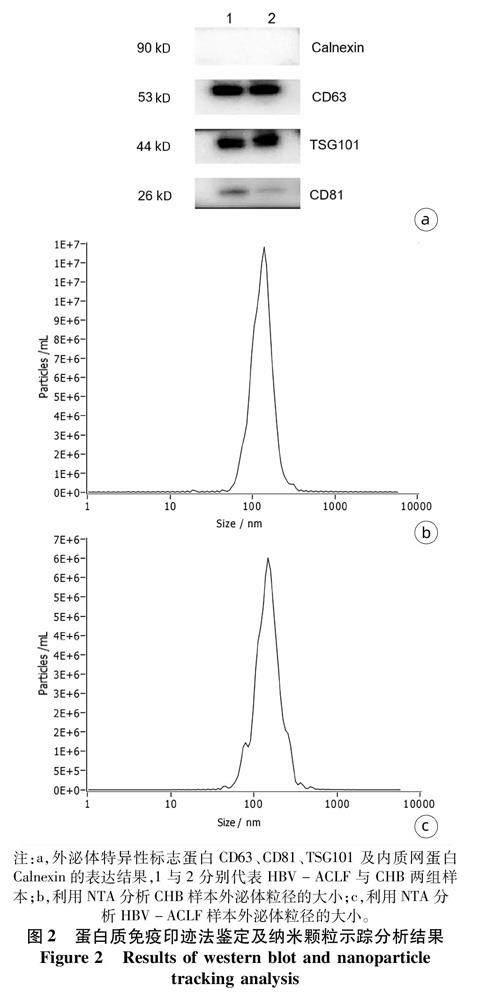
2.2血漿外泌體分離鑒定及外泌體miRNA表達譜比較利用透射電鏡、Western blot、NTA多層面鑒定外泌體。透射電鏡下可見CHB與HBV-ACLF來源外泌體均為直徑約100 nm左右的囊泡(圖1)。Western blot可檢測到膜蛋白CD63、CD81及膜結合蛋白TSG101的目的蛋白條帶,而內質網蛋白Calnexin在外泌體樣本中呈現陰性結果,符合外泌體的蛋白特征。外泌體粒子測定結果提示CHB及HBV-ACLF兩組樣本外泌體粒徑峰值分別為127.1 nm及142.5 nm(圖2),進一步提示提取物為外泌體。通過測序分析,確定miRNA差異表達譜,對得到的差異表達miRNA進行可視化(圖3)。樣本間差異表達miRNA的信號比值進行聚類(圖4),按照篩選標準共篩選出差異表達miRNA 249種,其中上調miRNA 126種,下調miRNA 123種。上調和下調最顯著的15種miRNA見表2。
2.3差異miRNA靶基因GO富集分析篩選出的249種差異表達miRNA主要參與染色質的共價修飾、分解代謝過程的正向調節、Ras蛋白信號轉導等重要的生物學過程,同時還與黏著斑、轉錄調節復合體、位單元前沿、核斑點、有被小泡、泛素連接酶復合體、早期內體、液泡膜等細胞組成密切相關,并具有DNA結合轉錄激活子活性、RNA聚合酶 Ⅱ 特異性、泛素蛋白連接酶結合、轉錄共調節因子活性、轉錄共激活因子活性、蛋白絲氨酸/蘇氨酸激酶活性等分子功能(圖5)。尤其是性腺發育、蛋白質穩定性的調節、細胞對外界刺激的反應等生物學過程與HBV-ACLF肝臟病變的進展密切相關,而細胞基質結、細胞器膜固有成分等細胞組成及分子功能的表達也共同參與肝細胞的損傷與再生。
2.4差異miRNA靶基因KEGG通路富集分析KEGG通路富集分析結果顯示這些靶基因涉及多種信號通路的調節(圖6),包括蛋白質多糖在癌癥中的作用、調節干細胞多能性、MAPK、細胞衰老、Hippo、TNF、脂質與動脈粥樣硬化、乙型肝炎、內吞作用、軸突導向等信號通路。尤其是乙型肝炎信號通路,表明這些靶基因可能通過影響細胞存活、脂質代謝、T淋巴細胞凋亡、生長因子及細胞因子等參與HBV-ACLF的發生發展(附錄A)。
3討論
近年來,外泌體在細胞間信息傳遞中的作用得到了廣泛認可。外泌體是大小為30~100 nm的雙層膜結構的細胞外囊泡,廣泛存在于包括血液、尿液、唾液等各種人體體液中,人體大多數細胞都可以產生外泌體,并參與免疫調節、細胞分化遷移、細胞間信號傳導等不同的生理功能[6-8]。而它除了作為細胞間通信維持人體正常的生理功能外,在疾病狀態下外泌體所包含成分的改變也使其作為各種疾病的生物標志物成為可能[6]。再加上外泌體具備作為生物標志物的所有特點[3],因此目前已成為極大的研究熱點并取得了很大進展。在所有外泌體包涵物中,蛋白質和miRNA是目前被認為最有潛力的生物標志物,也是被研究最多的外泌體生物標志物。有資料顯示,相對于蛋白質來說,外泌體源性的miRNA特異性更強[7],對于疾病的病理狀態反應更早且更為靈敏[8],更有潛力成為疾病的生物標志物。因此在本研究中選擇探究外泌體源性的miRNA而非蛋白質,來尋找可能作為HBV-ACLF早期診斷和預后評估的生物標志物。
本研究利用CHB與HBV-ACLF患者的血液樣本,分離血漿外泌體,運用Illumina 高通量測序進行miRNA表達譜分析,共篩選出249種外泌體差異表達miRNA,其中126種差異miRNA表現為上調,123種表現為下調。本研究結果提示CHB與HBV-ACLF患者血清中miRNA存在差異表達,有潛力成為HBV-ACLF早期診斷及判斷預后的標志物。相關研究提供了類似證據,Chen等[9]采用全基因組芯片對一對同卵雙胞胎(1名ACLF患者和1名HBV無癥狀攜帶者)外周血單個核細胞的miRNA表達譜進行比較,發現與HBV無癥狀攜帶者相比,ACLF患者hsa-let-7a和hsa-miR-16的表達上調均>8倍,表明hsa-miR-16和hsa-let-7a可能促進ACLF的發展。
在HBV-ACLF組表達上調的miRNA中,miR-122作為肝細胞基因網絡和通路的調節因子,在肝臟疾病的發生發展中發揮著重要作用[10-12]。例如肝細胞的分化[11]、調節膽固醇和脂肪酸代謝[12]等,已經成為有潛力的肝損傷生物標志物[13]。據研究[12]發現,miR-122在肝細胞癌(HCC)患者中的表達降低,通過局部引起腫瘤抑制基因Pten的下調,使得腫瘤起始細胞擴大,導致HCC的進展,并與HCC的不良預后和轉移潛力有關,屬于肝臟特異性腫瘤抑制因子[14]。也有研究[15]發現肝臟特異性miR-122通過與HCV基因組RNA的5′端非編碼區直接相互作用,可促進HCV的復制,這表明miR-122可能是抗病毒干預的重要靶點。可見miR-122參與控制多種生物過程,包括細胞分化、發育和凋亡,甚至影響病毒的復制等,涉及多種肝臟疾病的發生發展。在乙型肝炎方面,過表達的miR-122可下調MAP3K2信號通路對乙型肝炎表面抗原的遷移和分泌產生抑制作用[16],但Wen等[17]發現miR-122-3p的表達水平與HBV-ACLF患者肝臟炎癥的嚴重程度呈正相關,其表達上調可能導致HBV特異性T淋巴細胞功能受損并加強病毒持久性損傷,這有助于預測HBV-ACLF的嚴重程度,本研究與之相符的是,相較于CHB組,hsa-miR-122b-3p在HBV-ACLF組血漿中表達上調,但hsa-miR-122b-3p是否可以作為HBV-ACLF早期診斷的生物標志物,尚需做進一步的驗證。Let-7是一個龐大而古老的miRNA家族,以犧牲再生為代價發揮腫瘤抑制作用,在腫瘤中表達下調[18-19]。另外有研究[20]表明,肝硬化患者血清中let-7a-5p水平降低,且與肝纖維化嚴重程度明顯相關,其機制可能是通過肝星狀細胞中的TGF-β信號通路激活肝纖維化前過程。在肝衰竭方面,一項動物研究[21]發現,急性肝衰竭小鼠模型在加重至肝性腦病過程中由于TGF-β1信號通路的激活導致let-7f表達增加,并最終預后較差。這一發現與本研究中HBV-ACLF組血漿外泌體源性let-7b-3p呈高表達趨勢一致,但是目前未見let-7b-3p與HBV-ACLF相關的研究報道,對于let-7b-3p是否可以作為HBV-ACLF患者預后判斷的生物標志物,仍需進一步研究。
在HBV-ACLF組表達下調的miRNA中,miR-96與消化系統腫瘤及轉移瘤的發生發展關系密切[22-24]。一項動物研究[23]表明,在二乙基亞硝胺誘導的大鼠HCC模型中,miR-96在HCC組顯著上調,且研究[24]發現miR-96水平在肝臟原發性腫瘤到遠處轉移的過程中升高,說明miRNA-96可能在HCC的起始或進展中起作用。但Shi等[25]研究發現miR-96參與了葡萄籽原花青素提取物對高脂飲食誘導的小鼠模型血脂異常的調節過程,可能通過mTOR和FOXO1信號通路促進自噬通量以清除脂質積累,幫助調控體內血脂水平,減輕高脂飲食對肝臟的損傷,這對維持細胞穩態、保持器官功能和循環至關重要。ACLF患者病程中確實存在血脂代謝異常[26],本研究首次在 HBV-ACLF 患者外泌體中檢測到miR-96-3p表達下調,其表達下調是否影響血脂調控而進一步加重肝損傷,從而參與HBV- ACLF發病過程,仍需要進一步的實驗驗證。
綜上所述,本研究通過對CHB與HBV-ACLF患者血漿外泌體源性的miRNA表達譜比較分析,篩選出249種差異miRNA,利用生物信息學分析,發現這些差異miRNA主要參與性腺發育、蛋白質穩定性的調節、細胞對外界刺激的反應等生物學過程,并與乙型肝炎、蛋白多糖在癌癥中的作用、調節干細胞多能性、MAPK、Hippo、TNF、脂質代謝等信號通路密切相關。這為尋找HBV-ACLF早期診斷及表征預后的生物標志物并進一步探究發病機制提供了參考依據。
倫理學聲明:本研究方案于2021年9月9日經由青島市市立醫院醫學倫理委員會審批,批號:2021臨審字Y第017號。所有研究對象已簽署知情同意書。 利益沖突聲明:本文不存在任何利益沖突。作者貢獻聲明:張舒陽負責查閱、歸納文獻,資料分析,撰寫論文;畢研貞、劉守勝負責修改論文;柳盛負責參與血液標本收集;辛永寧負責擬定寫作思路,指導撰寫文章并最后定稿。
附錄A見二維碼
參考文獻:
[1]TANG Y, LIANG H, ZENG G, et al. Advances in new antivirals for chronic hepatitis B[J]. Chin Med J (Engl), 2022, 135(5): 571-583. DOI: 10.1097/CM9.0000000000001994.
[2]ARROYO V, MOREAU R, JALAN R. Acute-on-chronic liver failure[J]. N Engl J Med, 2020, 382(22): 2137-2145. DOI: 10.1056/NEJMra1914900.
[3]CONSOLE L, SCALISE M, INDIVERI C. Exosomes in inflammation and role as biomarkers[J]. Clin Chim Acta, 2019, 488: 165-171. DOI: 10.1016/j.cca.2018.11.009.
[4]Chinese Society of Infectious Diseases, Chinese Medical Association; Chinese Society of Hepatology, Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B(version 2019) [J]. J Clin Hepatol, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007.中華醫學會感染病學分會, 中華醫學會肝病學分會. 慢性乙型肝炎防治指南(2019年版)[J]. 臨床肝膽病雜志, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007.
[5]Liver Failure and Artificial Liver Group, Chinese Society of Infectious Diseases, Chinese Medical Association; Severe Liver Disease and Artificial Liver Group, Chinese Society of Hepatology, Chinese Medical Association. Guideline for diagnosis and treatment of liver failure( 2018) [J]. J Clin Hepatol, 2019, 35(1): 38-44. DOI: 10. 3969/j. issn. 1001-5256. 2019. 01. 007.中華醫學會感染病學分會肝衰竭與人工肝學組, 中華醫學會肝病學分會重型肝病與人工肝學組. 肝衰竭診治指南(2018年版)[J]. 臨床肝膽病雜志, 2019, 35(1): 38-44. DOI: 10.3969/j.issn.1001-5256.2019.01.007.
[6]GURUNATHAN S, KANG MH, JEYARAJ M, et al. Review of the isolation, characterization, biological function, and multifarious therapeutic approaches of exosomes[J]. Cells, 2019, 8(4): 307. DOI:? 10.3390/cells8040307.
[7]MORI MA, LUDWIG RG, GARCIA-MARTIN R, et al. Extracellular miRNAs: from biomarkers to mediators of physiology and disease[J]. Cell Metab, 2019, 30(4): 656-673. DOI: 10.1016/j.cmet.2019.07.011.
[8]ZHANG J, LI S, LI L, et al. Exosome and exosomal microRNA: trafficking, sorting, and function[J]. Genomics Proteomics Bioinformatics, 2015, 13(1): 17-24. DOI: 10.1016/j.gpb.2015.02.001.
[9]CHEN W, YAN ZH, WANG YM, et al. Genome-wide microarray-based analysis of miRNAs expression in patients with acute-on-chronic liver failure[J]. Hepatobiliary Pancreat Dis Int, 2014, 13(1): 32-39. DOI: 10.1016/s1499-3872(14)60004-7.
[10]HU J, XU Y, HAO J, et al. MiR-122 in hepatic function and liver diseases[J]. Protein Cell, 2012, 3(5): 364-371. DOI: 10.1007/s13238-012-2036-3.
[11]TANIMIZU N, KOBAYASHI S, ICHINOHE N, et al. Downregulation of miR122 by grainyhead-like 2 restricts the hepatocytic differentiation potential of adult liver progenitor cells[J]. Development, 2014, 141(23): 4448-4456. DOI: 10.1242/dev.113654.
[12]TU WL, YOU LR, TSOU AP, et al. Pten haplodeficiency accelerates liver tumor growth in miR-122a-Null mice via expansion of periportal hepatocyte-like cells[J]. Am J Pathol, 2018, 188(11): 2688-2702. DOI: 10.1016/j.ajpath.2018.07.019.
[13]KRAUSKOPF J, CAIMENT F, CLAESSEN SM, et al. Application of high-throughput sequencing to circulating microRNAs reveals novel biomarkers for drug-induced liver injury[J]. Toxicol Sci, 2015, 143(2): 268-276. DOI: 10.1093/toxsci/kfu232.
[14]BAI S, NASSER MW, WANG B, et al. MicroRNA-122 inhibits tumorigenic properties of hepatocellular carcinoma cells and sensitizes these cells to sorafenib[J]. J Biol Chem, 2009, 284(46): 32015-32027. DOI: 10.1074/jbc.M109.016774.
[15]JOPLING CL, YI M, LANCASTER AM, et al. Modulation of hepatitis C virus RNA abundance by a liver-specific microRNA[J]. Science, 2005, 309(5740): 1577-1581. DOI: 10.1126/science.1113329.
[16]CHEN S, YANG L, PAN A, et al. Inhibitory effect on the hepatitis B cells through the regulation of miR-122-MAP3K2 signal pathway[J]. An Acad Bras Cienc, 2019, 91(2): e20180941. DOI: 10.1590/0001-3765201920180941.
[17]WEN Y, PENG SF, FU L, et al. Serum levels of miRNA in patients with hepatitis B virus-associated acute-on-chronic liver failure[J]. Hepatobiliary Pancreat Dis Int, 2018, 17(2): 126-132. DOI: 10.1016/j.hbpd.2018.03.004.
[18]WU L, NGUYEN LH, ZHOU K, et al. Precise let-7 expression levels balance organ regeneration against tumor suppression[J]. Elife, 2015, 4: e09431. DOI: 10.7554/eLife.09431.
[19]MCDANIEL K, HUANG L, SATO K, et al. The let-7/Lin28 axis regulates activation of hepatic stellate cells in alcoholic liver injury[J]. J Biol Chem, 2017, 292(27): 11336-11347. DOI: 10.1074/jbc.M116.773291.
[20]MATSUURA K, AIZAWA N, ENOMOTO H, et al. Circulating let-7 levels in serum correlate with the severity of hepatic fibrosis in chronic hepatitis C[J]. Open Forum Infect Dis, 2018, 5(11): ofy268. DOI: 10.1093/ofid/ofy268.
[21]SANDHU GK, MCMILLIN M, FRAMPTON G, et al. Let-7f-dependent suppression of neuronal IGF1 by aberrant TGFβ1 signaling contributes to the neurological decline observed during acute liver failure[J]. J Gastroenterology, 2017, 152(5): S1066. DOI: 10.1016/s0016-5085(17)33601-6.
[22]YANG S, CHEN Z, FAN D, et al. Retracted Article: MiR-182-5p and miR-96-5p increased hepatocellular carcinoma cell mobility, proliferation and cisplatin resistance partially by targeting RND3[J]. RSC Adv, 2018, 8(61): 34973-34983. DOI: 10.1039/c8ra07055e.
[23]CHANDEL R, DAS A, CHAWLA YK, et al. Mo1477 Progression of hepatocellular carcinoma is associated with the up regulation of rno-miR-96/182/183 cluster in liver of wistar rats[J]. J Gastroenterology, 2016, 150(4): S1125. DOI: 10.1016/s0016-5085(16)33799-4
[24]MANDAL R, HARDIN H, BAUS R, et al. Analysis of miR-96 and miR-133a expression in gastrointestinal neuroendocrine neoplasms[J]. Endocr Pathol, 2017, 28(4): 345-350. DOI: 10.1007/s12022-017-9504-5.
[25]SHI Y, JIA M, XU L, et al. miR-96 and autophagy are involved in the beneficial effect of grape seed proanthocyanidins against high-fat-diet-induced dyslipidemia in mice[J]. Phytother Res, 2019, 33(4): 1222-1232. DOI: 10.1002/ptr.6318.
[26]BAJAJ JS, REDDY KR, O'LEARY JG, et al. Serum levels of metabolites produced by intestinal microbes and lipid moieties independently associated with acute-on-chronic liver failure and death in patients with cirrhosis[J]. Gastroenterology, 2020, 159(5): 1715-1730. e12. DOI: 10.1053/j.gastro.2020.07.019.
收稿日期:2022-12-07;錄用日期:2023-01-17
本文編輯:林姣
引證本文:ZHANG SY, BI YZ, LIU SS, et al. Differentially expressed microRNAs in plasma exosomes from patients with chronic hepatitis B or hepatitis B virus-related acute-on-chronic liver failure: A bioinformatics analysis[J]. J Clin Hepatol, 2023, 39(8): 1848-1856.

