抗真菌藥物非臨床藥效學研究技術指南
高路 甄誠 鹿輝 姜遠英
摘要:本文是抗菌藥物(包括抗細菌藥物、抗真菌藥物、抗結核菌藥物等)非臨床研究技術指南系列文章之一,是由中國藥理學會化療藥理專委會組織國內從事相關研究的專家編寫而成。本文主要針對真菌生物學特點,介紹了抗真菌藥物非臨床研究中藥效學之體外藥效學研究、體內藥效學研究、體內PK/PD研究、抗真菌作用機制研究等方面的技術要點,其中省略了體外藥效學研究中與抗細菌藥物類同的內容。期望能為抗真菌藥物非臨床藥效學研究提供參考。
關鍵詞:抗真菌藥物;非臨床藥效學評價;作用機制
中圖分類號:R978.5文獻標志碼:A
Abstract This paper is one of a series of articles on the technical guidelines of pre-clinical research of antibiotic drugs including anti-bacterial drugs, antifungal drugs, and anti-tuberculosis drugs, which is compiled by domestic experts engaged in relevant research organized by the special committee of chemotherapy pharmacology of China Pharmacological Society. According to the biological characteristics of fungi, this paper mainly introduces the technical points of pre-clinical study of antifungal drugs, including in vitro pharmacodynamics, in vivo pharmacodynamics, in vivo PK/PD and antifungal mechanisms of action. The contents of in vitro pharmacodynamics similar to those of anti-bacterial drugs are omitted. It is expected to provide a reference for the pre-Clinical Pharmacodynamics research of antifungal drugs.
Key words Antifungal drugs; Non-clinical pharmacodynamic evaluation; Mechanism of action
隨著免疫受損或免疫功能低下人群的增加,侵襲性真菌感染的發病率在近30年來一直呈上升趨勢,已成為嚴重危害人類健康的致死性疾病,病死率高達30%~50%,全球每年約有150~200萬人死于真菌感染[1]。真菌耐藥性的產生,特別是超級耐藥真菌——耳念珠菌(Candida auris)的傳播[2-3],使侵襲性真菌感染的治療面臨更大困難,急需研發新結構類型、新作用機制的抗真菌藥物。近年來,抗真菌藥物研發已引起業界的廣泛重視,但其臨床前研究尚缺乏指導性的原則,本文嘗試對抗真菌藥物非臨床研究技術要點進行綜述,并對所需的技術進行了闡述,為非臨床研究提供技術參考。
抗真菌藥物從用途上分類,包括外用于淺表真菌感染的藥物和全身應用于深部真菌感染的藥物二大類。從抗真菌作用機制上主要分為:①氮唑類藥物,通過抑制真菌CYP51,導致細胞膜麥角甾醇合成受阻發揮抗真菌作用[4],如酮康唑、咪康唑、氟康唑、伏立康唑、泊沙康唑、艾沙康唑[5]等,其中前二者主要用于淺表真菌感染,后四者主要用于深部真菌感染。②烯丙胺類藥物,通過抑制角鯊烯環氧化酶,阻礙真菌細胞膜的麥角甾醇合成發揮抗真菌作用,如特比萘芬、布替萘芬等,主要用于淺表真菌感染[6]。③多烯類藥物,通過與真菌細胞膜上的麥角甾醇結合,破壞細胞膜的屏障功能發揮抗真菌作用[7],如兩性霉素B、制霉菌素等,前者主要用于系統性感染,后者主要用于局部感染。④嘧啶類藥物,主要通過抑制嘧啶核苷的合成發揮抗真菌作用,如5-氟胞嘧啶,單用易產生耐藥性,主要與兩性霉素B或氟康唑合用治療全身性真菌感染[8]。⑤棘白菌素類藥物,通過抑制真菌細胞壁的β-(1,3)-D-葡聚糖合成酶,阻礙細胞壁的葡聚糖合成,發揮抗真菌作用,如卡泊芬凈、米卡芬凈和阿尼芬凈等,主要用于全身性念珠菌感染的治療[9]。
能使人致病的真菌主要包括:①皮膚癬菌類,如毛癬菌屬、小孢子菌屬和表皮癬菌屬等,主要引起皮膚、毛發等部位的淺表真菌感染[10]。②念珠菌屬,最常見,如白念珠菌、熱帶念珠菌、光滑念珠菌、克柔念珠菌和耳念珠菌等,可引起全身性感染或局部如消化道和泌尿生殖道黏膜感染[11]。③隱球菌屬,包括新生隱球菌和格特隱球菌,主要引起全身性真菌感染,特別是隱球菌性腦膜炎等[12]。④曲霉菌,如煙曲霉、黃曲霉和黑曲霉等,常引起免疫功能受損患者的肺部感染[13]。⑤雙相型真菌,如孢子絲菌屬、組織胞漿菌屬和球孢子菌屬等,雙相型真菌為自然界的腐生菌,是原發性真菌病的病原菌[14],除孢子絲菌多為皮膚外傷后感染外,其他主要引起呼吸道感染。⑥接合菌,比較常見的致病菌來自根霉屬、梨頭霉屬、根毛霉屬和毛霉屬,接合菌病好發于免疫受損人群,可引起皮膚和鼻竇感染[15]。⑦暗色真菌,是一類具有黑色素樣顏色的真菌,如鏈格孢、卡氏枝孢瓶霉、裴氏著色霉等,著色真菌病是一種慢性的,局限于皮膚和皮下組織的疾病,偶爾向深部組織浸潤,甚至發生系統性感染而危及生命[16]。⑧卡氏肺孢子菌,可引起免疫受損者的肺部及全身感染[1],傳統抗真菌藥物對其無效,可用磺胺類藥物如復方磺胺甲惡唑等治療[17]。
抗真菌藥物的非臨床研究內容與其他藥物相似,都包括:藥效學(包括作用機制)、一般藥理學、藥動學和毒理學研究等[18-19],主要不同之處是藥效學研究、藥動學與藥效學(pharmacokinetic/pharmacodynamics,PK/PD)研究。抗真菌藥物的非臨床研究內容與抗細菌藥物更是相似,主要是藥效學的部分研究內容有區別,本章主要介紹有區別的部分藥效學研究內容,包括體外抗真菌試驗、體內抗真菌試驗、PK/PD研究和抗真菌作用機制研究。
藥效學研究的主要內容是通過對藥物的體內外活性、體內外量效關系、作用機制和靶點等進行研究,為臨床用藥提供參考。抗真藥物的藥效學研究內容主要分為兩類,分別為體外和體內抗真菌試驗[18]。
1 體外抗真菌試驗[18]
1.1 最小抑菌濃度測定
體外抗真菌試驗反映藥物的抗真菌譜及抗真菌的效價效能等特點,通過體外抗真菌試驗,獲取最小抑菌濃度(minimal inhibitory concentration, MIC)、最小殺菌濃度(minimal bactericidal concentration, MBC)、時間殺菌曲線[21](time-killing curve)、抗生素后效應(post antibiotic effect,PAE)、聯合藥敏指數(fractional inhibitory concentration index,FICI)等數據[18,21]。這些試驗與抗細菌藥物的非臨床藥效研究內容相似,可參考抗細菌藥物的相應內容。
抗真菌非臨床藥效試驗的MIC測定[21]采用的主要方法是微量液基稀釋法,常輔以紙片法和點板法等相互佐證。測試的真菌應包括皮膚癬菌類、念珠菌、隱球菌和曲霉菌等,每種真菌應包括購自中國醫學科學院病原微生物菌(毒)種保藏中心的標準菌株、近期分離的采自不同地域、不同機構的臨床菌株和耐藥菌株,并注明出處,每種真菌測試30~80株。對其他罕見菌屬如接合菌、雙相型真菌、暗色真菌和卡氏肺孢子菌等也可委托有研究能力的專業機構做MIC/MBC測定。要盡可能全面考察化合物的抗真菌活性和抗真菌譜。
應根據抗真菌藥物自身的特點及未來擬定的臨床適應證選擇受試真菌株,適當加大未來適應證中可能涵蓋的病原真菌研究。考慮到病原真菌存在地區差異以及隨時間的耐藥性變遷等特性,入選的受試真菌應滿足以下要求:①代表性:選擇的受試真菌應盡可能來自未來可能的適應證菌株,并盡量體現其野生株的特點。②區域性:至少有3個區域的受試真菌株進行匯總分析。③近期分離:受試真菌一般應選擇近2~3年的臨床分離菌株,以反映流行病原真菌的敏感性和天然耐藥特點。一些收集困難的菌種可考慮5年內或更長時間的臨床分離菌株。應根據國際公認方法對各種受試菌進行鑒定和MIC測定。測定結果描述包括MIC范圍、MIC50和MIC90等[22]。
藥效試驗要設陽性對照,選用同類藥物中臨床一線使用的品種,沒有同類藥物的原創新藥選用臨床一線使用的品種做陽性對照,通過比較,體現出試驗藥物在抗真菌譜和效價效能方面的特色優勢。
要選擇代表性的敏感真菌株研究不同培養條件(如溫度變化)、不同培養基(如Spider培養基、RPMI1640培養基、Lee's培養基、YPD培養基;固體或液體培養基;含血清或不含血清培養基等)對化合物抗真菌活性的影響。還要注意培養基中鈣離子、鉀離子、鐵離子及不同碳源等對藥物抗真菌活性的影響。
1.2 抑制真菌菌絲形成的濃度測定
菌絲態真菌具有侵襲感染的能力,因此,除了要觀察化合物對酵母態真菌生長繁殖的影響外,還要觀察化合物在不同濃度下對真菌菌絲生長的抑制作用,分別測試化合物在Spider培養基(包括固體/液體)、Lee's培養基(包括固體/液體)、含血清1640培養基上對真菌菌絲形成的抑制作用,顯微鏡下觀察菌絲的形成情況,判定化合物抑制菌絲形成的最低濃度[23]。
1.3 抑制生物被膜的濃度測定
生物被膜形成是導致真菌多重耐藥的重要機制,也是導管相關真菌體內感染遷延不愈的重要原因,因而,抗生物被膜形成的藥物具有重要的臨床意義。要測試化合物對真菌生物被膜形成的抑制作用,先將一定數量的真菌在塑料培養板中按照生物被膜形成條件培養24 h,采用XTT法[24]或激光共聚焦顯微鏡觀察生物被膜形成的方法,觀察不同濃度化合物對真菌生物被膜生成的抑制作用和對已形成成熟生物被膜的破壞作用。
1.4 真菌耐藥性研究
抗真菌藥物在臨床廣泛應用于治療多種真菌感染,但隨著藥物長時間大范圍的應用,真菌產生耐藥性問題也日趨嚴重,在新藥臨床前評價中也要求進行耐藥性方面的研究[18]。①與臨床常用的結構類似的藥物比較,分別測定對臨床分離耐藥真菌的最低抑菌濃度MIC、MBC等,比較它們的體外抗耐藥真菌活性,了解同結構類似物有沒有交叉耐藥性。②應用防耐藥突變選擇窗理論[25],測定藥物對臨床分離真菌的防耐藥突變濃度(mutation preventive concentration,MPC)及突變選擇窗(mutant selection windows,MSW為MIC與MPC之間的濃度范圍)[26],比較新的藥物與同類藥物抗耐藥突變真菌株選擇的能力[18]。③選用3株敏感真菌株,分別與遞增濃度的測試藥物共培養30 d,觀察真菌MIC值的變化,評價藥物誘導真菌耐藥性產生的能力[27-28]。
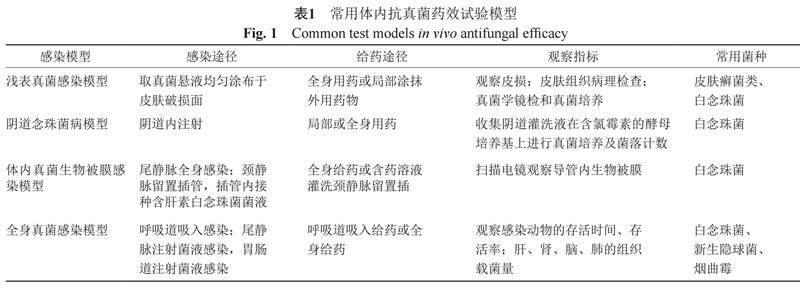
2 體內抗真菌試驗(表1)
2.1 淺表真菌感染模型
一般選用健康豚鼠建立皮膚真菌感染模型,實驗前也可全身用免疫抑制劑抑制動物的免疫功能。用脫毛劑去除豚鼠背部局部區域的毛發,用無菌砂紙打磨脫毛皮膚,以出現點狀出血為宜,用75%乙醇消毒干燥后,取預先制備的真菌懸液均勻涂布于皮膚破損面[29-30]。動物感染5~7 d后,皮損局部出現紅斑、脫屑、糜爛和結痂,皮損取材直接鏡檢可見菌絲和孢子,皮損取材能培養出原感染真菌,皮損組織病理學檢查顯示在角質層內或在毛發周圍可見菌絲和/或孢子[30]。在感染的次日開始口服給藥或局部涂抹外用藥物治療,設陽性對照和陰性對照組。每日觀察皮損并拍照,連續觀察14 d,并在第5、8、11和14天進行皮膚組織病理檢查、真菌學鏡檢和真菌培養。比較指標包括皮損打分和真菌鏡檢及真菌培養結果[31]。
2.2 陰道念珠菌病模型
用于評價治療陰道念珠菌病藥物的療效。采用成年雌性大鼠或小鼠,皮下注射戊酸雌二醇和/或腹腔注射環磷酰胺使動物易感。制備白念珠菌混懸液,采用陰道內注射的方法造成陰道念珠菌感染。在感染造模的第2天給予藥物治療(局部或全身用藥,設高中低3個劑量),設陽性對照藥物和陰性對照組,在藥物治療后的不同時間點,采用無菌PBS 緩沖液進行陰道灌洗,收集灌洗液稀釋后在含氯霉素的酵母培養基上進行真菌培養及菌落計數。比較陰性對照組、陽性藥對照組、試驗藥物治療組菌落計數的差異,并行顯著性檢驗[32-33]。
2.3 體內真菌生物被膜感染模型
可采用導尿管模型,雌性小鼠或大鼠,留置導尿管后,通過尾靜脈全身感染白念珠菌,尿中可查到白念珠菌,10~20 d后導尿管內可見到白念珠菌生物被膜形成,可通過全身給藥或含藥溶液灌洗導尿管膀胱,觀察藥物的抗生物被膜作用。也可采用靜脈內置導管模型,采用大鼠或家兔,頸靜脈留置插管,插管內接種含肝素白念珠菌菌液形成生物被膜,可采用全身給藥或插管內灌注含藥溶液的方法觀察藥物的體內抗生物被膜作用。藥物治療結束后,在無菌環境中取出導管,用掃描電鏡觀察導管內生物被膜[34-35]。
2.4 全身真菌感染模型
用來研究抗真菌藥物對動物全身感染的保護作用, 觀察藥物保護作用的量效關系、最低起效劑量和最強藥效(效能),必要時可計算藥物保護作用的ED50(median effective dose)。一般體內試驗,是用小鼠真菌感染模型,造模后2 h或24 h再給予藥物治療,觀察藥物對感染動物的保護存活率[18]和體重變化。在進行體內試驗時,注意給藥途徑一般要與臨床擬給藥途徑一致;最好同時觀察比較藥物口服,注射時的保護作用,小鼠不便多次尾靜脈注射給藥時,可用腹腔注射或皮下注射途徑替代參考[18]。動物體內感染模型應與臨床適應癥盡量一致,如臨床擬用于肺部真菌感染,需要提供真菌經呼吸道肺部感染的模型[18,36];如臨床擬用于全身系統性真菌感染,需經小鼠尾靜脈注射致死量的真菌造成全身系統性感染模型,進行相關試驗[37-38]。人體胃腸道內常有白念珠菌定植,當人體免疫力受損或胃腸道功能紊亂時,白念珠菌可通過胃腸道經血液向全身侵襲感染,在研究抗白念珠菌藥物的藥效時,可提供白念珠菌在免疫抑制狀態下經胃腸道感染模型,考察藥物的保護作用[39]。在申報材料中,一般要求擬申請的適應癥,有相應體內藥效學試驗的支持[18]。
在體內藥效學試驗中,除了觀察感染動物的死亡率外,還要測定重要靶器官如肺、腦、肝和腎等的組織載菌量,觀察藥物降低重要靶器官組織載菌量的作用,至少設計3個給藥劑量,觀察藥物作用的量效關系。一般在小鼠感染模型上,同時考察藥物對感染死亡率和組織載菌量的影響。
3 藥動學與藥效學(PK/PD)的研究
體外試驗雖能在一定程度上反映抗真菌藥物的抗真菌活性,但由于其活性是將真菌置于固定的抗真菌藥物濃度中測得的,而體內抗真菌藥物濃度需要經過機體的吸收、分布、代謝和排泄過程,給藥后, 藥物濃度在各器官組織分布隨時間發生變化。要體現藥物在體內的動態抗真菌作用,可通過PK/PD研究[40],將藥效學參數MIC和藥動學參數AUC(area under curve)、Cmax(peak concentration)、T(血藥濃度維持時間)等結合, 找出最能反映量效關系的PK/PD參數,為制定后續臨床試驗方案、指導臨床合理用藥提供參考[18]。這部分內容可參考抗菌藥物的PK/PD研究[41]。
具體來說,由于不同種類的藥物的抗菌行為不同,因此療效評價的指標也有所不同。以上PK/PD參數之間有時高度相關,例如大劑量給藥時,不僅Cmax/MIC提高,AUC0~24/MIC和T>MIC也同樣增加,因此很難區分高劑量情況下療效改變最相關的參數。為了使3個PK/PD參數相互獨立,一些研究采用劑量分層的方法,例如將每日給藥劑量分成q1 h、q3 h、q6 h、q12 h和q24 h間隔給藥, AUC0~24/MIC不變的情況下Cmax/MIC逐漸增加,將抗菌效果和這些參數進行曲線回歸,得到與抗菌效果最為相關的PK/PD參數。如果各給藥間隔的療效無差異,則AUC0~24/MIC是評價療效的關鍵指標;如果給藥間隔加大療效升高,則Cmax/MIC是重要的評價指標;如果給藥間隔加大療效反而降低,則藥物的主要PK/PD參數是T>MIC
不同抗菌藥物抗菌行為存在較大差異,根據上述PK/PD研究結果,抗菌藥物可以分為3類。第一類稱為濃度依賴性抗菌藥物,有較長的抗菌藥物后效應(PAE),藥物濃度越高,殺菌速度和程度越大,臨床可以大劑量長間歇給藥。AUC0~24/MIC和Cmax/MIC是預測療效的主要指標,對每日一次給藥者,該參數可簡化為Cmax/MIC。
第二類為時間依賴性抗菌藥物,當給藥劑量增加到一定程度,這類藥物殺菌效果不再增加,臨床療效也不隨藥物濃度的增加而增加,且當體內藥物濃度低于MIC時細菌很快恢復生長。其中一部分藥物抗菌藥物后效應(post antibiotic effect, PAE)不明顯,該類藥物制定給藥方案時需保證足夠的有效藥物濃度持續時間,預測該類藥的主要指標是T>MIC。
第三類為時間依賴性抗菌藥物且PAE持續時間較長,抗菌藥物低于MIC后仍可以在一定時間內抑制給藥間歇細菌恢復生長,AUC0~24/MIC是評價療效的主要PK/PD指標[42]。
4 抗真菌作用機制研究[43]
研究藥物作用機制的目的是了解藥物發揮藥效作用的本質,對新抗真菌藥物進行作用機制的研究,可為抗真菌藥物的臨床合理應用、聯合使用提供依據[18]。新抗真菌藥物如果是已知作用機制藥物的結構類似物,只需進行驗證性作用機制研究,但仍要做出量效關系并與陽性藥進行對比,考察其效價、效能的差異。如果是作用機制不明的新結構類型的化合物,則要通過觀察藥物對真菌細胞結構、功能、生化代謝的影響,探索其可能的作用機制或作用通路,最好是通過化學生物學或化學基因組學[44]的方法、基因表達譜分析和信號通路分析的方法、小分子結合靶蛋白或抑制靶蛋白功能的分析方法闡明其作用靶點,為進一步的優化改造和新藥研究奠定基礎。
5 本技術指南的目的及應用范圍
本技術指南為滿足藥物臨床試驗的要求,闡明了抗真菌藥物非臨床試驗的基本技術要求,部分內容參照了抗細菌藥物的技術要求[45],有區別的地方主要是真菌生物學特點不同,真菌常現的感染部位不同,真菌有菌絲形成的特征,抗真菌藥物的作用機制不同等。本技術指南不能完全覆蓋抗真菌藥物非臨床研究可能會遇到的各種具體問題,但意在為藥品注冊申請人和非臨床試驗研究者在規劃、設計、實施和監督試驗,收集和分析試驗數據時提供必要的技術指導,使安全有效的抗真菌藥物得以更好更早地用于臨床治療。本技術指南適用于全身用藥或局部用藥的創新性抗真菌藥物的臨床前評價[46]。
參 考 文 獻
Brown G D, Denning D W, Gow N A, et al. Hidden killers: Human fungal infections[J]. Sci Transl Med, 2012, 4(165): 165rv13.
Quindós G, Marcos-Arias C, San-Millán R, et al. The continuous changes in the aetiology and epidemiology of invasive Candidiasis: From familiar Candida albicans to multiresistant Candida auris[J]. Int Microbiol, 2018, 21(3): 107-119.
Ahmad A, Spencer J E, Lockhart S R, et al. A high-throughput and rapid method for accurate identification of emerging multidrug-resistant Candida auris[J]. Mycoses, 2019, 62(6): 513-518.
Greenblatt H K, Greenblatt D J. Liver injury associated with ketoconazole: Review of the published evidence[J]. J Clin Pharmacol. 2014, 54(12): 1321-1329.
Jenks J D, Salzer H J F, Prattes J. Spotlight on isavuconazole in the treatment of invasive aspergillosis and mucormycosis: Design, development, and place in therapy[J]. Drug Des Devel Ther, 2018, 12(default): 1033-1044.
孫青龑, 劉超美. 抗真菌藥物的研究與開發[J]. 藥學進展, 2001, 25(4): 213-219.
Gray K C, Palacios D S, Dailey I, et al. Amphotericin primarily kills yeast by simply binding ergosterol[J]. Proc Natl Acad Sci U S A, 2012, 109(7): 2234-2239.
陳宏, 溫海, 徐紅, 等. 兩性霉素B和5-氟胞嘧啶的體外聯合藥敏試驗[J]. 第二軍醫大學學報, 2003, 24(4): 453-454.
張詩琪, 程德云. 棘白菌素類抗真菌藥物的臨床應用進展[J]. 醫學綜述, 2020, 26(5): 986-990.
余凡, 朱曉芳. 皮膚癬菌感染的治療進展[J]. 皮膚性病診療學雜志, 2020, 27(1): 57-60.
Xiao M, Sun Z Y, Kang M, et al. Five-year national surveillance of invasive candidiasis: species distribution and azole susceptibility from the china hospital invasive fungal surveillance net (CHIF-NET) study[J]. J Clin Microbiol, 2018, 56(7): e00577-18.
Park B J, Wannemuehler K A, Marston B J, et al. Estimation of the current global burden of cryptococcal meningitis among persons living with HIV/AIDS[J]. AIDS, 2009, 23(4): 525-530.
K?hler J R, Hube B. Fungi that infect humans[J]. Microbiol Spectr, 2017, 5(3): 1-29.
Cleare L G, Zamith-Miranda D, Nosanchuk J D. Heat shock proteins in histoplasma and paracoccidioides[J]. Clin Vaccine Immunol, 2017, 24(11): e00221-17.
Ribes J A, Vanover-Sams C L, Baker D J. Zygomycetes in human disease[J]. Clin Microbiol Rev, 2000, 13(2): 236-301.
Kauffman C A, Pappas P G, Patterson T F. Fungal infections associated with contaminated methylprednisolone injections[J]. N Engl J Med, 2013, 368(26): 2495-2500.
孫培培, 童朝暉. 肺孢子菌肺炎的診斷和治療進展[J]. 中華結核和呼吸雜志, 2012, (10): 775-776.
胡曉敏, 孫濤. 抗菌藥物非臨床研究的考慮[J]. 中國臨床藥理學雜志, 2008, (4): 382-384.
王慶利. 我國藥物非臨床研究評價指導原則體系構建與發展[J]. 中國新藥雜志, 2014, 23(22): 2607-2610, 2658.
楊萬鎮, 涂杰, 盛春泉, 等. 體外抗真菌活性測試[J]. Bio-protocol, 2021, doi: 10.21769/BioProtoc.1010851.
The Clinical and Laboratory Standards Institute(CLSI), Performance Standards for Antimicrobial[S]. Susceptibility Testing, 31st. Edition. https://clsi.org/about/press-releases/clsi-publishes-m100-performance-standards-for-antimicrobial-susceptibility-testing-31st-edition.
國家食品藥品監督管理總局. 抗菌藥物藥代動力學/藥效學研究技術指導原則[EB/OL]. (2017-08-21)[2022-3-1].https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/ggtg/qtggtg/20170821170301371.html.
Li P, Zou J, Dong Y, et al. Tetrandrine, a potent antifungal agent, inhibits mycelial growth and virulence of botrytis cinerea[J]. Phytopathology, 2021, 111(7): 1152-1157.
Loures F V, Levitz S M. XTT assay of antifungal activity[J]. Bio Protoc, 2015, 5(15): e1543.
Blondeau J M. New concepts in antimicrobial susceptibility testing: the mutant prevention concentration and mutant selection window approach[J]. Vet Dermatol, 2009, 20(5-6): 383-396.
Fujiwara N, Murakami K, Yoshida K, et al. Suppressive effects of 2-methacryloyloxyethyl phosphorylcholine (MPC)-polymer on the adherence of Candida species and MRSA to acrylic denture resin[J]. Heliyon, 2020, 6(6): e04211.
Carolus H, Pierson S, Munoz J F, et al. Genome-wide analysis of experimentally evolved Candida auris reveals multiple novel mechanisms of multidrug resistance[J]. mBio, 2021, 12.
Barchiesi F, Calabrese D, Sanglard D, et al. Experimental induction of fluconazole resistance in Candida tropicalis ATCC 750[J]. Antimicrob Agents Chemother, 2000, 44: 1578-1584.
吳燕, 孔健, 袁海龍, 等. 復方鹽酸特比萘芬凝膠抗皮膚癬菌感染的組織病理學療效觀察[J]. 中國真菌學雜志,? 2017, 12(5): 283-287.
李曼, 殷中瓊, 魏琴, 等. 姜射梔提取物涂膜劑對家兔人工感染真菌皮癬病的療效觀察[J]. 中國獸醫科學, 2014, 44(3): 313-319.
Pfaller M A, Diekema D J. Epidemiology of invasive candidiasis: A persistent public health problem[J]. Clin Microbiol Rev, 2007, 20(1): 133-163.
劉穎, 孫愛軍. 雌激素與外陰陰道念珠菌病[J]. 中國婦幼保健, 2005, 20(20): 3.
劉道凡, 伍啟康. 日舒安洗液聯合克霉唑治療小鼠外陰陰道念珠菌病的療效觀察[J]. 中國真菌學雜志, 2019, 14(1): 32-36.
Andes D, Nett J, Oschel P, et al. Development and characterization of an in vivo central venous catheter Candida albicans biofilm model[J]. Infect Immun, 2004, 72(10): 6023-6031.
李瑞蓮, 王倬, 杜昱光. 白色念珠菌生物被膜研究進展[J]. 微生物學報, 2017, 57(8): 1206-1218.
Wang J, Zu Q, Wang W. Analysis of factors of pulmonary fungal infection in mice in respiratory medicine department based on logistic regression analysis model and progranulin[J]. Saudi J Biol Sci, 2020, 27(2): 629-635.
王迪, 黃勁, 姚昌昊, 等. 不同品系小鼠侵襲性真菌感染動物模型的構建[J]. 貴州醫科大學學報, 2021, 46(10): 9.
Tucey T M, Verma J, Harrison P F, et al. Glucose homeostasis is important for immune cell viability during candida challenge and host survival of systemic fungal infection[J]. Cell Metab, 2018, 27(5): 988-1006.
Koh A Y, K?hler J R, Coggshall K T, et al. Mucosal damage and neutropenia are required for Candida albicans dissemination[J]. PLoS Pathog, 2008, 4(2): e35.
Craig W A. Pharmacokinetic/pharmacodynamic parameters: Rationale for antibacterial dosing of mice and men[J]. Clin Infect Dis, 1998, 26(1): 1-12.
沈愛宗, 張圣雨, 陳泳伍, 等. 抗菌藥物PK/PD理論及其臨床應用研究進展[J]. 藥學進展, 2019, 43(11): 880-884.
肖永紅. 利用抗菌藥物PK/PD優化感染治療[J]. 中國抗生素雜志, 2017, 42(12): 1033-1039.
Odds F C, Brown A J, Gow N A. Antifungal agents: Mechanisms of action[J]. Trends Microbiol, 2003, 11(6): 272-279.
De Backer M D, Van Dijck P. Progress in functional genomics approaches to antifungal drug target discovery[J]. Trends Microbiol, 2003, 11(10): 470-478
Roemer T, Boone C. Systems-level antimicrobial drug and drug synergy discovery[J]. Nat Chem Biol, 2013, 9(4): 222-231.
《抗菌藥物臨床試驗技術指導原則》寫作組. 抗菌藥物臨床試驗技術指導原則[J]. 中國臨床藥理學雜志, 2014, 30(9): 844-856.
作者簡介:高路,男,生于1998年,在讀博士研究生,主要研究方向為免疫學與病原微生物,E-mail: 2031283@tongji.edu.cn

