β-內(nèi)酰胺酶抑制劑復(fù)方制劑非臨床研究技術(shù)指南
卞星晨 黃志偉 胡付品 武曉捷 李鑫 張菁
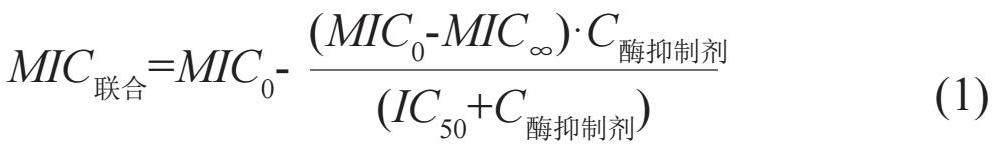


摘要:β-內(nèi)酰胺酶抑制劑復(fù)方制劑在臨床上被廣泛應(yīng)用于治療耐藥菌所致感染,由于早期β-內(nèi)酰胺酶抑制劑的抑酶譜較窄,抑酶譜更廣泛的酶抑制劑在不斷研發(fā)之中。與一般抗菌藥物臨床前研究不同,β-內(nèi)酰胺酶抑制劑復(fù)方制劑的臨床前研究需明確β-內(nèi)酰胺類藥物或酶抑制劑本身的抗菌譜與抗菌活性,尤其是明確酶抑制劑是否具有抗菌活性。需要確定合適的β-內(nèi)酰胺類藥物與酶抑制劑復(fù)方制劑,以及適用的不同酶型的目標(biāo)病原菌。本文主要介紹新型β-內(nèi)酰胺酶抑制劑復(fù)方制劑臨床前研究方法。臨床前研究階段的β-內(nèi)酰胺酶抑制劑復(fù)方制劑研究包括體外研究和體內(nèi)研究兩部分,前者主要為體外藥效學(xué)研究和體外藥動(dòng)學(xué)/藥效學(xué)(pharmacokinetic/pharmacodynamic, PK/PD)研究,常用研究方法包括β-內(nèi)酰胺類藥物和β-內(nèi)酰胺酶抑制劑復(fù)方制劑最低抑菌濃度測定、最低殺菌濃度測定、抗生素后效應(yīng)測定及時(shí)間殺菌曲線。后者主要為動(dòng)物藥動(dòng)學(xué)研究、感染動(dòng)物藥效學(xué)研究和感染動(dòng)物藥動(dòng)學(xué)/藥效學(xué)研究。在動(dòng)物藥動(dòng)學(xué)/藥效學(xué)研究中,需考慮β-內(nèi)酰胺類藥物與酶抑制劑的相互影響。這些研究方法的應(yīng)用旨在闡明β-內(nèi)酰胺酶抑制劑復(fù)方制劑兩組分藥效學(xué)特點(diǎn)、藥動(dòng)學(xué)相似與否、PK/PD指數(shù)及其臨床前PK/PD靶值,為進(jìn)入臨床試驗(yàn)階段目標(biāo)適應(yīng)癥及劑量選擇提供依據(jù)。
關(guān)鍵詞:β-內(nèi)酰胺酶抑制劑復(fù)方制劑;藥動(dòng)學(xué);藥效學(xué);藥動(dòng)學(xué)/藥效學(xué)靶值
中圖分類號:R978.1文獻(xiàn)標(biāo)志碼:A
Abstract? ? β-lactam/β-lactamase inhibitor combinations are widely used in clinical treatment of resistant bacterial infections. The early-developed β-lactamase inhibitors have narrow inhibitory spectrum, those with broader inhibitory spectrums are being developed. Different from general antimicrobials, preclinical studies of β-lactam/β-lactamase inhibitor combinations need to clarify the antimicrobial spectrum and activities of β-lactam or β-lactamase inhibitors, especially whether β-lactamase inhibitors have antimicrobial activities. Its necessary to determine the appropriate β- lactam and β-lactamase inhibitor combinations, as well as the applicable range of target pathogens with different β-lactam types. The technical guidelines mainly introduce preclinical research methods of new β-lactam/β-lactamase inhibitor combinations. Preclinical studies of β-lactam/β-lactamase inhibitor combinations include in vitro and in vivo sections. The former mainly refers to in vitro pharmacodynamics(PD)and pharmacokinetic/pharmacodynamic(PK/PD)studies. Common methods include minimum inhibitory concentration and minimum bactericidal concentration determinations, post-antibiotic effect determination and time-killing curve assay of β-lactam/β-lactamase inhibitor combinations. The latter mainly refers to PK studies in animals, PD and PK/PD studies in infected animals. In animal PK/PD studies, the interaction between β-lactams and β-lactamase inhibitors should be considered. The purpose is to elucidate the pharmacodynamic properties, pharmacokinetic similarities of β-lactam and β-lactamase inhibitor in the studied combination, and to determine the PK/PD indices and preclinical PK/PD target values, and hence to provide basis for target indications and dose selection in clinical trial.
Key words? ? β-lactam/β-lactamase inhibitor combinations;Pharmacokinetics;Pharmacodynamics;Pharmacokinetic/pharmacodynamic target values
各種β-內(nèi)酰胺酶的產(chǎn)生是絕大部分革蘭陰性菌對β-內(nèi)酰胺類抗生素耐藥的最重要機(jī)制,主要可分為絲氨酸酶(A類、C類和D類酶)和金屬酶(B類酶)兩大類。為了避免β-內(nèi)酰胺類抗生素尤其是碳青霉烯類藥物被水解而失活,β-內(nèi)酰胺類抗生素/β-內(nèi)酰胺酶抑制劑復(fù)方制劑(簡稱β-內(nèi)酰胺酶抑制劑復(fù)方制劑)應(yīng)運(yùn)而生,目的在于恢復(fù)現(xiàn)有抗菌藥物活性,保護(hù)有效的治療藥物,延長使用周期[1]。早期研發(fā)的酶抑制劑克拉維酸、他唑巴坦與舒巴坦僅能覆蓋A類酶,近年來國外已上市了頭孢洛扎-他唑巴坦(2:1)、頭孢他啶-阿維巴坦(4:1)、美羅培南-法硼巴坦(1:1)及亞胺培南-西司他丁/雷利巴坦(2:2:1)4種酶抑制劑復(fù)方制劑,覆蓋酶類擴(kuò)展到C類與D類酶[1]。我國也在加速研發(fā)新型β-內(nèi)酰胺酶抑制劑復(fù)方制劑。
抗菌藥物研發(fā)最大的特點(diǎn)是可以通過臨床前研究指導(dǎo)臨床研究。相比于單藥抗菌藥物,β-內(nèi)酰胺酶抑制劑復(fù)方制劑的臨床前研究內(nèi)容與方法均有所差異,包括明確β-內(nèi)酰胺類藥物或酶抑制劑本身抗菌譜與抗菌活性,確定合適的β-內(nèi)酰胺類藥物與酶抑制劑組合,以及適用的目標(biāo)酶型病原菌,進(jìn)行動(dòng)物體內(nèi)兩藥藥動(dòng)學(xué)(pharmacokinetics, PK)研究,評價(jià)PK相似性,在PK/PD研究中需考慮β-內(nèi)酰胺類藥物和酶抑制劑間的相互影響、兩藥聯(lián)合最佳配比等。為此,本文在國家藥品審評中心2017年頒布的《抗菌藥物藥動(dòng)學(xué)/藥效學(xué)研究技術(shù)指導(dǎo)原則》基礎(chǔ)上,結(jié)合已上市酶抑制劑復(fù)方制劑的臨床前研發(fā)公布數(shù)據(jù)及相關(guān)文獻(xiàn),著重介紹β-內(nèi)酰胺酶抑制劑復(fù)方制劑與一般抗菌藥物臨床前研究的差異性與關(guān)注點(diǎn),以期為我國新型β-內(nèi)酰胺酶抑制劑復(fù)方制劑的臨床前研發(fā)提供參考。
1 概述
1.1 β-內(nèi)酰胺酶抑制劑復(fù)方制劑臨床前研究內(nèi)容
β-內(nèi)酰胺酶抑制劑復(fù)方制劑的臨床前研究包括體外研究和體內(nèi)研究兩部分,前者主要為體外PD研究和體外PK/PD研究,常用研究方法包括最低抑菌濃度(minimum inhibitory concentration, MIC)測定、最低殺菌濃度(minimum bactericidal concentration, MBC)測定、抗生素后效應(yīng)(post-antibiotic effect, PAE)測定及時(shí)間殺菌曲線。后者主要為動(dòng)物PK研究、感染動(dòng)物PD研究和感染動(dòng)物PK/PD研究[1]。
1.2 臨床前研究目的、應(yīng)用范圍
β-內(nèi)酰胺酶抑制劑復(fù)方制劑的臨床前研究目的包括以下幾個(gè)方面:明確β-內(nèi)酰胺類藥物及酶抑制劑單獨(dú)應(yīng)用與作為復(fù)方制劑聯(lián)用時(shí)的抗菌譜、抗菌活性與最佳配比。揭示β-內(nèi)酰胺類藥物及酶抑制劑在動(dòng)物體內(nèi)的PK特征,評價(jià)兩藥聯(lián)合對感染動(dòng)物的療效,獲得兩藥PK/PD指數(shù)與靶值。
2體外研究
2.1 體外藥效學(xué)研究
本部分研究旨在明確β-內(nèi)酰胺類藥物及酶抑制劑單獨(dú)應(yīng)用與作為復(fù)方制劑聯(lián)用時(shí)的抗菌譜、抗菌活性等藥效學(xué)特征,主要評價(jià)參數(shù)、技術(shù)方法和要求及結(jié)果描述如下。
2.1.1 單藥抗菌活性
受試菌的選擇、測定的總株數(shù)、受試濃度及測定方法參見《抗菌藥物藥效學(xué)非臨床研究技術(shù)指南》[2]。
2.1.2 聯(lián)合抗菌活性
采用棋盤法開展β-內(nèi)酰胺類藥物與酶抑制劑聯(lián)合藥敏試驗(yàn)。酶抑制劑在大多數(shù)情況下無抗菌活性,無法采用部分抑菌濃度指數(shù)(fractional inhibitory concentration index, FICI)評價(jià)協(xié)同作用。可引入模型法,設(shè)計(jì)一系列β-內(nèi)酰胺類藥物與酶抑制劑的濃度梯度,獲得兩藥協(xié)同抑菌濃度后,采用inhibitory Emax模型(公式1),建立聯(lián)合方案下β-內(nèi)酰胺類藥物MIC值與酶抑制劑濃度的關(guān)系[3]。結(jié)果描述包括無酶抑制劑存在下和酶抑制劑濃度趨向無窮大時(shí)β-內(nèi)酰胺類藥物最低抑菌濃度MIC0和MIC∞,反映酶抑制劑抑酶活性的濃度比值MIC0/MIC∞,50%和90%最大抑菌作用下酶抑制劑的濃度IC50和IC90,β-內(nèi)酰胺類藥物MIC值-酶抑制劑濃度擬合效果圖等。
2.1.3 酶抑制劑對β-內(nèi)酰胺酶的體外抑制活性
選取常見β-內(nèi)酰胺酶類型,測定酶抑制劑對四類β-內(nèi)酰胺酶的體外抑制活性,包括絲氨酸酶(A類、C類和D類酶)及金屬酶(B類酶)。酶種類應(yīng)具有較高的臨床檢出率與代表性,結(jié)果描述參數(shù)為IC50值,即抑制50% β-內(nèi)酰胺酶所需酶抑制劑濃度,確定該酶抑制劑針對哪一種產(chǎn)酶菌株具有最佳抑制效果。
2.1.4 β-內(nèi)酰胺酶抑制劑復(fù)方制劑最佳配比
β-內(nèi)酰胺酶抑制劑復(fù)方制劑配比篩選一般采用棋盤法聯(lián)合藥敏試驗(yàn),兩藥以不同系列的濃度進(jìn)行混合,過夜孵育后閱讀結(jié)果,獲得兩藥最佳配比,包括固定比例配比和固定濃度配比。固定比例配比一般可涵蓋8:1、4:1、2:1、1:1[4],固定濃度時(shí)酶抑制劑濃度范圍一般為2~8 mg/L。
除體外藥效學(xué)研究,體外PK/PD模型及感染動(dòng)物PD研究也可用于以上兩藥最佳配比的篩選,以菌落數(shù)下降作為藥效學(xué)指標(biāo)。
2.1.5 β-內(nèi)酰胺類藥物最低殺菌濃度
受試菌的選擇、測定的總株數(shù)及測定方法參見《抗菌藥物藥效學(xué)非臨床研究技術(shù)指南》[2]。
2.1.6 β-內(nèi)酰胺類藥物抗生素后效應(yīng)
受試菌的選擇、測定方法參見《抗菌藥物藥效學(xué)非臨床研究技術(shù)指南》[2]。
2.1.7 時(shí)間殺菌曲線
時(shí)間殺菌曲線(time-killing curve)通常指靜態(tài)殺菌曲線,是指在β-內(nèi)酰胺類藥物及酶抑制劑單藥及聯(lián)合應(yīng)用下,選擇合適的兩藥配比,觀察藥物對受試菌的殺菌活性及殺菌速率隨濃度的變化過程。聯(lián)合方案中的藥物配比可參照“2.1.4”篩選獲得的最佳配比或固定酶抑制劑濃度。受試菌選擇、結(jié)果描述參見《抗菌藥物藥效學(xué)非臨床研究技術(shù)指南》[2]。
2.2 體外PK/PD模型
抗菌藥物體外PK/PD模型(in vitro PK/PD model)借助體外裝置模擬抗菌藥物在機(jī)體內(nèi)藥物濃度隨時(shí)間變化(藥動(dòng)學(xué)過程),在動(dòng)態(tài)藥物濃度下研究抗菌藥物對細(xì)菌的抑制或殺滅作用(藥效學(xué))。此模型可用于抗菌藥物體外PK/PD指數(shù)及靶值的制定、給藥方案的篩選,尤其適用于基于細(xì)菌耐藥機(jī)制的抗菌藥物PK/PD研究。研究持續(xù)時(shí)間取決于研究目的,對于藥物的PK/PD指數(shù)相關(guān)研究,給藥持續(xù)時(shí)間通常為1~3 d,以24 h最為多見。如研究不同給藥方案下細(xì)菌耐藥性的發(fā)生發(fā)展,給藥持續(xù)時(shí)間應(yīng)模擬臨床上該適應(yīng)證的療程,通常至少持續(xù)5~8 d。體外研究的實(shí)施有助于減少后續(xù)實(shí)驗(yàn)動(dòng)物的消耗,減小臨床試驗(yàn)的規(guī)模[5]。有關(guān)于模型分類,目標(biāo)病原菌的選擇及藥動(dòng)學(xué)模擬參考《抗菌藥物藥動(dòng)學(xué)/藥效學(xué)研究技術(shù)指導(dǎo)原則》[6]。
2.3 基于機(jī)制的PK/PD模型
獲得體外靜態(tài)或動(dòng)態(tài)殺菌實(shí)驗(yàn)數(shù)據(jù)后,可建立基于機(jī)制的PK/PD模型,用于預(yù)測不同給藥方案對目標(biāo)病原菌的殺菌效果[7]。考慮到敏感菌和耐藥菌對藥物的反應(yīng)不同,細(xì)菌通常被分為敏感和耐藥兩個(gè)亞群,模型構(gòu)成包括細(xì)菌生長、β-內(nèi)酰胺類藥物自身的殺菌作用,β-內(nèi)酰胺酶對藥物的降解,酶抑制劑對其殺菌作用的增強(qiáng),對β-內(nèi)酰胺酶的抑制作用,如酶抑制劑本身有抗菌活性也需要考慮在內(nèi)。
3 體內(nèi)研究
動(dòng)物感染模型(in vivo PK/PD model)可用于研究β-內(nèi)酰胺酶抑制劑復(fù)方制劑體內(nèi)PK特點(diǎn)、抑菌或殺菌作用,據(jù)此獲得的動(dòng)物PK/PD指數(shù)及靶值可外推至人體,其結(jié)果與臨床研究結(jié)果有較好的一致性。現(xiàn)有動(dòng)物感染模型如大腿感染、尿路感染、肺炎、腹腔感染、心內(nèi)膜炎和全身感染模型等,已用于目標(biāo)適應(yīng)證為細(xì)菌性肺炎、尿路感染、血液感染、復(fù)雜性腹腔感染和皮膚軟組織感染等抗菌新藥研發(fā)中[6]。
選擇的動(dòng)物PK/PD模型應(yīng)與β-內(nèi)酰胺酶抑制劑復(fù)方制劑可能治療的感染類型有很好的一致性。模型建立時(shí),采用的感染動(dòng)物一般為小鼠、大鼠,對于一些較復(fù)雜的模型如腦膜炎、心內(nèi)膜炎等可采用兔,且通常同時(shí)在免疫抑制感染動(dòng)物和免疫正常感染動(dòng)物體內(nèi)評價(jià)β-內(nèi)酰胺酶抑制劑復(fù)方制劑體內(nèi)活性。通過腹腔注射環(huán)磷酰胺的方法進(jìn)行免疫抑制,常用的免疫抑制鼠大腿感染模型和肺炎模型,其藥效判斷指標(biāo)明確(組織菌落計(jì)數(shù)對數(shù)值變化)、重復(fù)性好且操作簡單。藥動(dòng)學(xué)參數(shù)一般來源于血漿/血清藥物濃度,可采用微透析技術(shù)測定靶部位的藥物濃度動(dòng)態(tài)變化,比較和評價(jià)藥物在血液及靶組織中的PK/PD特性[6]。
感染菌株的選擇一般需包括標(biāo)準(zhǔn)菌株和臨床菌株、敏感菌株和耐藥菌株。對于耐藥菌株需采用分子生物學(xué)方法確定菌株攜帶的耐藥基因及產(chǎn)β-內(nèi)酰胺酶類型,明確其遺傳背景。
獲得感染動(dòng)物模型中PK/PD靶值的關(guān)鍵步驟包括β-內(nèi)酰胺酶抑制劑復(fù)方制劑給藥方案的設(shè)計(jì)、藥物體內(nèi)暴露量的準(zhǔn)確測定、藥效學(xué)指標(biāo)的選擇和體內(nèi)PK/PD指數(shù)的選擇等。
3.1 動(dòng)物PK研究
動(dòng)物PK研究內(nèi)容、要求及結(jié)果分析等詳見NMPA頒布的《藥物臨床前藥動(dòng)學(xué)研究技術(shù)指導(dǎo)原則》[8]。一般在感染動(dòng)物模型中測定β-內(nèi)酰胺類藥物及酶抑制劑在動(dòng)物體內(nèi)不同時(shí)間點(diǎn)血漿(血清)濃度,計(jì)算兩藥單藥及聯(lián)合后不同劑量和配比、不同給藥頻率給藥后動(dòng)物的PK參數(shù),比較β-內(nèi)酰胺類藥物及酶抑制劑的消除半衰期是否接近,較接近者適合作為復(fù)方制劑聯(lián)合應(yīng)用。實(shí)驗(yàn)組需設(shè)立單獨(dú)給藥組與聯(lián)合給藥組,考察兩藥之間的PK是否存在相互作用,聯(lián)合時(shí)的PK是否發(fā)生改變。當(dāng)感染狀態(tài)影響藥物在組織中的穿透性時(shí),需研究感染動(dòng)物與正常動(dòng)物PK的差異。對于使用環(huán)磷酰胺進(jìn)行免疫抑制的動(dòng)物,應(yīng)說明其對于動(dòng)物PK的可能影響。對于某些動(dòng)物組織或部位,如中樞神經(jīng)系統(tǒng)、肺和皮膚,其藥物濃度可能明顯不同于血漿/血清中的濃度,因此,除血漿/血清中藥物濃度外,建議提供該感染部位中藥物濃度數(shù)據(jù)和組織體液穿透率等。
3.2 感染動(dòng)物PD研究
本部分研究旨在篩選可獲得最佳殺菌效果的β-內(nèi)酰胺類藥物與酶抑制劑的劑量與配比。通常采用小鼠大腿或肺部感染模型,選取β-內(nèi)酰胺類藥物主要目標(biāo)適應(yīng)證覆蓋的目標(biāo)細(xì)菌,若酶抑制劑為新藥,依據(jù)體外篩選結(jié)果選取主要抑制的產(chǎn)酶類型菌株,需包含不同MIC值的細(xì)菌。實(shí)驗(yàn)組的設(shè)計(jì)分以下幾種情況:①β-內(nèi)酰胺類藥物為新藥,設(shè)立治療組(β-內(nèi)酰胺類藥物單藥及復(fù)方制劑)與對照組(未給予藥物治療者);②酶抑制劑為新藥且本身無抗菌活性,實(shí)驗(yàn)組同①,本身有抗菌活性實(shí)驗(yàn)組在①基礎(chǔ)上增加一組酶抑制劑單藥;③兩藥均為新藥,治療組應(yīng)包括兩藥單藥以及作為復(fù)方制劑應(yīng)用,另設(shè)立對照組。通常先進(jìn)行預(yù)實(shí)驗(yàn)摸索給藥劑量,給藥劑量范圍需涵蓋無效至最大藥效劑量,兩藥配比可涵蓋8:1、4:1、2:1、1:1,以不同頻率給藥,給藥后不同時(shí)間進(jìn)行感染動(dòng)物局部組織或血液中細(xì)菌菌落計(jì)數(shù),記錄感染動(dòng)物存活率/死亡率及存活天數(shù)等藥效學(xué)指標(biāo),確定最佳用藥劑量及配比。
確定最佳給藥方案后,選取更多不同種屬細(xì)菌,比較β-內(nèi)酰胺類藥物單藥及聯(lián)合酶抑制劑對各種屬目標(biāo)細(xì)菌的殺菌效果,據(jù)此進(jìn)行藥效學(xué)評價(jià)。
3.3 感染動(dòng)物PK/PD研究
該研究通過建立數(shù)學(xué)模型定量描述抗菌藥物不同給藥方案下感染動(dòng)物體內(nèi)藥物暴露量隨時(shí)間變化以及與藥效學(xué)指標(biāo)之間的關(guān)系,藥效學(xué)指標(biāo)包括動(dòng)物體內(nèi)細(xì)菌菌落計(jì)數(shù)變化、動(dòng)物存活率或死亡率,菌落計(jì)數(shù)變化由于定量方便準(zhǔn)確更常被采用。一般需要3~5株研究菌株,覆蓋主要的目標(biāo)適應(yīng)證細(xì)菌,需選取MIC較高的野生型菌株,應(yīng)覆蓋MIC50和MIC90的菌株。感染動(dòng)物模型可用于評價(jià)抗菌藥物不同給藥方案(劑量、間隔、治療天數(shù))下取得的微生物學(xué)療效(感染血液/組織中細(xì)菌菌落數(shù)降低)和治療效果(動(dòng)物存活率),劑量組設(shè)計(jì)應(yīng)涵蓋盡可能寬的范圍,更有利于Emax模型的準(zhǔn)確擬合,據(jù)此推薦預(yù)期人體內(nèi)最大殺菌效果和臨床療效的給藥方案,為后續(xù)臨床試驗(yàn)有效劑量范圍的選擇提供參考。
4 PK/PD靶值研究
4.1 β-內(nèi)酰胺類藥物單獨(dú)應(yīng)用的PK/PD靶值
設(shè)計(jì)β-內(nèi)酰胺類藥物劑量遞增和劑量分割實(shí)驗(yàn),結(jié)合該藥PK參數(shù)如Cmax、AUC0-24,蛋白結(jié)合率及受試菌MIC值,建立3個(gè)PK/PD指數(shù)fCmax/MIC、fAUC0-24/MIC和f%T>MIC與其藥效學(xué)參數(shù)(細(xì)菌菌落計(jì)數(shù)變化值,ΔLog10CFU)的藥效學(xué)模型(如Sigmoidal Emax模型,公式2)。根據(jù)相關(guān)性大小(R2)選擇代表該β-內(nèi)酰胺類藥物的最佳體外PK/PD指數(shù),多數(shù)β-內(nèi)酰胺類藥物最佳體外PK/PD指數(shù)為f%T>MIC。將細(xì)菌菌落計(jì)數(shù)對數(shù)降低不同單位時(shí)(ΔLog10CFU取值0、-1或-2,分別對應(yīng)細(xì)菌凈生長為零、細(xì)菌菌落計(jì)數(shù)降低至1/10和1/100)fCmax/MIC、fAUC0-24/MIC或f%T>MIC的對應(yīng)值作為PK/PD靶值。可合并同種菌株計(jì)算PK/PD靶值,或逐個(gè)菌株進(jìn)行分析,并對PK/PD靶值作描述性統(tǒng)計(jì)分析。結(jié)果描述中需包括細(xì)菌菌落計(jì)數(shù)變化值-PK/PD指數(shù)圖(圖1)。
其中E0為細(xì)菌基線計(jì)數(shù)值,Emax為最大殺菌效力、EC50為達(dá)最大殺菌效力一半時(shí)的PK/PD指數(shù)值、γ為希爾系數(shù)(反映曲線陡度),X為PK/PD指數(shù)值。
4.2 β-內(nèi)酰胺類藥物與酶抑制劑聯(lián)合的PK/PD靶值
為明確β-內(nèi)酰胺類藥物與酶抑制劑聯(lián)合時(shí)其PK/PD靶值是否發(fā)生改變,可開展本部分研究。一般酶抑制劑維持恒定濃度或固定劑量,β-內(nèi)酰胺類藥物依據(jù)單獨(dú)應(yīng)用時(shí)靶值制定流程[9]。
4.3 β-內(nèi)酰胺酶抑制劑的PK/PD靶值
如酶抑制劑本身對細(xì)菌具有抗菌活性(如舒巴坦對鮑曼不動(dòng)桿菌有一定抗菌活性),則參照β-內(nèi)酰胺類藥物PK/PD靶值制定流程。考慮到大部分酶抑制劑本身不具有抗菌活性,一般需聯(lián)合β-內(nèi)酰胺類藥物。β-內(nèi)酰胺類藥物以合適的固定劑量給藥,與空白對照組細(xì)菌生長相當(dāng)?shù)淖罡邉┝繛榧眩?內(nèi)酰胺類藥物劑量過大可能掩蓋酶抑制劑的劑量效應(yīng)關(guān)系[10-11]。
對酶抑制劑進(jìn)行劑量遞增和劑量分割實(shí)驗(yàn),流程參考4.1部分。由于酶抑制劑抗菌活性的多樣性,其PK/PD指數(shù)有多種可能,阿維巴坦和他唑巴坦PK/PD指數(shù)為f%T>CT,法硼巴坦和雷利巴坦PK/PD指數(shù)為fAUC0-24/MIC(此處MIC指聯(lián)合8 mg/L法硼巴坦時(shí)美羅培南MIC或聯(lián)合4 mg/L雷利巴坦時(shí)亞胺培南MIC,如有酶抑制劑人體PK研究可參考穩(wěn)態(tài)坪濃度確定其在MIC測定中的固定濃度)[11-12]。CT值為可抑制β-內(nèi)酰胺酶活性,保證β-內(nèi)酰胺類藥物不被水解的酶抑制劑濃度,也可為與藥效學(xué)參數(shù)最相關(guān)的濃度值(即相關(guān)性大小R2最高)[13]。CT值的確定:建立中空纖維感染模型,β-內(nèi)酰胺類藥物以恒定濃度恒速加入,改變酶抑制劑的濃度,依據(jù)受試細(xì)菌發(fā)生再生長時(shí)間點(diǎn)時(shí)的酶抑制劑濃度估計(jì)CT值的范圍[13];或選取數(shù)個(gè)CT值,對每一個(gè)CT值進(jìn)行模型擬合,以擬合效果最佳的濃度作為CT值[14]。
4.4 注意事項(xiàng)
β-內(nèi)酰胺酶抑制劑復(fù)方制劑PK/PD研究應(yīng)注意選擇合適范圍的劑量組。劑量選擇不宜過窄,窄劑量如果落在PK/PD指數(shù)低處,可能導(dǎo)致無法精確估計(jì)Emax(圖1-A),以至于遠(yuǎn)遠(yuǎn)高估Emax;窄劑量如果落在EC50處,可能導(dǎo)致Emax模型無法擬合(圖1-B);窄劑量如果落在PK/PD指數(shù)高處,可能導(dǎo)致無法精確估計(jì)EC50和希爾系數(shù)γ(圖1-C),導(dǎo)致EC50估計(jì)遠(yuǎn)遠(yuǎn)低于真實(shí)值。理想的Emax模型擬合圖應(yīng)能精確估計(jì)各個(gè)參數(shù)(圖1-D)。因此,除了考慮PK/PD指數(shù)與抗菌效應(yīng)的相關(guān)性,也應(yīng)注重模型參數(shù)估計(jì)的準(zhǔn)確性。
在探索β-內(nèi)酰胺酶抑制劑復(fù)方制劑的PK/PD指數(shù)時(shí),應(yīng)探索多種PK/PD指數(shù)的可能性,包括但不限于fAUC、fCmax、f%T>CT(f %T>0.25 mg/L、%T>1 mg/L、%T>4 mg/L和%T>8 mg/L等)、fAUC/MIC、fCmax/MIC等,尋找與抗菌效應(yīng)最相關(guān)的PK/PD指數(shù)[11,15]。此外,體外PK/PD模型所估計(jì)的PK/PD靶值可能與動(dòng)物研究或者臨床研究的PK/PD靶值不一致,三者之間不能完全等價(jià)。
參 考 文 獻(xiàn)
俞云松等. β-內(nèi)酰胺類抗生素/β-內(nèi)酰胺酶抑制劑復(fù)方制劑臨床應(yīng)用專家共識[J]. 中華醫(yī)學(xué)雜志, 2020, 100(10): 738-747.
李聰然,楊信怡,王秀坤等. 抗菌藥物藥效學(xué)非臨床研究技術(shù)指南[J]. 中國抗生素雜志, 2023, 48(1): 1-7.
Chauzy A, Buyck J, De Jonge B L M, et al. Pharmacodynamic modelling of beta-lactam/beta-lactamase inhibitor checkerboard data: illustration with aztreonam-avibactam[J]. Clin Microbiol Infect, 2019, 25(4): 515 e1- e4.
Livermore D M, Mushtaq S. Activity of biapenem (RPX2003) combined with the boronate beta-lactamase inhibitor RPX7009 against carbapenem-resistant Enterobacteriaceae[J]. J Antimicrob Chemother, 2013, 68(8): 1825-1831.
張菁. 藥動(dòng)學(xué)-藥效學(xué): 理論與應(yīng)用[M]. 科學(xué)出版社, 2021.
NMPA. 抗菌藥物藥代動(dòng)力學(xué)/藥效學(xué)研究技術(shù)指導(dǎo)原則 [EB/OL]. https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=000fb29bc72a100e6f266433e4d7be5c.
Chauzy A, Gaelzer Silva Torres B, Buyck J, et al. Semimechanistic pharmacodynamic modeling of aztreonam-avibactam combination to understand its antimicrobial activity against multidrug-resistant Gram-negative bacteria[J]. CPT Pharmacometrics Syst Pharmacol, 2019, 8(11): 815-824.
NMPA. 藥物非臨床藥代動(dòng)力學(xué)研究技術(shù)指導(dǎo)原則 [EB/OL]. https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=1f823fceeb386389432d22162290e61e.
Bhagwat S S, Periasamy H, Takalkar S S, et al. The novel β-lactam enhancer zidebactam augments the in vivo pharmacodynamic activity of cefepime in a neutropenic mouse lung Acinetobacter baumannii infection model[J]. Antimicrob Agents Chemother, 2019, 63(4): e02146-18.
Singh R, Kim A, Tanudra M A, et al. Pharmacokinetics/pharmacodynamics of a β-lactam and β-lactamase inhibitor combination: a novel approach for aztreonam/avibactam[J]. J Antimicrob Chemother, 2015, 70(9): 2618-2626.
Griffith D C, Sabet M, Tarazi Z, et al. Pharmacokinetics/pharmacodynamics of vaborbactam, a novel beta-lactamase inhibitor, in combination with meropenem[J]. Antimicrob Agents Chemother, 2018, 63(1): e01659-18.
Bhagunde P, Zhang Z, Racine F, et al. A translational pharmacokinetic/pharmacodynamic model to characterize bacterial kill in the presence of imipenem-relebactam[J]. Int J Infect Dis, 2019, 89: 55-61.
Coleman K, Levasseur P, Girard A M, et al. Activities of ceftazidime and avibactam against β-lactamase-producing Enterobacteriaceae in a hollow-fiber pharmacodynamic model[J]. Antimicrob Agents Chemother, 2014, 58(6): 3366-3372.
Berkhout J, Melchers Maria J, Van Mil Anita C, et al. Pharmacodynamics of ceftazidime and avibactam in neutropenic mice with thigh or lung infection[J]. Antimicrob Agents Chemother, 2016, 60(1): 368-375.
Wu J, Racine F, Wismer Michael K, et al. Exploring the pharmacokinetic/pharmacodynamic relationship of relebactam (MK-7655) in combination with imipenem in a hollow-fiber infection model[J]. Antimicrob Agents Chemother, 2018, 62(5): e02323-17.
基金項(xiàng)目:國家自然科學(xué)基金(No. 82173896)和上海市領(lǐng)軍人才(No. LJ2016-01)
作者簡介:卞星晨,女,生于1994年,主要研究方向?yàn)榭咕幬锵到y(tǒng)藥理學(xué)研究,E-mail: bxc19940216@163.com

