抗菌增敏藥藥效學(xué)非臨床研究技術(shù)指南
周紅 覃容欣
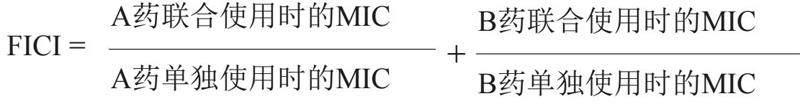

摘要:抗菌增敏藥是一類本身并不具有抗菌作用的藥物,但是其與抗菌藥物聯(lián)合應(yīng)用后可增加抗菌藥物的抗菌活性。抗菌增敏藥是抗菌藥物研究領(lǐng)域的新的研究方向,它的非臨床研究的藥效學(xué)內(nèi)容同樣包括體內(nèi)和體外兩個(gè)方面。在體外研究中,評(píng)價(jià)指標(biāo)除包括與其他單一抗菌藥物評(píng)價(jià)相同的指標(biāo)如MIC、MBC、KCs、PAE和ED50,還需要做聯(lián)合用藥后聯(lián)合抑菌指數(shù)(FICI)和聯(lián)合時(shí)間-殺菌曲線的研究。在體內(nèi)研究中,評(píng)價(jià)指標(biāo)同單一抗菌藥物評(píng)價(jià)指標(biāo),但是需要特別注意聯(lián)合用藥藥物的配伍劑量的選擇。本技術(shù)指南對(duì)抗菌增敏藥非臨床研究藥效學(xué)的內(nèi)容及方法進(jìn)行論述,旨在為抗菌增敏藥的臨床前藥效學(xué)研究提供參考。
關(guān)鍵詞:抗菌藥物增敏藥;藥效學(xué);技術(shù)指南;抗菌活性;聯(lián)合抑菌指數(shù)
中圖分類號(hào):R9文獻(xiàn)標(biāo)志碼:A
Abstract? ? Antimicrobial sensitizers refer to the drugs that do not have antibacterial effect by themselves, but can increase the antibacterial activity of the antibacterial drugs after combined application. The investigation of antimicrobial sensitizers is a new research direction in the field of antibacterial drugs, and its pharmacodynamics of non-clinical research content also includes in vivo and in vitro experiments. In addition to the evaluation indexes including MIC, MBC, KCs, PAE, and ED50, which are the same as those of other single antibacterial drugs, in vitro studies on fractional inhibitory concentration index (FICI) and combined time-killing curve after combination therapy are also required. As for in vivo studies, the evaluation criteria are the same as those for single antimicrobial drugs, but special attention needs to be paid to the selection of compatible doses for drugs combinations. The technical guidelines discuss the contents and methods of pharmacodynamics of non-clinical research study of antimicrobial sensitizers, aiming to provide a reference for preclinical pharmacodynamics study of antimicrobial sensitizers.
Key words Antibacterial sensitizer; Pharmacodynamics; Technical guidelines; Antibacterial activity; Fractional inhibitory concentration index
1 概述
1.1 抗菌藥物增敏藥的定義
目前,抗菌策略包括直接抗菌和間接抗菌策略兩種。直接抗菌策略指的是可以直接抑制細(xì)菌生長(zhǎng)甚至殺滅細(xì)菌的藥物,如臨床上常用的抗菌藥物。間接抗菌策略指的是并非直接抑制細(xì)菌生長(zhǎng)或者殺滅細(xì)菌的藥物,該類藥物需要和其他藥物聯(lián)合使用。
基于間接抗菌策略的藥物組合主要有兩類,包括:①不具有抗菌作用的藥物與抗菌藥物的聯(lián)合應(yīng)用;②均不具有抗菌作用的兩個(gè)藥物的聯(lián)合應(yīng)用。在前者中,不具有抗菌作用的藥物被稱為抗菌增敏藥(antibacterial sensitizer)[1-3]。其作用機(jī)制包括以下兩種:①該類藥物本身沒有或具有較低的抗菌活性,但是與抗菌藥物聯(lián)合使用后,可以通過改變細(xì)菌表型或抑制細(xì)菌的耐藥機(jī)制從而提高或恢復(fù)聯(lián)合使用的抗菌藥物的抗菌活性。該類藥物針對(duì)的靶標(biāo)分子是細(xì)菌耐藥機(jī)制或者細(xì)菌生長(zhǎng)過程中所必需的重要分子。目前在臨床上廣泛使用的β-內(nèi)酰胺酶抑制劑(如克拉維酸、舒巴坦、他唑巴坦、阿維巴坦)屬于抗菌增敏藥之列,該類藥物可以以共價(jià)鍵與β-內(nèi)酰胺酶結(jié)合,使得該酶破壞β-內(nèi)酰胺類抗生素的作用消失,從而使聯(lián)合使用的抗生素能夠繼續(xù)發(fā)揮抗菌作用;②本身也不具有抗菌作用,但是可以提高宿主清除細(xì)菌的能力;與抗菌藥物聯(lián)合使用后可以提高抗菌藥物的抗菌作用,因此也稱為抗菌佐劑(antibacterial adjuvant) [1-3],與目前使用的免疫調(diào)節(jié)藥的內(nèi)涵相似。
1.2 藥效學(xué)非臨床研究
本文中介紹的是抗菌增敏藥,有關(guān)抗菌增敏藥的藥效學(xué)非臨床研究?jī)?nèi)容包括體外活性評(píng)價(jià)和體內(nèi)活性評(píng)價(jià)兩方面。
1.3 目的和應(yīng)用范圍
鑒于目前國(guó)內(nèi)外尚無有關(guān)抗菌增敏藥的藥效學(xué)非臨床研究相關(guān)技術(shù)指南,因此特撰寫此文,旨在為抗菌增敏藥的新藥研究與評(píng)價(jià)提供參考。本技術(shù)指南適用于和抗菌藥物聯(lián)合使用的、針對(duì)細(xì)菌感染的抗菌增敏藥的研究,針對(duì)的是細(xì)菌而非宿主,也不包括針對(duì)結(jié)核桿菌、真菌的研究,關(guān)于β-內(nèi)酰胺酶抑制劑合劑的藥效學(xué)非臨床研究技術(shù)指南在本技術(shù)指南系列文章中有專門的文章介紹,因此本文中不再介紹。
2 主要研究?jī)?nèi)容
2.1 體外藥效學(xué)研究
在體外研究中,不同化學(xué)結(jié)構(gòu)或不同作用機(jī)制的抗菌增敏藥都采用規(guī)范而統(tǒng)一的指標(biāo)進(jìn)行評(píng)價(jià)。評(píng)價(jià)指標(biāo)除包括MIC、MBC、KCs、PAE、ED50和細(xì)菌生長(zhǎng)曲線,與單一抗菌藥物的評(píng)價(jià)指標(biāo)相同;此外,還需要進(jìn)行專門用于聯(lián)合用藥的評(píng)價(jià)指標(biāo)如聯(lián)合抑菌指數(shù)(fractional inhibitory concentration index,F(xiàn)ICI)和聯(lián)合時(shí)間-殺菌曲線的研究。有關(guān)MIC、MBC、KCs、PAE和ED50的測(cè)定在本技術(shù)指南系列文章中單一藥物的抗菌藥物藥效學(xué)非臨床研究技術(shù)指南中已經(jīng)具體敘述[4],因此本文重點(diǎn)闡述FICI和聯(lián)合時(shí)間-殺菌曲線的研究。
2.1.1 FICI的測(cè)定
在測(cè)定單獨(dú)的抗菌藥物、抗菌增敏藥的MIC的基礎(chǔ)上,進(jìn)行兩者聯(lián)合之后FICI的測(cè)定[5]。受試菌的選擇與要求同單獨(dú)的抗菌藥物一樣[4]。
聯(lián)合抑菌指數(shù)反映的是兩種藥物聯(lián)合使用后的藥效學(xué)情況。其計(jì)算公式為:
評(píng)價(jià)方案為:當(dāng)FICI≤0.5時(shí),表明兩種藥物具有協(xié)同效應(yīng)(synergy);當(dāng)0.5 體外協(xié)同作用的測(cè)定方法及評(píng)判標(biāo)準(zhǔn)化合物之間協(xié)同作用的評(píng)價(jià)方法較多,但是棋盤法、時(shí)間-殺菌曲線是其中使用最廣泛的兩種方法,其中棋盤法的操作更為簡(jiǎn)便、準(zhǔn)確。結(jié)果描述中需包括抗菌增敏藥和抗菌藥物對(duì)各種受試細(xì)菌的MIC和FICI,可參照表1格式。 與其他抗菌藥物一樣,抗菌增敏藥也要進(jìn)行MIC測(cè)定。需要注意的是,對(duì)于難以溶于水的藥物其初始最高濃度可選擇其在最大溶解條件下的濃度,然后再依次對(duì)比稀釋。 (1)棋盤法 棋盤法可測(cè)定藥物聯(lián)用對(duì)細(xì)菌生長(zhǎng)的MIC。操作如下:先在96孔板中加入待測(cè)細(xì)菌,起始濃度為1.0×105 CFU/mL[6],然后加入抗菌藥物和抗菌增敏藥。以各藥物單用時(shí)的MIC為基礎(chǔ),將抗菌藥物沿96孔平板的X軸倍比稀釋,與之聯(lián)合的抗菌增敏藥在平板的Y軸也進(jìn)行倍比稀釋(反之亦可)。這一方法是將兩藥MIC的倍比稀釋濃度在同一平板上進(jìn)行交叉配合,包含了兩藥的多種濃度組合。如果是3個(gè)及3個(gè)藥物以上聯(lián)合,則是將抗菌藥物沿96孔板一個(gè)方向倍比稀釋,另外兩個(gè)藥物(抗菌增敏藥)沿孔板另一個(gè)方向倍比稀釋。 在實(shí)驗(yàn)過程中,需要同時(shí)設(shè)立抗菌藥物和抗菌增敏藥單獨(dú)組、陽性對(duì)照組(只加細(xì)菌不加藥物的生長(zhǎng)對(duì)照組)、陰性對(duì)照組(只加培養(yǎng)基對(duì)照組)。經(jīng)過18~24 h的培養(yǎng)后進(jìn)行結(jié)果判讀,陰性孔顯示清亮,用(-)表示;陽性孔顯示混濁,用(+)表示。MIC為抑制細(xì)菌肉眼可見生長(zhǎng)的最低藥物濃度。 (2)Epsilometer測(cè)定法(E-test) E-test是體外測(cè)定抗菌藥物抗菌活性的另外一種方法。該方法是利用一條經(jīng)核準(zhǔn)的塑料長(zhǎng)條,將其浸入不同濃度的抗菌藥物溶液中,再置于接種有待測(cè)菌的瓊脂盤培養(yǎng)基中,由抑菌圈與刻度的交點(diǎn)處來判斷MIC。這一方法被應(yīng)用于許多抗菌藥物的敏感性測(cè)定試驗(yàn)中,如果實(shí)驗(yàn)條件穩(wěn)定,E-test法與其他藥敏實(shí)驗(yàn)方法(如微孔二倍稀釋法)在單藥藥敏試驗(yàn)中相關(guān)性良好。E-test法易于操作,其不足之處在于:①在不同培養(yǎng)基上,細(xì)菌的生長(zhǎng)情況可能不一致;②拖尾現(xiàn)象使MIC測(cè)定結(jié)果不明。 2.1.2 時(shí)間-殺菌曲線的測(cè)定 時(shí)間-殺菌曲線(time-killing curve)是指固定抗菌藥物的一系列濃度觀察其在不同的時(shí)相點(diǎn)對(duì)受試菌的殺菌速率和殺菌活性[7-8],在抗菌增敏藥的藥效學(xué)非臨床研究中同樣適用。受試菌一般應(yīng)覆蓋目標(biāo)適應(yīng)證的主要病原菌種。每種細(xì)菌最好包含質(zhì)控菌株、敏感株、耐藥株。 時(shí)間-殺菌曲線的測(cè)定方法同單一藥物的測(cè)定[4]。將受試菌接種于培養(yǎng)基中,接種量為1.0×106 CFU/mL。需要注意的是,除設(shè)置適當(dāng)?shù)乃幬餄舛冉M別(1×MIC、2×MIC、4×MIC、8×MIC、16×MIC)外,還應(yīng)增加相應(yīng)的藥物濃度和抗菌增敏藥配伍組,具體藥物濃度需要參考FICI的結(jié)果設(shè)置。在培養(yǎng)過程中定時(shí)取樣,通常在2、4、6、8、12和24 h取樣,恰當(dāng)比例稀釋后均勻涂布于瓊脂糖平板上進(jìn)行活菌落數(shù)或通過測(cè)定菌液的光密度(optical density,OD)值繪制時(shí)間-殺菌曲線,以評(píng)價(jià)藥物的活性。 2.2 抗菌增敏作用機(jī)制 應(yīng)盡可能明確藥物的作用機(jī)制,以支持其聯(lián)合應(yīng)用的可行性。有關(guān)其作用機(jī)制的研究思路一般首先考慮細(xì)菌對(duì)聯(lián)合應(yīng)用的抗菌藥物的耐藥機(jī)制[9],即從抗菌增敏藥對(duì)細(xì)菌耐藥機(jī)制的影響著手;同時(shí),也要考慮細(xì)菌耐藥機(jī)制外的機(jī)制,其研究思路同本技術(shù)指南系列文章中單一藥物的抗菌藥物藥效學(xué)非臨床研究[4]。 2.3 耐藥性及其機(jī)制 應(yīng)在體外模型中評(píng)估臨床分離菌株對(duì)聯(lián)合用藥配伍可能產(chǎn)生耐藥性的可能性及其機(jī)制,為將來臨床應(yīng)用奠定基礎(chǔ),其研究思路同本技術(shù)指南系列文章中單一藥物的抗菌藥物藥效學(xué)非臨床研究[4]。 2.4 體內(nèi)藥效學(xué)研究 抗菌增敏藥的體內(nèi)藥效學(xué)研究與評(píng)價(jià)單一抗菌藥物的實(shí)驗(yàn)方法一樣,根據(jù)其適應(yīng)癥選擇全身或局部感染模型[10]。本技術(shù)指南主要介紹藥物在全身細(xì)菌性感染模型中的研究方法。 目前誘發(fā)全身感染動(dòng)物模型一般采用注射途徑感染,如腹腔注射細(xì)菌、靜脈注射細(xì)菌誘導(dǎo)的感染模型。但也有不經(jīng)注射途徑,通過制造組織或器官的損傷誘導(dǎo)內(nèi)源性細(xì)菌感染導(dǎo)致的全身感染動(dòng)物模型如盲腸結(jié)扎穿孔術(shù)(cecal ligation and puncture, CLP)膿毒癥模型。CLP模型被認(rèn)為是目前最接近臨床的膿毒癥“金標(biāo)準(zhǔn)”動(dòng)物模型[11]。 2.4.1 動(dòng)物 選擇有合格證號(hào)動(dòng)物房提供的外觀健康的BALB/c或昆明種小鼠,體重18~22 g,每個(gè)劑量組動(dòng)物至少10只,雌雄各半。小鼠一般在動(dòng)物試驗(yàn)房適應(yīng)性飼養(yǎng)2~3 d后再使用。必要時(shí)可選用大鼠、豚鼠等其它動(dòng)物。 2.4.2 細(xì)菌 感染細(xì)菌原則上應(yīng)選用臨床上的耐藥菌株,如耐甲氧西林金黃色葡萄球菌、耐藥大腸埃希菌等。 2.4.3 藥物 (1)藥物及其配制:抗菌增敏藥的配制與抗菌藥物相同,稱取適量。可溶性藥物用滅菌水或培養(yǎng)基配制成相應(yīng)濃度的溶液,不建議與抗菌藥物混合配制。水溶性較差的藥物需根據(jù)藥物理化性質(zhì),先溶于溶劑(如DMSO等)中,再加水至所需濃度,但有機(jī)溶劑濃度一般不超過1%~5%,同時(shí)設(shè)溶劑對(duì)照組,注意有些藥物在DMSO里溶解度很好,但加水或培養(yǎng)基后藥物析出。有些難溶性藥物需將其顆粒磨細(xì),加入少量吐溫80、3%~5%阿拉伯膠、2%~4%淀粉或0.5%~1%羧甲基纖維素(CMC)研磨成均勻混懸液,但只能用于口服給藥,不能用于注射給藥。注射給藥的藥液配制過程中要注意無菌操作,配制好的藥液可以分裝放-80℃存放,避免反復(fù)凍融。 (2)藥物劑量選擇:抗菌增敏藥的劑量可參照藥物的體外MIC結(jié)果并經(jīng)預(yù)試驗(yàn)確定。預(yù)試驗(yàn)中,在確定了抗菌藥物劑量后(值得注意的是單獨(dú)抗菌藥物的治療效果不能太好,以免觀察不出抗菌增敏藥的效應(yīng)。一般來說,單獨(dú)使用抗菌藥物的治療率在30%左右即可),將抗菌增敏藥設(shè)為高、中和低3個(gè)劑量組,每組3~5只小鼠,組間劑量差距可先相差10倍,觀察藥物組合對(duì)小鼠的保護(hù)率。當(dāng)確定了有效范圍之后,可以縮小組間劑量差距的倍數(shù),直至找到有效的藥物劑量,要求高劑量組保護(hù)80%~100%感染動(dòng)物,低劑量組80%~100%感染動(dòng)物死亡。 (3)給藥途徑:原則上藥物給藥途徑應(yīng)與擬推薦的臨床給藥途徑一致,根據(jù)推薦的藥物臨床給藥途徑不同,可分為灌胃給藥(po)、靜脈注射(iv)和皮下注射(sc)。灌胃給藥、靜脈注射和皮下注射最大給藥體積分別為0.1~0.3 mL/10 g、0.1 mL~0.2 mL/10 g和0.1~0.3 mL/10 g。腹腔感染動(dòng)物模型不宜再進(jìn)行腹腔注射給藥治療。靜脈注射給藥一般可用皮下注射給藥代替。給藥次數(shù)和間隔應(yīng)與抗菌藥物一致。 (4)體內(nèi)保護(hù)試驗(yàn) 將18~22 g小鼠按體重隨機(jī)分組,給藥組[抗菌藥物(固定劑量)聯(lián)用抗菌增敏藥(3個(gè)劑量組)],另設(shè)感染對(duì)照組(空白對(duì)照藥組)、單獨(dú)抗菌藥物組、單獨(dú)抗菌增敏藥組(最高劑量),每組至少10只。在給予菌液感染成功后4 h,按照由低至高的劑量順序,分別口服、靜脈或皮下給藥,抗菌增敏藥與抗菌藥物同時(shí)給藥[12]。 給藥后觀察動(dòng)物的活動(dòng)和反應(yīng)情況,必要時(shí)檢查體溫、血藥、心率和體重,觀察局部反應(yīng)及其他相關(guān)指標(biāo)如血小板計(jì)數(shù)等,記錄動(dòng)物死亡時(shí)間和數(shù)量。觀察時(shí)間根據(jù)接種細(xì)菌的毒力和接種量而定,一般觀察7~14 d。發(fā)現(xiàn)動(dòng)物在觀察期內(nèi)死亡,應(yīng)立即進(jìn)行解剖;如在預(yù)定觀察時(shí)間內(nèi)動(dòng)物沒有死亡,存活動(dòng)物也應(yīng)處死并進(jìn)行解剖觀察。 體內(nèi)藥效學(xué)結(jié)果的判斷指標(biāo)較多,其中生存時(shí)間、生存率或死亡率最為重要;同時(shí)可進(jìn)行血培養(yǎng)和臟器細(xì)菌計(jì)數(shù)、病理組織檢查評(píng)等。通常觀察感染7 d內(nèi)動(dòng)物死亡數(shù),用Bliss法計(jì)算半數(shù)有效劑量(ED50)及其95%可信限,進(jìn)行統(tǒng)計(jì)學(xué)處理,并與對(duì)照藥進(jìn)行比較。資料整理可參照表2~3。 3 小結(jié)與展望 抗菌增敏藥是目前抗菌藥物研究的新領(lǐng)域,對(duì)提高現(xiàn)有抗菌藥物的抗菌活性、延遲其使用周期具有重要意義。 有關(guān)抗菌增敏藥藥效學(xué)非臨床研究技術(shù)指南考察的指標(biāo)與單獨(dú)的抗菌藥物藥效學(xué)非臨床研究技術(shù)指南相似,但是其特點(diǎn)是在研究過程中一定要選擇合適的配伍抗菌藥物。在體外研究中一定要進(jìn)行聯(lián)合抑菌指數(shù)和聯(lián)合時(shí)間-殺菌曲線的研究,在體內(nèi)實(shí)驗(yàn)中抗菌增敏藥和抗菌藥物要選擇合適的配伍劑量以體現(xiàn)抗菌增敏藥的抗菌增敏作用。此外,隨著具有新作用機(jī)制的抗菌增敏藥的發(fā)現(xiàn),為了更全面評(píng)價(jià)其作用及其分子機(jī)制,則需要依據(jù)其作用特點(diǎn)和機(jī)制建立新的評(píng)價(jià)方法以滿足新藥研究的需要。 參 考 文 獻(xiàn) Tyers M, Wright G D. Drug combinations: A strategy to extend the life of antibiotics in the 21st century[J]. Nat Rev Microbiol, 2019, 17(3): 141-155. Wright G D. Antibiotic adjuvants: Rescuing antibiotics from resistance[J]. Trends Microbiol, 2016, 24(11): 862-871. Worthington R J, Melander C. Combination approaches to combat multidrug-resistant bacteria[J]. Trends Biotechnol, 2013, 31(3): 177-184. 李聰然, 楊信怡, 王秀坤, 等. 抗菌藥物藥效學(xué)非臨床研究技術(shù)指南[J]. 中國(guó)抗生素雜志, 2023, 48(1): 1-7. Odds F C. Synergy, antagonism, and what the chequerboard puts between them[J]. J Antimicrob Chemother, 2003, 52(1): 1. Amsterdam D. Antibiotics in laboratory medicine[M]. Sixth Edition. Philadelphia: Wolters Kluwer, 2015. Clinical and laboratory standards institute (CLSI). Performance standards for antimicrobial susceptibility testing[M]. USA: Wayne, PA, 2021:31st Edition. M100. Clinical and Laboratory Standards Institute (CLSI). Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically[M]. USA: Wayne, PA, 2019: 11th Edition. M07. Fair R J, Tor Y. Antibiotics and bacterial resistance in the 21st century[J]. Perspect Medicin Chem, 2014, 28(6): 25-64. Zak O, Sande M A. Handbook of animal models of infection: Experimental models in antimicrobial chemotherapy[M]. New York: Academic Press, 1999. Rittirsch D, Huber-Lang M S, Flierl M A, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4(1): 31-36. Qin R, Xiao K, Li B, et al. Combination of catechin and epicatechin gallate from Fructus crataegi potentiates β-lactam antibiotics against methicillin-resistant Staphylococcus aureus (MRSA) in vitro and in vivo[J]. Int J Mol Sci, 2013, 14(1): 1802-1821. 基金項(xiàng)目:國(guó)家自然科學(xué)基金委員會(huì)-貴州省人民政府聯(lián)合基金項(xiàng)目(No. U1812403-4-1) 作者簡(jiǎn)介:周紅,女,生于1964年,教授,主要研究方向?yàn)榭寡着c抗感染藥物藥理學(xué),E-mail: zhouh64@163.com

