谷氨酰胺轉氨酶對高水分豌豆蛋白擠出物結構及消化特性的影響
劉 瀟,秦鑒新,李江華,周景文,陳 堅*
(江南大學未來食品科學中心,江蘇 無錫 214122)
根據聯合國數據統計,到2050年,世界人口將達到97億。人口的持續增長導致居民飲食結構與營養來源發生變化,同時糧食安全的保障以及持續惡化的環境導致資源緊缺都是目前亟需解決的問題[1-3]。因此,尋求傳統食用動物蛋白以外的新型蛋白來源成為新的發展方向。植物基肉制品是指以植物蛋白為原料,經一定加工工藝制成的具有與動物蛋白類似的質構、風味、形態等品質特征的食品。植物基肉制品的出現不僅緩解了資源環境壓力,同時也降低了飽和脂肪酸攝入,滿足了人們對營養及口味的追求[4-5]。
豌豆蛋白是一種氨基酸含量相對均衡的優質蛋白質。由于豌豆蛋白沒有致敏性并且能夠在更溫和的氣候條件下生長,因此豌豆蛋白正逐漸替代大豆蛋白作為植物基肉制品的原料[6]。目前,植物基肉制品的質構品質與動物肉制品的相似程度是影響其市場接受度的關鍵因素之一。因此如何改善植物基肉制品的質構口感成為當前面臨的主要問題之一[7]。在食品加工過程中,通過添加不同的成分,如蛋白質、多糖和交聯劑,可以部分改善食品的質地。作為交聯酶,谷氨酰胺轉氨酶(transglutaminase,TG)通過催化蛋白質中谷氨酰胺殘基的γ-羥胺基團與伯胺化合物(酰基受體)之間發生酰基轉移反應,使蛋白質發生共價交聯,通過胺的導入、交聯及脫胺3 種途徑改性蛋白質,從而引起蛋白質的多種功能特性(如凝膠性、熱穩定性、乳化性、保水性、流變性等)發生變化,有助于改善食品的質地口感[8]。
高水分擠壓技術具有優良的混合和喂料能力、較強的可控性和自潔性,是目前植物蛋白肉最常見的生產加工方式[9]。在擠出過程中,植物蛋白粉料在擠壓機中與水混合成均勻狀態,之后經過蒸煮區,在高溫、高剪切的條件下形成熔融體。混合物在溫度降低至臨界溫度以下時會發生相分離,緊接著在經過細長的冷卻套筒過程中使蛋白質分子發生重排、互相交聯,最終形成高彈性、高韌性的纖維狀組織結構,從而使其質地更接近動物肉組織結構。目前已有研究報道TG改性可以改善植物蛋白肉制品產品的質構屬性[10]。
植物基肉制品中纖維和蛋白質分子的結構受其加工技術的影響。近年來,大量研究證明食物的消化特性受其結構的影響。因此,為了評估TG修飾以及擠壓對植物基肉制品質構特性的影響,有必要研究其蛋白質消化率[11-12]。目前對于植物基肉制品蛋白質消化率的研究很少。因此,本研究以豌豆蛋白為原料,探究高水分擠出過程中不同比例TG對豌豆蛋白擠出物品質的影響,并通過體外模擬消化,探究TG對豌豆蛋白擠出物的胃腸道消化率及氨基酸釋放的影響。
1 材料與方法
1.1 材料與試劑
豌豆分離蛋白(pea protein isolate,PPI)粉(蛋白質干基相對含量為84.2%)由煙臺雙塔食品有限公司提供。
TG(120 U/g) 江蘇東圣生物科技有限公司;α-淀粉酶、胃蛋白酶、胰蛋白酶 西格瑪奧德里奇(上海)貿易有限公司;膽汁鹽、氯化鈉、氯化鉀、碳酸氫鈉、二硫蘇糖醇(dithiothreitol,DTT)、硫酸二氫鈉、磷酸氫二鈉、尿素、巰基乙醇、十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)、無水乙醇、三氯乙酸國藥控股化學試劑有限公司;除單獨說明外,所有其他化學試劑均為分析純。
1.2 儀器與設備
BCTM-30雙螺桿擠出機 瑞士布勒機械有限公司;K9860全自動凱氏定氮儀 山東海能科學儀器有限公司;SU1510日立掃描電子顯微鏡(scanning electron microscope,SEM) 日本Hitachi公司;TA.XT plus質構分析儀 英國SMS公司;Mastersizer 3000E激光粒度儀英國馬爾文帕納科有限公司;1100高效液相色譜(high performance liquid chromatography,HPLC)儀 美國安捷倫科技有限公司;Synergy H1/Synergy2酶標儀 美國伯騰儀器有限公司。
1.3 方法
1.3.1 PPI粉-TG擠出物的制備
將PPI粉與TG混合均勻,TG添加量分別為0%、0.25%、0.50%、1.00%、1.50%和2.00%(以最終料水混合物的質量計),之后以9 kg/h的恒定速率將混合物送入擠出機(干基)。在第二區以9 kg/h的速率輸送水,保持最終進料水分質量分數為50%。擠壓機參數如下:螺桿轉速為230 r/min,機筒溫度從第一區到第八區分別為25、40、60、80、100、120、130、120 ℃。冷卻套筒溫度保持在90 ℃。待擠出穩定后,收集樣品,待樣品冷卻至室溫后分裝,保存在-20 ℃備用。
1.3.2 擠出物宏觀與微觀結構觀察
將新鮮的擠出物進行拍照觀察,分析擠出物宏觀結構差異。將擠出物切片后冷凍干燥,最后將表面用金濺射涂層。用SEM在300 倍下觀察其表觀形態。
1.3.3 質構及組織化分析
將擠出物裁成10 mm×10 mm×10 mm的形狀,使用P/36R探頭測定組織化豌豆蛋白的硬度、彈性、內聚性和咀嚼性。具體參數設置為測試前速率為1 mm/s、測試速率為1 mm/s、測試后速率為2 mm/s、下壓程度為50%,往復2 次,每組樣品重復測試10 次,去掉兩個最大值和兩個最小值取平均值。
取長方體樣品(20 mm×20 mm×10 mm),使用A/CKB探頭對其進行剪切測試,具體參數設置為測試前速率為1 mm/s、測試速率為1 mm/s、測試后速率為2 mm/s、剪切程度為75%,每組樣品重復測試10 次,去掉兩個最大值和兩個最小值取平均值。垂直剪切力與平行剪切力的比值被定義為組織化度。
1.3.4 蛋白質溶解度測定
為了揭示擠出物結構形成和維持過程中蛋白質之間的相互作用,制備如表1所示的8 種蛋白提取溶劑,測定樣品的蛋白質溶解度并計算化學鍵的變化。將樣品冷凍干燥后粉碎過60 目篩網。稱取0.25 g樣品于50 mL離心管中,分別加入如表1所示的8 種蛋白提取溶劑,攪拌浸提1 h后,4 ℃、12 000 r/min離心15 min,保留上清液。再分別加入上述8 種蛋白提取溶劑將沉淀重懸,重復浸提一次。用去離子水將獲得的上清液稀釋20 倍,混勻后向96 孔酶標板中加入20 μL稀釋后的上清液。采用BCA蛋白濃度測定試劑盒測定樣品在562 nm波長處的吸光度,計算上清液中的可溶性蛋白質量濃度,用凱氏定氮法測定樣品的總蛋白質量濃度,計算如公式(1)所示,然后根據公式(2)計算蛋白質溶解度。根據樣品在不同溶液中的溶解度進行加減計算得到不同的化學鍵。

表1 蛋白浸提液及化學鍵計算方式Table 1 Protein extraction buffer solutions and calculation of corresponding chemical bonds
1.3.5 體外消化實驗
對豌豆蛋白擠出物進行體外消化實驗。消化實驗分3 個階段進行。
口腔階段:將擠出物使用研磨機研磨15 s,取1.5 g樣品加6 mL去離子水放入25 mL燒杯中,使每組樣品中的蛋白質含量保持不變。將7.5 mL含有α-淀粉酶的模擬唾液(simulated salivary fluid,SSF)添加到樣品中。最終口服混合物中淀粉酶的活力為75 U/mL。將燒杯密封并在37 ℃的水浴磁力攪拌鍋中以500 r/min攪拌2 min。
體外胃消化階段:將15 g經上述口服階段的樣品與300 mL蒸餾水混合,并用6 mol/L HCl溶液將pH值調節至2.0。加入15 mL模擬胃液(5 g胃蛋白酶溶解于250 mL 0.1 mol/L HCl溶液中),將混合物在37 ℃水浴攪拌,分別在30、60、120 min時取樣,每個時間點采樣后將樣品pH值調至7.0滅酶以終止胃消化。隨后在4 ℃、4 000 r/min離心15 min。將上清液與沉淀物分別在-80 ℃保存。
體外腸消化階段:取165 mL上述胃消化后的混合物,用1 mol/L NaHCO3將pH值調節至7.2,隨后加入37.5 mL的膽汁鹽和胰酶混合溶液(1.2 g膽汁鹽和0.2 g胰酶溶解于100 mL NaHCO3(0.1 mol/L))及37.5 mL NaCl/KCl混合溶液(質量濃度7.02 g/L NaCl、質量濃度0.37 g/L KCl),在37 ℃水浴攪拌,分別在15、30、60、120 min時取樣,每個時間點采樣后將樣品沸水浴5 min滅酶以終止腸消化。隨后在4 ℃、4 000 r/min離心15 min。將上清液與沉淀物分別在-80 ℃保存。
1.3.6 消化物的粒度測定
使用Mastersizer 3000E激光粒度分析儀測定消化物的粒度,結果以D4,3表示。
1.3.7 十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳測定
在還原條件下,使用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)測定初始和消化后的擠出物蛋白質組成。對于未消化的樣品,將2.0 mg磨碎的樣品與0.5 mL樣品緩沖液(0.5 mol/L Tris、2.0% SDS、0.03% DTT、pH 6.8)混合。對于消化過的樣品,在沸水中煮5 min以使酶失活。使用1 mol/L NaOH溶液將胃食糜的pH值調節至7.0。然后,將樣品緩沖液和食糜以體積比1∶1混合,攪拌3 min。
1.3.8 蛋白質消化率測定
將胃和腸反應得到的消化液分別與3 倍體積的無水乙醇混合,并在4 ℃下反應12 h,以去除未消化的蛋白質和高分子質量肽。然后將樣品在4 ℃下以10 000 r/min離心20 min,將沉淀物懸浮在5 mL蛋白質提取緩沖液中以測定未消化的蛋白質含量,將混合物在4 ℃下以4 000 r/min離心5 min,收集上清液,通過BCA蛋白濃度測定試劑盒對上清液中的可溶性蛋白含量進行測定。蛋白質消化率計算如公式(3)所示。
式中:m1為未消化蛋白質量/g;m0為消化前樣品中蛋白質量/g。
1.3.9 游離氨基酸質量濃度分析
使用HPLC儀測定游離氨基酸質量濃度。在分析之前,用質量濃度0.1 g/mL三氯乙酸等體積稀釋樣品,靜置1 h。取1 mL樣液10 000 r/min離心30 min,然后將上清液通過0.22 μm過濾膜過濾用于HPLC分析。
1.4 數據統計與分析
實驗數據結果以平均值±標準差表示。利用Origin 2018與SPSS 26.0軟件對數據進行統計和方差分析,用Duncan法進行差異顯著性分析(P<0.05)。
2 結果與分析
2.1 宏觀和微觀結構分析結果
對擠出物而言,其質構品質與動物肉制品的相似程度是評價其品質的一個關鍵因素。而宏觀和微觀觀察是評價擠出物質構特性的直接手段[13-15]。選取新鮮的豌豆蛋白擠出物樣品,拍照觀察不同TG誘導對豌豆蛋白組織結構的影響。由圖1可知,所有的豌豆蛋白擠出物都呈現出各向異性結構。相較于添加TG的擠出物,未添加TG的擠出物纖維層次感較差,且形成的纖維較粗糙、易斷裂。而TG添加量為0.25%~1.00%的擠出物樣品組織纖維層次感強烈,且纖維較細密,并且TG添加量越大,擠出物的纖維結構越好,呈現出正相關趨勢。這是由于TG的加入促進了蛋白分子間交聯,使蛋白分子間形成了致密的網絡結構。當TG添加量達到1.5%之后,樣品的各向異性減弱,組織纖維感變差,只能看到“V”型的組織化纖維趨勢,且纖維易斷裂,沒有形成細小的纖維結構,原因可能是過量酶的加入對纖維的形成起到了抑制作用[10]。

圖1 不同添加量TG誘導豌豆蛋白擠出物樣品Fig.1 Pea protein extrudates with different TG concentrations
通過SEM觀察豌豆蛋白擠出物的形態。由圖2可知,擠出物的微觀結構與樣品宏觀形態基本保持一致。添加TG的擠出樣品與未添加TG樣品(圖2A)的形態差別較大。可以明顯看出未添加TG樣品的微觀結構纖維感差,蛋白為塊狀聚集體,略有分層。而添加TG的擠出樣品則分層明顯,且有強烈的纖維感。當擠出物的TG添加量為1.00%時(圖2D),其纖維結構細密且纖維感最強烈,具有類似肉類纖維的層次感和形態。而隨著TG添加量的增加,擠出物的微觀形態又發生了變化,如圖2F所示,雖然有層狀結構出現,但纖維感較差,且蛋白多為塊狀聚集體,缺乏動物肉類的纖維感。結合宏觀、微觀分析結果可知,TG的加入有利于豌豆蛋白擠出物纖維結構的形成,但過量的TG會起到抑制作用。

圖2 不同添加量TG誘導豌豆蛋白擠出物的SEM觀察結果Fig.2 Microstructures of pea protein extrudates with different TG concentrations observed by SEM
2.2 擠出物質構分析
擠出物的質構特性是評價擠出物品質優劣的重要標準[16-18]。TG添加量對豌豆蛋白擠出物質構的影響如表2所示。交聯酶的添加在一定程度上會有利于擠出物各向異性結構的形成[10,19]。在一定范圍內(0~1%),增加TG添加量,豌豆蛋白擠出物的硬度和咀嚼度均顯著增大。當TG添加量在0.25%以上時,樣品的硬度和咀嚼度顯著大于未添加TG的豌豆蛋白擠出物。當TG添加量為1.00%時,硬度和咀嚼度最大,而彈性最小,約為0.79。但是隨著TG添加量的進一步增加,擠出物的硬度和咀嚼度開始減小,原因可能是過量TG的加入由于其高濃度導致表面蛋白分子間快速且高度的交聯,形成了致密的蛋白交聯網絡,進而阻礙了TG與蛋白分子的進一步交聯。總而言之,TG誘導豌豆蛋白交聯,增加了其硬度與咀嚼感,同時使彈性下降,進一步改善了其凝膠特性。
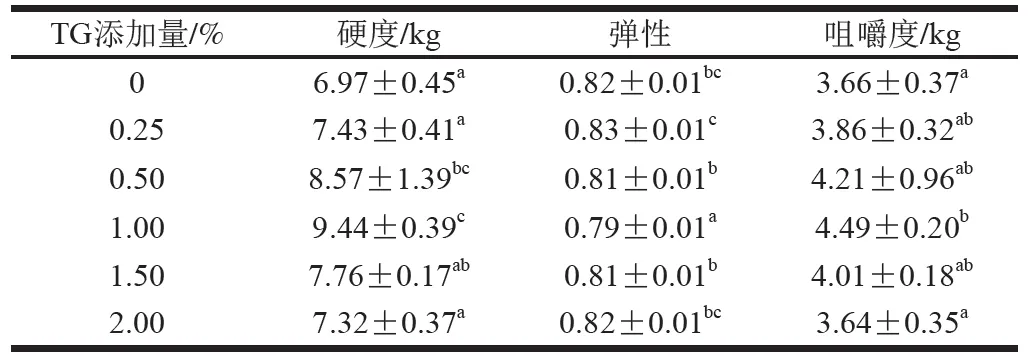
表2 TG添加量對豌豆蛋白擠出物質構特性的影響Table 2 Effects of TG concentration on the texture of pea protein extrudates
豌豆蛋白擠出物的組織化度隨TG添加量的變化如表3所示。隨著TG添加量(0%~1.00%)的逐漸增大,樣品的平行切力、垂直切力以及組織化度與0% TG相比都有所提高,這是TG的交聯作用造成的[20-21]。當TG添加量為1.00%時,樣品的組織化度最高,而TG添加量超過1.00%,組織化度等指標又出現減小的趨勢。由此說明,添加1.00% TG對豌豆蛋白的交聯效果最好,此時豌豆蛋白擠出物的組織化度最高。
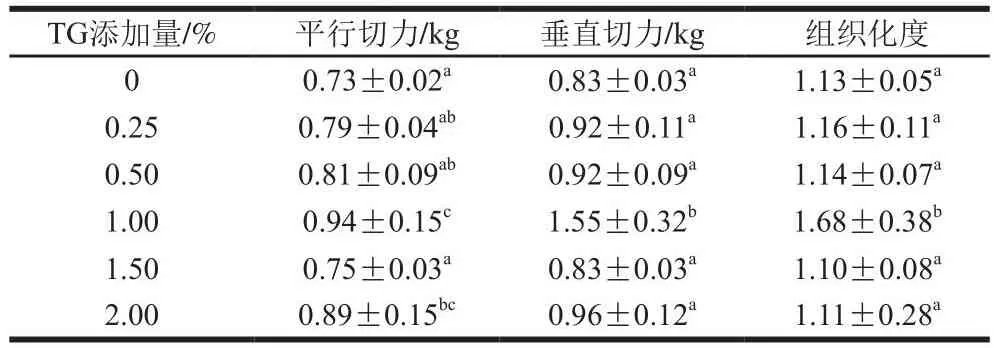
表3 TG添加量對豌豆蛋白擠出物組織化度的影響Table 3 Effects of TG concentration on the texturization degree of pea protein extrudates
2.3 蛋白質溶解度及分子間作用力分析結果
根據不同TG添加量誘導的豌豆蛋白擠出物在8 種浸提溶劑中的溶解度,計算得到擠出物化學鍵的變化,如表4所示。蛋白質分子間的相互作用力有很多種,包括共價鍵和非共價鍵及其交互作用[21]。與未添加TG的樣品組相比,添加TG的擠出物樣品氫鍵和二硫鍵數量有所減少,而氫鍵&二硫鍵交互作用以及疏水&二硫鍵交互作用有所增強。總體而言,隨著TG添加量的增大,擠出物樣品氫鍵和疏水相互作用的數量呈下降趨勢,而氫鍵&疏水&二硫鍵作用呈上升趨勢。而當TG添加量為0.50%時,氫鍵&二硫鍵的交互作用以及氫鍵&疏水&二硫鍵作用最強。
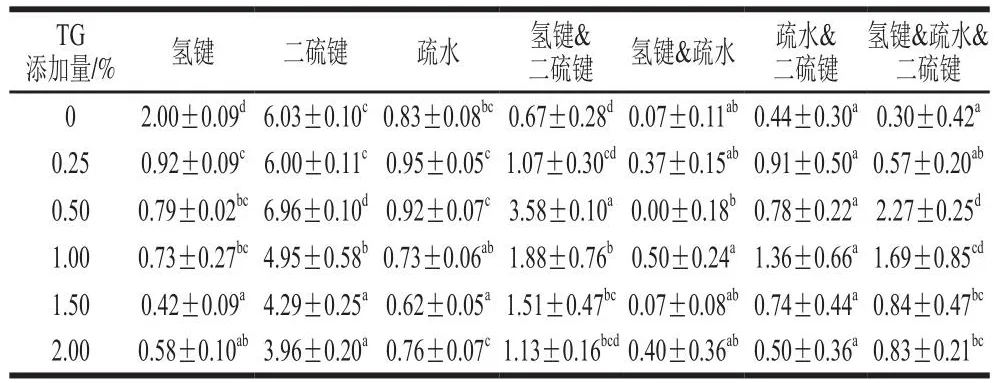
表4 TG添加量對豌豆蛋白擠出物化學鍵的影響Table 4 Effects of TG concentration on chemical bonds of pea protein extrudates
有研究表明,二硫鍵在確定擠出物結構的完整性和纖維形成方面起著關鍵作用[22]。而本研究中TG的誘導作用使得擠出物的二硫鍵數量隨TG的添加量增加先增加后減少,但其仍然是維持豌豆蛋白擠出物結構的主要作用力,這與之前的研究結果[23]相似。與此同時,兩種及多種化學鍵之間的交互作用也增強。
2.4 體外消化過程擠出物的粒度分析
由于在腸消化階段擠出物的大部分纖維已被破壞,蛋白質已水解成肽和氨基酸,導致粒度不能準確檢測,這里僅分析在胃消化30、60 min和120 min時消化物的粒度。從圖3可知,在胃消化過程中,不同添加量TG誘導的豌豆蛋白擠出物的粒度存在明顯差異。在胃消化30 min時,未添加TG的樣品粒度最大,約為127 μm,與其他添加TG的擠出物存在顯著差異(P<0.05)。這表明TG的加入促進了擠出物纖維結構的分解。經胃消化60 min后,擠出物樣品的粒度呈現出減小的趨勢,表明大部分纖維結構已被胃蛋白酶水解破壞[23]。當胃消化過程結束時,TG添加量為1.00%的擠出物樣品粒度最小,即纖維結構的分解率最高。上述結果表明,TG的加入對擠出物在胃消化過程中的分解速率有很大影響。添加適量TG(1.00%)擠出物的分解率更高。
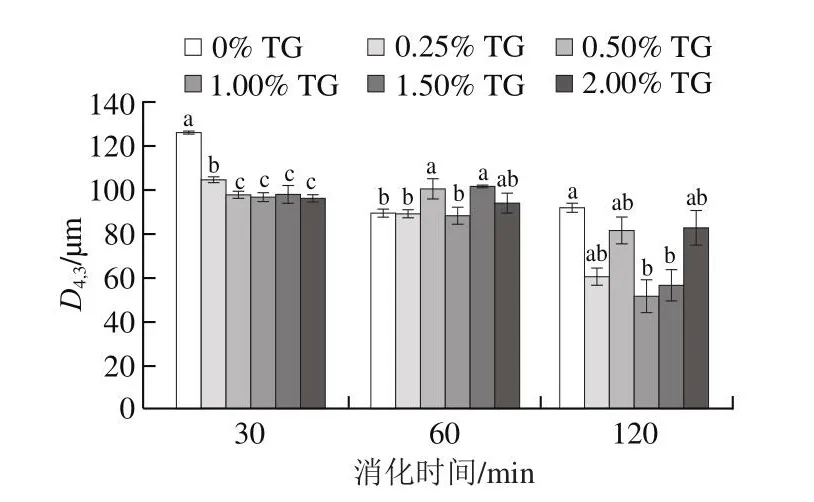
圖3 在胃消化過程中不同添加量TG豌豆蛋白擠出物的粒度Fig.3 Particle size of pea protein extrudates with different TG concentrations during gastric digestion
2.5 體外消化過程擠出物的SDS-PAGE分析結果
使用SDS-PAGE驗證不同TG誘導的豌豆蛋白擠出物和未添加TG的體外蛋白質消化情況。如圖4所示,消化前,擠出樣品中在蛋白膠泳道上方條帶的強度高于未添加TG樣品,這可能是由于在擠出過程中形成了蛋白質的聚集和交聯。在擠壓過程中,蛋白質經歷了大約4 種主要的構象變化:分子鏈的展開、締合、聚集以及潛在降解或氧化的交聯[10]。在胃消化30 min后,可以明顯看到所有樣品的蛋白條帶灰度下降,這表明蛋白質已被水解成肽和游離氨基酸,只有分子質量在44 kDa左右的蛋白條帶仍然存在,研究表明該蛋白為11S球蛋白[24-25]。隨著消化時間的延長,胃蛋白酶將大分子蛋白質(>180 kDa)分解,導致部分蛋白條帶變清晰[24]。而大部分條帶沒有明顯變化,說明蛋白水解主要發生在胃消化早期。
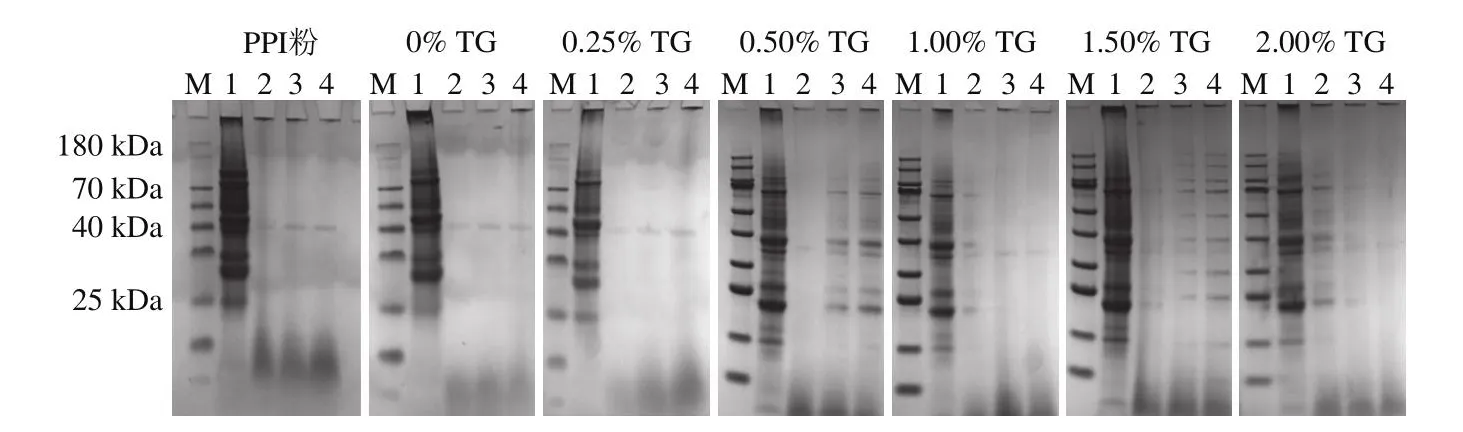
圖4 胃消化過程中添加不同TG豌豆蛋白擠出物的SDS-PAGE圖譜Fig.4 SDS-PAGE profiles of pea protein extrudates with different TG concentrations during gastric digestion
結合上述擠出物蛋白質分子間作用力的結果可以得出,擠壓過程導致擠出物二硫鍵數量增多,使擠出物樣品的大分子蛋白質含量高于PPI樣品,并且TG的加入降低了二硫鍵的數量,造成了樣品更易被胃蛋白酶分解。以上結果表明,豌豆蛋白中隱藏的疏水基團在TG的作用下暴露出來并與其他分子相互作用,而疏水基團的展開導致更多的胃蛋白酶底物受體位點暴露。這種機制可能是造成TG誘導的豌豆蛋白擠出物更易分解的原因。
2.6 體外消化過程擠出物的消化率分析結果
蛋白質的生物利用度通常通過消化率來評估[26-28]。TG對豌豆蛋白高水分擠出物在模擬胃腸消化下消化率的影響如表5所示。在胃消化30 min時,豌豆蛋白擠出物的消化率已經達到96%左右。這表明豌豆蛋白擠出物在胃中的消化速度更快,但在小腸中的消化速度較慢,這可能是由于絕大多數蛋白已在胃相中被消化,也有研究表明,豌豆蛋白的蛋白質類型、結構組織和膳食纖維更易被胃蛋白酶結合并分解[29-30]。在胃消化階段,擠出處理后豌豆蛋白的消化率低于未擠出的豌豆蛋白(PPI粉),這說明在擠出過程中,熱機械作用使豌豆蛋白的分子結構發生變化,更難被消化酶所分解。當TG添加量為2.00%的豌豆蛋白擠出物消化率遠低于其他樣品,這可能是過量的TG誘導導致形成的豌豆蛋白分子網絡交聯過于緊密,難以在短時間內分解完全[10]。在腸消化階段,也有相似的趨勢。

表5 TG添加量對豌豆蛋白擠出物消化率的影響Table 5 Effects of TG concentration on the digestibility of pea protein extrudates
2.7 體外消化過程擠出物的游離氨基酸分析結果
蛋白質只有在水解為單個氨基酸或短多肽后才會在腸道中吸收。因此,消化過程中產生的游離氨基酸量可用于反映蛋白質的消化率和生物利用度[24,31]。高水分擠壓和使用酶制劑處理會導致蛋白質變性或者使蛋白發生分子間交聯,從而導致蛋白質聚集,影響消化酶的效果和氨基酸的釋放。
TG處理對豌豆蛋白擠出物在胃腸消化過程中游離氨基酸釋放的影響如表6、7所示。有研究表明,擠壓過程可能有利于美拉德反應的進行,經過擠壓處理的蛋白,其分子結構會發生很大的變化,會出現游離氨基酸含量降低,蛋白亞基發生聚集等現象[30]。在胃消化120 min時,擠出后的豌豆蛋白樣品釋放的游離氨基酸總量均小于PPI粉,這表明擠出過程緩解了豌豆蛋白游離氨基酸的釋放。而隨著TG添加量的增加,豌豆蛋白擠出物的總氨基酸釋放量呈現出先增加后減小的趨勢,當TG添加量為1.00%時,擠出物樣品的游離氨基酸的總釋放量達到最大值,為707.62 mg/mL。這表明TG在一定的添加量范圍內(0%~1.00%),能夠促進游離氨基酸的釋放。樣品的消化率也呈現類似的變化趨勢。腸消化120 min后,未被擠壓的PPI粉的總游離氨基酸釋放量要高于豌豆蛋白擠出物。而在豌豆蛋白擠出物中,添加0.50% TG的樣品的游離氨基酸總釋放量最高。這與樣品的消化率呈現出相似的變化趨勢。同時這也表明擠壓可以增強蛋白樣品的耐消化程度,并且可以通過改變TG的添加量來調節游離氨基酸的釋放。
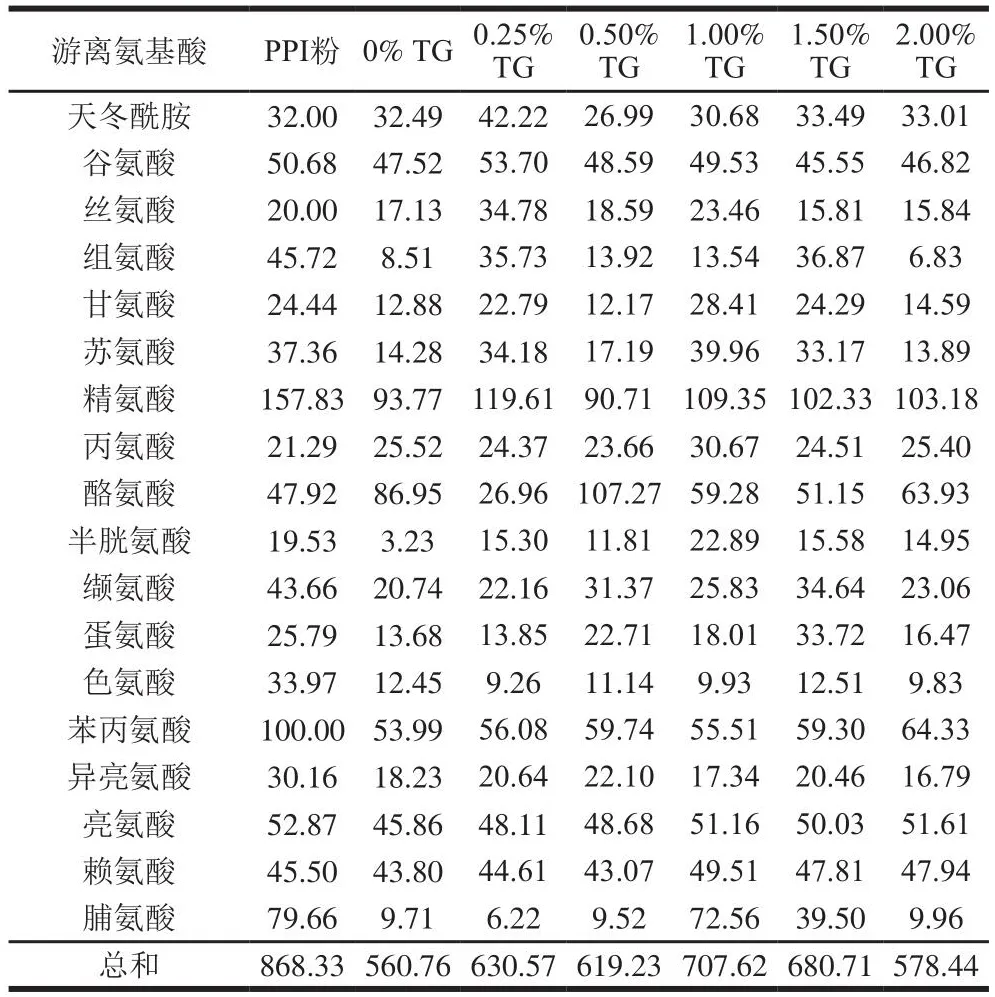
表6 體外胃消化120 min后樣品的游離氨基酸的釋放量Table 6 Release of free amino acids from pea protein extrudates after in vitro gastric digestion for 120 min mg/mL
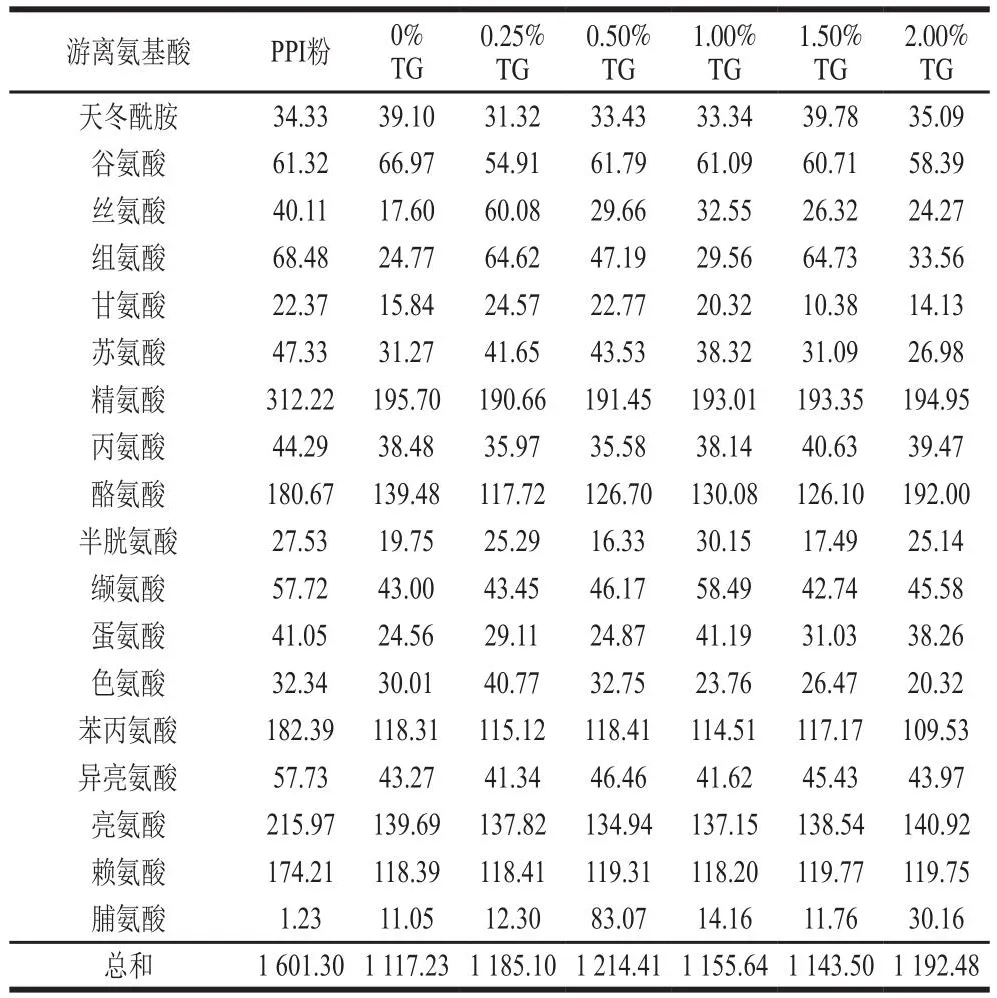
表7 體外腸消化120 min后樣品的游離氨基酸的釋放量Table 7 Release of free amino acids from pea protein extrudates after in vitro intestinal digestion for 120 min mg/mL
3 結 論
本研究表明,相比于未添加TG樣品,適量添加TG的豌豆蛋白高水分擠出物的組織化度有所升高。通過對不同添加量TG的豌豆蛋白擠出物進行宏觀和微觀觀察,發現添加1.00% TG的樣品更具有類似肉類的纖維結構,TG通過其交聯作用增強了擠出物的纖維特性。同時體外消化實驗表明擠壓過程中的熱-機械處理使蛋白質分子變性,從而導致其消化率降低。通過對不同添加量TG誘導的豌豆蛋白擠出物胃食糜進行SDS-PAGE蛋白凝膠電泳和游離氨基酸分析,發現添加1.00% TG的樣品更易消化,且游離氨基酸釋放量較多,更易于人體吸收利用。該研究表明TG作為交聯劑在高水分擠壓生產中有廣闊的應用潛力,有利于開發出具有較高營養價值的肉類類似物。

