平板計數法與紙片法檢測食品微生物菌落總數的比較分析
◎劉 珂,余 希
(南昌市西湖區疾病預防控制中心,江西 南昌 330009)
菌落總數是指食品在一定條件下經過處理后,所得1 g 或1 mL 檢樣中所含的細菌菌落總數。菌落總數作為判別食品被污染程度的標志,其目的在于了解食品從原料加工到成品包裝受外界污染的情況。在此過程中,無論采取何種方式加工食品,都不可避免地發生微生物污染食品的情況,但只要食品中的微生物含量在合理范圍內就不會給人體健康帶來威脅。通過采用合理的計數方法確定食品微生物菌落總數,不僅可以提升食品檢測結果的準確性,還可以提高食品安全管理水平,對推動食品行業發展有著積極的意義。
平板計數法是指利用瓊脂、明膠等凝膠型固體培養基制成一個平面,并在此培養基上培養微生物,若干天后,對已形成菌落數進行統計,得到菌落總數的方法。該方法在具體應用過程中的流程如下:首先,將待測樣品適當稀釋,其中的微生物充分分散成單個細胞;然后,取一定量的稀釋樣液涂布到平板上,經過培養后,每個單細胞生長繁殖形成肉眼可見的菌落,即一個單菌落應代表原樣品中的一個單細胞;最后,統計菌落數,根據其稀釋倍數和取樣接種量即可換算出樣品中的含菌數。該方法在使用過程中,具有培養結果易于辨認、計數結果準確性較高等優勢,但也存在不足,如檢測周期較長、受環境影響較大等。紙片檢測方法是利用快檢紙片代替培養基,利用菌落顯色藥劑指示菌落總數,從而得到相應的計數結果。其具體操作流程如下:在進行計數實驗前,需要確保樣品以外所有需要和紙片進行接觸的物品,如移液管、燒杯等,都在前期進行無菌化處理。同時,計數實驗人員需要佩戴口罩、頭套、手套(均經過無菌化處理),方可進行實驗,檢測人員將紙片從盒中抽出后,利用生理鹽水進行浸泡,這樣可以確保紙片和樣品充分接觸,整個過程維持30 s,隨后將紙片從樣品中取出,并將其放置在37 ℃恒溫箱內進行培養,培養18 h 后根據菌落顯示進行計數。該方法在使用過程中,由于具有采樣過程污染小、攜帶便捷性強、環境適應性強、結果方便統計等優點受到研究者的青睞。另一方面,該技術在應用中也有一些不足之處,如細菌數量較大時,計數結果不可用,并且檢測內容比較固定,一次只能檢測一類菌種,具有一定的局限性[1]。
1 菌落總數相關內容論述
除上述提到的基本概念外,菌落總數的計數基礎是每一個細菌在培養基中可以逐漸形成一個能夠肉眼觀察到的單獨菌落。另外,培養菌體需要在有氧環境下進行,部分細菌(如厭氧的乳酸菌、硝化細菌等)在此環境下無法生存,而且一些特殊細菌(如硫化細菌等)在生長過程中需要某些特殊營養物。因此,所統計的數據并不代表樣品中實際存活的細菌總數。需要明確的是,在培養基中所得到的細菌數量主要以喜愛中溫、有氧型、兼性厭氧的細菌種類為主,而其他類型的菌種,還需要采取其他的處理方式進行檢測,從而得到準確的檢測數據,提高檢測結果的準確性。
現階段,國內食品微生物檢測工作中有關菌落技術檢測的要求,主要遵循《食品安全國家標準 食品微生物學檢驗 菌落總數測定》進行。該規則主要以平板計數法作為主要檢測方法,該方法具有培養結果易于辨認、計數結果準確性較高等優勢。但也有一些檢測機構將紙片法作為主要檢測方法,其參考了《食品中細菌總數的檢測再水化干膜法》中的相關內容。紙片法目前主要是在加拿大、美國等地區進行推廣,國內對于紙片法的應用尚處于討論階段,目前仍是以平板計數法作為主要的檢測手段。
2 材料與方法
2.1 材料與儀器
①平板計數瓊脂培養基,校核是否變質,按要求對其進行存儲。②3M Petrifilm 菌落總數測試片,校核是否變質,按要求對其進行存儲。③質控樣品2 份,作為參考組使用。
2.2 實驗樣液制備
為了對比平板計數法和紙片檢測方法的優劣,需要進行相關實驗。①質控樣品。在無菌環境下打開裝有凍干樣品的西林瓶,在30 s 內用滴定管(5 mL)吸取4 mL 無菌生理鹽水加入西林瓶中,使凍干樣品中的粉末充分溶解,隨后將混合溶液轉移到無菌錐形瓶中,再用剩余的生理鹽水清洗西林瓶內壁,經多次沖洗后得到的混合液體也轉移到無菌錐形瓶中,共得到50 mL 混合液體,即待測樣品原液。②食品樣品樣液。與質控樣品制作過程相類似,在無菌操作臺上,對食品進行切塊、粉碎、稀釋等處理,從而得到食品樣品樣液。③稀釋溶液。將上述2 種樣品樣液取出1 mL 添加到9 mL 無菌生理鹽水試管中,用滴管攪拌均勻后制備成10 倍稀釋度樣液,隨后再從中抽取1 mL 樣液將其轉移到9 mL 無菌生理鹽水試管中,攪拌均勻后制備成100 倍稀釋度樣液,待測[2]。
2.3 實驗方法
2.3.1 平板計數法
在無菌條件下,用滅菌后的吸管(容量為1 mL)從上述制備的稀釋液中吸取1 mL,放入2 個無菌培養皿中,隨后利用滅菌吸管(容量為1 mL)吸取1 袋生理鹽水,注入平板計數瓊脂培養基,提前將溫度調整到46 ℃,培養基容積為5~20 mL,按要求進行搖勻操作,等待其冷卻凝固后,將其放置在(36±1)℃環境中培養,培養時間控制在(48±2)h。
2.3.2 紙片法
在無菌條件下,用滅菌吸管(容量為1 mL)從上述制備的稀釋液中吸取1 mL,放入2 個測試紙片,完成此操作后,覆蓋好紙片,將其放置在(36±1)℃環境中進行培養,培養時間控制在(48±2)h。
2.4 統計方法和計算方法
利用平板計數法和紙片法對培養后的菌落進行計數,所得到的數據可利用SPSS 19.0 進行統計學處理,若P <0.05,說明具有統計學意義。使用“Z-比分數”進行評價,根據得到的計算數值可以進行以下評價。①如果|Z|≤2,那么此次測試結果為“滿意”。②如果2 <|Z|<3,那么此次結果中存在問題,需要采取措施進行處理。③如果|Z|≥3,那么此次測試結果為“不滿意”[3]。
3 結果與分析
3.1 食品檢測結果比較
在實驗中設置了40 組樣品(平板計數法與紙片法各20 組)進行實驗,隨后利用平板計數法與紙片法進行計數處理,對得到的檢測結果利用T檢驗展開分析,同時對實驗結果進行統計學處理。由表1 知:①平板計數法所得到的計算結果為235.6 CFU·g-1,t值為-0.345,同時P>0.05,表明采用平板計數法計算菌落總數結果不顯著。②紙片法得到的計算結果為278.9 CFU·g-1,t值為-0.366,同時P>0.05,與平板計數法相比,二者在顯著性方面并沒有明顯區別。由標準樣液的參考值253.3 CFU·g-1來看,平板計數法更具備應用價值[4]。

表1 食品檢測結果表
3.2 菌落數區間結果比較
參考2.1 內容對菌落區間進行等級劃分,分別為0~100 CFU·g-1、100~1 000 CFU·g-1和>1 000 CFU·g-1,并對實驗結果進行統計學處理,分析結果見表2。由表2 可知:①平板計數法所得到0~100 CFU·g-1、100~1 000 CFU·g-1和>1 000 CFU·g-1的菌落區間對應t值分別是-0.345、-0.376、-0.843,同時P>0.05,表明平板計數法在使用過程中,其檢測菌落區間差異不顯著。②紙片法所得到的不同菌落區間t值分別是-1.753、-1.766、-1.466,同時P>0.05,表明紙片法在使用過程中,其檢測菌落區間差異不顯著。標準樣液0~100 CFU·g-1、100~1 000 CFU·g-1和 >1 000 CFU·g-1的菌落區間對應t值為-0.435、-0.436、-0.703。將平板計數法與紙片法不同菌落區間的t值和標準樣液的t值對比之后可以發現,在該實驗中平板計數法更具備應用價值[5]。
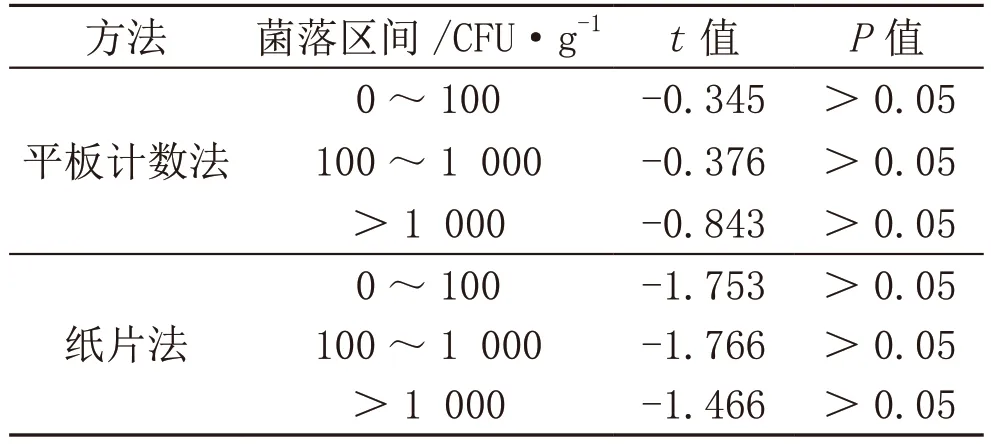
表2 菌落數區間結果表
3.3 質控樣品菌落總數檢測結果分析
本實驗中設置了質控樣品實驗,隨后利用平板計數法與紙片法進行計數處理,得到的檢測結果利用T檢驗展開分析,同時對實驗結果進行統計學處理,結果見表3。由表3 可知:①平板計數法的平均菌落數為16 000 CFU·g-1,t值為-0.325,同時P>0.05,Z值為1.2,表明平板計數法在使用過程中,其檢測菌落總數結果之間的差異不顯著。②紙片法的平均菌落數為為20 000 CFU·g-1,t值為-0.336,同時P>0.05,Z值為1.5,表明紙片法在使用過程中,其檢測菌落總數結果之間的差異不顯著。此外,根據Z值統計結果顯示,在質控樣品的實驗中,2 種方法都可以滿足相應的檢測要求,其均適用于該樣品檢測。

表3 質控樣品菌落總數檢測結果表
4 討論
在此次研究中,通過組建實驗的方式討論平板計數法與紙片法在食品菌落總數校核中的應用情況。實驗結果顯示,2 種方法在應用中并不存在顯著性差異,均具有應用價值。在平板計數法的應用過程中,一個稀釋梯度需要使用2 個平板,而檢測某一個樣品的菌落總數,則需要使用多個梯度,也會使用數量更多的平板,整體所占體積較大。許多檢測機構的場地相對有限,無法購買更多數量的培養箱用于制備培養基,另一方面,由于其檢測結果的準確性較高,主要應用于一些高精度檢測要求的食品檢測。
與平板計數法相比,紙片法操作過程簡單,減少了人力成本的支出。在檢測中使用的主要載體為相同厚度的薄紙片,根據需要分析的梯度配置相應數量的薄紙片,所占空間較小,適用于目前許多檢測場地較小、送檢樣品較多的機構。但是其準確性方面不如平板計數法,適合用于一些快速檢測活動。
5 結論
平板計數法與紙片法均能夠對菌落總數進行測定。平板計數法的檢測準確性更高,該方法的應用前提條件是需要做好樣品的稀釋工作,同時做好無菌化處理,以滿足相應的管理需求。紙片法的檢測速度快,適用于許多檢測場地較小、送檢樣品較多的機構。具體選擇哪一類檢測方法,需根據精度要求等實際情況進行選擇,以提高實驗檢測結果的準確性。

