不同移植部位對可注射組織工程化脂肪生存率的影響
呂成鵬,倪 華,李 龍,劉彥普,賀龍龍
(1.西安交通大學口腔醫院 陜西省顱頜面精準醫學研究重點實驗室 陜西 西安 710004;2.空軍軍醫大學口腔醫院組織工程研發中心 陜西 西安 710032;3.廣東省深圳市南山區蛇口人民醫院口腔科 廣東 深圳 518066;4.空軍軍醫大學口腔醫院口腔頜面外科 陜西 西安 710032)
頜面部軟組織缺損的美學修復是臨床工作中經常面臨的問題[1-2]。目前,缺損的修復手段主要包括假體的植入、透明質酸充填和自體脂肪移植等,但這些方法都有一定的局限性。假體植入和透明質酸充填由于其可能存在的術后并發癥給病人帶來風險[3],而自體脂肪由于其分布廣泛、手術操作便捷及無排斥反應和倫理問題越來越廣泛地應用于頜面軟組織缺損修復,但脂肪移植后不可控的吸收問題為脂肪移植帶來困擾[4]。人工誘導脂肪再生(即組織工程化脂肪)技術的出現為軟組織缺損的修復提供了新的思路,組織工程化脂肪可通過提供種子細胞、血運條件及再生微環境實現脂肪組織的新生。組織工程脂肪被認為是目前最有前景的治療軟組織缺損的方法[5]。本研究通過將構建的可注射組織工程化脂肪移植于裸鼠皮下不同部位,探討不同移植部位對可注射組織工程化脂肪生存率的影響。
1 材料和方法
1.1 主要試劑:高糖D M E M(G i b c o),胎牛血清(G i b c o),I 型膠原酶(S i g m a),β-甘油磷酸鈉(S i g m a),3-異丁基-1-甲基黃嘌呤(I B M X)(Peprotech),吲哚美辛(Peprotech),茜素紅(Peprotech)。
1.2 實驗動物:6月齡新西蘭大白兔3只,體重2.5~3 kg,6周齡雌性裸鼠6只,移植后裸鼠分為兩組,裸鼠背部皮下組和裸鼠腹股溝皮下組(同體對照,每組6個位置)。由空軍軍醫大學實驗動物中心提供和飼養。
1.3 ADSCs的分離和培養:取新西蘭兔雙側腹股溝及頸背部的皮下脂肪,剪碎并清理切取的脂肪組織,用DMEM高糖配制1%I型膠原酶37℃消化1 h;1 000 r/min離心5 min,棄上清。加入DMEM培養基(含雙抗,10%胎牛血清,292 mg/L的谷氨酰胺,50 mg/L的Vita min C)重懸浮;接種于25 cm2培養瓶中,5%CO2,37℃飽和濕度培養,3 d后換液,后隔日換液;5~7 d后按照1∶2比例傳代,第二代細胞以1∶3傳代。
1.4 ADSCs的成脂、成骨多向分化能力檢測
1.4.1 成脂分化能力檢測:取第3代的ADSCs細胞,1×105個/cm2接種于1.2 cm×1.2 cm的蓋玻片上,細胞密度達80%后加入成脂誘導培養基,3 d換液1次,7 d后用4%的多聚甲醛固定15 min,PBS洗3遍,60%異丙醇淋洗。浸入油紅〇染液10 min,60%異丙醇分色至背景無色,雙蒸水洗1遍,蘇木精復染,晾干,甘油明膠封片,光鏡下檢查。
1.4.2 成骨分化能力檢測:取第3代的ADSCs細胞,1×105個/cm2接種于1.2cm×1.2 cm的蓋玻片上,細胞密度達80%以后加入成骨誘導培養基,每3 d換1次液,4周后用4%的多聚甲醛固定15 min,PBS洗3遍,加1%茜素紅溶液,37℃染色30 min,雙蒸水洗去多余的染料,晾干,甘油明膠封片,光鏡下檢查。
1.5 富含血小板血漿(PRP)的制備:20 ml無菌注射器抽取抗凝劑枸櫞酸鈉2 ml,于新西蘭大白兔耳中動脈抽取18 ml動脈血,1 500 rpm離心20 min,使PRP/PPP和紅細胞分開,超凈臺內吸取全部上清液、白膜層及以下2 mm的紅細胞層,置于抗凝管中,再次以2 000 rpm離心10 min,棄掉部分上清液,剩余液體即為PRP;按照10∶1比例加入激活劑(10%CaCl2+凝血酶),20 s即凝固,將PRP凝膠剪碎平均分成6份,置于4℃冰箱中備用。
1.6 脂肪移植物的制備及移植方法;兔耳緣靜脈注射3%戊巴比妥鈉(1 ml/kg),取頸背部脂肪清理并修剪,將脂肪組織剪成直徑為1 mm的顆粒。每個樣本加入1×106個第三代脂肪基質干細胞。1 ml的針管18號白色針頭吸取脂肪移植物,在裸鼠背部及裸鼠腹股溝皮下利用針頭潛行分離,注射構建的脂肪復合物,背部皮下組及腹股溝皮下組各6個標本,每個點注射0.3 ml脂肪復合體(ADSCs+PRP+脂肪顆粒)。
1.6 B超測量移植物體積方法:測量由2位固定的醫生執行以減少系統誤差,測量介質為水。測量指標為移植物的長、寬和高,通過計算公式:1/2×a×b×c(a長、b寬、c高)來計算體積[6],對第1、2、4、6周進行測量。存活率=各時間點測量脂肪體積/0.3×100%。
1.7 統計學分析:統計分析運用SPSS 26.0軟件,對不同移植部位的脂肪存活率進行分析。分析方法:運用重復測量的方差分析來評價背部移植組與腹股溝移植組移植物體積隨時間變化的差異。
2 結果
2.1 ADSCs的體外培養及多向誘導能力檢測:對新西蘭兔切去脂肪組織進行原代培養。8 h細胞貼壁,24 h貼壁完成,72 h更換培養液,培養細胞呈多角形、短梭形(圖1A),傳代后漸漸成為均質的長梭形細胞。取第3代培養細胞進行成脂肪、成骨誘導。加入成脂誘導液后,細胞逐漸變為多角形,3 d后細胞內可見小脂滴形成,4 d后脂滴逐漸變大(圖1B)。油紅〇染色見紅染的脂滴(圖1C)。加入成骨誘導液3 d后,細胞變成短梭形,4周后茜素紅染色陽性(圖1D)。
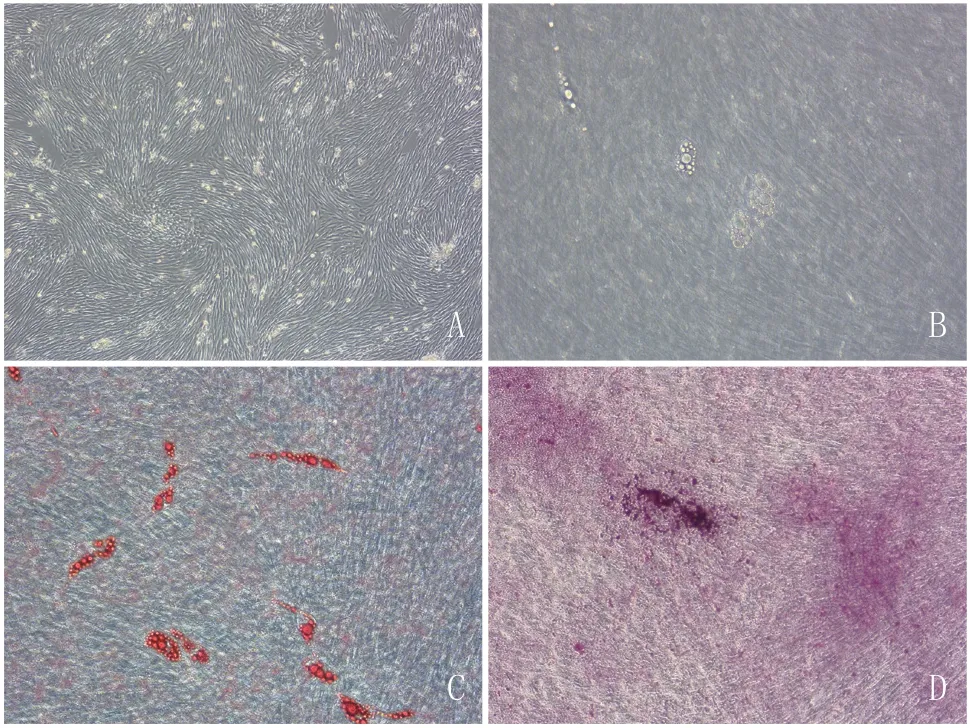
圖1 脂肪基質干細胞(ADSCs)的成脂、成骨誘導
2.2 不同移植部位的可注射組織工程化脂肪存活率:大體肉眼觀察,兩組移植裸鼠均存活,脂肪移植物健康,無感染及排斥反應發生。隨時間變化,裸鼠腹股溝及背部脂肪移植物體積逐漸變小。第6周時,腹股溝移植組脂肪體積明顯大于背部移植組(圖2)。
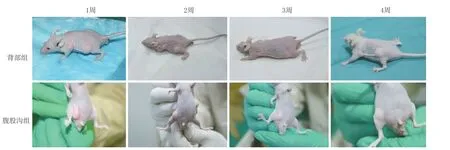
圖2 兩組第1、2、4、6周大體觀察
B超對兩組移植物不同時間點體積進行測量(圖3),并計算存活率。腹股溝組與背部組存活率隨時間的推移逐漸降低(表1),第2~4周降幅最大,第6周時腹股溝組的存活率明顯高于背部組(P<0.05),差異有統計學意義。運用重復測量的統計學分析,兩組的存活率有顯著差異(P=0.033),腹股溝組存活率高于背部組(見表1)。
表1 兩組第1、2、4、6周移植脂肪存活率比較 (±s,%)

表1 兩組第1、2、4、6周移植脂肪存活率比較 (±s,%)
注:*表示腹股溝組與背部組的重復測量分析有統計學差異(n=6,P<0.05),#表示兩組第6周比較,P<0.05。
images/BZ_12_213_400_1179_461.png
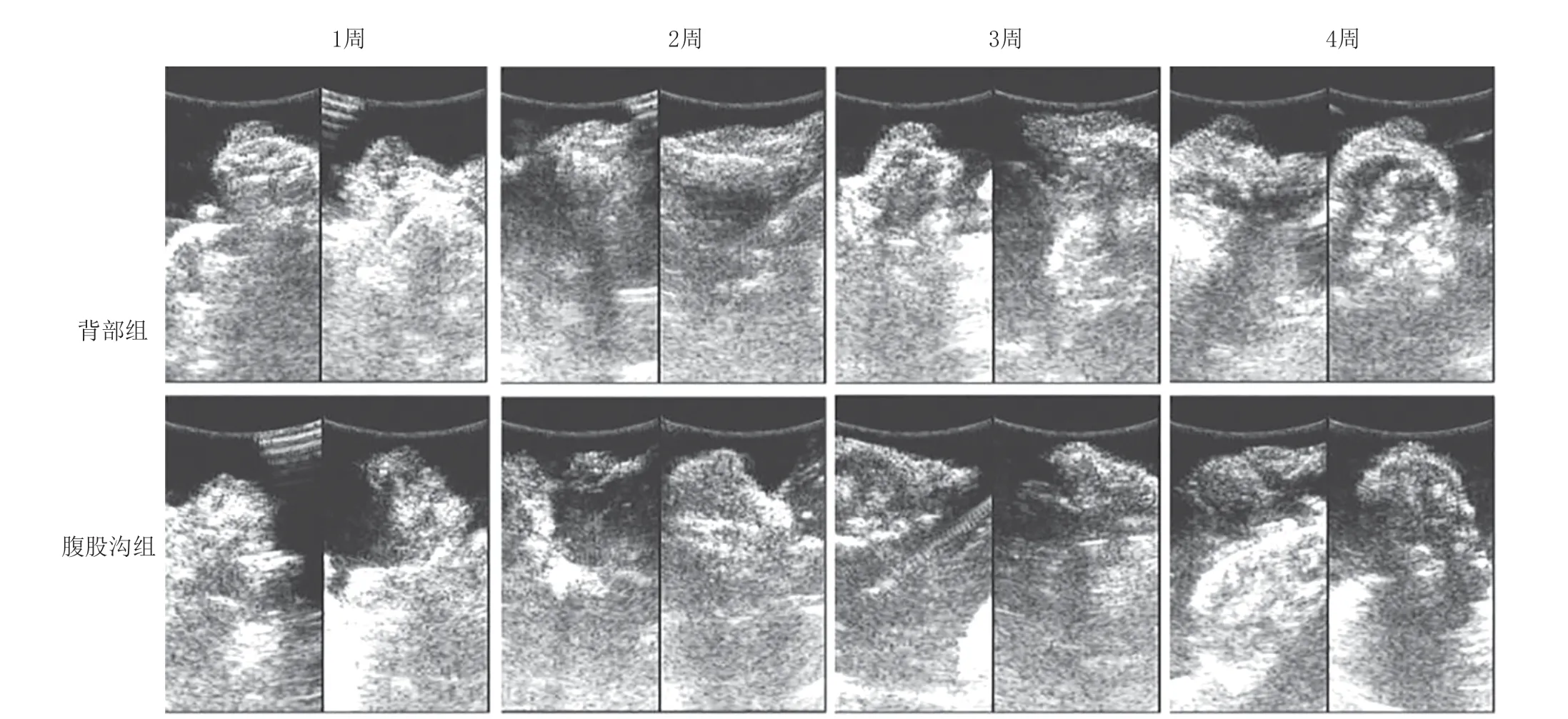
圖3 兩組第1、2、4、6周B超測量脂肪移植物體積變化情況
3 討論
創傷、感染、腫瘤、先天畸形等各種因素可以導致頜面部軟組織大面積缺損,自體組織移植是目前頜面軟組織修復重建的主要手段,包括皮瓣移植、皮膚擴張、脂肪移植等技術[7]。其中,脂肪移植因其具有操作簡便、取材方便、來源豐富、組織相容性好等特點被廣泛運用于臨床。隨著對脂肪移植研究的不斷深入,在移植手術中對于脂肪的獲取、處理、移植后處理等環節也得到不斷的更新和優化[8]。目前,脂肪移植不僅用于軟組織的修復重建,在美容整形領域也有廣泛運用[9]。脂肪移植不僅可以單獨應用,也可以與皮瓣移植結合使用,術后的效果比傳統皮瓣移植更加自然、患者滿意度高。而脂肪移植技術在應用過程中也存在移植脂肪吸收率高等難題,其中移植脂肪組織的血供重建是影響治療效果的關鍵因素[10]。
脂肪基質干細胞(Adipose-derived stem cells,ADSCs)是組織工程中常用的種子細胞。其具有多項分化作用,在合適的條件下ADSCs能夠被誘導成為成脂細胞、軟骨細胞、肌細胞、神經細胞、成骨細胞和內皮細胞;另外,移植的ADSCs能通過旁分泌作用促進組織建立新生血管、調節炎性反應來刺激宿主來源干細胞成脂[11-12]。富含血小板血漿(PRP)能夠緩慢釋放各種生長因子,可以促進血管內皮細胞再生。PRP與脂肪顆粒聯合注射后,可以增大脂肪顆粒周圍毛細血管密度,提高脂肪移植的生存率[13]。本課題組[14]通過脂肪基質干細胞復合PRP運用于脂肪移植中,能夠顯著提高移植脂肪的存活率。
唐軍[15]等對Wistar雌性大鼠背部皮下和股二頭肌內進行組織工程脂肪移植,發現背部皮下組脂肪存活率優于股二頭肌組,認為背部皮下為良好的移植位點。本研究通過將組織工程脂肪復合物移植于裸鼠背部皮下與腹股溝皮下,觀察移植物體積變化,從而判斷不同部位對于脂肪移植后生存率的影響。通過重復測量的方差分析,腹股溝皮下組移植后體積大于背部皮下組,體積變化差異P=0.033<0.05,差異有統計學意義;第1、2、4周時,組間對比P>0.05,組間差異無統計學意義;第6周時,組間對比P<0.05,腹股溝皮下組體積大于背部皮下組,體積差異有統計學意義。腹股溝皮下脂肪移植能夠減少脂肪移植后的吸收。實驗結果可能與裸鼠腹股溝皮下血供良好、機械張力小等因素有關,其細胞與分子學機制需要進一步研究。
總之,組織工程化脂肪生存率有耐于良好的成脂微環境,血運供應和機械張力都應該是動物模型建立需要考慮的問題。本研究發現可注射組織工程化脂肪的裸鼠腹股溝皮下移植組存活率大于背部皮下移植,為組織工程脂肪移植受區的選擇提供一些參考。

