昆崳山區欲植赤松林地赤枯病病基指數預測*
胡瑞瑞 梁 軍 謝 憲 車吉明 苑曉雯 張英軍 張星耀
(1.中國林業科學研究院森林生態環境與保護研究所 國家林業和草原局森林保護學重點實驗室 北京 100091;2.天津市植物保護研究所 天津 300380; 3.昆崳山森林生態系統定位研究站 煙臺 264100)
赤松赤枯病(Pestalotiopsisfunerea)是森林生態系統中主要為害松屬(Pinus)樹種幼齡林植株葉部的病害(Sousaetal., 2004; Orlikowskietal., 2014)。在南方主要為害馬尾松(Pinusmassoniana)、海岸松(P.pinaster)、濕地松(P.elliottii)、油松(P.tabulaeformis)等。我國東北地區優良造林樹種之一的樟子松(P.sylvestrisvar.mongolica)也遭受著赤枯病的為害(徐陽等, 2017)。赤枯病主要危害松樹的新葉,但發病嚴重時也會使2年生針葉受害,引起枯梢(梁軍等, 2016),導致林分一片枯紅,甚至影響生態系統的穩定性(Lietal., 2012)。松針受害初期,受害處出現水漬狀黃色段斑,然后段斑逐漸變為褐色且略微細縊,最后形成灰白色或暗灰色病斑,常以一暗紅色的環作為病健分界的標志,黑色分生孢子盤自病部突出。干物質質量和脫落率均隨病害的加重而加大,同時嚴重影響樹高生長量(邱德勛等, 1980)。長期以來,昆崳山赤松(Pinusdensiflora)林頻繁遭受赤枯病的威脅,大量赤松的針葉受害。因此,及時開展赤松赤枯病的調控機制和防治措施的研究十分必要。
立地因子如坡向、海拔、坡度、土壤理化性質等(Gaston, 2000)都會影響病蟲害的發生。立地因子通常通過影響林分群落各層物種組成間接影響病蟲害的發生(張子良等, 2014),且影響不同林分病蟲害發生程度的主導因子不同(程立超等, 2016)。在實際營林過程中,常會因沒有考慮當地的立地條件而盲目引種和造林,結果出現樹種和立地不匹配,林木遭受嚴重病害的現象。如遼寧省章古臺以樟子松為主要的固沙林樹種,因在早期引種時沒有考慮立地要素對該樹種生長的影響,致使低洼積水和干燥處嚴重發生松枯梢病(宋曉東, 2000)。我國海南因盲目從廣東引種桉樹(Eucalyptus)的無性系苗木,沒有提前對適合海南桉樹無性系的立地條件的種類進行研究,從而造成桉樹潰瘍病(Phomaeucalyptica)、青枯病(Pseudomonassdancearum)、枯梢病(Sphaeropsissapinea)和焦枯病(Cylindrocladiumscoparium)的嚴重發生(牛勇, 2007)。因此應對欲種植在林地上的特定樹種與欲植林地的適合性做出預判,使其因與立地相匹配而輕度或極輕度地遭受特定病原物的侵染。本研究以赤松赤枯病病基指數(胡瑞瑞等, 2020)為基礎,建立其與立地因子的關系方程,用于定量預測欲植林地種植赤松后其遭受赤枯病病原菌侵染的程度,以期避免在赤枯病潛在嚴重危害的林地上種植赤松。
1 研究區概況
昆崳山(121°41′34″—121°48′04″E,37°11′50″—37°17′22″N)位于山東半島東部,東與黃海毗鄰,北與渤海相望,山脈地跨威海和煙臺兩界,總面積15 416.5 hm2。該區域受暖溫帶季風氣候影響,氣候溫和,年均氣溫12.3 ℃,年降水量為800~1 200 mm,年均相對濕度62.6%,無霜期200~220 天。土壤多為棕壤,且大部分為沙質壤土。森林類型有赤松林、黑松(Pinusthunbergii)林、日本落葉松(Larixkaempferi)/杉木(Cunninghamialanceolata)林、針葉樹麻櫟(Quercusacutissima)林、針葉樹雜木林和闊葉林6種。赤松作為昆崳山的主要建群種,從山麓至海拔800 m均有分布。
2 研究方法
2.1 樣地設置
依據昆崳山二類森林資源調查數據提供的信息,于2017年5—8月進行樣地的選取并展開調查工作。選取林齡相對一致[(34±2年)]、林相整齊、空間分布均勻的赤松純林,設立121個臨時調查樣地(30 m×30 m)。
2.2 赤松赤枯病病基指數的獲得
各樣地的病基指數通過查閱赤松赤枯病病基指數曲線群圖獲得。在病基指數曲線群圖中,橫坐標為各樣地的林分密度,縱坐標為病情指數。因此,若已知每塊樣地的林分密度和病情指數,便可查出其對應的病基指數(胡瑞瑞等, 2020)。
2.3 因子項目和類目的選擇
選擇地形地貌因子: 海拔、坡度、坡向、坡位和坡形; 選擇土壤因子: 土壤質地、土層厚度和腐殖質層厚度。并對各個定性因子進行分級處理,連同協變量,共19個類目(表1)。
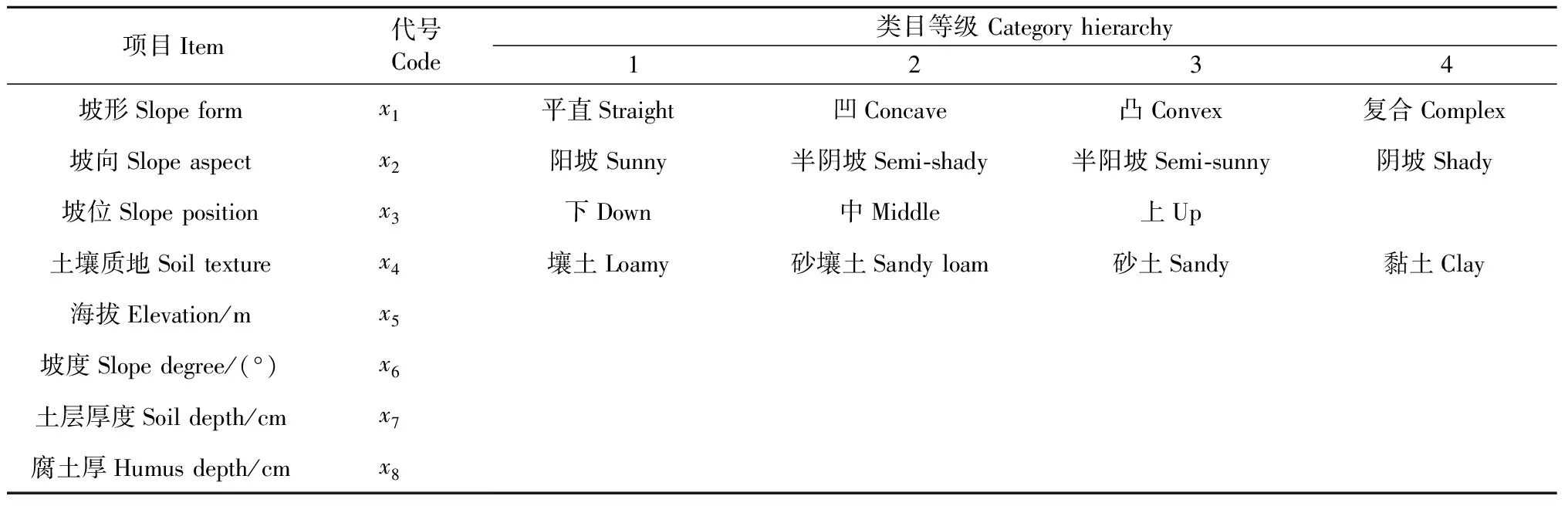
表1 各立地因子項目及類目劃分標準Tab. 1 Criteria for classification of each site factor item and category
2.4 赤松赤枯病病基指數立地因子模型的建立
數量化模型表示形式:
(1)
2.5 自變量的篩選
在數量化理論Ⅰ輸出結果的因子方差分析表中,通過各項目對赤松赤枯病病基指數影響的顯著性大小,篩選出對病基指數具有顯著影響的立地因子,將其作為模型的自變量。
2.6 模型評價
模型的評價包含2部分: 第一,對所構建模型本身的評價,主要通過決定系數R2和均方根誤差RMSE來評價; 第二,利用未參加建模的數據(20%樣本數據)對由赤松赤枯病病基指數-立地因子模型推算出的病基指數進行評價,除R2和RMSE外,還選用平均誤差MAE、總體相對誤差TRE和平均預估誤差MPE 3個指標,確定模型的擬合效果和可靠性(惠剛盈等, 2010; 馬克西等, 2018)。
決定系數:
(2)
均方根誤差:
(3)
平均誤差:
(4)
總體相對誤差:
(5)
(6)
2.7 數據分析
赤松赤枯病病基指數在各關鍵因子中的分布特征通過單因素方差分析,并進行Tukey多重比較,差異在5%的水平上顯著。以上操作全部在SPSS v22.0(美國, IBM)中完成。
數量化方法Ⅰ既可以處理海拔、坡度、土壤厚度等定量的立地因子,又可以處理坡向、坡位和土壤質地等定性的立地因子,通過F檢驗來篩選對因變量有顯著影響作用的因子,并建立因變量對自變量的回歸方程(李長虹, 1994)。通過Forstat 2.1(北京, 中國)建立欲植林地病基指數-立地因子模型。
3 結果與分析
3.1 關鍵立地因子的篩選
通過F檢驗可知,立地因子中,海拔、腐殖質層厚度和土壤質地對病基指數的影響極顯著(P<0.01),坡向對病基指數的影響顯著。由平方和的值可知,4個關鍵立地因子對病基指數的貢獻大小順序是坡向<土壤質地<海拔<腐殖質層厚度(表2)。

表2 關鍵立地因子的篩選Tab. 2 The screening of key site factors
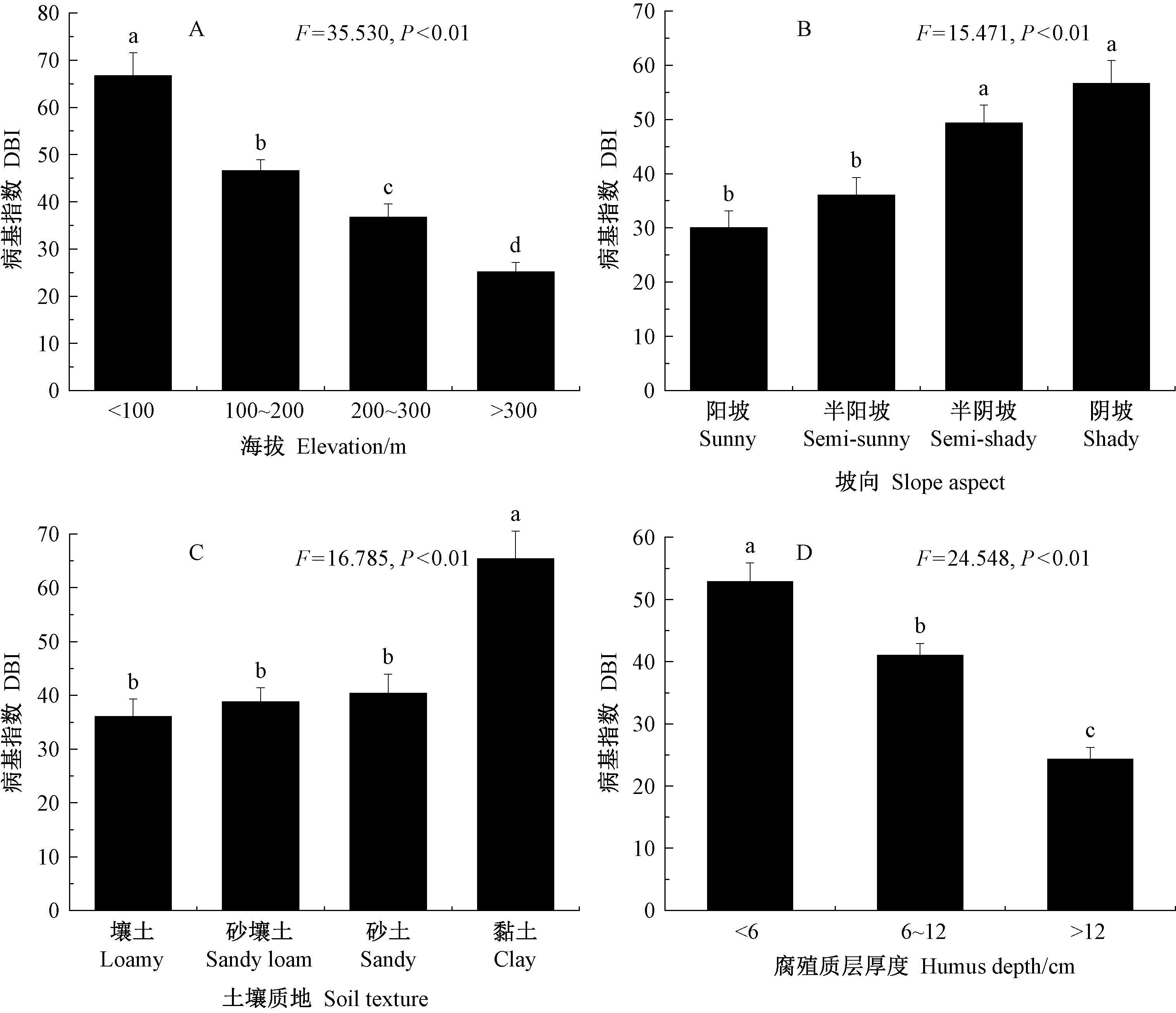
圖1 病基指數與關鍵立地因子的關系Fig.1 The relationship between DBI and key site factors
3.2 病基指數與關鍵立地因子的關系
為明確赤松赤枯病病基指數在各關鍵立地因子中的分布情況,將各立地因子按實際分布范圍進行分組。由圖1A可知,赤松赤枯病在低海拔林分(<100 m)、中海拔林分(100~200 m, 200~300 m)和高海拔林分(>300 m)的分布情況。研究海拔對赤枯病病基指數的影響,表明病基指數在不同海拔分組間差異顯著(F=35.530,P<0.01),病基指數以高海拔林分最低,平均值為25.17,屬于Ⅱ級; 以低海拔林分最高,平均值為66.67,屬于Ⅳ級,說明赤松赤枯病的病基指數與海拔呈負相關。
由圖1B可知,病基指數在不同類型的坡向中差異極顯著(P<0.01),陽坡的病基指數顯著低于陰坡和半陰坡的值,但略低于半陽坡的值,即與半陽坡的組間差異不顯著。
將土壤質地分為壤土、砂壤土、砂土和黏土4種類型。由圖1C可知,赤枯病病基指數在生長于粘土的赤松林分中發生最嚴重(65.38,Ⅳ級),但其他3組中赤松的病基指數差異不顯著。總體上,不同分組的土壤質地對赤枯病病基指數的影響顯著(F=16.785,P<0.01)。
土壤腐殖質層厚度分為: Ⅰ組: <6 cm; Ⅱ組: 6~12 cm; Ⅲ組: >12 cm。由圖1 D可知,赤枯病的病基指數隨土壤腐殖質層厚度的增大而顯著減小(F=24.548,P<0.01)。
3.3 欲植林地病基指數方程的建立
每個項目的最后一個類目是多余參數,因此得分為0。將全部類目和赤松赤枯病病基指數進行擬合,得方程表達式(1):y=80.720-2.345x11-0.897x12-0.224x13+9.461x21+6.461x22+1.689x23-6.034x31-4.912x32-15.058x41-14.001x42-13.728x43-0.053x5-0.074x6-0.009x7-1.678x8。在所有類目中,陰坡、半陰坡、下坡位、土壤質地各類目、海拔和腐殖質層厚度的P值均小于0.05,說明有較大的把握認為這些類目的系數不等于0。
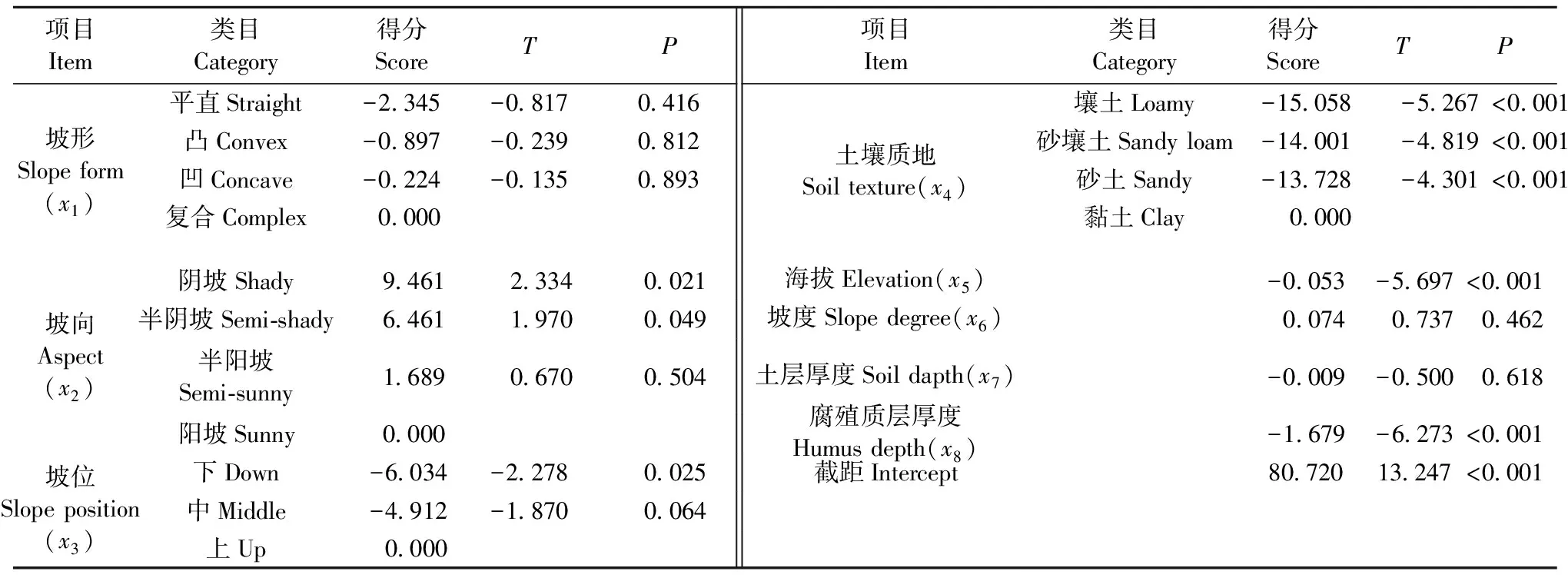
表3 各立地因子的數量化得分Tab. 3 Quantitative score of each site factor
利用4個關鍵立地因子建立其與赤松赤枯病病基指數的方程,表達式(2)為:y=77.055+9.081x21+6.425x22+1.689x23-15.031x41-14.868x42-14.125x43-0.052x5-1.605x8。除陰坡和半陽坡外,其余所有類目的P值均小于0.05,說明這些參數不等于0的可靠性均達95%以上,對病基指數的影響極顯著(表4)。
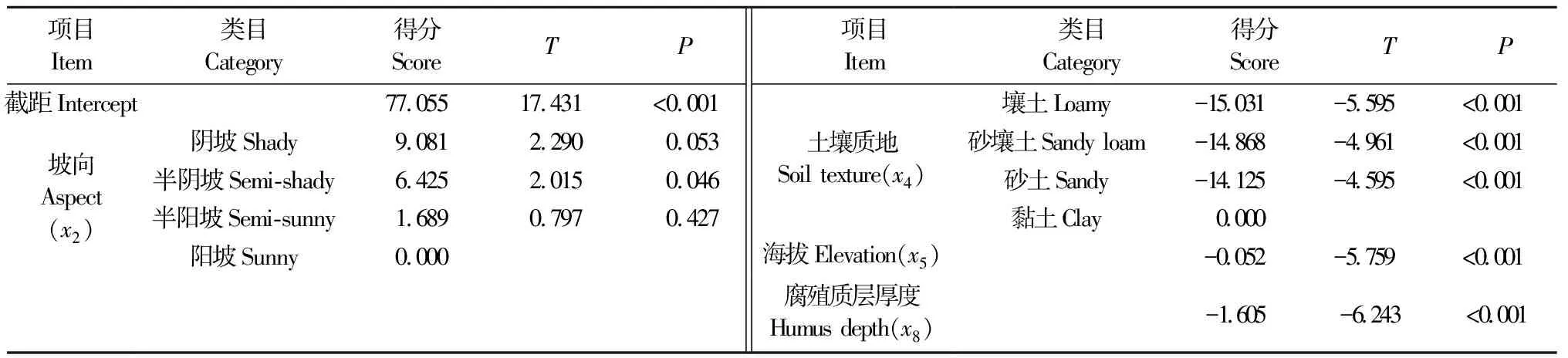
表4 關鍵立地因子數量化得分Tab. 4 Quantitative score of key site factors
3.4 欲植林地病基指數方程模型的評價
F檢驗表明,模型(1)和(2)的復相關系數R分別是0.842 6和0.814 9,且P<0.01,說明回歸方程非常顯著,而且復相關關系緊密,故所建立的2個預測方程均有實際意義。同時,決定系數R2分別是0.710 0和0.678 0,均方根誤差RMSE分別是8.259 4和10.685 4,表明方程均較可靠。以上評價指標說明用關鍵立地因子和用全部立地因子所建方程的擬合效果相近,所以,用4個關鍵立地因子表示其與赤松赤枯病病基指數的方程模型,既符合精度要求又減少了工作量。
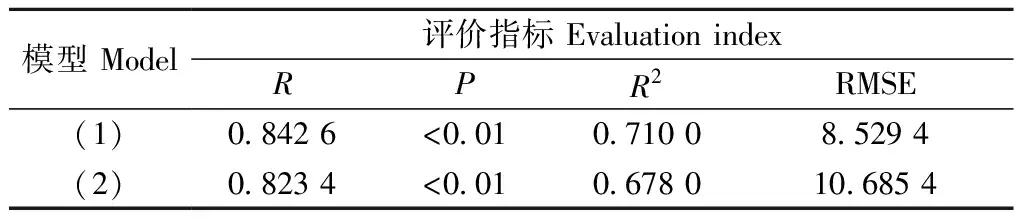
表5 赤松赤枯病病基指數模型擬合結果Tab. 5 Fitting results of site factors and disease based index to pine needle blight
依據方程(2),分別根據所調查的4個關鍵立地因子,求出未參與建模的24個樣地的立地對赤松赤枯病潛在發生程度的預估等級,并與實測等級進行比較(表6)。立地對赤松赤枯病發生的評估等級是依據不同區間的病基指數劃分所得,因此只要病基指數落在同一區間范圍內,則評估等級就相同。結果表明,在24個調查樣地中,只有4個樣地的評估等級有錯誤,使樣本平均正確率為83.33%。模型的5個統計指標分別為:R2=0.664 0,RMSE=11.293 2,MAE=9.735 0,TRE=-1.40%,MPE=8.73%。TRE接近于0,而MPE小于10%,說明平均預估精度在90%以上。圖2表明預測值與實測值之間的符合度較高,相關系數的平方是0.730 8。

表6 所建模型用于赤松赤枯病病基指數預測時的評價指標Tab.6 Evaluation index of developed models for predicting DBI of pine needle blight
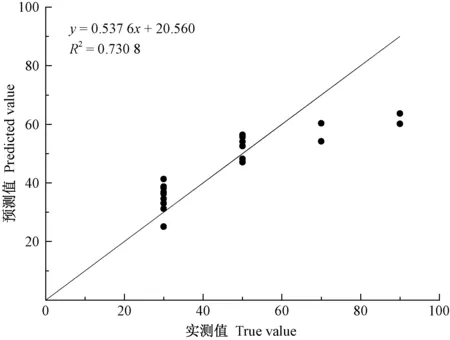
圖2 赤松赤枯病病基指數的預測值和實測值Fig.2 Predicted-Measured value of disease based index of pine needle blight
3.5 欲植林地病基指數方程的應用
為定量評價立地對赤松赤枯病發生狀況的作用等級,將病基指數分成Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ5個級別。所以在欲植林地模型中,也將病基指數的值域(0~100)平均劃分為5個區間。若所得病基指數落在[0, 20)區間內,則該欲植林地的病基指數為Ⅰ,赤松赤枯病在這類立地中極輕度發生; 若所得病基指數落在[20,40)區間內,則該欲植林地的病基指數為Ⅱ,表示立地對赤松赤枯病潛在發生程度的作用等級為Ⅱ級; 若所得病基指數落在[40,60)區間內,則該欲植林地的病基指數為Ⅲ; 若所得病基指數落在[60,80)區間內,則該欲植林地的病基指數為Ⅳ或70; 當所得病基指數≥80時,表明該欲植林地的病基指數是Ⅴ或90,赤松與這類立地非常不匹配,赤松赤枯病會特重度發生。
如果測量一塊欲植林地的各項立地指標,海拔是220 m,坡向為陰坡,土壤質地為砂土,腐殖質層厚度是20 cm,則代入公式y=77.055+9.081x21-14.125x42-0.052x5-1.605x8得病基指數y=28.47,表明該欲植林地對赤松赤枯病潛在發生程度的作用等級是Ⅱ級,或是赤松赤枯病在此立地中為輕度發生。
對昆崳山區赤松純林,要使赤枯病僅極輕度或輕度發生,則需將赤松選擇在高海拔(660 m)的陽坡,且土壤質地為壤土,腐殖質層厚度為15 cm處種植,代入公式求得此時的病基指數y=3.62。此時,立地對赤松赤枯病潛在發生程度的作用等級是Ⅰ級,為極輕度發生, 即,在這類立地中種植的赤松遭受赤枯病原菌侵染的程度極低。但需避免在低海拔處的陰坡、土壤質地為黏土且腐殖質層薄的區域種植赤松,如赤松在昆崳山區分布的最低海拔是57 m,最薄腐殖質層厚度是3.73 cm,代入公式得病基指數y=77.19。此時,立地對赤松赤枯病潛在發生程度的作用等級是Ⅳ級,為重度發生, 即,在這類立地中種植赤松,極易遭受赤枯病原菌的侵染。
4 討論
在8項立地因子中,F檢驗篩選出海拔、坡向、土壤質地和腐殖質層厚度為影響病基指數大小的顯著因子。當赤松林的土壤質地為黏土時,其潛在發生赤枯病的嚴重程度顯著高于其他3種質地(壤土、砂壤土和砂土)下的赤松林。黏土顆粒間孔隙較小,會阻礙根系對土壤養分的吸收,進而影響赤松的生長和對病原菌的抵抗能力(曹光明, 2004)。空氣濕度隨著海拔的升高而下降,但氮素含量在高海拔地區的值較高(Westbeeketal., 1999; Hikosakaetal., 2002),這些都不利于赤枯病病原菌的生存和侵染。在本研究調查的時間段內,昆崳山區降水較少、普遍干旱,所以濕度成為該地區影響赤枯病發病的主要因素。濕度是影響病原菌孢子萌發及侵染的最重要因素(張劍斌等, 2000),陰坡和半陰坡空氣濕度大,有利于病原菌孢子的萌發和菌絲的侵染(Metzetal., 2000)。土壤腐殖質層厚度反映土壤的受侵蝕程度,土壤腐殖質層厚度減小時,土壤質地加速粗化(王旭艷等, 2011)。赤松赤枯病病基指數在腐殖質層薄的林地中最大,分析可能是因為腐殖質層厚度較小時,立地的質地較差、營養缺乏,赤松赤枯病容易嚴重發生。
要預測一塊欲植林地種植赤松后發生赤枯病的一般潛在程度,則需建立赤松赤枯病病基指數立地因子方程模型。依據該模型,若已知某欲植林地的立地因子,則可求出該林地的病基指數; 再對應上述病基指數曲線群,便可預判出欲植林地潛在遭受該病害的等級。該方程模型的自變量既有定性因子又有定量因子,因此,本研究運用數量化理論Ⅰ來進行建模,它可以使定性因子定量化,有效避免了人為的主觀性,使結論更加科學、合理(李真珍等, 2009); 且這些立地因子均可從傳統的森林資源調查中獲得,估算方法簡單易操作。本研究分別使用全部立地因子和4個關鍵立地因子建立與赤松赤枯病病基指數的關系模型,模型檢驗結果表明,2個方程的決定系數R2分別是0.710 0和0.678 0,說明它們具有較高的有效性(惠剛盈等, 2010),均方根誤差RMSE分別是8.529 4和10.685 4,表明方程均較可靠。以上評價指標說明用關鍵立地因子和用全部立地因子構建的方程模型擬合效果相近,且由4個關鍵立地因子建立的模型既滿足精度要求,又簡化了模型,減少了野外調查的工作量,所以,選其作為赤松赤枯病病基指數立地因子方程模型。對所選方程的場外檢驗表明,模型的預估精度在90%以上,立地對病害的作用等級評估時雖然有4個樣地的判斷有錯誤,但并沒有出現“跳級”的現象,屬于可接受的范圍。
因此,所建立的赤松赤枯病病基指數立地因子方程模型可以指導昆崳山區赤松的科學經營,避免在潛在遭受赤枯病病原菌嚴重侵染的立地上種植赤松。但該模型的病基指數由查找赤松純林的赤枯病病基指數曲線群獲得,只適用指導昆崳山區赤松的種植。因此,今后的研究需將繼續建立赤枯病病原菌侵染其他針葉樹種的病基指數曲線群和病基指數立地因子方程模型,進而達到通過配置合適的樹種,將該林地的病害發生嚴重程度控制在最低水平的目標。
5 結論
相關性分析表明,海拔、坡向、土壤質地和腐殖質層厚度極顯著影響病基指數的大小。其中,病基指數的值在低海拔、陰坡、黏土和腐殖質層厚度小的樣地類型中較大,說明這種類型的林地對赤松赤枯病潛在發生程度的作用等級較大,為重度或特重度危害。
運用數量化理論Ⅰ建立的4個關鍵立地因子與赤松赤枯病病基指數模型具有良好的擬合效果,可以便捷、準確地判斷欲植林地潛在遭受赤松赤枯病為害的可能或等級。通過該模型指導昆崳山區赤松林的科學經營,避免在潛在遭受赤松赤枯病嚴重為害的林地上種植赤松。

