單葉蔓荊種子休眠特性與解除方法*
尹德潔 布鳳琴 徐艷芳 黃 彪 李 成
(1.山東建筑大學風景園林研究中心 濟南 250101; 2.國際竹藤中心 國家林業和草原局/北京市共建竹藤科學與技術重點實驗室 北京 100102)
單葉蔓荊(Vitexrotundifolia)又名蔓荊子,為馬鞭草科(Verbenaceae)牡荊屬(Vitex)落葉小灌木,主要分布在沙灘海岸前沿、海邊及湖畔,在我國主要集中分布于山東、河北、遼寧、江蘇、福建、浙江、安徽、江西、廣東、臺灣等地。植株具有防風固沙及改良土壤作用,果實為傳統中藥,具有鎮痛降壓作用,對心血管疾病有顯著療效。隨著人們不斷深入認識單葉蔓荊的較高開發利用價值(喬勇進等, 2001),其需求量俱增,導致野生種質資源日漸稀少,已被列入國家Ⅲ級瀕危保護植物。單葉蔓荊在生產上主要以扦插和斷蔓等營養繁殖為主,種子繁殖困難,無法形成播種產業化種植。目前研究多集中在化學成分、藥理作用及生態效應上(常宗濤等, 2016; 陳懷遠等, 2018; 魏宗賢等, 2011),對種子萌發條件及休眠特性等種苗繁殖的研究較少。
自然界中不同植物在長期進化中形成不同種子休眠特性,可分5類(Baskinetal., 2004): 1)物理休眠(physical dormancy, PY),通常由果皮或種皮中存在的不透水的柵欄細胞所引起,通過機械損傷可解除休眠,如白皮松(Pinusbungeana)、歐榛(Corylusavellana)、栝樓(Trichosantheskirilowii)(郭聰聰等, 2019; 孫婷等, 2008; 王世杰等, 2018)等。2) 生理休眠(physiological dormancy, PD),是最普遍的休眠類型,又可分為深度、中度和淺度生理休眠。深度生理休眠種子的離體胚不能正常生長或產生畸形苗,種子萌發需低溫層積處理3~4個月,赤霉素處理不能破除休眠,如挪威槭(Acerplatanoides)(付婷婷等, 2009); 中度生理休眠種子的離體胚能正常生長,赤霉素處理可促進部分種類種子萌發,低溫層積2~3個月便可萌發,如歐亞槭(Acerpseudoplatanus)(洑香香等, 2011); 大多數種子屬淺度生理休眠,離體胚能產生正常幼苗,赤霉素處理和層積處理能解除休眠。3)形態休眠(morphological dormancy, MD),屬非生理休眠,此類種子的胚雖已分化但未發育完全,解除休眠需較長時間讓胚生長至足夠體積,如牡丹(Paeoniasuffruticosa)(潘昊磊等, 2019)和貝母屬(Fritillaria)植物(朱敏嘉等, 2019)。4)形態生理休眠(morphophysiological dormancy, MPD),指種子的胚未發育完全,同時具有生理休眠,如巫山淫羊藿(Epimediumwushanense)(蘇賀, 2016)和凹葉木蘭(Magnoliasargentiana)(唐安軍, 2014)。5)復合休眠(combinational dormancy, PY+PD),指胚具有生理休眠,同時種皮或果皮有不透水性,如窄葉野碗豆(Viciaangustifolia)(張瑞等, 2014)。本文研究了單葉蔓荊種子的休眠特性,并探討解除休眠方法,為其保護及利用、人工種苗繁育及規模化種植提供參考。
1 材料與方法
1.1 試驗材料 單葉蔓荊果實于2018年10月采于山東省濱州市(117°51′21.41″E,38°15′52.73″N),果實采回置于室內自然風干后,置于4 ℃冰箱中保存待用。選擇發育飽滿且完好的果實進行發芽試驗。
1.2 試驗方法 1) 果實和種子形態特征及空殼率的測定 對完整的單葉蔓荊果實及種子形態進行觀察,注意有無果柄及是否宿存萼片; 選取生長一致的果實,從中部橫切和縱切,觀察果實內部組織結構; 用游標卡尺測定果實大小; 用萬分之一電子天平測定果實千粒質量; 隨機挑選100粒果實橫切,對種子進行計數,重復3次,凈度風選儀清選后計算空殼率。
2) 果實和種子吸水性 取果皮完整的果實和用小刀切割處理的果實各100粒,稱其質量,浸入3倍于果實體積的蒸餾水中,置于25 ℃恒溫培養箱內,在前12 h每2 h取出果實后用濾紙快速吸干表面水分并稱量,以后每6 h稱量1次,直至質量恒定。試驗3次重復,計算果實吸水率[吸水率=(濕質量-干質量)/干質量×100%]。
解剖出單葉蔓荊種子,取有完整種皮的種子和用小刀破皮的種子各100粒,用上述同樣的方法計算種子吸水率,試驗重復3次。
3) 萌發抑制物部位及類型的測定 取2份去掉宿存花萼的完整單葉蔓荊果實2 g,用0.1%的KMnO4溶液消毒,蒸餾水中浸泡24 h,自然風干后分離果皮和種子,分別充分研磨成粉末,并分別用蒸餾水和甲醇定容至20 mL。置于4 ℃振蕩培養箱中浸提36 h,4 ℃、4 000 r·min-1的冷凍離心機中離心15 min,取上清液。將蒸餾水上清液定容至20 mL; 用旋轉蒸發儀在56 ℃下對甲醇上清液進行處理,使甲醇揮發干凈,用蒸餾水溶解剩余物質,并定容至20 mL。即得濃度為0.1 g·mL-1的蒸餾水和甲醇粗提物母液,試驗重復3次。
參照王小平等(1998)的方法,設置粗提物濃度為0(CK)、0.1、0.01、0.05 g·mL-1,每個處理取30粒白菜種子,放在有雙層濾紙的培養皿中,加入10 mL粗提物溶液,在25 ℃恒溫培養箱中培養,保持培養皿濕潤,48 h后測定白菜種子發芽率,72 h后測量根長和苗高,并計算內源萌發抑制物活性(抑制物活性=1-處理組發芽率/對照發芽率×100%)。
4) 種子休眠解除方法 將用0.1%的KMnO4溶液消毒后的單葉蔓荊果實置于蒸餾水中,浸泡24 h后,進行不同處理(表1)。
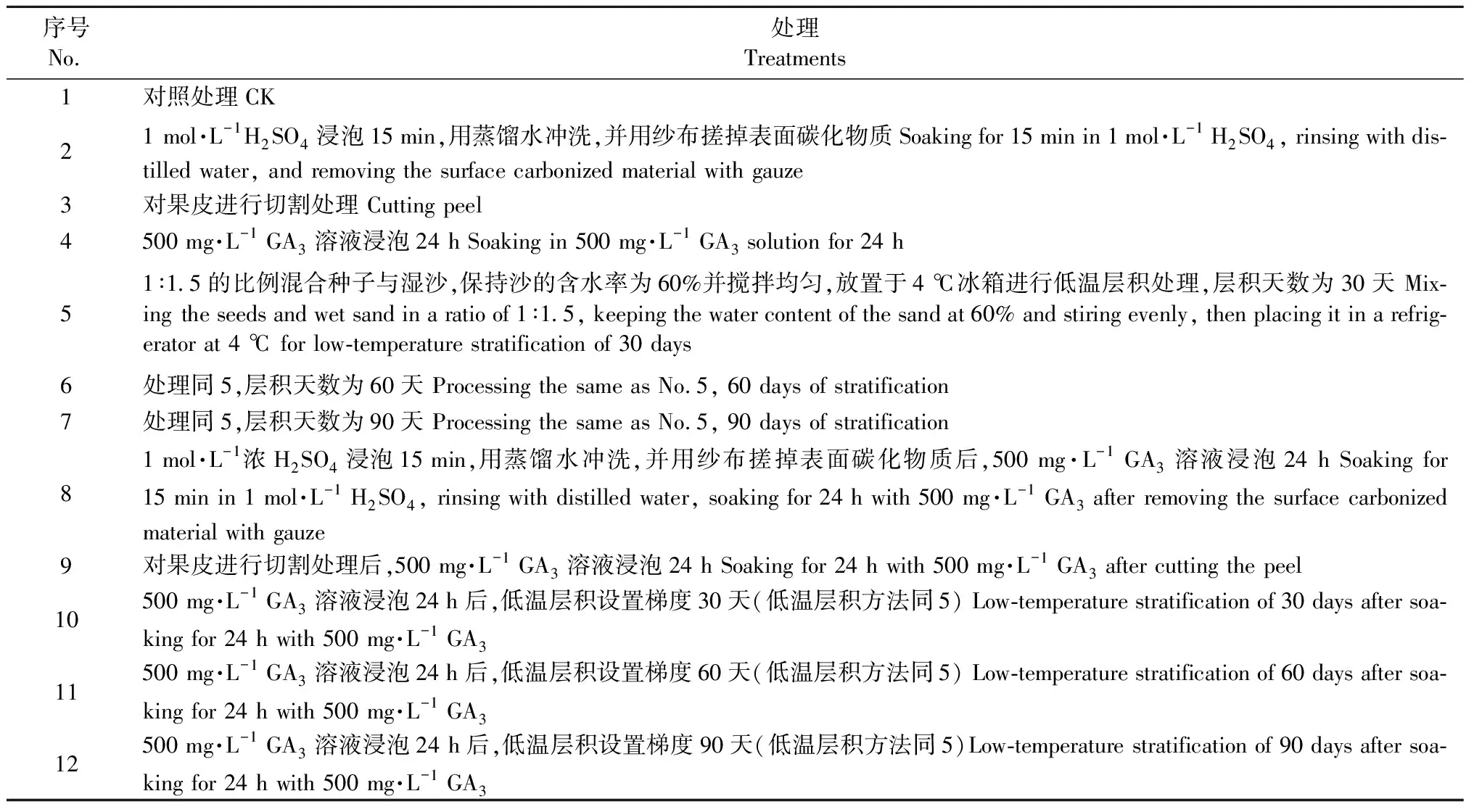
表1 對單葉蔓荊果實的不同試驗處理Tab.1 Different experimental treatments on the fruits of Vitex rotundifolia
每個處理均選取飽滿果實50粒,置于雙層濾紙的培養皿中,在25 ℃恒溫培養箱中進行發芽試驗,每個處理重復3次。保持濾紙濕潤,每天觀測,胚根突出種皮的長度為種子長度的一半時為種子萌發。第30天測定發芽勢(GP),第45天統計發芽率(GR)、發芽指數(GI)和活力指數(VI),測量根長(cm),發芽試驗持續觀測時間為45天。發芽勢和發芽指數能衡量種子的發芽能力,即萌發的速度和整齊度; 而活力指數反映的是種子萌發的動力。
發芽勢=(第30天發芽數/供試種子總數)×100%;
發芽率=(第45天發芽數/供試種子總數)×100%;
發芽指數=∑Gt/Dt;
活力指數=發芽指數×根長。
式中,Gt為發芽后第t日的發芽數,Dt為Gt對應的發芽天數。
萌發抑制物清除 取去掉宿存花萼的完整單葉蔓荊果實2 g,用0.1%的KMnO4溶液消毒且用蒸餾水浸泡24 h后,用500 mg·L-1的GA3溶液浸泡24 h。處理完成后參照3)進行粗提物制備及其活性測定。設置粗提物的濃度為0(CK)、0.1、0.01、0.05 g·mL-1,24 h后測定白菜種子發芽率,48 h后測量根長和苗高。
1.3 數據分析 數據采用Microsoft Excel和SPSS 19.0軟件進行統計分析和圖表處理。
2 結果與分析
2.1 單葉蔓荊果實的形態特征 單葉蔓荊果實為圓球形核果(圖1),成熟后表面黑色或褐色,花萼宿存; 果實具短小果梗,縱軸為4.0~6.0 mm,短軸為3.8~5.8 mm。橫切面果皮厚,包括灰黑色的外層和黃白色的內層,內果皮由完全木栓化的石細胞層組成,內外層之間有棕褐色排列成環的油點; 內含種子通常為0~4粒,種仁黃白色或白色。單葉蔓荊果實平均千粒質量為29.15 g,空殼率為26%。

圖1 單葉蔓荊果實組織結構及種子萌發Fig.1 Fruit organization and seed germination of V. rotundifoliaA. 完整果實Complete fruit; B. 果實橫切面Fruit cross section 1: 4粒種子Four seeds; 2: 3粒種子Three seeds; 3: 2粒種子Two seed; 4: 1粒種子One seeds; 5: 無種子No seeds. C. 果實橫切面(圖中等比例擴大3倍)Fruit cross section (triple the proportion) a. 外果皮Exocarp; b. 內果皮Endocarp; c. 外果皮和內果皮之間排列成環的油點The oil spots are arranged in a ring between exocarp and endocarp; d. 種子Seed。 D. 種子發芽過程Seed germination.
2.2 單葉蔓荊果實和種子吸水性 由圖2可知,單葉蔓荊果實浸水后立即吸漲,浸種2 h吸水最快,為急劇吸水期; 浸種18 h后開始較為緩和的吸水階段,未切割果皮的和切割果皮的果實的吸水率分別達到(103.99%±7.43%)和(155.67%±2.33%)。總體來看,在0~36 h內,未切割果皮和切割果皮的果實的吸水率表現出相似變化,但數值相差較大,且切割果皮的果實吸水率一直較高,說明果皮對果實及內部種子吸水有明顯機械阻礙。由圖3可知,單葉蔓荊種子百粒質量為0.231 4 g,吸水18 h后質量達到恒定,完整的和破皮的種子百粒質量分別為0.273 8 g和0.275 3 g,且吸水率差值不明顯,說明單葉蔓荊種子沒有吸水障礙。
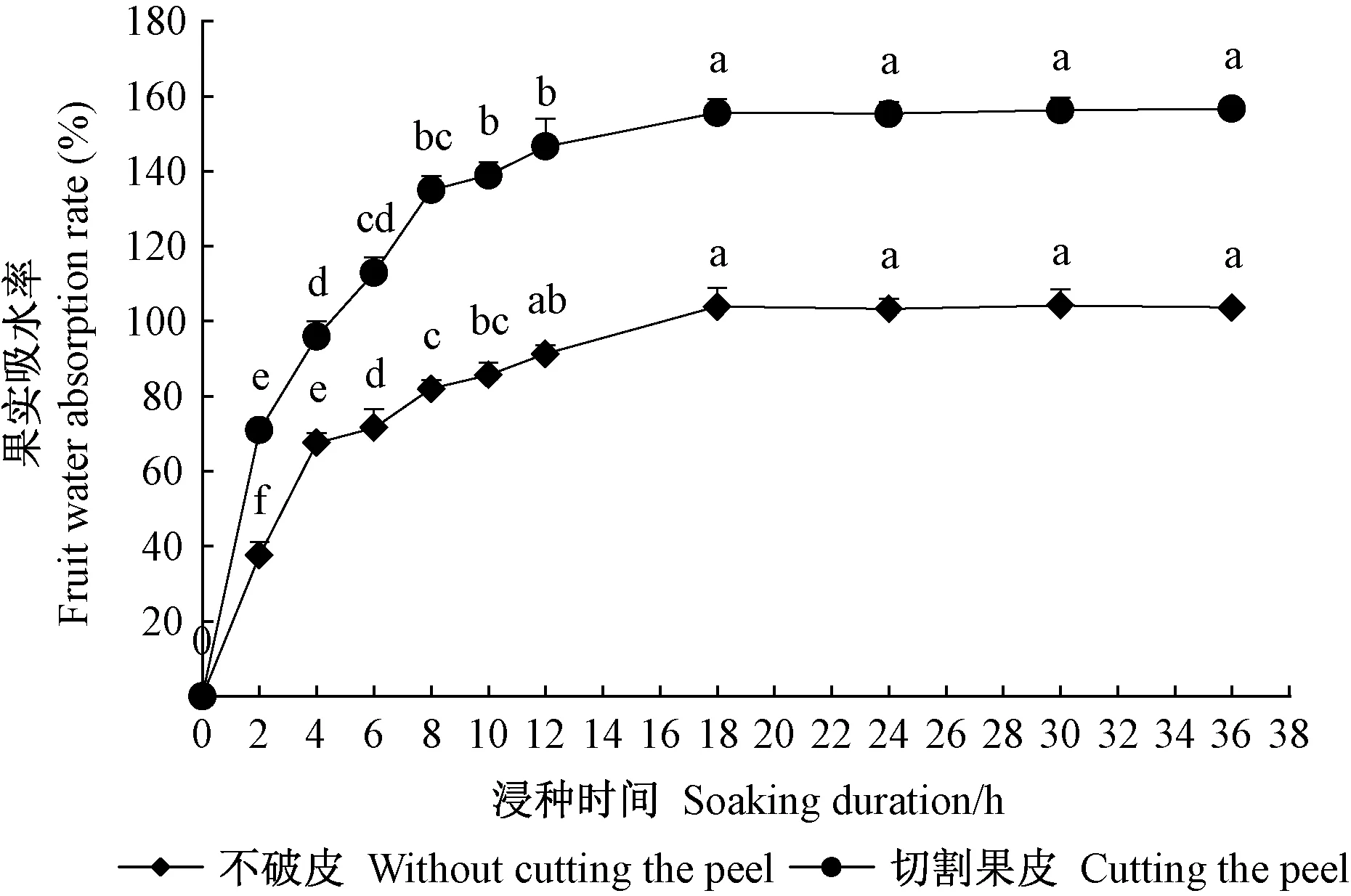
圖2 在20 ℃條件下單葉蔓荊果實吸水率隨浸泡時間的變化Fig.2 Changes of water absorption of V. rotundifolia fruit to soaking duration under 20 ℃
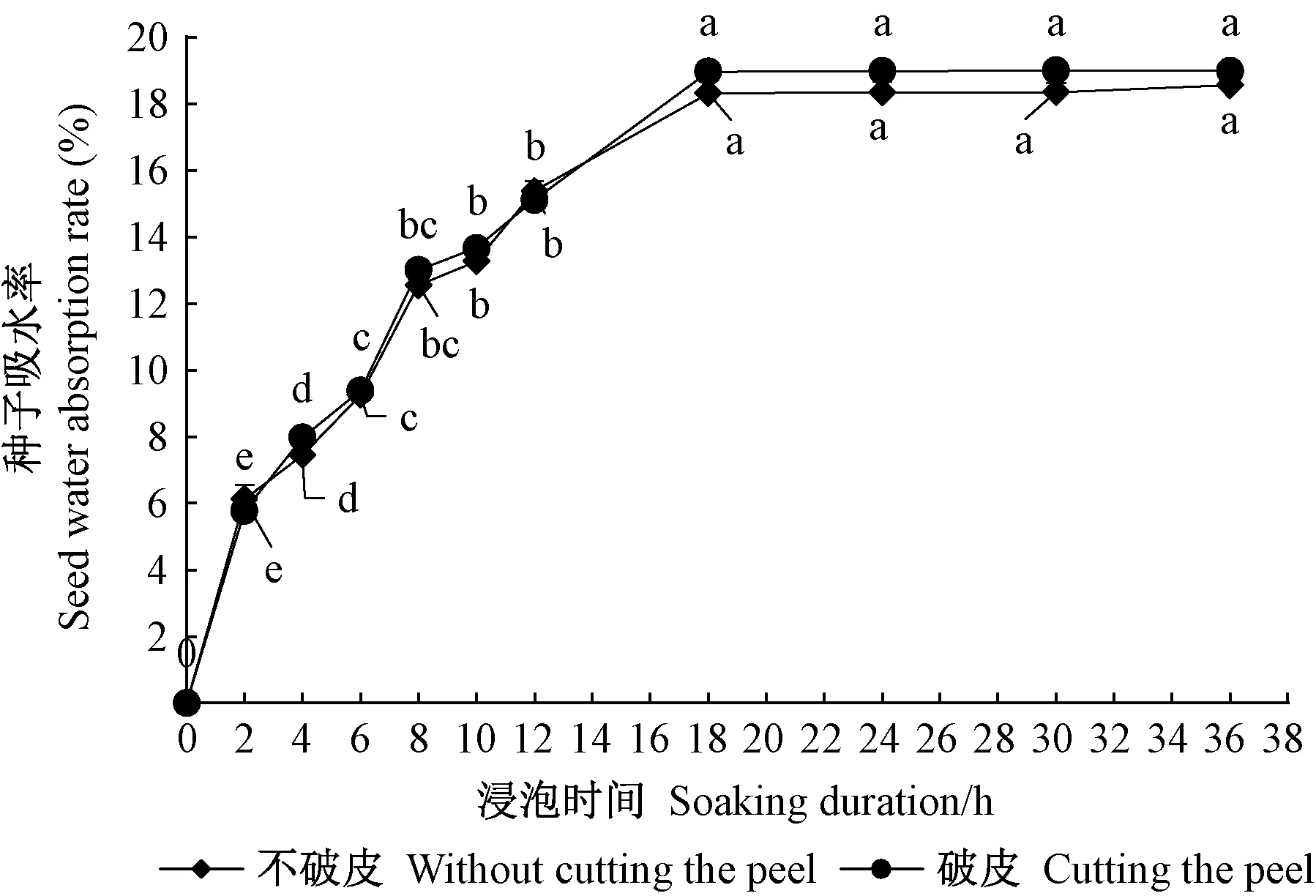
圖3 在20 ℃條件下單葉蔓荊種子吸水率隨浸泡時間的變化Fig.3 Changes of water absorption of V. rotundifolia seed to soaking duration under 20 ℃
2.3 萌發抑制物對白菜種子萌發特性的影響 1) 果皮不同浸提液對白菜種子萌發及幼苗生長的影響
由表2可知,單葉蔓荊果皮水浸提液和甲醇浸提液對白菜種子發芽的抑制作用,隨浸提液濃度增加而逐漸增強。不同濃度的水浸提液和甲醇浸提液的發芽率組間差異顯著(P<0.05)。水浸提液濃度為0.01、0.05、0.1 g·mL-1時,發芽率比對照分別降低40.33%、41%、43.66%,水浸提液濃度為0.1 g·mL-1時的發芽率顯著低于濃度0.01、0.05 g·mL-1時; 不同濃度甲醇浸提液的發芽率與對照相比差異顯著,濃度在0.01、0.05、0.1 g·mL-1時比對照分別降低38.66%、39.35%、41%。
由表2可知,隨著果皮水浸提液和甲醇浸提液濃度升高,對白菜根長生長的抑制逐漸增強,對照的主根長為2.13 cm,而不同濃度的水浸提液、甲醇浸提液處理后的主根長分別為1.33~1.35 cm、1.31~1.75 cm。不同濃度水浸提液的白菜幼苗主根長與對照相比有顯著差異,不同濃度間差異不顯著; 甲醇浸提液濃度為0.05和0.1 g·mL-1時,主根長與對照相比差異顯著,且處理間差異不顯著。由此可知,果皮水浸提液對白菜主根長的抑制作用更明顯。隨著果皮水浸提液和甲醇浸提液濃度升高,對白菜苗高生長的抑制作用也逐漸增強,當水浸提液濃度和甲醇浸提液濃度為0.05和0.1 g·mL-1時,苗高比對照顯著降低8.39%、8.81%和8.03%、8.63%,水浸提液對苗高的抑制作用要強于甲醇浸提液。
綜上說明,單葉蔓荊果皮內含有影響種子萌發的水溶性內源抑制物和醇溶性內源抑制物,且內源抑制物的活性和抑制種子發芽及幼苗生長的作用隨浸提液濃度增大而增強。果皮水浸提液的抑制作用高于甲醇浸提液,這可能是由于果皮內萌發抑制物的水中溶解性大于甲醇中溶解性。
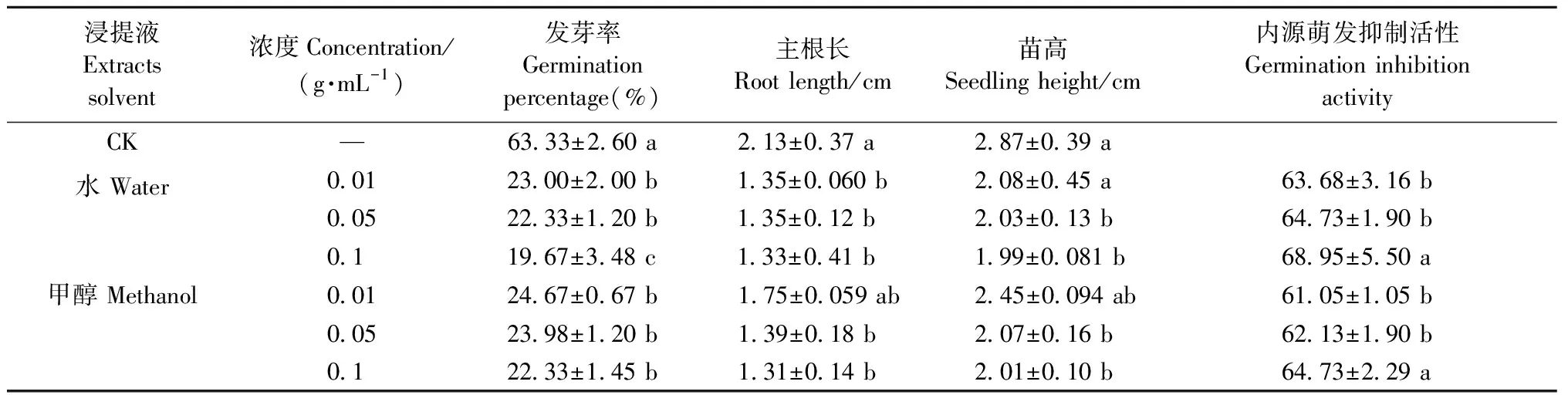
表2 果皮粗提物對白菜種子萌發及幼苗生長的影響①Tab.2 Effect of different peel extracts on seed germination and seedling growth of Chinese cabbage
2) 種子不同浸提液對白菜種子萌發及幼苗生長的影響 單葉蔓荊種子不同濃度的水浸提液和甲醇浸提液處理的白菜種子發芽率、根長和苗高與對照相比均無顯著差異(表2),說明單葉蔓荊種子不含使種子休眠的內源萌發抑制物質。
3) GA3處理后果皮提取液對白菜種子萌發及幼苗生長的影響 由表3可知,采用GA3處理后的單葉蔓荊果皮水浸提液和甲醇浸提液對白菜種子萌發和幼苗生長有抑制作用,且抑制作用隨濃度增大而增強。不同濃度的水浸提液和甲醇浸提液培養的白菜種子發芽率與對照相比均差異顯著,但不同濃度間差異不顯著。結合表2結果可知,經GA3處理的不同濃度浸提液培養的白菜種子,其發芽率均要高于未處理,說明GA3處理后降低果皮浸提液抑制作用。尤其在濃度為0.01 g·mL-1時,果皮水浸提液和甲醇浸提液培養下的白菜種子發芽率較未用GA3處理時顯著提高23.25%和27.15%。
由表3可知,GA3處理后的果皮不同濃度水浸提液培養的白菜種子幼苗的根長與對照相比差異顯著,甲醇浸提液培養的幼苗根長在0.01 g·mL-1與對照相比無顯著差異,在0.05和0.1 g·mL-1時與對照相比差異顯著; 水浸提液培養的白菜種子幼苗的苗高在0.05、0.1 g·mL-1與對照相比有顯著差異,不同濃度甲醇浸提液培養的幼苗苗高與對照相比均無顯著差異。結合表2可知,GA3處理后的果皮浸提液培養的白菜幼苗根長和苗高均大于未經GA3處理時。綜上所述,GA3處理可減弱單葉蔓荊果實內源抑制物的活性。
2.4 解除休眠的方式 采用多種處理,研究單葉蔓荊種子的休眠解除方式。由表4可知: 對照(流水浸種24 h)、1 mol·L-1H2SO4、切割果皮、低溫層積30天以及低溫層積60天均不會使種子萌發,即不能解除種子休眠。而低溫層積90天、GA3、GA3+1 mol·L-1H2SO4、GA3+切割果皮、GA3+低溫層積(30、60、90天)均可促進種子萌發。其中GA3+1 mol·L-1H2SO4處理的種子發芽時間最短,為14天,比單純用GA3處理提前4天,比低溫層積90天處理提前11天。
GA3+1 mol·L-1H2SO4處理的單葉蔓荊種子發芽率最高(44%),分別比低溫層積90天、GA3、GA3+切割果皮、GA3+低溫層積(30、60、90天)提高28%、21.33%、10.67%、24.67%、22.67%、8%,均差異顯著; 其發芽勢比低溫層積90天、GA3、GA3+切割果皮、GA3+低溫層積(30、60天)分別顯著提高16.67%、13.34%、8.67%、14.67%、12.67%,但與GA3+低溫層積90天處理差異不顯著; 其發芽指數較低溫層積90天、GA3、GA3+切割果皮、GA3+低溫層積(30、60、90天)分別顯著提高5.72%、2.08%、2.79%、4.75%、4.58%、0.58%; 活力指數較低溫層積90天、GA3、GA3+切割果皮、GA3+低溫層積(30、60、90天)分別顯著提高7.05%、3.37%、4.83%、6.58%、6.17%、1.08%。
綜合不同處理結果可知,低溫層積90天、GA3、GA3+H2SO4、GA3+切割果皮、GA3+低溫層積(30、60、90天)均可不同程度地解除單葉蔓荊種子的休眠。在GA3+H2SO4處理下,種子發芽能力及種子活力最強,休眠解除作用最顯著。
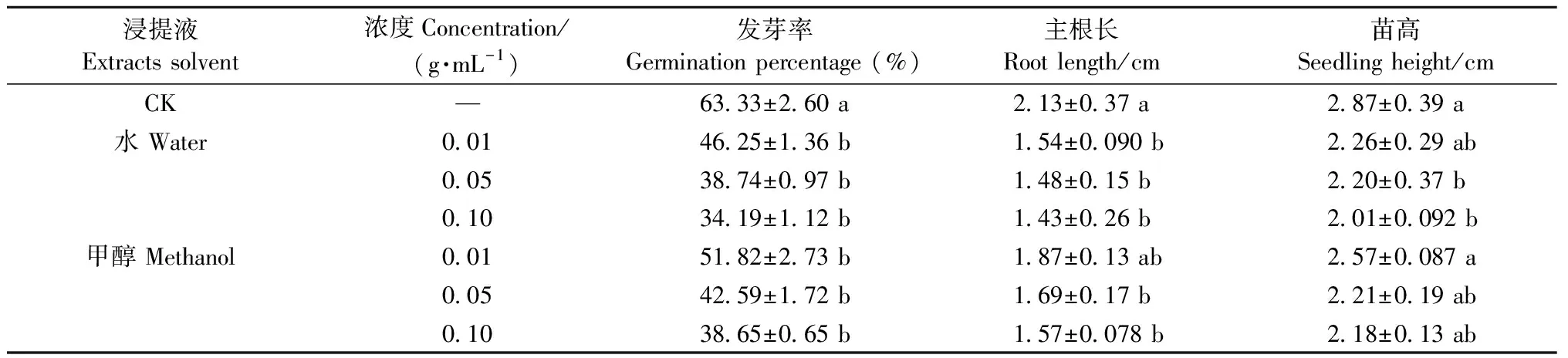
表3 GA3處理后不同浸提液對白菜種子萌發及幼苗生長的影響Tab.3 Effect of different extracts on seed germination and seedling growth of Chinese cabbage after gibberellin treatment
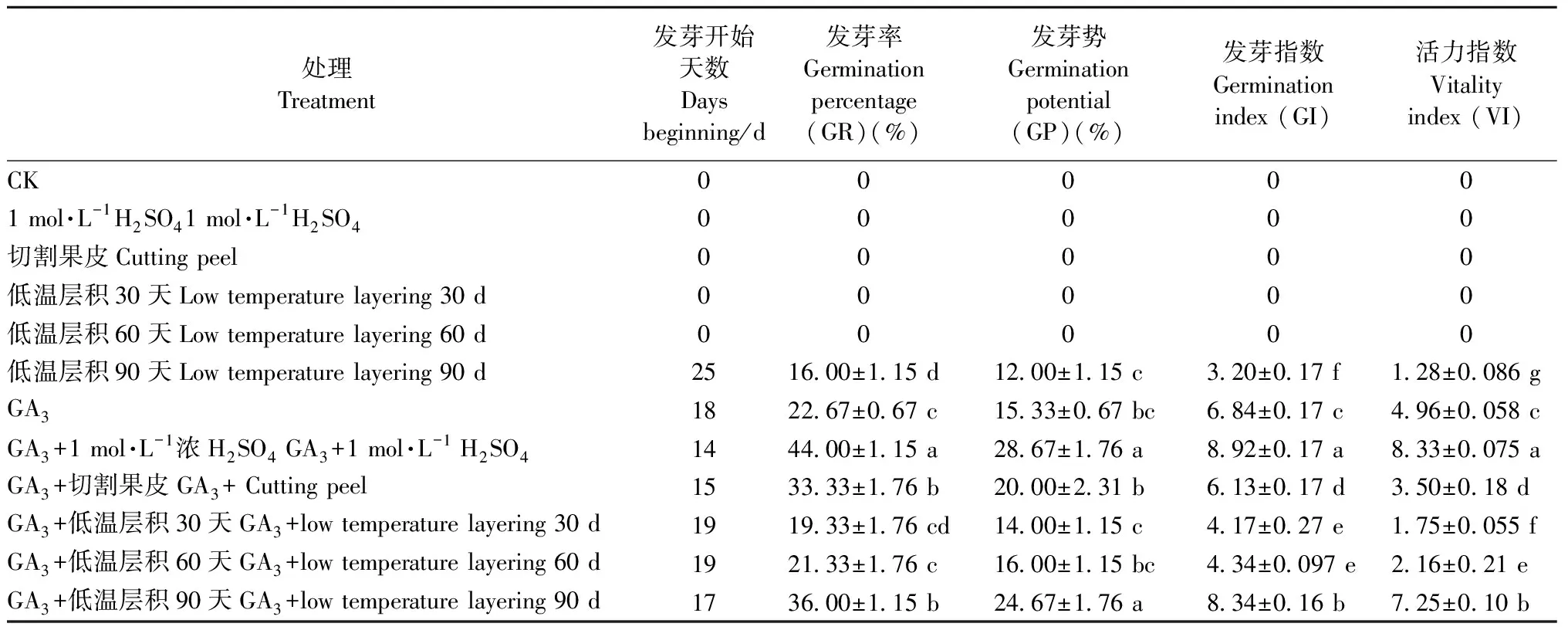
表4 不同處理對單葉蔓荊種子萌發的影響Tab.4 Influence of different treatments on germination of V. rotundifolia seeds
3 討論
3.1 影響單葉蔓荊種子休眠的主要因素 1)果皮是種子萌發的主要障礙 通過果實吸水性可知,果實破皮后的吸水率遠高于未破皮,且隨時間延長時二者也無法一致,說明堅硬果皮是種子吸水的阻礙因素之一。而種子破皮與不破皮處理的種子吸水率無顯著差異,說明種皮并無吸水障礙,這與對滇重樓(Parispolyphyllavar.yunnanensis)(黃瑋等, 2008)、紅芪(Hedysarumpolybotrys)(孫云波等, 2015)等的研究結果相似。
2) 果皮中內源抑制物是造成種子休眠的重要因素 單葉蔓荊果皮粗提物能明顯抑制白菜種子萌發和生長,說明果皮含有萌發抑制物質,青錢柳(Cyclocaryapaliurus)的果皮中也存在活性較強的引起種子休眠的內源抑制物質(尚旭嵐等, 2011)。內源萌發抑制物質引起的種子休眠歸為形態學-生理學休眠(Nikolaeva, 1977),很多研究認為內源激素的參與誘導生理休眠以及其維持和終止(顏啟傳, 2001)。GA3是一種重要的植物內源激素,對種子萌發有重要調節作用,是一種萌發刺激物。經GA3處理后的單葉蔓荊果皮粗提物能顯著促進白菜種子萌發和生長,萌發率和根長、苗高顯著高于未經GA3處理,說明GA3降低了果皮內抑制劑的作用,促進了內源GA3和生長素的合成,從而促使種子解除休眠,Debeaujon等(2000)研究表明,胚的生理休眠主要原因在于抑制劑濃度過高、促進劑濃度過低導致。而在單葉蔓荊種皮中不存在萌發抑制物質,這與孫榮進等(2012)研究結果一致。具有休眠特性的不同植物種子的萌發抑制物質存在的部位不同,如梔子(Gardeniajasminoides)(顏升等, 2014)存在于果肉和果皮中,沙拐棗(Calligonummongolicum)存在于果皮中(于卓等, 1998),黃山花楸(Sorbusamabilis)存在于果實中。抑制物質的活性強弱順序依次為果肉、果皮、種子(徐向東等, 2014)。
單葉蔓荊果皮中同時存在水溶性和醇溶性萌發抑制物,且水溶性萌發抑制物的活性更大,這與肉果秤錘樹(Sinojackiasarcocarpa)的果肉中的萌發抑制物研究結果相反(劉超等, 2013)。而在茅蒼術(Atractylodeslancea)和細葉鳶尾(Iristenuifolia)種子內僅含有醇溶性萌發抑制物質(張丹等, 2011)。在滇重樓種子中,乙醇提取液抑制活性強,而甲醇提取液抑制活性很弱(古今等, 2013)。
種子的休眠特性是長期演化中形成的適應外界不良環境的一種方式,具有重要意義(Kermode, 2005; Gusanoetal., 2004)。單葉蔓荊生長在沙灘海岸前沿,為沙生和鹽生植物,這一區域土壤干旱貧瘠,風大風多,時而發生短期海浸現象,因此單葉蔓荊演化出由完全木栓化的石細胞層組成的內果皮,僅在果梗處有一核孔吸收氧氣和水分。孫榮進等(2012)解剖發現,單葉蔓荊種子具有完整的胚,因此不存在生理后熟,即排除形態休眠。單葉蔓荊內果皮木栓化石細胞機械阻礙造成的物理休眠是造成種子萌發困難的主要障礙,果皮中的內源抑制物也是造成種子休眠的重要因素之一。對單葉蔓荊而言,影響種子萌發的關鍵因素都集中在果皮上,因此下一步應深入研究果皮的成分組成,通過液相色譜等手段鑒定出休眠物質成分,這也是本研究的不足之處。
3.2 破除單葉蔓荊種子休眠的處理方法 1) GA3可清除果皮中內源抑制物 采用低溫層積90天、500 mg·L-1GA3+濃H2SO4、500 mg·L-1GA3+切割果皮、500 mg·L-1GA3+低溫層積30天、500 mg·L-1GA3+低溫層積60天、500 mg·L-1GA3+低溫層積90天的處理,可打破種子休眠和促使種子萌發率提高。僅用物理手段如濃H2SO4和切割果皮來打破果皮機械障礙,并不能解除種子休眠,而用500 mg·L-1GA3處理可使種子萌發,說明內源萌發抑制物質是影響單葉蔓荊種子萌發的決定性因素。因此,要想解除單葉蔓荊種子休眠,必須要有GA3等外源萌發刺激物質來清除內源抑制物。
2) 低溫層積90天才可破除種子休眠 最常見的種子休眠類型為生理休眠,表現為種皮無吸水障礙,但胚生長能力較弱,需經過低溫層積或暖層積來提高胚的生長能力,以此來提高種子萌發率(Baskinetal., 2004; Carricketal., 1994)。在本研究中,低溫層積30、60天時,同樣不能使種子萌發,而層積90天時的種子得以萌發,與疏葉香根芹(Osmorhizaaristatavar.laxa)和野生黃瑞香(Daphnegiraldii)種子的研究結果一致(Walcketal., 2002; 閆芳等, 2016); 但與曹曉曉(2011)的單葉蔓荊種子低溫層積120天的萌發率依然為0的結果不同,這可能與本試驗在低溫層積之前流水浸種24 h有關。
由于單葉蔓荊果皮堅硬且難以去除,種子難以輕松剝取,因此生產中直接將單葉蔓荊果實視為種子進行播種。本試驗中雖剝取單葉蔓荊種子以進行種子吸水率研究,但在實際生產中,可對單葉蔓荊果實進行低溫沙藏,但低溫層積一般要3個月以上才可能解除種子休眠,如何采用更快速且易操作的方式處理單葉蔓荊果實,使種子快速、整齊的發芽,仍需進一步研究。
本研究中,500 mg·L-1GA3+濃H2SO4處理能較明顯地打破單葉蔓荊種子休眠,說明濃H2SO4腐蝕果皮打破了機械阻礙和GA3清除了內源萌發抑制物質,2個作用機制的結合是解除種子休眠和提高發芽率的最佳手段。但未來需進一步研究單葉蔓荊果皮內萌發抑制物的成分及GA3解除種子休眠的機制。
4 結論
單葉蔓荊種子休眠既有果皮結構造成的物理休眠因素,也有內源萌發抑制物的影響。克服堅硬果皮和清除萌發抑制物,是打破其種子休眠的關鍵。本研究中,采用500 mg·L-1GA3+濃H2SO4處理,可有效解除種子休眠,提高發芽率。

