免疫檢查點抑制劑聯合抗血管生成治療中晚期肝癌安全性和臨床效果的meta分析*
鮮 楓,張 弛,許國輝
(1.南充市中心醫院腫瘤中心,四川南充 637000;2.電子科技大學醫學院,成都 611731;3.四川省腫瘤醫院介入科,成都 610042)
肝癌在全球所有惡性腫瘤的發病率居第6位,致死率居第3位[1]。在中國,超過78%的肝癌發生與乙型肝炎病毒感染相關,肝癌成為危害我國居民健康的主要問題之一。肝細胞癌(HCC)患者早期經過手術切除等手段可獲得較高的5年生存率,而對于不可切除的晚期肝癌患者,治療手段較為局限且療效欠佳[2]。多靶點拮抗劑索拉菲尼和侖伐替尼作為晚期HCC的一線治療藥物,可在一定程度上控制腫瘤進展,但單藥的療效十分有限。近年來,免疫檢查點抑制劑(ICIs)的出現為晚期肝癌的治療提供了新方案。肝臟具有特殊的免疫抑制細胞體系,使其存在固有免疫耐受狀態,因此肝癌在發生時會通過多途徑導致腫瘤“免疫逃逸”。ICIs通過解除免疫抑制,對肝癌的治療發揮作用,其中納武利尤單抗及帕博利珠單抗被多個指南推薦為晚期肝癌二線治療用藥[3-4]。血管生成和免疫逃逸是肝癌發生和發展的兩種途徑[5],抗血管內皮生長(VEGF)療法聯合ICIs在理論上既可以促進HCC的血管正常化,也可以增強腫瘤免疫反應[6-9]。目前,部分臨床研究表明ICIs聯合抗血管新生藥物可以提高對肝癌的治療效果,但在該聯合方案的療效及安全性方面尚無一致性結論。本研究為全面評估ICIs聯合抗血管藥物治療肝癌的療效及安全性,對現有使用ICIs聯合抗血管藥物治療肝癌的臨床研究進行系統評價和薈萃分析,以提供科學依據。
1 資料與方法
1.1 文獻納入及排除標準
納入標準:(1)分為ICIs聯合抗血管生成組和對照組,治療肝癌患者所開展的隨機對照研究或回顧性研究,對照組為ICI單藥或抗血管生成單藥;(2)經手術或穿刺病理活檢證實為原發性HCC;(3)所有研究必須提供無進展生存(PFS)時間、總生存(OS)時間、客觀緩解率(ORR)、常見不良反應發生率等以下至少1個研究終點指標,文獻中需報告PFS或OS時間及其危險比值(HR)、95%置信區間(95%CI);(4)對于同一作者的研究,僅納入近期發表或樣本量較大、質量較高的研究。排除標準:(1)研究類型未明確說明;(2)無法從文中提取有效結局數據;(3)重復文獻;(4)無法獲取全文;(5)樣本量太小(組中病例數<5例);(6)文獻中病例包含非原發性HCC患者或患者同時患有其他惡性腫瘤性疾病;(7)文獻來源為綜述、會議報告、個案報告等文獻;(8)涉及藥物不同劑量的自身對照及未設置對照組的研究。
1.2 文獻檢索
檢索Pubmed、Embase、Web of science(WOS)、ClinicalTrails.gov、中國生物醫學文獻數據庫(CBM)、中國知網(CNKI)、維普-中文科技期刊系統數據庫(VIP)、萬方數據資源系統等數據庫及中國臨床實驗注冊中心(ChiCTR)。檢索時限為從建庫至2022年2月10日。英文檢索詞:“Liver Cancer”“Hepatocellular Carcinoma”“immune checkpoint inhibitors”“PD L1 Inhibitors”“Molecular Targeted Therapy”“Angiogenesis Inhibitors”“VEGFR targeted therapy”。中文檢索詞:“肝癌”“免疫檢查點抑制劑”“PD-1/PD-L1抑制劑”“分子靶向藥”“血管生成抑制劑”“VEGFR抑制劑”“血管內皮生長因子受體拮抗劑”。對檢索結果的參考文獻做進一步檢索,以防漏檢。
1.3 數據提取
由兩名研究員分別對檢索文獻進行篩選,并且對文獻的一般信息和研究信息進行提取,當存在爭議時由通信作者決定是否納入。文獻篩選時先讀取文獻題目和摘要,在排除明顯不相關的文獻后,進行全文閱讀以確定是否最終納入。
資料提取的內容包括:(1)納入研究的基本信息,包括研究題目、研究類型、第一作者、發表時間等;(2)研究對象的基本特征,包括樣本總數、入組病例性別構成等;(3)干預的具體方法、隨訪時間等;(4)所關注的結局指標;(5)文獻質量評價所需要的信息。
1.4 文獻質量評估
按照Cochrane協作網編輯的“Cochrane偏倚風險評估工具”,按以下6個方面對納入的研究進行評價:(1)隨機分配方法;(2)分配方案隱蔽;(3)盲法;(4)結果數據的完整性;(5)選擇性報告研究結果;(6)其他偏倚來源(樣本量少、隨訪偏倚、干預措施偏倚等)。依據偏倚風險評估標準,對以上偏倚做出“低偏倚風險”“不清楚”和“高偏倚風險”判斷,利用Rev Man 5.3軟件繪制偏倚風險圖。如遇到分歧,經兩名研究者及通信作者討論、協商后達成一致。
1.5 統計學處理
采用RevMan 5.3和Stata 14.0軟件對提取的數據進行分析。二分類變量采用相對危險度(RR)及其95%CI對合并效應量進行統計分析。采用Mantel-Haenszel法進行分析,檢驗水準α=0.05。采用χ2檢驗對各組研究的異質性進行分析,當I2≤50%、P≥0.1時采用固定效應模型分析;當I2>50%、P<0.1時表明研究異質性大,采用隨機效應模型分析。當檢測到顯著異質性時,通過拉貝圖、星狀圖并排除個別研究后進行敏感性分析,以探尋異質性來源。當納入文獻少于3篇時,僅對結果做描述性分析。采用Begg法檢測發表偏倚。
2 結 果
2.1 文獻檢索結果
在所選數據庫中,共檢索到文獻2 656篇,按照納入、排除標準進行篩選,剔除重復的803篇文獻,通過閱讀題目、摘要排除meta分析、系統評價、綜述及動物實驗類文獻899篇、研究內容不吻合的文獻914篇,閱讀全文后最終納入9篇文獻[10-18],文獻篩選流程見圖1,納入文獻的基本特征見表1。
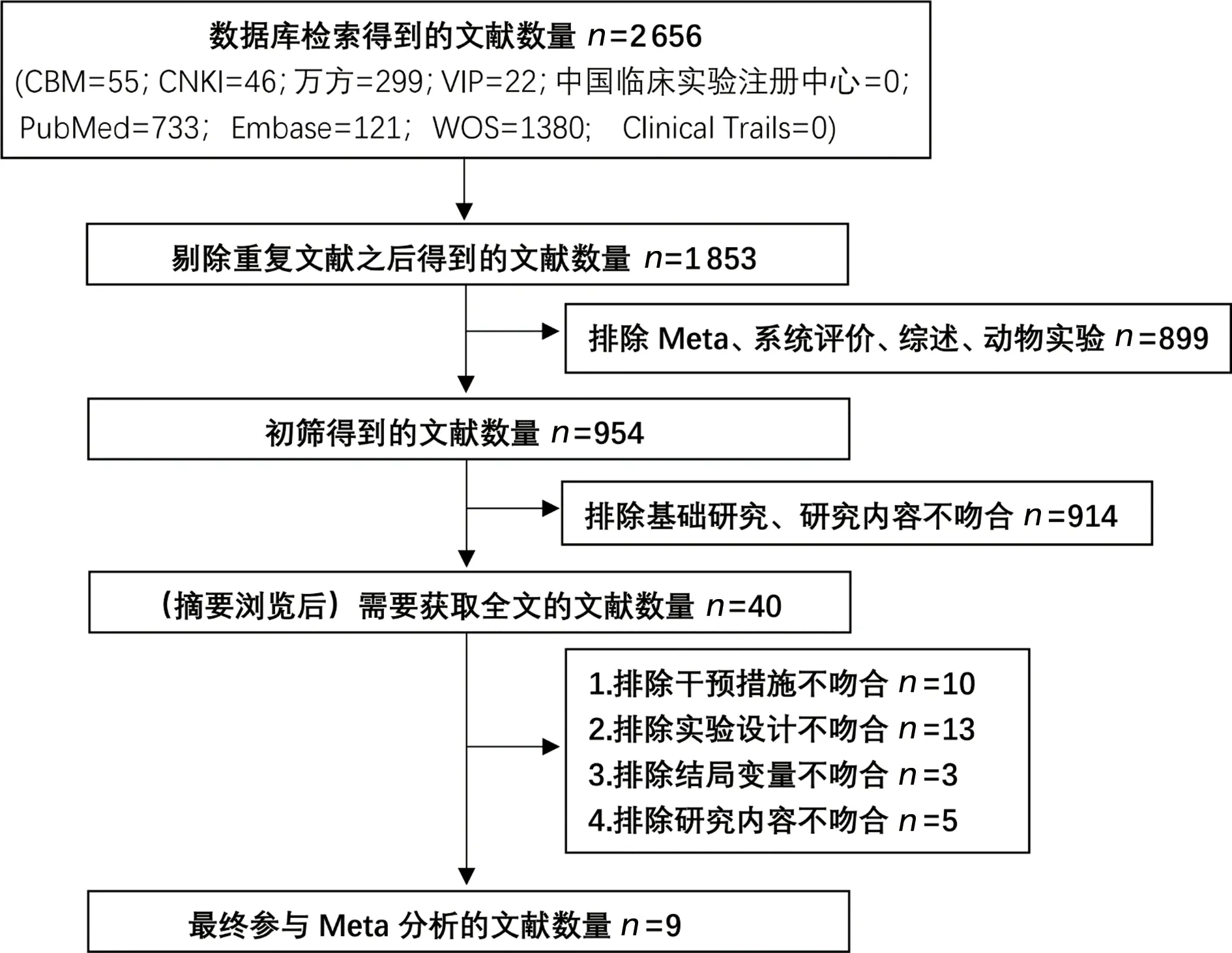
圖1 文獻篩選流程圖
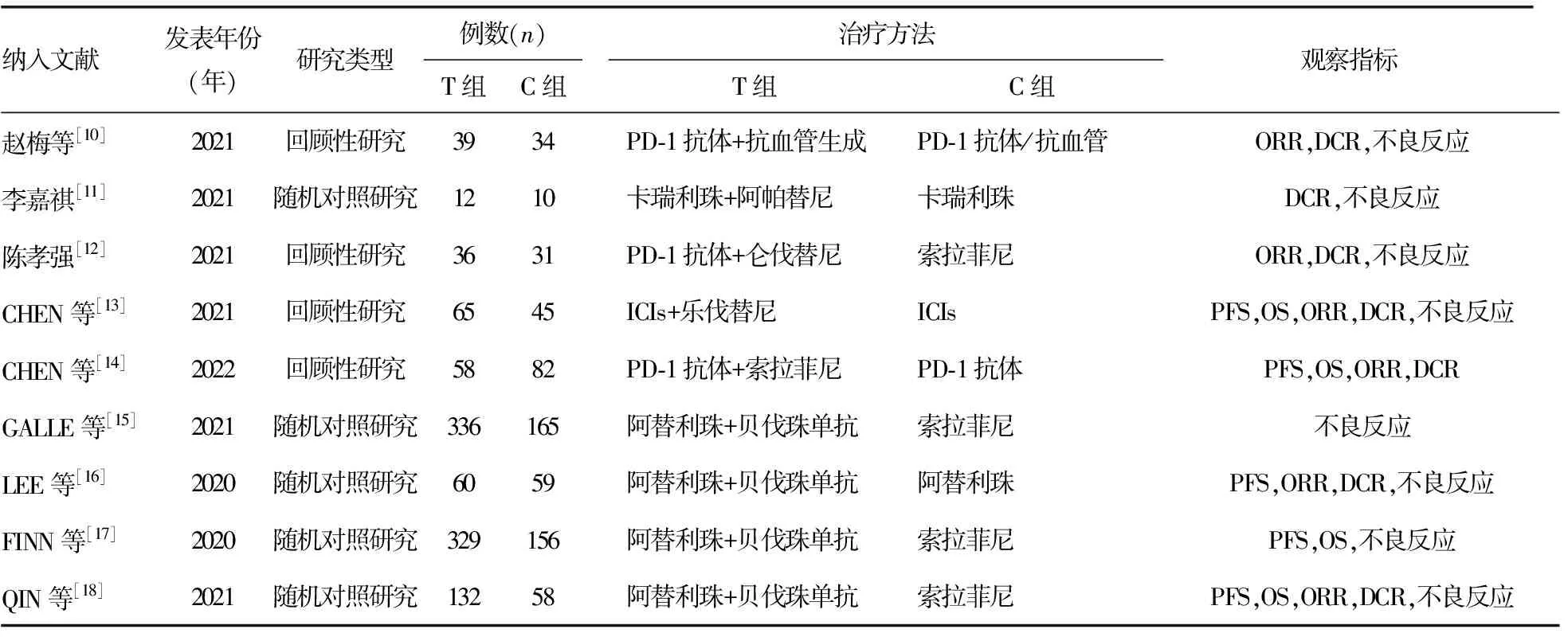
表1 納入研究的基本特征
2.2 文獻質量評估
對納入的9篇文獻進行方法學的質量評價,除其中4篇文獻未明確提出是否采用隨機分配原則外,其余文獻均明確采用了隨機分組原則;部分未表明是否采用分配隱藏及雙盲。經繪制偏倚風險總結圖后提示納入文獻質量整體較高,可用于二次分析,見圖2。
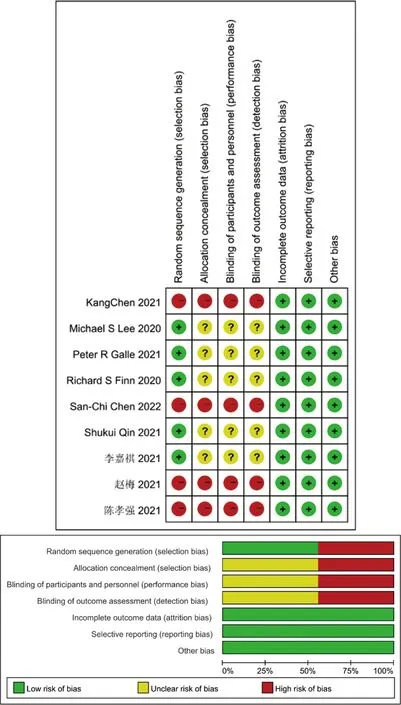
圖2 偏倚風險評估圖
2.3 療效指標
2.3.1PFS
共納入5篇文獻[13-14,16-18],經過異質性檢驗(P=0.46,I2=0%),提示納入研究文獻之間無異質性,選擇固定效應合并效應量。結果顯示,ICIs聯合抗血管生成藥治療晚期肝癌較單藥治療可顯著延長患者的PFS(P<0.01),聯合治療組出現疾病進展的風險為對照組的0.46倍(HR=0.46,95%CI=0.36~0.60),見表2。
2.3.2OS
共納入4篇文獻[13-14,17-18],經過異質性檢驗(P=0.77,I2=0%),提示納入研究文獻之間無異質性,選擇固定效應合并效應量。結果顯示,ICIs聯合抗血管生成藥治療晚期肝癌較單藥治療可顯著延長患者的OS時間(P<0.01),聯合治療組出現疾病進展的風險為對照組的0.52倍(HR=0.52,95%CI=0.41~0.64),見表2。
2.3.3DCR
共納入7篇文獻[10-14,16,18],經過異質性檢驗(P=0.08,I2=47%),提示納入研究文獻之間存在顯著異質性,進一步考察拉貝圖和星狀圖(圖3、4),結果提示,本研究納入文獻之間存在輕度異質性,選擇隨機效應合并效應量。結果顯示,ICIs聯合抗血管生成藥治療晚期肝癌較單藥治療的疾病控制率更高(P<0.01),聯合治療組的疾病控制率為對照組的1.36倍(RR=1.36,95%CI=1.14~1.63),見表2。
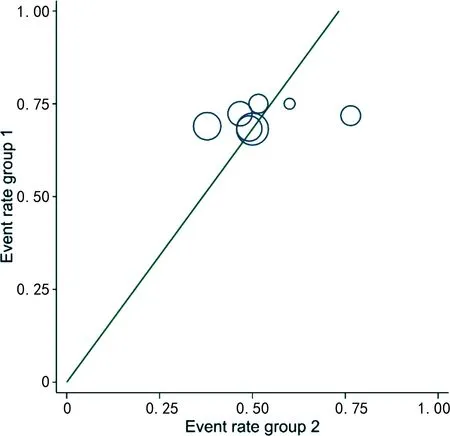
Event group 1:各研究中聯合治療組的疾病控制率;Event rate group 2:各研究中對照組的疾病控制率。
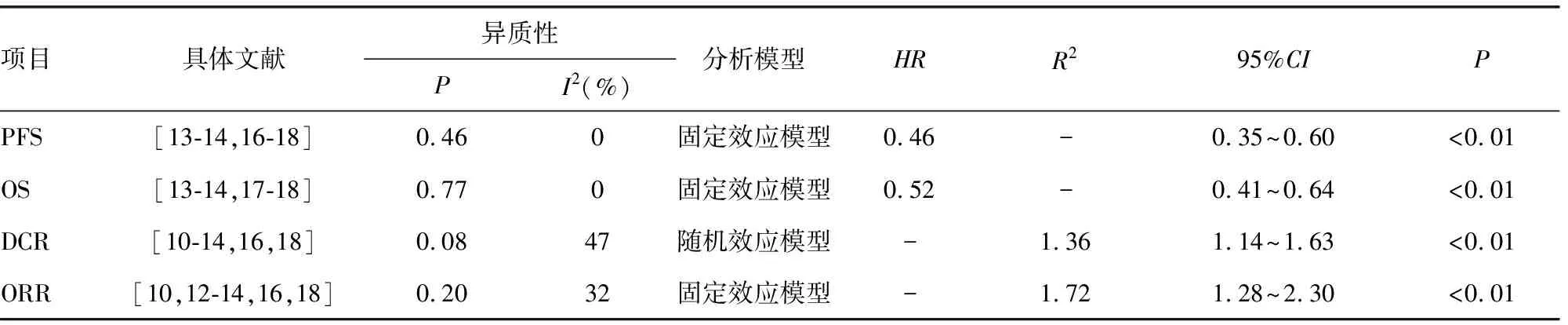
表2 ICIs聯合抗血管生成與單藥靶向組療效指標meta分析結果
2.3.4ORR
共納入6篇文獻[10,12-14,16,18],經過異質性檢驗(P=0.20,I2=32%),選擇固定效應合并效應量。結果顯示,ICIs聯合抗血管生成藥治療晚期肝癌較單藥治療可明顯提高ORR(P<0.01),聯合治療組的客觀緩解率為對照組的1.72倍(HR=1.72,95%CI=1.28~2.30),見表2。
2.4 安全性指標
2.4.1不良反應總發生率
共納入4篇文獻[10,12,17-18],經過異質性檢驗(P=0.92,I2=0%),各研究間不存在異質性,采用固定效應合并效應量。結果顯示,聯合治療組發生不良反應的風險略低于對照組,但差異無統計學意義(RR=0.99,95%CI=0.95~1.03,P=0.59),見表3。納入5篇文獻[12,14,16-18],行重度不良反應(≥3級)發生率分析,各文獻間無異質性(P=0.41,I2=0%),采用固定效應合并效應量。結果顯示,聯合治療組中重度不良反應發生率略高于對照組,但差異無統計學意義(RR=1.12,95%CI=0.96~1.30,P=0.14),見表3。綜上提示,ICIs聯合抗血管治療方案與單藥治療發生不良反應風險與≥3級不良反應的風險均無明顯差異。
2.4.2高血壓發生情況
共納入5篇文獻[11-13,16,18],各研究間不存在異質性(P=0.33,I2=13%),采用固定效應合并效應量。結果顯示,聯合治療組發生高血壓的風險高于對照組,差異有統計學意義(RR=1.58,95%CI=1.14~2.18,P<0.01),見表3)。
2.4.3甲狀腺功能減退
共納入3篇文獻[10,12,18],各研究間不存在異質性(P=0.48,I2=0%),采用固定效應合并效應量。結果顯示,聯合治療組發生甲狀腺功能減退的風險高于對照組,差異有統計學意義(RR=6.79,95%CI=2.31~20.1,P<0.01),見表3。
2.4.4其他不良反應事件
通過亞組分析,在惡心嘔吐、乏力、腹瀉、皮疹、食欲減退、轉氨酶上升等不良反應方面,聯合治療組和對照組之間比較差異均無統計學意義(P>0.05),見表3。
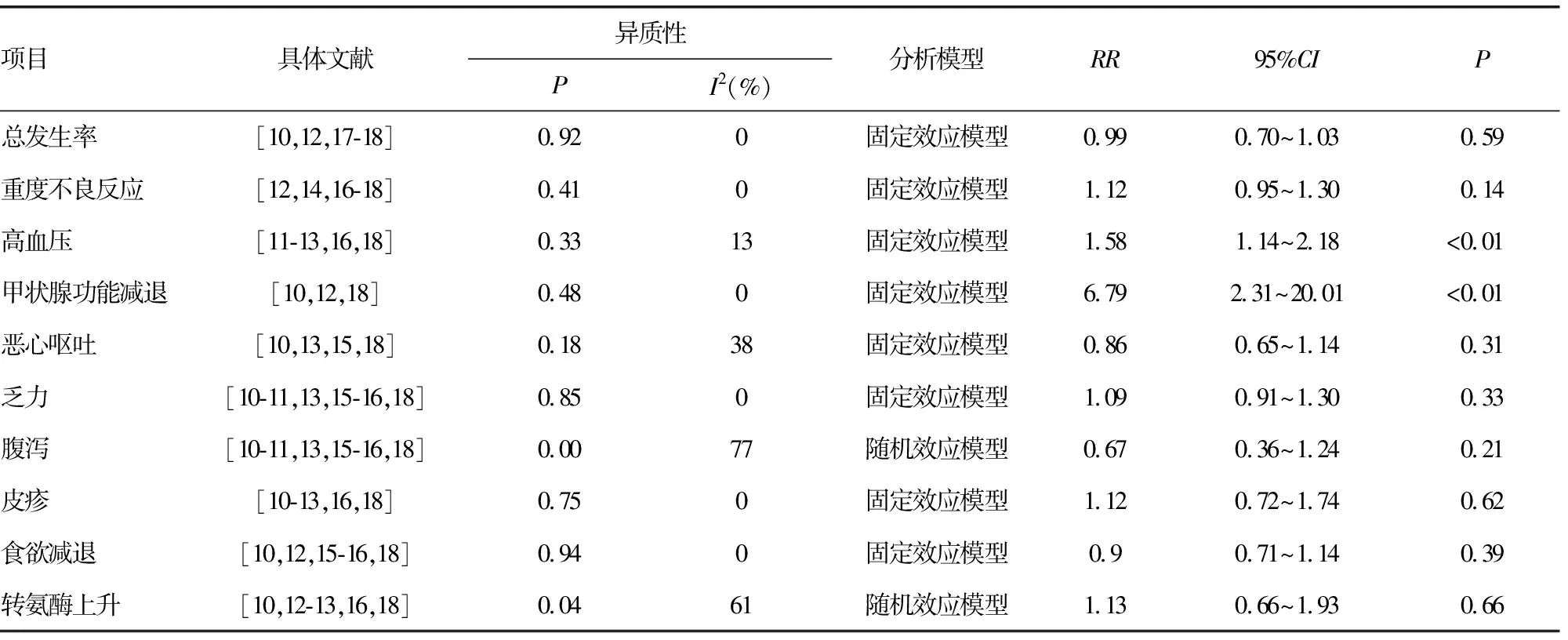
表3 ICIs聯合抗血管生成與單藥靶向組其他部分不良反應的meta分析結果
3 討 論
HCC是肝癌最常見的病理類型(占肝癌的80%~90%),其發病隱匿,超過70%的患者無手術指征,以姑息治療為主[19-20]。索拉非尼、卡博替尼等常被用于一、二線姑息治療[21],但不能避免耐藥的發生。ICIs的開發對HCC治療具有重大突破。研究顯示,納武利尤單抗和帕博利珠單抗治療索拉非尼耐藥患者的ORR和OS時間分別為15%和1年[4];替西木單抗治療丙型肝炎相關HCC的ORR達到17.6%,中位PFS時間為6.48個月,且治療期間丙型肝炎病毒載量降低[22]。盡管顯示出部分臨床獲益,但ICIs單藥在一線、二線治療中的療效仍欠佳[23-24]。因此,臨床將HCC的治療目光轉向了聯合用藥,抗血管生成和免疫療法的聯合成為焦點。抗血管生成聯合ICIs是基于促血管生成因子VEGF-A在腫瘤中的免疫調節作用,抑制VEGF-A表達會導致腫瘤組織內CD8+細胞數量的增加和腫瘤生長減緩[25-27]。
研究證實,VEGF-A在促腫瘤“免疫逃逸”方面具有關鍵作用,對非小細胞肺癌、腎細胞癌及結直腸癌模型的研究表明,抗VEGF-A可使血管正常化并增加T細胞對腫瘤的浸潤[28]。在腎細胞癌模型中,經貝伐珠單抗(抗VEGF)聯合阿替利珠單抗(抗PD-L1)治療后,檢測結果顯示主要組織相容性復合體(MHC)Ⅰ類、Th1標志物和效應T細胞在腫瘤內的表達增加[29]。
本次納入評價的文獻中,聯合用藥組的PFS、OS時間均顯著長于對照組,這與合并后的效應量一致,提示ICIs聯合抗血管藥物可以顯著改善HCC患者的預后。各納入文獻均展示了良好的疾病控制率,僅部分研究[12]顯示聯合用藥組的ORR雖優于對照組,但差異無統計學意義(P>0.05),經合并效應量后得出ICIs聯合抗血管藥物治療HCC可以顯著提高DCR和ORR,這與ZUCMAN-ROSSI等[30]及KUDO等[31]的研究結果一致。試驗過程中,部分結果顯示聯合用藥組的不良反應發生率高于對照組,但經過效應量合并后顯示,兩者間的總不良反應發生率及胃腸道反應、皮疹、食欲減退、肝功能損傷、嚴重不良反應發生率差異均無統計學意義(P>0.05),但聯合用藥組的高血壓、甲狀腺功能減退發生率顯著高于對照組,可能是因為ICIs和抗血管藥物均會導致血壓升高及甲狀腺功能損傷,這與相關研究觀察到的不良反應發生情況一致[30-32]。本研究結果表明,ICIs聯合抗血管生成治療HCC可改善患者預后、提高疾病控制率,但需密切防控高血壓、甲狀腺功能減退的發生。研究對于納入的文獻進行了嚴格篩查,盡可能減少偏倚的發生,但本研究仍存在納入研究較少、納入研究隨訪時間較短的缺陷,需多中心、大樣本量研究進一步證實。
綜上所述,ICIs聯合抗血管生成治療是不可切除或中晚期肝癌的一種有效治療方式,且在一線治療中療效明顯優于索拉非尼單藥,有望延長復發性肝癌患者的PFS時間,打破治療困局,為患者治療方案的選擇開辟新途徑。

