高聚合度異麥芽寡糖的制備及體外益生功能評價
許 瀅,王 蕾,魏貝貝,宿玲恰,陳 晟,吳 敬*
(1.食品科學與技術國家重點實驗室,江南大學,江蘇 無錫 214122;2.江南大學 生物工程學院,江蘇 無錫 214122)
異麥芽寡糖(isomaltooligosaccharides,IMO)是葡萄糖以α-1,6 糖苷鍵為主連接而成的低聚糖混合物,主要成分為異麥芽糖、潘糖、異麥芽三糖及四糖以上的低聚糖。IMO 甜度柔和,耐熱耐酸,升糖指數低,是一種良好的低熱量甜味劑,同時具有降低血清膽固醇含量、改善腸道微生物環境等益生效益[1]。由于其優良的理化性質及生理功能,IMO 被廣泛應用于功能性食品及醫藥保健品行業中,擁有巨大的市場需求量。
天然IMO 主要存在于味噌、黃酒等發酵食品中,并以游離狀態微量存在于紅薯、木薯等淀粉作物中。由于天然提取成本高且工藝復雜,目前市售IMO主要依靠酶法生產,聚合度(degree of polymerization,DP)大概在2~6。主流的工業制備IMO 方法是以淀粉質原料為底物,依靠α-淀粉酶及β-淀粉酶等將淀粉液化、糖化,生成以麥芽糖為主的低聚合度寡糖混合物,再結合α-葡萄糖苷酶的轉苷作用生成具有α-1,6 糖苷鍵的復雜寡糖混合物[2],該方法制備IMO 得率(IMO 產物質量與底物質量的比)一般在50%~55%,即為市售的IMO50,其主要成分為異麥芽糖、異麥芽三糖和潘糖。然而,研究表明,IMO 的益生功能主要歸功于三糖及以上的高聚合度組分[3-4]。另一種生產方式是以蔗糖為底物原料,使用葡聚糖蔗糖酶(dextransucrase,DS)合成右旋糖酐,再通過右旋糖酐酶(dextranase,DN)作用水解生產IMO[5],這種生產方法可通過調控底物濃度及DS、DN 使用比例來調整產物聚合度,但由于生產原料蔗糖成本較高,且該方法只能利用蔗糖中的葡萄糖單元,理論得率不超過50%,不適用于工業化生產。易子玲等通過將4,6-α-葡萄糖基轉移酶和普魯蘭酶、異普魯蘭酶、異麥芽三糖右旋糖酐酶復配,以淀粉為底物可制備高純度異麥芽三糖,產物得率為65.3%[6],為以淀粉為底物制備高聚合度IMO提供了新思路,但是該法存在使用復配酶種類多、工藝復雜等問題。因此,如何在低原料成本的基礎上,開發簡易新工藝,提升產品得率及聚合度是高效制備IMO 主要攻克的難題。
α-葡萄糖苷酶依靠轉移單個葡萄糖基生成IMO,其反應機理決定了產物主要集中為二糖、三糖等低DP 組分。在催化轉苷反應的同時,α-葡萄糖苷酶還會進行水解反應,形成大量葡萄糖,不利于高DP 組分的生成及穩定[7-8]。環糊精葡萄糖基轉移酶(CGTase)屬于糖基水解酶13 家族及α-淀粉酶家族,可發生3 種轉苷反應(歧化反應、環化反應、偶聯反應)及一種水解反應,其中歧化反應為分子間轉苷反應。不同于α-葡萄糖苷酶,CGTase 能以直鏈麥芽低聚糖為供體[9],將葡萄糖、麥芽糖等小分子糖作為受體[10],催化分子間轉苷反應,具有提高受體穩定性、改善理化性質等作用[11]。當其以直鏈多糖為供體和葡萄糖、麥芽糖等為受體時,可以生產得到線性寡糖混合物,進而提高淀粉制糖體系底物利用率[12]。針對工業生產IMO 的問題,在以往制備IMO主要用酶(α-葡萄糖苷酶)的基礎上,復配使用了CGTase,提出一種以麥芽糊精為底物,通過使用黑曲霉(Aspergillus niger)來源的α-葡萄糖苷酶復配嗜熱脂肪芽孢桿菌(Bacillus stearothermophilus NO2)來源的CGTase 制備IMO 的新方法,將這種雙酶復配法制備的聚合度提高的IMO 命名為IMOH。通過單因素實驗結合雙酶復配對酶轉化條件進行了優化,包括pH、溫度、反應時間、加酶量、底物種類、復配酶加酶量及復配酶反應時間等,在最優條件下制備得到反應液后,將產品經活性干酵母消化并冷凍干燥處理,對產物結構如相對分子質量、鏈長分布、鍵型比例進行測定分析,同時通過體外腸道微生物的發酵對產品的益生效果進行評價。與市售IMO50 比較,雙酶復配制備的IMOH中α-1,6 糖苷鍵鍵型占比更高,平均相對分子質量更大,益生效果更好。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株與質粒 畢赤酵母(Pichia pastoris)KM71、長雙歧桿菌(Bifidobacterium longum)、青春雙歧桿菌(Bifidobacterium adolescentis)、大腸桿菌(Escherichia coli)、具有A.niger 來源的α-葡萄糖苷酶基因的質粒pPIC9K[13]、具有B.stearothermophilus NO2 來源的環糊精葡萄糖基轉移酶(CGTase)基因的質粒pET-24a(+)[14]均保藏于作者所在實驗室。
1.1.2 材料與試劑 麥芽糊精:菏澤天邦生物制品有限公司產品;商業化異麥芽寡糖IMO50:山東百龍生物有限公司產品;高溫α-淀粉酶、淀粉葡萄糖苷酶、普魯蘭酶:山東隆大生物工程有限公司產品;酵母粉、胰蛋白胨:英國Oxoid 公司產品;牛肉浸粉:美國Neogen 公司產品;異麥芽糖、潘糖、異麥芽三糖標準品:日本Glycarbo 公司產品;其他試劑(均為國產分析純):上海國藥集團產品。
1.1.3 儀器與設備 Agilent 1260 Infinity II 液相色譜系統、Hi-Plex Ca(7.7 mm×300 mm)色譜柱:安捷倫科技有限公司產品;高效凝膠排阻色譜儀:美國懷雅特技術公司產品;HYPERSIL APS2(250 mm×4.6 mm,5 μm)色譜柱、離子色譜儀:美國賽默飛公司產品;全數字化核磁共振波譜儀:德國布魯克公司產品;厭氧工作站:英國依萊泰科公司產品。
1.1.4 培養基 腸道微生物基礎培養基(g/L):蛋白胨2.0,酵母粉2.0,NaCl 0.1,K2HPO40.04,KH2PO40.04,CaCl2·2H2O 0.01,MgSO4·7H2O 0.01,NaHCO30.5,半胱氨酸鹽酸鹽0.5,膽鹽0.5,吐溫80 2.0。MRS 培養基(g/L):蛋白胨10.0,酵母粉50,牛肉浸粉10.0,葡萄糖20.0,檸檬酸氫二銨2.0,乙酸鈉5.0,K2HPO42.0,MgSO4·7H2O 0.2,MnSO4·H2O 0.05,吐溫80 1.0。其余培養基為培養大腸桿菌及畢赤酵母常用培養基:LB、TB、YPD、BMGY、BMMY 等培養基。
1.2 實驗方法
1.2.1 α-葡萄糖苷酶及CGTase 酶液的制備 以P.pastoris KM71 為宿主,對α-葡萄糖苷酶基因進行表達;以E.coli BL21(DE3)為宿主,對CGTase 基因進行表達。使用大腸桿菌[14]及畢赤酵母[13]常用培養方法培養對應重組菌株,發酵結束后于8 000 r/min 下離心20 min 收集上清液,即得到對應粗酶液。
1.2.2 酶活力測定 α-葡萄糖苷酶轉苷酶活力在pH 5.5 的50 mmol/L 乙酸-乙酸鈉緩沖液中測定,緩沖液中溶有50 g/L 的麥芽糖溶液。在45 ℃下,以900 μL 麥芽糖溶液為底物,加入100 μL 稀釋一定倍數的酶液,精確反應5 min 后煮沸滅酶。體系中轉苷生成的異麥芽糖、異麥芽三糖、潘糖含量由HPLC測定。酶活力定義:在上述條件下,將每分鐘催化轉苷1 μmol 葡萄糖基所需的酶量定義為一個酶活力單位。CGTase 的歧化酶活力測定方法參考文獻[15]中的EPS 法。酶活力定義:該測定條件每分鐘轉化1 μmol EPS 所需的酶量定義為一個酶活力單位。
1.2.3 高聚合度異麥芽寡糖的制備 以溶于50 mmol/L 乙酸-乙酸鈉緩沖液的300 g/L 麥芽糊精為底物,加入一定量的α-葡萄糖苷酶酶液及CGTase酶液,在一定溫度下于轉速為150 r/min 水浴搖床中反應一定時間,反應完成后煮沸滅酶。將反應體系pH 調整為5.0,加入100 U/g(以底物質量計)高溫α-淀粉酶、20 U/g 淀粉葡萄糖苷酶(以底物質量計)及1 U/g(以底物質量計)普魯蘭酶消化處理未反應完全的麥芽糊精,于60 ℃、150 r/min 水浴搖床中反應2 h 后煮沸滅酶,離心得到產物IMOH。
1.2.4 高聚合度異麥芽寡糖的制備工藝優化
1)時間優化 反應條件為pH 5.5、45 ℃,底物為DE 值在15~20 的300 g/L 麥芽糊精,α-葡萄糖苷酶加酶量控制為2 U/g(以底物質量計),每隔6 h取樣,至24 h 反應結束。
2)溫度優化 控制其他條件不變,將反應溫度分別設置為40、45、50、55、60 ℃,反應時間為12 h。
3)pH優化 控制其他條件不變,將反應pH 分別設置為4.0、4.5、5.0、5.5、6.0,反應時間為12 h。
4)底物種類優化 控制其他條件不變,將底物種類分別設置為DE 值為2、DE 值為8~10、DE 值為15~20 的麥芽糊精,反應時間為12 h。
5)加酶量優化 控制其他條件不變,將α-葡萄糖苷酶加酶量分別設置為2、5、10、15、20 U/g(以底物質量計),反應時間為12 h。
6)復配酶加酶量優化 控制其他條件不變,α-葡萄糖苷酶加酶量為5 U/g(以底物質量計),將復配酶(CGTase)加酶量分別設置為10、15、20、25 U/g(以底物質量計),每隔6 h 取樣至24 h 反應結束。
1.2.5 酶轉化產物的檢測 將酶轉化產物進行一定比例的稀釋后使用0.22 μm 濾膜過濾,制備得到液相檢測樣品,使用HPLC 檢測相關產物的含量,計算得率,其中IMOH包含DP≥3 的高聚合度組分和異麥芽糖。測定高聚合度成分使用的HPLC 程序及參數:Agilent 1260 Infinity II 液相色譜系統,RID 示差檢測器,Hi-Plex Ca(7.7 mm×300 mm)色譜柱,柱溫80 ℃,檢測器溫度為40 ℃,以純水作為流動相,流量為0.5 mL/min,通過面積歸一法對產物定量。測定異麥芽糖使用的HPLC 程序及參數:Agilent 1260 Infinity II 液相色譜系統,RID 示差檢測器,HYPERSIL APS2(250 mm×4.6 mm,5 μm)色譜柱,柱溫及檢測器溫度為35 ℃,以體積分數為75%的乙腈為流動相,流量為0.8 mL/min,通過外標法對產物定量。
1.2.6 酶轉化產物理化性質測定方法
1)酶轉化產物的分離 將得到的酶轉化產物離心后,加入0.33 g/g(以底物質量計)的活性干酵母消化[16]去除葡萄糖,于30 ℃、200 r/min 搖床下反應8 h 后煮沸滅菌,離心分離后得到上清液。將上清液冷凍干燥,得到產品,即為IMOH粉末。
2)相對分子質量測定 使用高效凝膠排阻色譜法(HPSEC)測定IMOH產物的平均相對分子質量,HPSEC 利用產物在流動相中的體積大小、流動速度對其進行大小測定。HPSEC 設置程序及參數:采用ULtrahydrogelTMLinear(300 mm×7.8 mm)凝膠柱,柱溫為45 ℃,以0.1 mol/L NaNO3為流動相,流量為0.9 mL/min。
3)鏈長分布 使用高效陰離子交換色譜(HPACEPAD)對產物成分進行分析。HPACE-PAD 利用微孔聚合陰離子交換樹脂對DP≤12 的糖組分進行交換層析,隨后進入檢測器進行分析。采用DIONEX ICS-5000+SP-5 離子色譜儀進行檢測,使用CarboPac PA1 色譜柱(4 mm× 250 mm),以0.6 mol/L乙酸鈉為流動相,流量為1.0 mL/min,使用麥芽糊精作為標準品。
4)核磁光譜分析(1H-NMR)稱取20 mg 冷凍干燥后的產物,溶于500 μL 重水中,其中重水中含有用于校準化學位移的內標物0.3 g/L 三甲基硅烷磷酸酯(TMSP)。使用全數字化核磁共振波譜儀AVANCE III 在環境溫度下以400 MHz 對產品進行氫譜分析。通過在δ 為5.00 和5.39 處的信號峰峰面積的積分來計算產品的鍵型比例。
1.2.7 腸道微生物的培養 將菌株于37 ℃恒溫恒濕厭氧培養箱中靜置培養24~48 h 進行活化。在活化擴大培養后,取一定量的菌液分別轉接至含有10 g/L IMOH、市售IMO50、未添加其他碳源(空白)的基礎培養基中,使得初始OD600為0.05,于37 ℃恒溫恒濕厭氧培養箱中靜置培養。分別在6、12、24、36、48 h 取樣,測定菌液在600 nm 處吸光度及發酵液pH 變化,分別繪制對應曲線,比較不同碳源下不同腸道微生物的生長狀態[17-18]。
2 結果與分析
2.1 高聚合度異麥芽寡糖產物制備
2.1.1 酶轉化單因素優化 為了提高IMO 產量,對酶轉化涉及參數進行了優化。首先采用單因素實驗分析了反應時間、pH、溫度、底物種類、加酶量對IMOH制備的影響(見圖1)。初步分析得到了IMOH制備最優條件為反應時間12 h,反應溫度50 ℃,反應pH 為5.5,底物選擇葡萄糖含量較高的DE 值為15~20 的麥芽糊精,α-葡萄糖苷酶加酶量為5 U/g(以底物質量計),在此最優條件下IMO 得率最高可達41.34%。
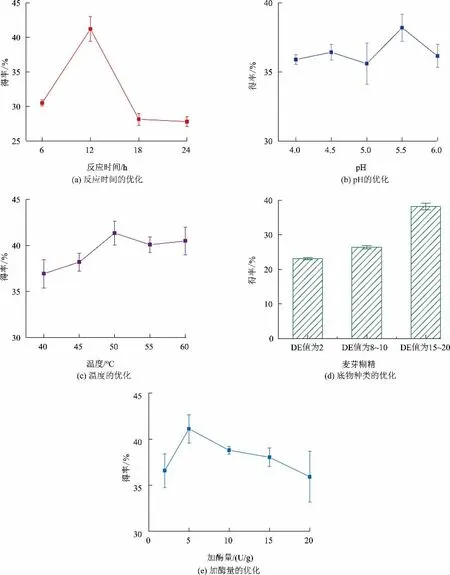
圖1 α-葡萄糖苷酶制備IMO 優化結果Fig.1 Optimization of IMO synthesis by α-glucosidase
2.1.2 雙酶復配優化 基于單因素研究結果,復配使用CGTase,探究了復配酶加酶量及反應時間對得率的影響。產物得率在不同復配酶加酶量下隨時間的變化結果如圖2 所示。在復配酶加酶量為15 U/g(以底物質量計),反應時間為18 h 時,得率達到較為穩定的水平,IMOH得率最高可達64.27%,其中三糖及以上高聚合度組分占比可達71.57%。此后再延長反應時間,得率不能得到進一步提升,同時可能因為酶的水解作用,對生成產物進行水解,從而降低制備效率。

圖2 雙酶復配優化結果Fig.2 Results of optimization by the dual-enzyme combination
對轉化產物消化前葡萄糖含量和消化后高聚合度組分含量進行分析,如表1 所示,實驗結果表明,在復配CGTase 后,產物的葡萄糖組分明顯減少,IMOH得率得到大幅度提升,證明雙酶復配法在一定程度上利用了葡萄糖并生成了更長鏈的糖分子。
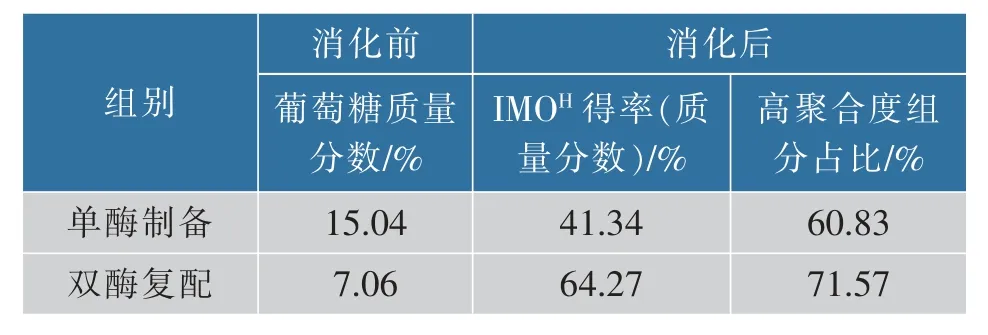
表1 IMOH 組分Table 1 Content of IMOH
根據α-葡萄糖苷酶和CGTase 作用機制,作者繪制如圖3 的雙酶復配原理示意圖。α-葡萄糖苷酶主要以底物中麥芽糖、麥芽三糖為主的寡糖為供體底物,通過第一步反應生成葡萄糖-α-葡萄糖苷酶復合物,第二步以水分子或葡萄糖、麥芽糖等做受體,發生水解或轉苷反應[19-20],最終分別生成葡萄糖或異麥芽糖、潘糖等IMO 成分。α-葡萄糖苷酶的水解活性較高,因此體系中會存在大量葡萄糖,在轉苷反應中該葡萄糖同時也會與生成的異麥芽糖、潘糖等競爭,不利于三糖及以上聚合度寡糖生成。在復配使用CGTase 后,CGTase 可直接利用反應液中的麥芽多糖作供體,以葡萄糖、麥芽糖等小分子糖為受體發生轉苷反應[10],利用體系產生的葡萄糖;同時,也會將麥芽多糖轉化成聚合度降低的麥芽寡糖,為α-葡萄糖苷酶提供轉苷反應底物。這些可能是復配CGTase 能夠提高產物聚合度和得率的原因。
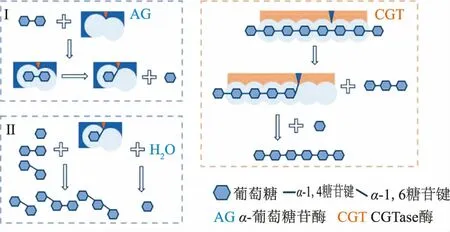
圖3 雙酶復配原理示意圖Fig.3 Schematic diagram of the principle of dual-enzyme combination
2.2 產物結構分析
IMO 的結構與性質取決于聚合度、糖苷鍵鍵型比例、葡萄糖單元連接方式等,其中聚合度越高,α-1,6 糖苷鍵比例越高,產物結構越復雜,IMO 越不易在消化道中被消化,益生效果更好[21]。為確定產物結構與性質,對IMOH平均相對分子質量、鏈長分布及鍵型比例進行測定。如圖4(a)所示,對產物相對分子質量進行測定,其中相對分子質量與出峰時間之間的關系由不同相對分子質量的葡聚糖標準品進行校正,IMOH平均相對分子質量MW為706,這說明產物的平均聚合度為4.36,相較于市售IMO50 的平均聚合度(3.12)更高。同時,為了確定實際產物組分,使用高效陰離子交換色譜對鏈長分布進行了分析,結果如圖4(b)所示,相較于市售IMO50,IMOH高聚合度組分占比更高。為進一步鑒定產物鍵型,使用1H-NMR 分析,結果如圖4(c)所示,在δ=5.00和δ=5.39 處出現了分別對應于α-1,4 糖苷鍵和α-1,6 糖苷鍵的特征峰,按照峰面積比例計算,產物α-1,6 糖苷鍵達到70.67%,相較于市售IMO50 的鍵型占比(53.27%),IMOH更占優勢。根據測定結果,可以推測出IMOH具有更優良的產品性質。
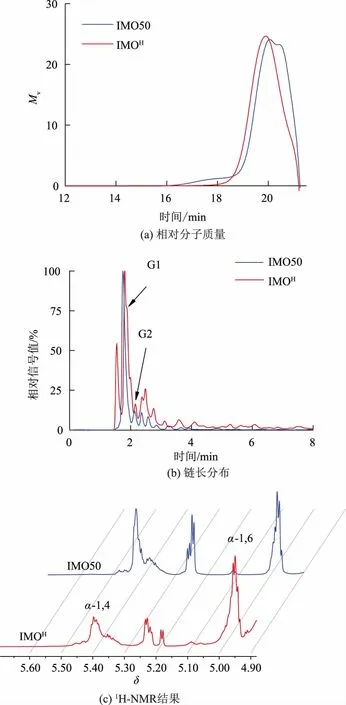
圖4 產物性質測定結果Fig.4 Properties detection of the production
2.3 體外益生效果評價
2.3.1 生長曲線變化 目前,許多研究利用腸道微生物對產品進行體外發酵實驗確定其實際益生效果。腸道益生菌如雙歧桿菌可選擇性利用含有α-1,6 糖苷鍵的益生元進行增殖,在大量增殖后可產生局部厭氧環境,抑制好氧有害菌的生長[17-18]。因此,通過腸道微生物的體外生長狀況可推測產品的益生功能。作者將IMOH及市售IMO50 作為碳源添加到基礎培養基中,以基礎培養基(空白)為對照,選取成人腸道益生菌雙歧桿菌中占比最高的兩種菌種——青春雙歧桿菌及長雙歧桿菌[22]和腸道條件致病菌大腸桿菌作為研究對象,考察了IMOH對益生菌、條件致病菌生長狀況的影響。圖5(a)及圖5(b)分別為青春雙歧桿菌及長雙歧桿菌的生長曲線,IMOH對益生菌青春雙歧桿菌更具有增殖作用,對長雙歧桿菌作用效果與IMO50 相近;圖5(c)為腸道條件致病菌大腸桿菌的生長曲線,IMOH對腸道條件致病菌大腸桿菌具有抑制作用,具有一定的體外益生功能[22-23]。
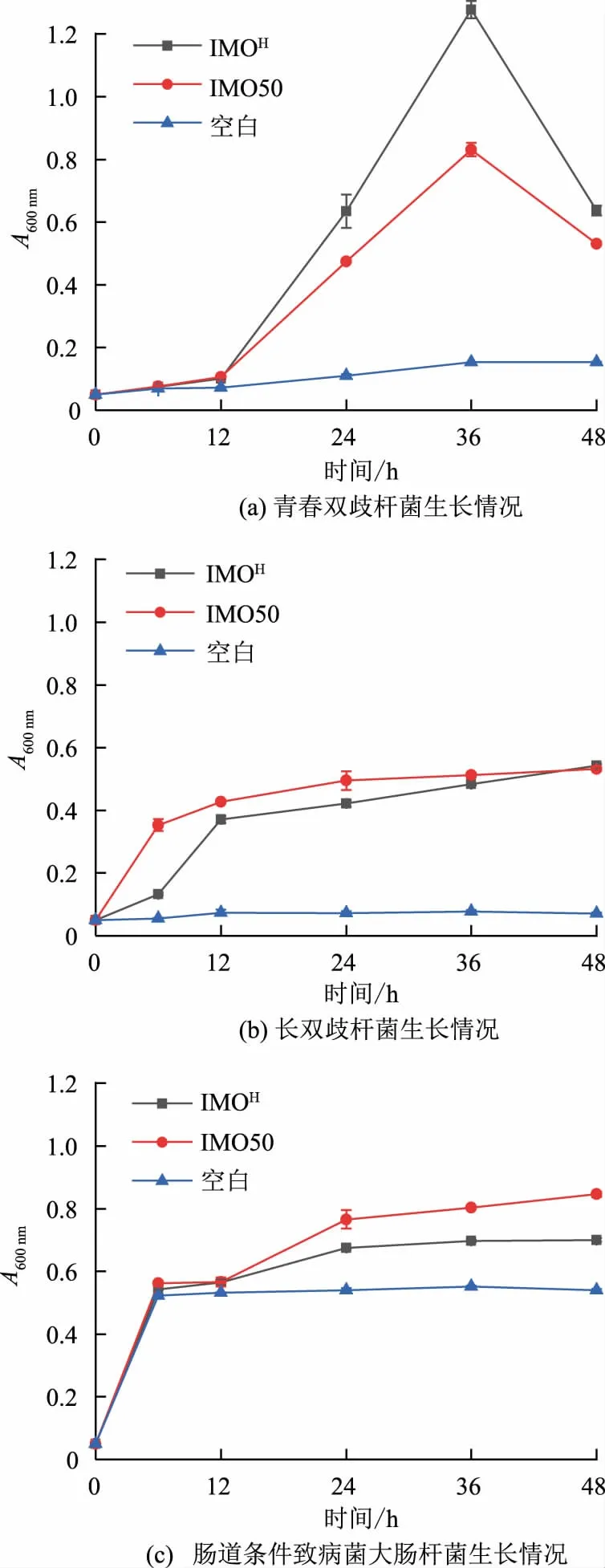
圖5 腸道微生物體外培養生長情況Fig.5 Growth of intestinal microorganisms cultivated in vitro
2.3.2 pH 變化 腸道益生菌在生長過程中會代謝如乙酸、丁酸等短鏈脂肪酸,這些化合物會降低腸道環境pH,抑制腸道有害菌的生長,同時減少有害代謝物質的生成[24]。通過pH 變化情況,可推斷腸道微生物生長環境的變化及有益代謝物質的生成。如圖6(a)及圖6(b)所示,與空白組相比,青春雙歧桿菌及長雙歧桿菌在含IMOH基礎培養基中培養時產生酸性物質降低環境pH,其pH 變化與IMO50 中的接近;圖6(c)為腸道條件致病菌大腸桿菌的生長曲線,大腸桿菌在含IMOH基礎培養基中培養時pH變化相較于IMO50 中的更小。
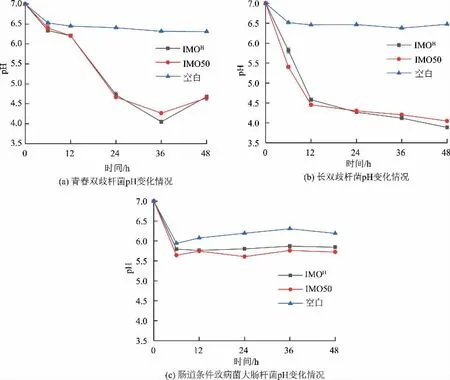
圖6 腸道微生物體外培養pH 變化情況Fig.6 pH of intestinal microorganisms cultivated in vitro
3 結語
作者基于α-葡萄糖苷酶生產IMO 的生產工藝,復配使用了CGTase,研究了IMOH的制備工藝、產物結構及體外益生功能。結果顯示,在經過酶轉化條件優化后,產品IMOH得率達到64.27%,其中三糖及以上高聚合度組分占比達到71.57%。經過消化、冷凍干燥后的產物平均相對分子質量為706,α-1,6 糖苷鍵鍵型占比達到70.67%,對益生菌青春雙歧桿菌具有增殖效果,且對于腸道條件致病菌大腸桿菌具有抑制效果。IMOH相較于市售IMO50 具有更良好的產品性質及體外益生功能。研究結果為IMO 的工業制備提供了新思路。在后續研究中,可對α-葡萄糖苷酶進行結構分析并改造,提高其轉苷活性,或尋找其他來源的轉苷活性更強的α-葡萄糖苷酶進行研究,進一步提高IMO 得率。

