超高效液相色譜-串聯質譜法檢測食品中腰果過敏原
寧亞維,楊 正,馬俊美,劉 茁,陳 佳,李 強,*
(1.河北科技大學食品與生物學院,河北 石家莊 050018;2.河北省食品檢驗研究院,河北 石家莊 050000;3.石家莊學院化工學院,河北 石家莊 050035)
近年來,食物過敏在世界范圍內的發生率呈現上升趨勢,食物過敏已成為僅次于微生物污染的第2大食品安全問題[1]。據數據研究顯示,食物過敏在成年人中的患病率約為5%,兒童由于自身的免疫系統尚未發育成熟,患病率約為8%[2]。當患者接觸過敏原時,典型的過敏癥狀包括嘔吐、腹瀉、呼吸困難以及皮膚表面出現蕁麻疹等,但也有患者出現比較嚴重的過敏性休克等危及生命的癥狀[3]。現階段對于食物過敏尚無有效的治療手段,避免接觸食物過敏原是避免消費者誘發過敏反應的唯一方法[4]。為了給消費者提供更可靠的食品信息,各國均制定了嚴格的食品過敏原標注要求[5-7],但由于各國對食品標簽要求不盡相同,因此過敏原信息標注存在差異,同時食品標簽難以對食品在生產、運輸和貯存過程中由于交叉污染而產生的隱性過敏原進行標注,這給過敏人群造成了潛在的風險[8]。為了幫助過敏患者規避食品中的過敏原,同時監督食品標簽準確性,開發食品過敏原高靈敏度檢測方法十分重要。
常見的食品過敏原主要包括花生、雞蛋、牛奶、大豆、堅果、含麩質的谷物、魚類和貝類八大類[9]。腰果與核桃、杏仁和榛子并稱為世界四大堅果[10],具有豐富的營養價值。然而腰果中存在堅果過敏原,可引起體溫下降、腹部疼痛、全身瘙癢及呼吸困難的食物過敏癥狀[11]。現階段用于腰果過敏原的檢測技術主要有酶聯免疫吸附(enzyme-linked immunosorbent assay,ELISA)法[12-13]、聚合酶鏈式反應(polymerase chain reaction,PCR)法[14-15]以及液相色譜-串聯質譜(liquid chromatography-tandem mass spectromotry,LC-MS)法[16-19]。其中,ELISA為現階段過敏原檢測技術中最為成熟的方法。該方法以致敏蛋白為檢測依據,基于抗原和抗體間的特異性結合反應進行檢測。Zhao Yiqing等[12]以Ana o 3為蛋白標記物,開發了一種雙抗體夾心ELISA法用于檢測預包裝食品中的殘留腰果成分。在餅干基質和巧克力基質中的定量限(limit of quantitation,LOQ)分別為40 mg/kg和4 mg/kg,在巧克力中回收率為74.0%~87.7%,但在餅干中的回收率僅為40.2%~44.9%,回收率較低。由此可見盡管ELISA技術檢測過敏原存在具有特異性強、靈敏度高的優勢,但針對經過烹煮、煎炒等高強度加工處理的食品,通常會因特異性結合表位的損傷而導致致敏蛋白難以被特異性抗體識別,因而存在假陰性結果[20]。PCR法依賴致敏蛋白的DNA進行檢測,避免了加工手段對致敏蛋白檢測的影響,但該方法通過DNA間接檢測致敏蛋白,且核酸在提取過程中易于受到污染而出現假陽性結果[21]。而食品在加工過程中不會造成蛋白質一級結構氨基酸序列的改變,因此基于過敏原特征肽段的質譜檢測技術可以改善ELISA的假陰性和PCR假陽性的問題,具有較好地開發潛力。目前使用液相色譜-串聯質譜法檢測腰果過敏原的文獻已有報道,Bignardi等[16]選取VFDCGVR為腰果特異性肽段,利用液相色譜-電噴霧串聯質譜法結合快速固相萃取技術,提高了餅干和巧克力中腰果的檢測靈敏度,其中在巧克力中腰果的定量限為50 mg/kg;Bignardi等[22]建立了液相色譜-串聯質譜檢測法檢測加工食品中的腰果過敏原,定量限為10 mg/kg;Lee等[23]采用液相色譜-質譜法結合多反應監測(multiple reaction monitoring,MRM)技術顯著提高了檢測餅干中的腰果過敏原,定量限為46 mg/kg。近年來,我國研究人員也逐漸對LC-MS聯用技術檢測食品過敏原引起重視,在2019年頒布了GB/T 38163—2019《常見過敏蛋白的測定 液相色譜-串聯質譜法》,標準中規定了固態食品中牛奶、雞蛋、花生、榛子、杏仁、大豆和核桃過敏蛋白的液相色譜-質譜檢測法,但目前我國還沒有針對液相色譜-質譜檢測腰果過敏原的相關報道。
基于質譜技術在過敏原檢測中準確、穩定且高效的優點,本研究采用Easy-nLC 1000納升液相色譜-四極桿-靜電場軌道阱高分辨質譜(Easy-nLC 1000-Q-Exactive)篩選腰果過敏原特異性肽段,并通過超高效液相色譜-串聯三重四極桿質譜,擬建立基于特征肽段的腰果過敏原MRM模式檢測方法,用于多種食品基質中腰果過敏原的快速篩查和定量檢測。
1 材料與方法
1.1 材料與試劑
三羥甲基氨基甲烷(Tris)、二硫蘇糖醇(dithiothreitol,DTT)、碘乙酰胺(iodoacetamide,IAA)、碳酸氫銨(均為分析純) 美國Sigma-Aldrich公司;尿素(分析純) 上海阿拉丁生化科技股份有限公司;正己烷、乙腈(均為質譜級) 美國Fisher Scientific公司;TPCK-胰蛋白酶(生物級) 美國AB SCIEX公司;甲酸(色譜純) 天津科密歐化學試劑有限公司;超純水由Millipore純水機制備;腰果、餅干、面包、蛋糕、桃酥、巧克力、飲料等食品隨機購買于當地超市。
1.2 儀器與設備
Easy-nLC 1000-Q-Exactive納升液相色譜-串聯四極桿-靜電場軌道阱高分辨質譜、C18色譜柱(2.1 mm×100 mm,2.6 μm)、超濾離心管(10 kDa)美國Thermo Scientific公司;Utimate3000-Qtrap5500超高效液相色譜-串聯三重四極桿質譜 美國AB SCIEX公司C18富集柱(100 μm×4 cm,5 μm,120 ?)、C18分析柱(75 μm×15 cm,5 μm,120 ?) 北京樂潤峰科技有限公司;低蛋白吸附樣品瓶(250 μL) 美國Waters公司。
1.3 方法
1.3.1 標準儲備液的制備
稱取2 g(精確至0.001 g)生腰果樣品于豆漿機中,加入50 mL水,使用豆漿機磨漿5 min,直至腰果顆粒完全溶解。將溶液轉移至100 mL容量瓶中,加水定容,配制成20 mg/mL的腰果標準儲備液,保存于4 ℃備用。
1.3.2 樣品前處理
稱取1 g(精確至0.001 g)經過研磨機研磨成粉末的樣品置于50 mL離心管,加入5 mL正己烷除脂,震蕩混勻15 min,4000×g離心15 min,棄去3 mL上清液,重復脫脂操作2 次。樣品用氮氣吹干后,加入4 mL提取緩沖液(含2 mol/L尿素的50 mmol/L Tris溶液),旋轉振蕩提取1 h,然后6000×g離心20 min。移取500 μL上清液至2 mL離心管中,加入10 μL還原劑(500 mmol/L DTT),混勻后置于60 ℃水浴鍋中振蕩反應30 min。將上述樣品混合物冷卻至室溫后,加入30 μL烷基化試劑(500 mmol/L IAA)暗處反應30 min,然后加入430 μL的酶解緩沖液(500 mmol/L的碳酸氫銨溶液和1 μmol/L的氯化鈣溶液)和20 μL胰蛋白酶(500 μg/mL),混勻后置于37 ℃水浴鍋孵育過夜。加入10 μL甲酸停止酶解反應后,將混合物于12000×g離心8 min,并將上清液轉移至10 kDa超濾離心管,14400×g離心20 min以凈化蛋白。最后,收集濾液進行分析(所有試劑均使用Watsons蒸餾水配制)。
1.3.3 Easy-nLC 1000-Q Exactive測定條件
色譜條件:預柱:C18色譜柱(100 μm×4 cm,5 μm,120 ?);分析柱:C18毛細色譜柱(75 μm×15 cm,5 μm,120 ?);流動相A為0.1%甲酸,流動相B 為乙腈;洗脫程序:0~3 min,97%~93% A,3%~7% B;3~38 min,93%~78% A,7%~22% B;38~48 min,78%~65% A,22%~35% B;48~50 min,65%~10% A,35%~90% B;50~60 min,10% A,90% B;流速300 μL/min;進樣體積2 μL。
質譜條件:Nanospray Flix電離源,正離子模式;掃描模式為Full MS/dd-MS2;Full MS分辨率70000;AGC target為1×106;質量掃描范圍m/z350~1800;dd-MS2分辨率17500;AGC target為1×105;隔離窗口為m/z2.0;Fixed first mass為m/z120.0;碰撞能量27 eV。
1.3.4 Utimate 3000-Qtrap 5500測定條件
色譜條件:C18色譜柱(2.1 mm×100 mm,2.6 μm);柱溫40 ℃;流動相A為0.1%甲酸,流動相B為0.1%甲酸-乙腈;洗脫程序:0~1.3 min,98% A,2% B;1.3~11 min,98%~60% A,2%~40% B;11~12.5 min,60%~2% A,40%~98% B;12.5~14.4 min,2% A,98% B;14.4~14.6 min,2%~98% A,98%~2% B;14.6~20 min,98% A,2% B;流速300 μL/min;進樣體積5 μL。
質譜條件:電噴霧離子源(正離子);MRM;離子化電壓4000 V;霧化氣壓力55 psi;輔助氣壓力55 psi;氣簾氣壓力30 psi;離子源溫度450 ℃。
1.3.5 方法學驗證
1.3.5.1 線性關系、檢出限、定量限
按照1.3.2節中的前處理步驟得到空白基質提取液,隨后使用空白基質提取液將腰果標準儲備液(20 mg/mL)稀釋至質量濃度為0.001、0.002、0.005、0.01、0.02、0.05、0.1、0.2、0.5、1、2、5、10 mg/mL的溶液。各質量濃度樣品分別取500 μL加入2 mL離心管中,經1.3.2節中的還原、烷基化和酶解后得到酶解液。之后加10 μL的甲酸停止消化,于12000×g離心8 min,取上清液過0.22 μm MCM濾膜,收集濾液進行LC-MS/MS分析。
以特征肽段的色譜峰面積作為縱坐標(Y),腰果的質量濃度為橫坐標(X)計算線性方程,每個樣品設置4 個平行。特征肽段的信噪比為3時對應的腰果質量濃度記為檢出限(limit of detection,LOD);當特征肽段的信噪比為10時,腰果對應的質量濃度記為LOQ。
1.3.5.2 加標回收率
向空白基質中添加腰果標準儲備液以測定回收率,添加量為腰果特征肽段的2、10、20 倍LOQ 3 個水平,每個質量濃度設置6 個平行以計算方法精密度。
1.3.5.3 基質效應
篩選配料表中不含腰果以及經檢測后不含腰果的餅干、面包、蛋糕、桃酥、巧克力和飲料樣品作為空白基質,精密移取一定量的腰果標準儲備液,用空白基質提取液梯度稀釋配成0.01、0.02、0.05、0.1、0.2、0.5、1、2、5、10 mg/mL的標準曲線溶液用于計算基質效應。基質效應按下式計算:
式中:slopematrix為空白基質標準曲線的斜率;slopestandard為水溶劑標準曲線的斜率。
1.3.6 實際樣品檢測
將固體樣品研磨成均勻粉末后稱取1 g,液體樣品直接移取500 μL,然后按照1.3.2節方法進行前處理,用所建立方法對樣品中的腰果含量進行定量。
2 結果與分析
2.1 腰果特征肽段的篩選
利用Q-Exactive高分辨率、高精確度的優勢,在Full MS/dd-MS2掃描模式下對樣品進行全掃描。基于Uniprot數據庫中全面的腰果蛋白信息,結合ProteinPilotTM軟件強大的Paragon算法,綜合考慮生物學修飾、錯切漏切和樣本特異性等因素,對掃描結果進行分析處理,在得到大量肽段信息中篩選最佳的腰果特異性肽段。
特征肽段的選擇是液相色譜-串聯質譜法檢測食品過敏原中的關鍵一步,為了保證檢驗方法的穩定性和準確性,篩選到的特征肽段需要滿足以下幾點[24-27]:首先肽段的長度應在8~25 個氨基酸之間;其次肽段應不含錯切和漏切的酶切位點,并且不含任何蛋白質修飾的位點[28]。同時,篩選到的肽段要經過BLAST搜索驗證肽段特異性,確保其為腰果特有肽段。目前已鑒定的腰果過敏原蛋白有3 種,分別為Ana o 1[29]、Ana o 2[30]和Ana o 3[31],其氨基酸序列如圖1所示。為了能夠全面的檢測食品中的腰果過敏原,本研究基于上述肽段篩選原則,針對每種腰果過敏原均篩選了2 條肽段,其中,AFSWEILEAALK和YGQLFEAER肽段對應于Ana o 1,這是首次篩選出腰果Ana o 1的肽段;ADIYTPEVGR和GQVQVVDNFGNR肽段對應于Ana o 2;ELYETASELPR和QFEEQQR對應于Ana o 3。篩選到的6 條肽段長度適中,特異性好,不易于降解;同時不含蛋白質修飾位點,不易于在蒸煮、燒烤和輻照等加工過程中發生成環、氧化和交聯等副反應,影響定性及定量檢測結果[28];此外,所篩選的肽段經過BLAST搜索驗證證實具有高度特異性。同時,為了進一步驗證所篩選肽段是否只存在于腰果中,制備了花生、杏仁、核桃、芝麻、葵花籽、開心果和榛子等常見堅果的酶解樣品驗證腰果肽段特異性,結果顯示,所篩選的6 條腰果肽段均只在腰果酶解樣品中檢測到,而其他堅果酶解樣品均顯示未檢出,進一步驗證了肽段特異性。

圖1 Ana o 1、Ana o 2和Ana o 3的氨基酸序列Fig.1 Amino acid sequences of Ana o 1,Ana o 2 and Ana o 3
2.2 質譜參數及液相色譜條件的優化
目標蛋白的定量檢測依賴于MRM模式,該模式的顯著優點是具有較高靈敏度和特異性,能夠對復雜基質中的微量靶向蛋白進行準確鑒定。為了提高特征肽段的檢測靈敏度和穩定性,本研究對液相色譜條件和MRM質譜參數進行優化。首先以全掃描模式確定各特征肽段的準確母離子數,分別對其母離子進行二級掃描,篩選響應值較高的子離子,每個肽段選擇了3 個子離子,響應值高且更加穩定的子離子作為定量離子,另外2 個子離子用于輔助定性。進一步優化每個子離子的碰撞能量、碎裂電壓等參數,得到的質譜參數優化結果如表1所示。
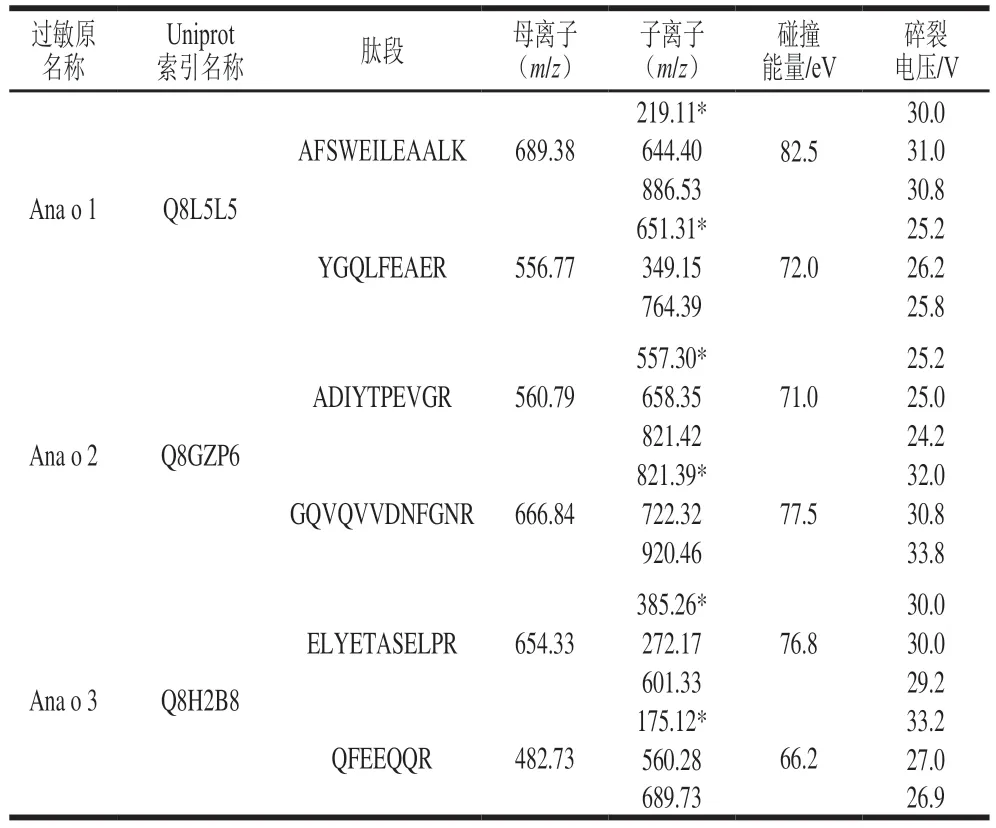
表1 腰果特征肽段的MRM參數Table 1 MRM mass spectrometric parameters for cashew specific peptides
比較乙腈-水和0.1%甲酸乙腈-0.1%甲酸分別作為流動相時肽段的峰形,以AFSWEILEAALK肽段為例,當使用乙腈-水作為流動相時,有明顯拖尾(圖2A);當流動相為0.1%甲酸乙腈-0.1%甲酸時肽段的峰形更佳,拖尾現象明顯改善(圖2B)。優化后6 條特征肽段的提取離子流圖如圖3所示。在相同濃度下的腰果酶解樣品中,ADIYTPEVGR肽段的響應值最高。綜合肽段的靈敏度以及穩定性,將ADIYTPEVGR作為腰果的定量肽段。
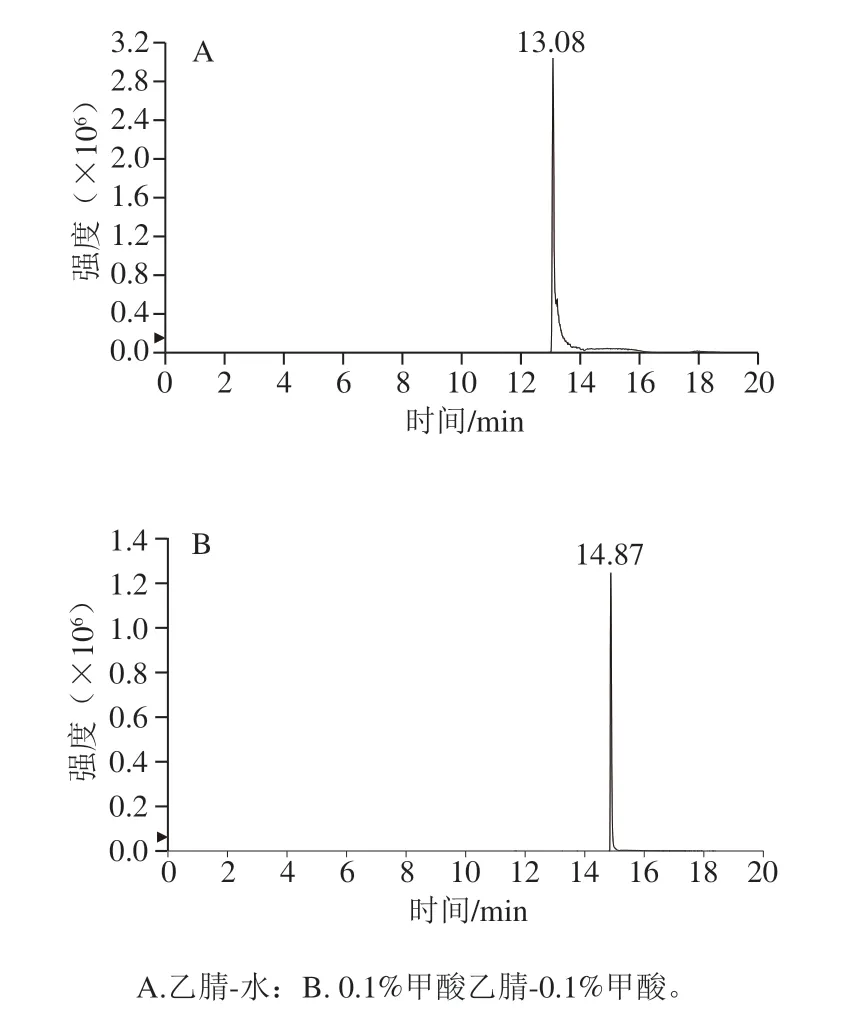
圖2 AFSWEILEAALK肽段流動相優化圖Fig.2 Optimization of mobile phase for separation of peptide AFSWEILEAALK
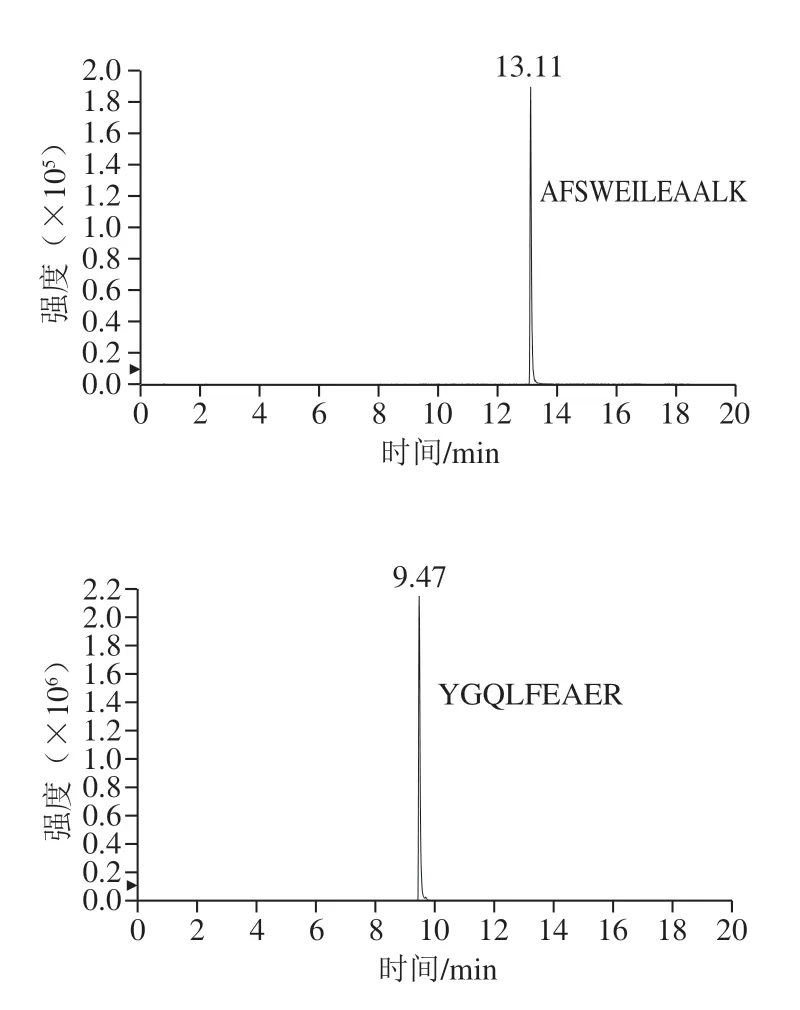
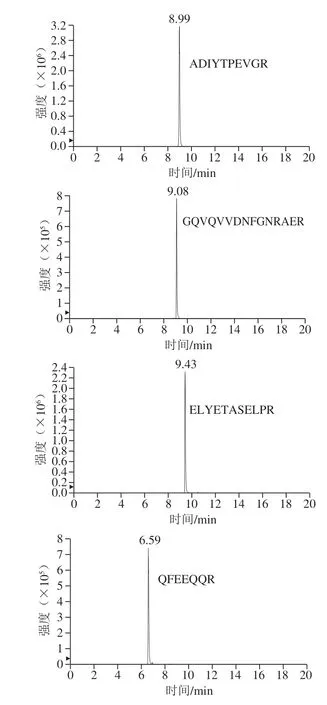
圖3 腰果6 條特征肽段提取離子流圖Fig.3 Extracted ion current chromatograms of six cashew specific peptides
2.3 方法學驗證
2.3.1 線性范圍、LOD和LOQ結果
為了評估方法的靈敏度,對方法的線性范圍、LOD和LOQ進行測定。如表2所示,所篩選的6 條特異性肽段中,AFSWEILEAALK、ADIYTPEVGR和ELYETASELPR三條肽段的靈敏度較高,在固體基質中的LOD和LOQ分別為1 mg/kg和2.5 mg/kg;飲料基質中的LOD和LOQ分別為0.002 mg/mL和0.005 mg/mL。YGQLFEAER、GQVQVVDNFGNR和QFEEQQR三條肽段靈敏度較低,在固體基質中的LOD和LOQ分別為2 mg/kg和5 mg/kg;在飲料基質中的LOD和LOQ為0.005 mg/mL和0.01 mg/mL。篩選的6 條腰果肽段在餅干、面包、蛋糕、桃酥、巧克力和飲料6 種基質中的線性良好,標準曲線的相關性系數均大于0.99。腰果的LOQ為2.5 mg/kg,說明本研究方法具有較高的靈敏度。另外本方法選取ADIYTPEVGR肽段作為定量肽段,AFSWEILEAALK、YGQLFEAER、GQVQVVDNFGNR、ELYETASELPR、QFEEQQR肽段用于輔助定性,能夠更準確地檢測食品中腰果過敏原,避免腰果成分誤檢和漏檢。
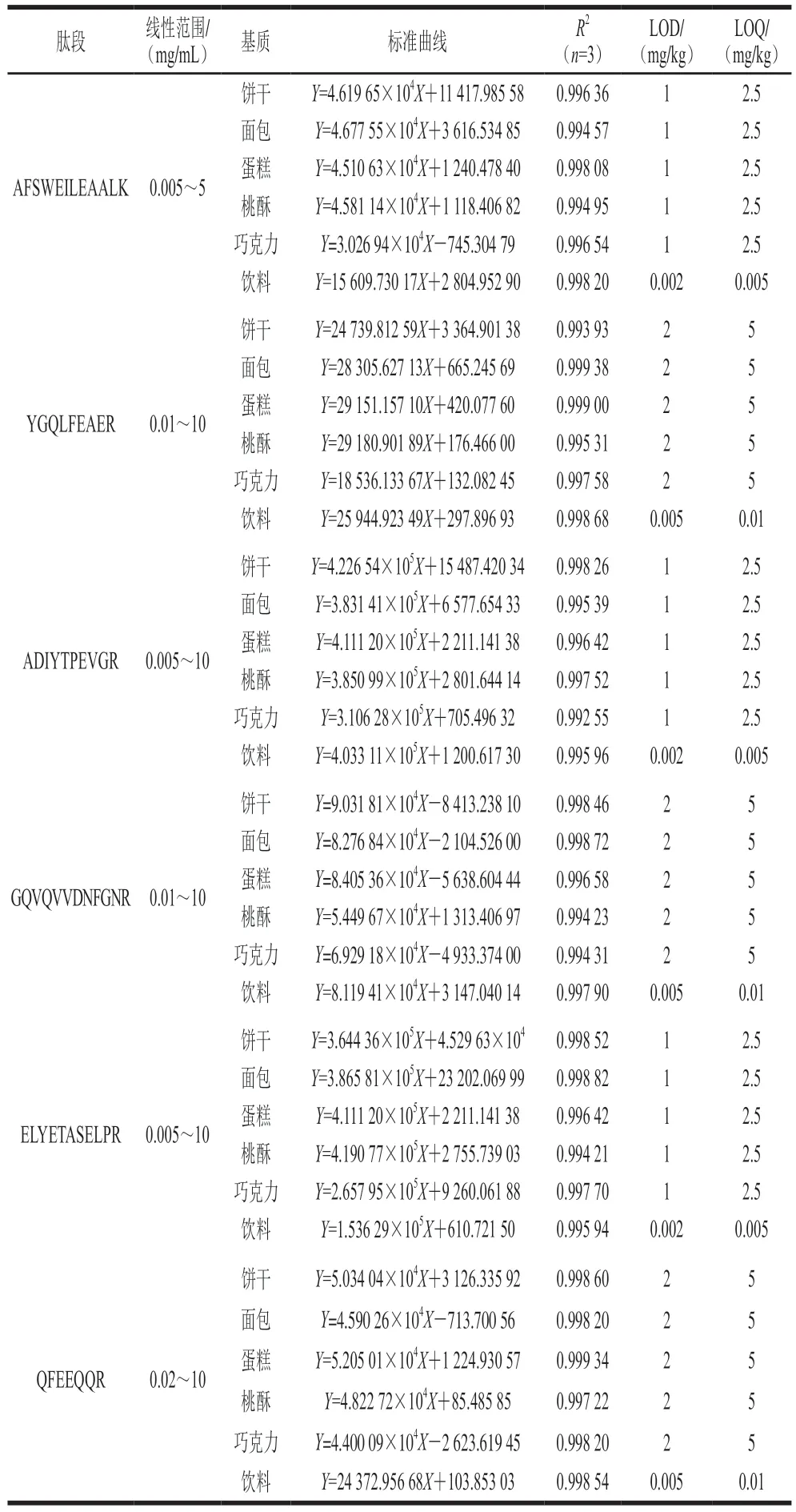
表2 腰果特征肽段不同基質中的線性關系Table 2 Linear calibration equations for determination of cashew specific peptides in different matrices
2.3.2 加標回收率結果
為了對方法的準確性和重復性進行驗證,向空白基質中添加腰果標準儲備液進行回收率的測定,結果如表3、4所示,6 條腰果特征肽段在餅干、面包、蛋糕、桃酥、巧克力和飲料6 種食品基質中的加標回收率為82.5%~109.9%,相對標準偏差(relative standard deviation,RSD)為0.9%~8.9%,均小于12%。證明此方法具有較高的可重復性和穩定性,可以用于不同食品基質中腰果過敏原成分測定。
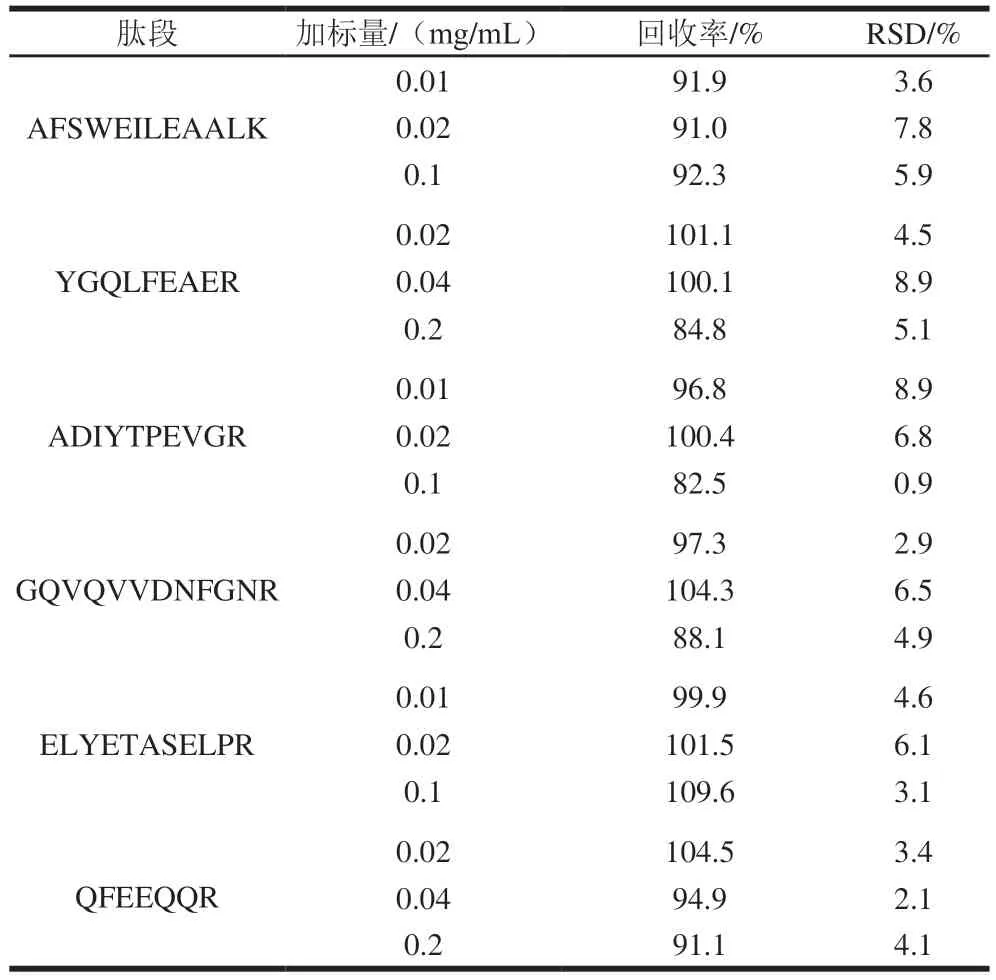
表3 腰果肽段在飲料基質中的加標回收率Table 3 Recoveries of added cashew peptides in beverage matrix
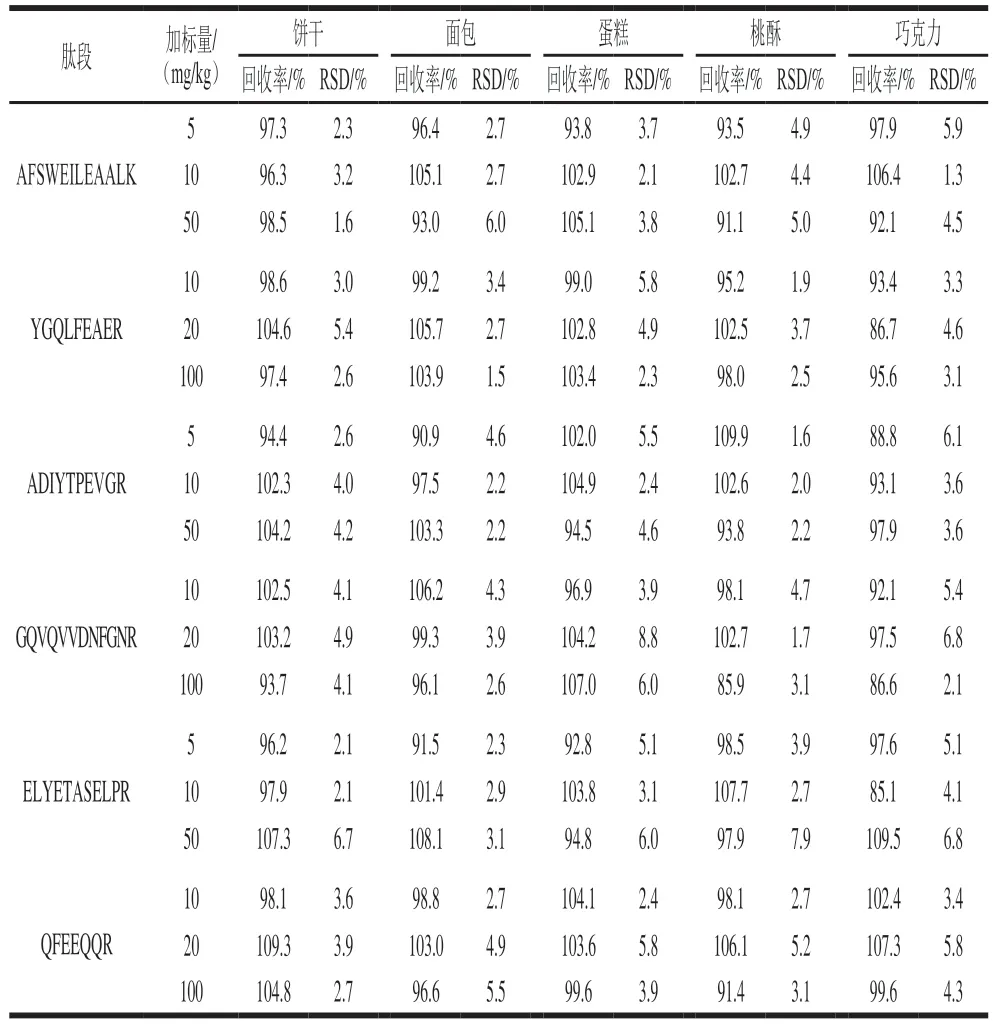
表4 腰果肽段不同固體基質中的加標回收率Table 4 Recoveries of added cashew peptides in different solid matrices
2.3.3 基質效應
食品基質可能對肽段檢測產生干擾影響檢測準確性,因此測定3 個肽段在6 種基質中的基質效應,結果顯示(表5):餅干、面包、蛋糕、桃酥和飲料5 種基質的基質效應均大于100%,說明這5 種基質對腰果肽段的檢測具有增益作用,巧克力基質的基質效應小于100%,說明巧克力對腰果肽段的檢測具有抑制作用,原因可能為巧克力中較為復雜的單寧和鞣酸等成分對肽段的離子化產生了影響。因此,本方法采用基質配標以補償基質效應。
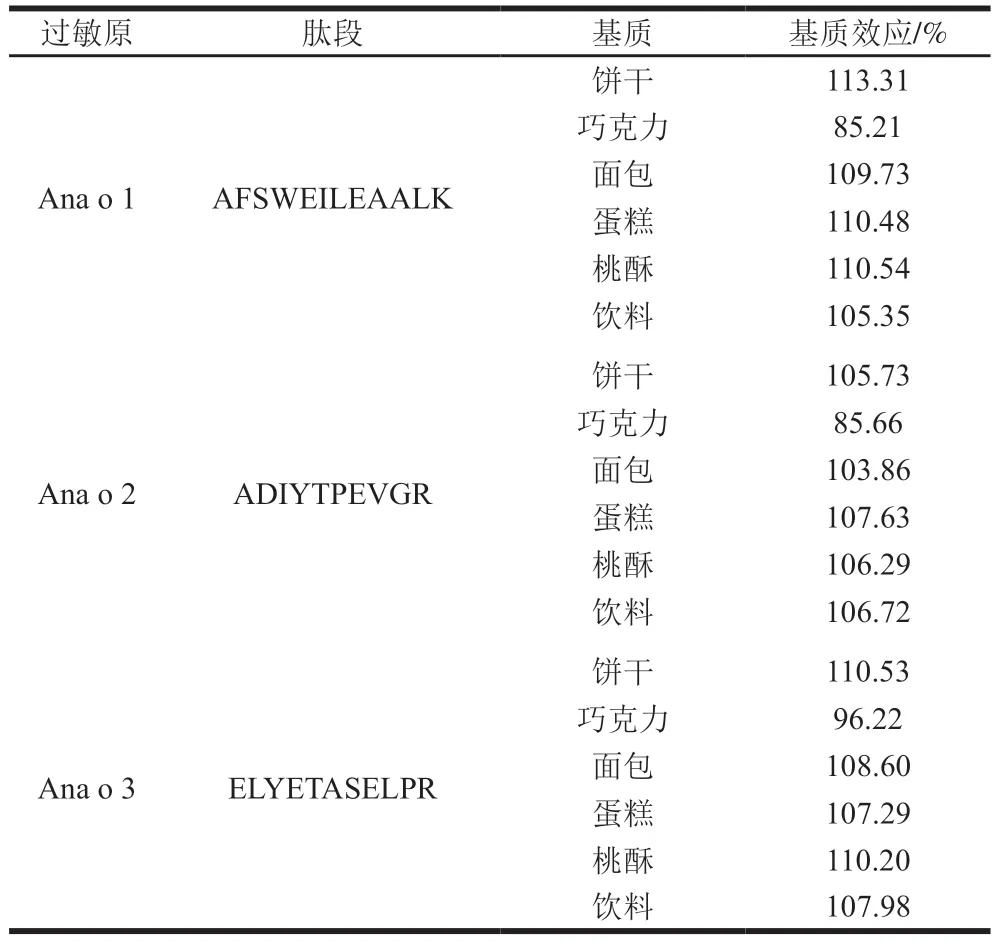
表5 腰果肽段在不同基質中的基質效應Table 5 Matrix effects of cashew specific peptides in different matrices
2.3.4 實際樣品檢測
利用建立的檢測方法對市售餅干、面包、蛋糕、桃酥、巧克力和飲料6 種食品進行了檢測。結果表明(表6),36 個樣品中共7 個樣品檢出腰果過敏原,檢出率為19.4%,樣品包括1 個面包樣品、1 個蛋糕樣品、1 個桃酥樣品和4 個飲料樣品。此外,將檢測結果與食品標簽的標注信息進行對比發現:23 個標注不含堅果成分的食品,檢測結果全部為未檢出;而11 個標注可能含堅果成分的樣品中,有5 個樣品檢出了腰果成分;另外,配料表中標注含有腰果,但未以過敏原形式標注的2 個飲料樣品,也檢出了腰果成分。上述結果表明該方法不僅可用于食品標簽中腰果成分標注情況的檢驗,還可用于食品中隱性腰果過敏原的篩查。

表6 市售樣品中腰果含量檢測結果Table 6 Results of detection of cashew contents in commercial food samples
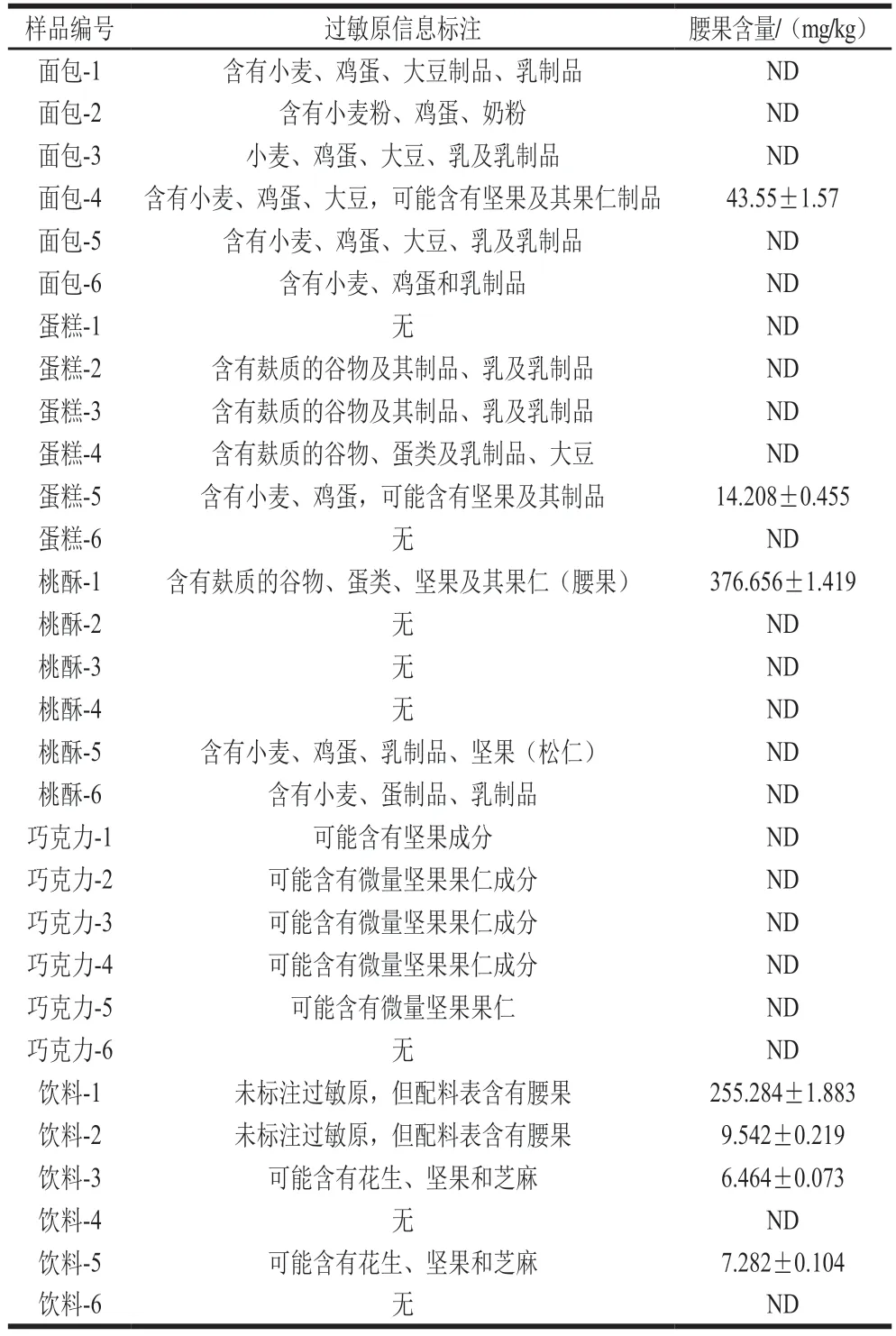
續表6
3 結論
建立食品中腰果過敏原的超高效液相色譜-串聯質譜快速檢測方法。通過蛋白質組學與高分辨質譜相結合,篩選到了6 條腰果特異性肽段,并采用三重四極桿質譜的MRM模式對食品中腰果過敏原進行定量,從而實現腰果過敏原的快速檢測。該方法可以為我國食品標簽真實性檢驗以及食品中隱性過敏原檢驗提供技術支持。

