等離子體協同白藜蘆醇改性香蕉淀粉及其性質
孫 穎,鄭麗麗,鄭曉燕,楊 旸,校 導,艾斌凌,張正科,盛占武,*
(1.海南大學食品科學與工程學院,海南 海口 570228;2.中國熱帶農業科學院海口實驗站,海南 海口 571101)
抗性淀粉(resistant starch,RS)指在健康個體小腸中120 min內無法消化的淀粉,具有類似于益生元和膳食纖維的生理作用[1]。當RS到達結腸時會被腸道微生物發酵,產生短鏈脂肪酸(short-chain fatty acid,SCFA),如乙酸、丙酸和丁酸,這些SCFA能夠刺激腸道有益菌的生長,如雙歧桿菌、乳桿菌[2]。香蕉是重要的熱帶經濟作物,聯合國糧食及農業組織將其列為第4大糧食作物,僅次于水稻、小麥和玉米[3]。淀粉是青香蕉的主要成分,而香蕉淀粉中的RS質量分數高達60%[4]。香蕉穗上一般有10%~15%的殘次果[5],可以作為提取淀粉的原料,從而避免了次品蕉的浪費,對于開發新型保健食品和提高香蕉產業的經濟效益具有重要意義。
然而,天然淀粉存在溶解度低、熱穩定性差、抗回生性差等問題,限制了其在食品加工領域的應用[6]。介質阻擋放電(dielectric barrier discharge,DBD)等離子體作為一種環保、非熱加工技術,可直接以空氣為氣源獲得高密度的等離子體,對輔助設備的要求低,適合工業應用。DBD等離子體產生的離子、中性粒子、光子、電子等高能粒子,能夠與淀粉發生物理或化學反應,如交聯、解聚和刻蝕,從而改善淀粉的理化性質和加工性能[7-8],在淀粉改性方面具有很大潛力[6]。
白藜蘆醇(反式-3,5,4’-三羥基芪)是一種天然多酚類物質,多存在于紅酒、葡萄和西紅柿皮中,具有保護神經、抗癌、抗氧化、消炎和抗病毒的作用[9-10]。然而,白藜蘆醇的水溶性差、生物利用率低以及光、熱穩定性差,使其在食品和醫藥領域中的應用受到限制[9]。研究表明,酚類物質可以通過非共價相互作用(如氫鍵、疏水相互作用和范德華力)與淀粉分子結合,并且與淀粉分子競爭α-淀粉酶和α-葡萄糖苷酶的活性位點,從而提高了淀粉的抗消化能力和熱穩定性[11]。另外,淀粉由于具有無毒、無害、生物相容性好和生物利用率高的特點,可以作為酚類物質的輸送基質,提高多酚在食品生產中和消化道內的穩定性和生物利用率[12]。
目前的研究多集中于單一的等離子體或多酚改性淀粉,對于等離子體協同多酚改性對香蕉淀粉性質的影響尚未闡明。Gao Shanshan等[13]提出DBD等離子體通過降解淀粉鏈,產生更多的線性片段,提高了淀粉與多酚復合的可能性。本研究通過DBD等離子體協同白藜蘆醇改性香蕉淀粉,以期提高淀粉與白藜蘆醇的復合率,改善淀粉的理化性質和加工性能,擴大淀粉在食品行業的應用范圍。
1 材料與方法
1.1 材料與試劑
青香蕉(南天黃),果皮顏色指數為1(根據成熟度比色卡比色),由中國熱帶農業科學院試驗基地提供。
香蕉成熟度比色卡 英國SH Pratt公司;白藜蘆醇上海阿拉丁生化科技股份有限公司;唾液α-淀粉酶(35 U/mg)、胃蛋白酶(2500 U/mg)、胰酶(4000 U/mg)、淀粉葡萄糖苷酶(34 .6 U/ mg)、豬膽鹽Sigma-Aldrich化學試劑公司;D-葡萄糖測定試劑盒(K-GLUK,GOPOD) 愛爾蘭Megazyme國際公司;其他試劑均為分析純。
1.2 儀器與設備
DBD-50型DBD等離子體反應系統(電源型號CTP-2000K) 南京蘇曼等離子科技有限公司;HJ-6A數顯恒溫磁力攪拌器 江蘇金怡儀器科技有限公司;D-37520高速離心機 美國Thermo公司;UV-1800紫外-可見分光光度計 日本島津有限公司;AL204電子分析天平、FE28 pH計 梅特勒-托利多儀器有限公司;ST85B3-1冷凍干燥機 美國Milirock公司;掃描電子顯微鏡(scanning electron microscopy,SEM) 德國卡爾蔡司公司;D8 ADVANCE A25 X射線衍射(X-ray diffraction,XRD)儀、傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,FTIR)儀 德國布魯克公司;7000差示掃描量熱儀(differential scanning calorimeter,DSC) 日本Hitachi公司;PCE-E3000恒溫水浴振蕩器 蘇州威爾實驗用品有限公司。
1.3 方法
1.3.1 香蕉淀粉的提取
參照Yan Siliang等[14]和畢玉[15]的方法。將青香蕉洗凈、去皮,切成2 mm厚的薄片,立即放入于護色液(20 g/L檸檬酸+2 g/L抗壞血酸)中浸泡15 min。護色后的香蕉片與去離子水以質量比1∶1進行打漿2 min,過150 μm篩,篩下物以4000 r/min離心10 min,棄去上清液,然后以3 g/L NaOH溶液溶解沉淀30 min以除去不可溶性纖維,再次離心棄去上清液,然后以去離子水洗滌至上清液呈中性。將沉淀冷凍干燥后過150 μm篩,所得香蕉淀粉標記為NS,密封避光保存。
1.3.2 香蕉淀粉基本成分的測定
水分含量測定:參照GB 5009.3—2016《食品中水分的測定》[16];蛋白質含量測定:參照GB 5009.5—2016《食品中蛋白質的測定》中的凱氏定氮法[17];脂肪含量測定:參照GB 5009.6—2016《食品中脂肪的測定》[18];灰分含量測定:參照GB 5009.4—2016《食品中灰分的測定》[19]進行;總淀粉含量測定:參照GB5009.9—2016《糧油檢驗 玉米淀粉含量測定 近紅外法》中的酶水解法[20]進行;直鏈淀粉含量測定:碘結合實驗法[21]。
1.3.3 DBD等離子體改性
DBD等離子體裝置由反應釜(DBD-100A協同DBD-50使用)、電源(GTP-2000K)和電壓調節器組成,如圖1所示。電極直徑為50 mm,放電距離為8 mm。香蕉淀粉(干基)均勻分散在反應釜中,蓋上上板,然后放入反應器中,以相對濕度40%的空氣為氣源,設置放電電流為2.0 A,放電電壓分別為(20±1)、(30±1)、(40±1)、(50±1)V,即輸入功率分別為40、60、80 W和100 W。放電處理3 min。得到的樣品分別標記為P40S、P60S、P80S、P100S。

圖1 DBD等離子體系統示意圖Fig.1 Photograph of DBD plasma system
1.3.4 香蕉淀粉-白藜蘆醇復合物的制備
參照GaoShanshan 等[13]的方法稍作修改。將1.0 g DBD等離子體改性/未改性香蕉淀粉與質量分數10%的白藜蘆醇一起溶解在30%乙醇溶液中,懸浮液于70 ℃、500 r/min避光攪拌1 h,然后5000 r/min離心10 min,沉淀用30 mL 50%的乙醇溶液洗滌3 次,以去除游離白藜蘆醇,將沉淀冷凍干燥并過150 μm篩,密封避光貯存備用。得到的復合物分別標記為Res-P40S、Res-P60S、Res-P80S、Res-P100S和Res-NS。
1.3.5 復合率的測定
參照Liu Hang等[22]的方法稍作修改。稱取1.0 g 由1.3.4節獲得的復合物于50 mL離心管中,加入20 mL去離子水,沸水浴加熱 2 min,然后將分散體10000 r/min離心15 min,取300 μL上清液與5 mL去離子水和1 mL碘試劑(I2(0.2%)+KI(2.0%))充分混合,在690 nm波長處測定復合物的吸光度,以青香蕉淀粉與白藜蘆醇復合物的吸光度作為參考,每個樣品重復測定3 次,根據式(1)計算復合率:
式中:A對照為對照組的吸光度;A樣品為待測樣品的吸光度。
1.3.6 SEM分析
取少量樣品固定于特殊的導電雙面膠,用離子濺射儀進行噴金處理,應用SEM觀察樣品微觀形貌,加速電壓為15 kV。
1.3.7 XRD分析
將預先平衡水分的10 mg待測淀粉粉末樣品平鋪于樣品池中制好樣,放入XRD儀樣品臺中進行測試。XRD儀在40 kV和30 mA操作條件下運行,掃描速率為4°/min,步長0.02°,掃描角度(2θ)在5°~60°之間。
1.3.8 FTIR分析
將1.0 mg樣品與100.0 mg KBr混合后壓片,在4000~400 cm-1的掃描范圍內,以4 cm-1的分辨率收集光譜。使用OMNIC進行去卷積處理,半峰寬為36 cm-1,增強因子為3.1,獲得1047 cm-1和1022 cm-1處的峰高比值。
1.3.9 溶解性和膨脹力
參照Liu Hang等[22]的方法,在50~90 ℃范圍內測定。稱取0.5 g樣品,加入25 mL去離子水,在水浴振蕩器中以150 r/min孵育30 min,待懸浮液冷卻至室溫后,3000 r/min離心15 min,將上清液在105 ℃干燥至質量恒定。溶解度和膨脹力計算公式如下:
式中:W1為干燥上清液后淀粉的質量/g;W0為樣品質量/g;W2為膨脹淀粉的質量/g。
1.3.10 持油能力
參照Wang Siyu等[23]的方法測定樣品的持油能力。準確稱取1.0 g樣品放入已稱量的離心管中,按1∶20質量比加入食用油,在30 ℃、200 r/min水浴振蕩30 min,然后10000 r/min離心15 min,除去上清液稱量。持油能力按下式計算:
式中:m1為樣品質量/g;m2為離心后沉淀的質量/g。
1.3.11 凍融穩定性
將1.0 g樣品和16 mL去離子水在沸水浴中加熱30 min,置于50 mL預先稱量的離心管中,于-20 ℃貯存24 h后于30 ℃解凍4 h,然后5000 r/min離心15 min,棄去上清液,凍融循環重復3 次。用析出的水量計算析水率。計算公式如下:
式中:W為析出水分的質量/g;M為樣品的質量/g。
1.3.12 凝沉特性
參照閆斯亮[24]的方法并稍作修改。將樣品配制成質量分數為1%的淀粉懸濁液,置于沸水浴中加熱并不斷攪拌15 min使其充分糊化。然后將淀粉糊倒入15 mL刻度試管中,加滿至刻度線,每隔一定時間記錄上清液體積,以析出的上清液體積占淀粉糊總體積的百分比表示樣品的凝沉性。
1.3.13 DSC分析
將2~4 mg樣品在鋁坩堝中稱量,加水使樣品-水質量比為1∶2,密封在室溫下平衡過夜,然后裝入DSC池中。以10 ℃/min的速率從20 ℃加熱至100 ℃,并用空坩堝作為空白。使用儀器軟件計算起始糊化溫度(To)、峰值糊化溫度(Tp)和終止溫度(Tc),糊化焓(ΔH)基于吸熱峰的面積計算。
1.3.14 體外消化性
參照國際標準和相關研究[25-26]并稍作修改。采用模擬唾液(simulated salivary fluid,SSF)、模擬胃液(simulated gastric fluid,SGF)和模擬腸液(simulated intestinal fluid,SIF)三步法評估樣品的模擬GIT體外消化特性。
口腔相:將50 mg樣品加入到預先加熱到37 ℃的10 mL含有唾液α-淀粉酶(75 U/mL)的SSF中混勻,將混合物調節pH 6.8,然后在37 ℃水浴培養振蕩器中100 r/min振蕩2 min。
胃相:將預熱至37 ℃的20 m L 含有胃蛋白酶(2000 U/mL)的SGF加入到口腔相得到的樣品中,調節pH 3.0。然后,將混合物置于37 ℃水浴培養振蕩器中100 r/min振蕩2 h。
小腸相:取20 mL由胃相產生的樣品并調節pH 7.0,加入10 mL SIF,5.0 mL溶于SIF的胰酶(800 U/mL)和淀粉葡萄糖苷酶(15 U/mL),3.5 mL豬膽鹽(53.57 mg/mL),調節pH 7.0。將混合物置于37 ℃的水浴培養振蕩器中100 r/min振蕩150 min以模擬腸道環境。
在口腔相消化2 min(S2),胃相消化20 min和120 min(G20和G120),以及在小腸中消化10、20、60、90、120、150 min(I10~I150)后,取樣0.5 mL,以測定樣品的水解度。利用D-葡萄糖測定試劑盒測定樣品消化過程中產生的葡萄糖濃度。淀粉水解率計算公式如下:
式中:Gh為水解產生的葡萄糖量/mg;Si為淀粉量/mg;0.9為從葡萄糖轉化成葡萄糖酐(淀粉組成單元)摩爾質量比轉化因子。
根據Go?i等[27]的研究,模擬小腸消化過程中淀粉水解的動力學計算如下:
式中:Ct為t時間(min)淀粉的水解率/%;C∞為淀粉的最終水解率/%;K為消化速率/min-1,通過轉換方程式的斜率對數測定:
樣品中快速消化淀粉(rapid digestible starch,RDS)、慢消化淀粉(slowly digestible starch,SDS)和RS的百分比計算如下:
式中:G120和G20分別為20 min和120 min內水解的葡萄糖含量/mg;F為游離糖含量/mg;T為淀粉的總質量/mg。
1.4 統計分析
實驗數據用Origin 2021軟件繪圖,用SPSS 23.0軟件ANOVA檢驗法進行顯著性分析(P<0.05),結果以表示。
2 結果與分析
2.1 香蕉淀粉的基本成分
如表1所示,總淀粉含量占87.32%,與當地大種高把(85.51%)和西貢蕉(91.96%)中淀粉的純度相當[15,24]。

表1 香蕉淀粉的基本成分含量(n=3)Table 1 Basic chemical components of banana starch (n=3)
2.2 復合率的測定結果
如表2所示,DBD等離子體改性提高了香蕉淀粉與白藜蘆醇的復合率,并且隨著處理功率的增加,復合率呈先上升后下降的趨勢。這是因為等離子體處理導致香蕉淀粉鏈解聚,分子質量降低,從而形成了更多短而小的線性片段,提高了與多酚結合的可能性[13];隨著處理功率的增加,淀粉鏈發生聚合或交聯,使得中、高分子質量淀粉鏈的比例增加[28],與多酚的接觸面積減小,導致復合率下降。由于不同功率的DBD等離子體處理對復合率的影響顯著(P<0.05),因此選用60 W的處理功率。

表2 不同功率DBD等離子體改性/未改性香蕉淀粉與白藜蘆醇的復合率Table 2 Complexation rates between resveratrol and modified/unmodified banana starch with different plasma powers
2.3 微觀形態
白藜蘆醇和淀粉樣品的顆粒形態如圖2所示。NS基本呈橢圓形(圖2B),在NS表面觀察到了一些凹陷,這些凹陷可能與淀粉在分離純化過程中護色液和NaOH的腐蝕以及粉碎過程中的機械力作用有關(圖2b)[7]。DBD等離子體處理后,顆粒形態基本不變,視野中的淀粉分子增多(圖2C),說明DBD等離子體能夠使淀粉鏈發生降解,產生了更多的淀粉碎片[29]。從圖2c可以看出,淀粉顆粒表面的凹陷程度加深,并且出現了一些裂紋或孔洞,這些非穿透性的損傷是由DBD等離子體刻蝕造成的。圖2D、E顯示,與白藜蘆醇復合后,淀粉能夠保持原有的顆粒形態,但顆粒表面變得粗糙,出現一些褶皺(圖2d、e),這是由于水熱處理對淀粉表面造成了一定的破壞;有白色物質附著說明白藜蘆醇結合在了淀粉表面。

圖2 白藜蘆醇和不同香蕉淀粉樣品的SEM圖Fig.2 SEM pictures of resveratrol and different banana starch samples
2.4 XRD圖譜
從圖3可以看出,淀粉樣品均在2θ為15°、17°和23°附近有主衍射峰,表現為CA型XRD圖譜,即與A型結構相似的C型圖譜[14]。這表明DBD等離子體處理及與白藜蘆醇復合并沒有改變香蕉淀粉的結晶形態,與之前的報道一致[12-13,30]。此外,在2θ為7°、13°和20°[31]處沒有出現衍射峰表明白藜蘆醇與香蕉淀粉沒有形成“V”型包合物,說明白藜蘆醇不占據香蕉淀粉的螺旋空腔。形成“V”型包合物的主要驅動力是疏水相互作用,而酚類物質的疏水性不足或尺寸過大都不能形成“V”型包合物。白藜蘆醇的分子質量較低,不存在尺寸過大不能進入螺旋空腔的問題,因此這是白藜蘆醇的疏水性不足導致[32]。DBD等離子體處理后結晶度升高,這是因為DBD等離子體產生了自由基和活性氧物質,如氧自由基、羥自由基、O、O3、、N+和,淀粉被這些高能粒子所修飾,從而導致淀粉分子鏈之間發生交聯現象,一些小碎片分子重組成更多的結晶域[30,33];還有可能是淀粉無定形區域在一定溫度下通過縮合和醚鍵形成的脫羥基可能導致淀粉分子以更有序的形式重新排列,更接近結晶區,從而導致相對結晶度的增加[34]。在等離子體處理的青香蕉淀粉、藜麥淀粉、苦蕎麥淀粉、高粱淀粉和小麥淀粉中也觀察到了類似結果[13,30,34]。白藜蘆醇可以與淀粉直鏈或支鏈上的α-D-葡萄糖的氫基團結合,即通過2~3 個弱CH-π鍵將芳香殘基堆積在淀粉吡喃糖環上從而與淀粉結合,并且一個多酚分子能同時與多個淀粉分子相互作用,起到“橋梁”作用,使無定形淀粉分子的有序度增加,半結晶區的堆積更加緊密,因此,結晶度升高[12,35]。

圖3 白藜蘆醇和4 種樣品的XRD圖譜和相對結晶度Fig.3 XRD patterns and relative crystallinity of resveratrol and normal and modified starch
2.5 FTIR 和傅里葉變換衰減全反射紅外光譜(attenuated total internal reflectance-FTIR,ATR-FTIR)分析
淀粉樣品在3000~4000、2925 cm-1和1654 cm-1處有3 個紅外吸收峰,分別對應于O—H、C—H和—CH2的伸縮振動[31]。從圖4a可以看出,所有樣品的FTIR光譜(4000~400 cm-1)均有相似的條帶,說明等離子體處理及與多酚復合沒有改變淀粉分子的化學基團,因此白藜蘆醇與香蕉淀粉之間主要通過非共價相互作用結合。之前研究也觀察到了相同結果[11,14,36-38]。1200~900 cm-1是淀粉的指紋結構區,1047 cm-1附近的峰反映了淀粉結晶區的結構特征,對應于淀粉的有序結構;1022 cm-1附近的峰反映了淀粉無定形區的結構特征,對應于淀粉的無序線團結構,比值R1047/1022反映了淀粉顆粒表面的短程有序程度[31,39]。對1200~900 cm-1波段的光譜進行去卷積化處理,結果如圖4b和表3所示。可以觀察到,經等離子體處理后,R1047/1022值有所增加,即香蕉淀粉顆粒表面的短程有序性增加,表明形成了更多的有序結構域;而與白藜蘆醇復合后R1047/1022值的增加可能是因為白藜蘆醇通過非共價鍵與淀粉分子結合,起到了交聯或增塑的作用,增強了分子的有序性[12],這與XRD的結果一致。
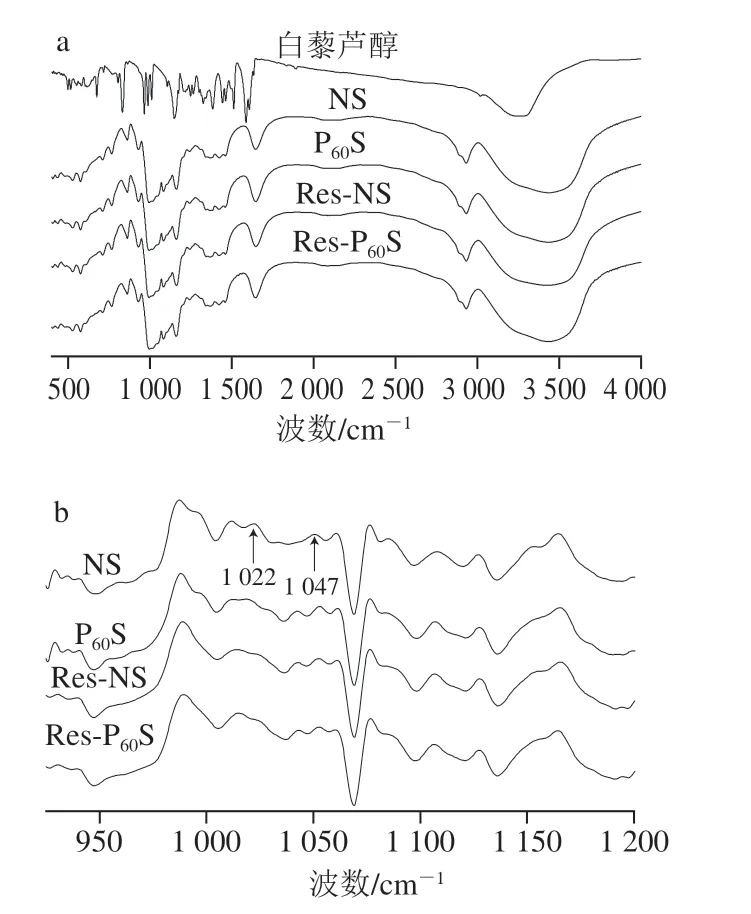
圖4 不同香蕉淀粉樣品及多酚的FTIR(a)和ATR-FTIR(b)光譜圖Fig.4 FTIR (a) and ATR-FTIR (b) spectra of resveratrol and normal and modified banana starch
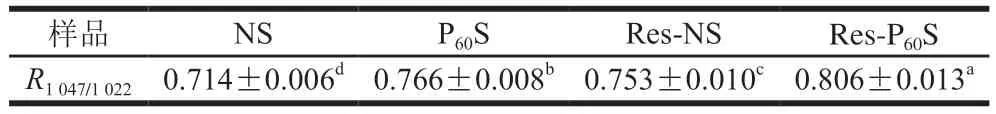
表3 DBD等離子體和白藜蘆醇對香蕉淀粉去卷積化圖譜的峰值比值R1047/1022的影響Table 3 Effects of DBD plasma and resveratrol on the ratio of absorbance (R1047/1022) from deconvoluted FTIR spectra at 1047 and 1022 cm-1 of resveratrol and normal and modified banana starch
2.6 溶解度和膨脹力測定結果
溶解度和膨脹力反映了淀粉結構的致密程度及其結晶區與無定形區的結合情況。如圖5所示,所有樣品的溶解度和膨脹力都隨溫度的升高而顯著增加。DBD等離子體處理使淀粉表面的分子鏈斷裂并伴有裂紋的產生,造成表面結構松散,水分子更容易沿著表面進入顆粒內部,導致內部的淀粉分子更易溶出,提高了淀粉的溶解度[33]。高溫可能導致直鏈淀粉從支鏈淀粉晶體表面完全遷移,增加了直鏈淀粉的淋溶,從而具有更高的溶解度[40]。淀粉與白藜蘆醇復合后溶解度降低,這是由于白藜蘆醇促進了淀粉分子的交聯,也可能與淀粉-白藜蘆醇復合物形成的致密晶型有關[13]。膨脹度主要與支鏈淀粉有關。支鏈淀粉構成淀粉的結晶結構,XRD已證明DBD等離子體與白藜蘆醇復合改性提高了香蕉淀粉的結晶度,支鏈淀粉的排列更加致密有序,復合物的結構更加穩定,從而抑制了淀粉的溶脹。

圖5 不同淀粉樣品的溶解度和膨脹力Fig.5 Solubility and swelling power of different starch samples
2.7 持油能力測定結果
從圖6可以看出,DBD等離子體改性后樣品的吸油率有很大提升,這主要是因為等離子體處理引起了淀粉表面損傷,產生了裂縫和小孔,油脂更容易滲入其中。也有可能是等離子體處理導致淀粉中的蛋白質與油脂的接觸面積增加,蛋白質的毛細作用將脂肪捕獲到淀粉結構中,因此等離子體處理的淀粉具有較高的持油能力[8]。香蕉淀粉-白藜蘆醇復合物具有更高的持油能力,這可能是因為香蕉淀粉與白藜蘆醇之間的相互作用力增加了淀粉的吸附性。在苦蕎淀粉與槲皮素復合后也觀察到了這種現象[41]。
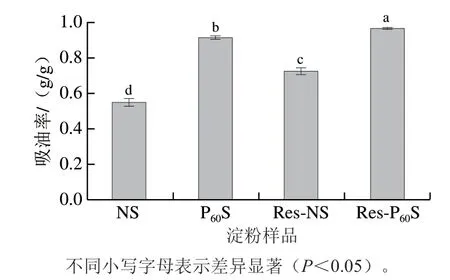
圖6 不同淀粉樣品的持油能力Fig.6 Oil-holding capacity of different starch samples
2.8 凍融穩定性測定結果
凍融穩定性反映了淀粉在冷凍和解凍過程中抵御外界物理變化的能力[42]。通常以析水率作為衡量指標,析水率越大,說明淀粉的凍融穩定性越差。析水率增加主要是由直鏈淀粉的老化造成[43-44]。不同淀粉樣品在凍融循環過程中析水率的變化如圖7所示,隨著凍融次數的增加,淀粉樣品的析水率增加,說明凍融穩定性逐漸變差。DBD等離子體處理后淀粉的析水率增加,這是因為等離子體處理導致直鏈淀粉分子增多,在老化過程中,相鄰淀粉鏈之間的氫鍵恢復,重排成更加致密結晶化的分子微晶束,香蕉淀粉分子間的水分被擠出。在冷凍過程中這些水分子結成冰,并在隨后的解凍過程中從淀粉凝膠的孔隙中析出,從而導致析水率增大。而淀粉與白藜蘆醇復合可以減緩淀粉的老化,因此凍融穩定性較強,這與蕎麥黃酮對玉米淀粉以及槲皮素對苦蕎淀粉凍融穩定性影響的結果一致[41,45]。
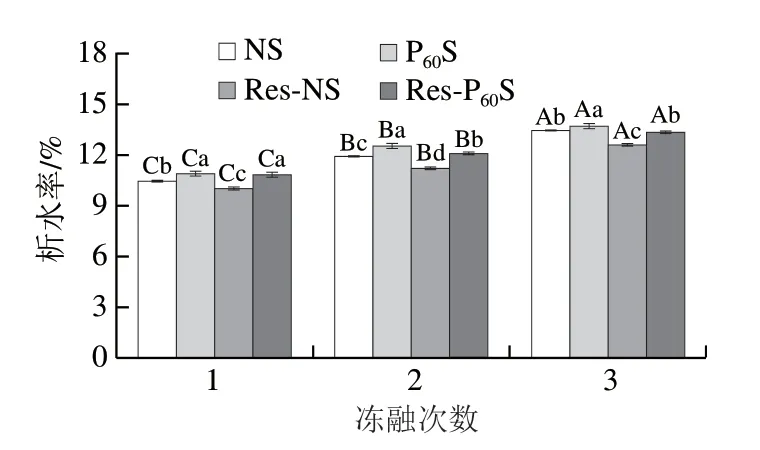
圖7 不同淀粉樣品在凍融循環過程中析水率的變化Fig.7 Change in syneresis of different starch samples during freeze-thaw cycles
2.9 凝沉特性測定結果
糊化淀粉的凝沉是淀粉分子重排的過程,是淀粉分子從無序混亂狀態趨于穩定有序狀態的過程[46-48]。在凝沉過程中,直鏈淀粉分子間的羥基更易形成氫鍵,鏈與鏈之間相互締合,形成排列緊密有序的大分子微晶膠束,進而發生凝沉;而支鏈淀粉分子由于其本身“枝椏”結構的影響,分子內部不易相互結合,因此不易發生凝沉。如圖8所示,經DBD等離子體處理后,由于淀粉鏈被降解,形成了更多、更短的直鏈淀粉碎片,彼此之間更容易發生重排,因此凝沉速率上升[24]。而白藜蘆醇可以與淀粉直鏈和支鏈上的α-D-葡萄糖的氫基團通過CH-π鍵結合[49],將芳香殘基堆積在淀粉吡喃糖環上[50],并且一個白藜蘆醇分子同時能與多個淀粉分子相互作用,形成直鏈淀粉-白藜蘆醇復合物和支鏈淀粉-白藜蘆醇“類直鏈淀粉”復合物[11],使無定形淀粉分子的有序度增加,從而進一步提高了凝沉速率。
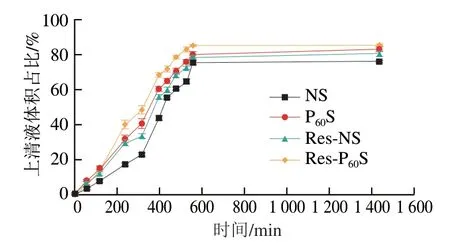
圖8 不同淀粉樣品的凝沉特性Fig.8 Retrogradation characteristics of different starch samples
2.10 凝膠化熱特性分析
通過DSC研究DBD等離子體和白藜蘆醇對青香蕉淀粉熱特性的影響,熱力學參數如表4所示。凝膠化分為3 個階段。首先,水分被吸收,淀粉顆粒膨脹;其次,更多的水分被吸收,雙折射現象迅速消失;最后,淀粉的可溶性部分從體系中浸出[51]。To表示最不穩定微晶的熔化溫度,Tc為最穩定微晶的熔化溫度[52]。凝膠化溫度To、Tp和Tc分別從64.10、71.14 ℃和73.92 ℃提高至70.18、75.79 ℃和82.53 ℃。DBD等離子體處理樣品的To、Tp、Tc和ΔH均升高,表明DBD等離子體處理拓寬了香蕉淀粉的凝膠化溫度范圍,凝膠化所需要的能量升高。這歸因于等離子體引起的交聯效應、淀粉微晶的異質性增加以及無定形區和結晶區之間的協同熔融程度降低[53]。與白藜蘆醇復合后,凝膠化溫度和ΔH也升高,這是由于復合物的結構更加致密穩定。此外,難溶性的白藜蘆醇附著在淀粉顆粒上,增加了空間位阻,限制了直鏈淀粉的滲透和支鏈淀粉的伸展,對淀粉顆粒的溶脹破裂具有阻礙作用[39,54-55]。本研究表明,DBD等離子體和白藜蘆醇協同處理提高了香蕉淀粉的凝膠化溫度,這與XRD和FTIR的結果一致。
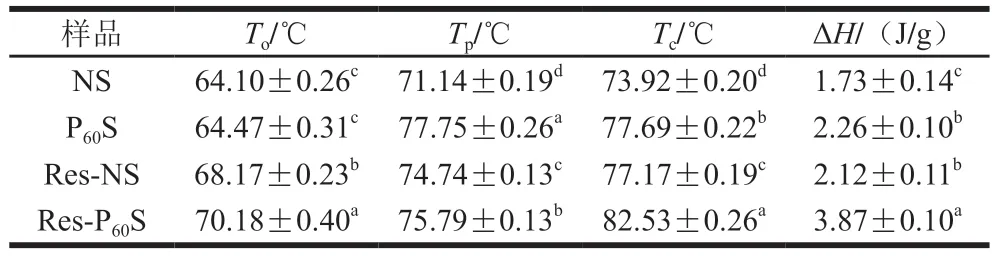
表4 不同香蕉淀粉樣品DSC的熱力學參數Table 4 DSC thermal parameters of different banana starches
2.11 消化特性測定結果
利用一級消化動力學模型計算淀粉水解的速率常數K、最終水解率C∞以及不同種類淀粉的含量(表5)。K值反映了淀粉的酶解速率,K值越大,說明消化速率越快[56]。圖9顯示了體外模擬消化過程中不同淀粉樣品的水解率。可以看出,等離子體處理后,K值和C∞增加,因此DBD等離子體處理提高了淀粉的水解率和水解速率,這是由RDS含量升高、SDS和RS含量的降低引起。淀粉消化率的提高還與支鏈淀粉和直鏈淀粉分子質量的降低以及較大比例的短鏈有關[57-60]。等離子體處理使淀粉分子發生解聚,產生了很多短鏈分子和一些單糖或寡糖分子,如麥芽糖、麥芽三糖和麥芽四糖[61],這些游離的小分子更易被淀粉酶消化,因此等離子體改性后淀粉的消化率和消化速率提高。與白藜蘆醇復合后,RS和SDS含量升高,RDS含量降低,因此淀粉的水解率降低。此外,白藜蘆醇通過非共價相互作用與香蕉淀粉結合,這會競爭性地抑制淀粉酶與淀粉分子的結合,并且白藜蘆醇本身對α-淀粉酶和α-葡萄糖苷酶的活性具有抑制作用[62]。因此,香蕉淀粉與多酚復合物具有開發低消化、低血糖保健食品的潛力。

表5 不同淀粉樣品模擬 GIT 體外消化的RDS、SDS和RS及水解動力學參數Table 5 Proportions of RDS,SDS and RS and hydrolysis kinetic parameters of different starch samples digested in simulated GIT
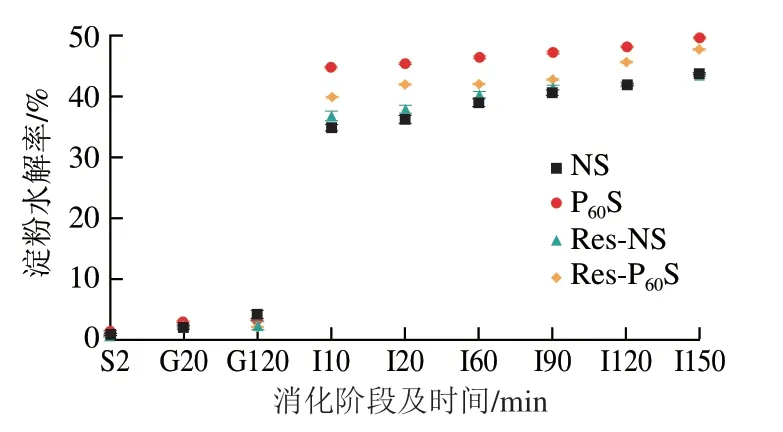
圖9 模擬體外消化過程中的不同樣品的淀粉水解率變化Fig.9 Changes in hydrolysis rate of different starch samples during in vitro digestion
3 結論
通過DBD等離子體和白藜蘆醇對香蕉淀粉進行復合改性,研究DBD等離子體改性香蕉淀粉-白藜蘆醇復合物的理化特性和消化性。經復合改性后,淀粉的溶解度、持油能力、凝沉性和凝膠化溫度顯著提高,膨脹力和凍融穩定性降低。香蕉淀粉與白藜蘆醇之間通過CH-π鍵形成結晶度較高的非包合物,結構更加致密有序,熱穩定性提高。體外消化實驗表明,DBD等離子體處理使淀粉的消化率提高;與白藜蘆醇復合后RDS含量降低,SDS和RS含量升高,淀粉的消化率降低。因此,這種新型的復合改性方法不僅改善了香蕉淀粉的加工性能,而且有利于促進等離子體在功能性食品中的應用,所形成的復合物可能兼具多酚和傳統RS的益生活性。

