鴨茅內生木霉菌株TD-MM鑒定及其特性研究
鄭嘉淇, 景 浩, 李夢圓, 張超文, 韓玉竹,2*
(1. 西南大學動物科學技術學院, 重慶 400000; 2. 草食動物科學重慶市重點實驗室, 重慶 400000)
植物病害在世界各種植區內頻繁發生,在一定程度上會降低農作物的產量與品質,限制作物的栽種與培育,影響農產品的運輸與貯藏,造成經濟損失[1]。絕大多數植物病害是由真菌侵染引起的[2],致病性真菌能夠引起植物出現根腐、萎蔫、葉斑、葉枯等病理癥狀,對寄主造成毀滅性的傷害[3]。許多真菌病害的防治十分依賴化學殺菌劑。然而,長期不規范地施用化學農藥,增強了病原微生物的抗藥性,加劇了土壤理化性質的惡化,嚴重破壞了糧食安全[4]。因此,尋找綠色、高效的病蟲害防治手段,是實現農業可持續發展的重要目標。生物防治符合生態農業的理念,近年來備受青睞。其中,利用拮抗微生物防治植物病害是一種相對安全和有效的方法[5-6],其具有選擇性強、經濟、無殘留的特點,能夠為開發環保型制劑提供技術支撐[7]。
植物內生菌廣泛分布在植物組織中[8-9],駐留在寄主的細胞間或細胞內,形成穩定互利的共生體系。植物體為內生菌的生長繁殖提供必需的營養物質,而內生菌則通過自身功能及其代謝產物直接或間接地影響植物[10]。相關研究表明,植物內生真菌能夠分泌多種抗菌活性物質,與病原微生物競爭營養及生態位,誘導寄主植物產生廣譜的系統抗性[11]。此外,內生菌能夠通過溶磷、固氮、產生鐵載體等機制促進作物對營養物質的吸收,并分泌赤霉素和生長素等植物激素[12]。如蜂巢草(Leucasaspera)葉片中的內生木霉具有促生和防病價值[13]。我國生物資源種類繁多,挖掘植物內生菌的應用潛力,可為提高植物抗逆性和維持生態系統平衡提供有益參考。
鴨茅(DactylisglomerataL.)是世界上最著名的冷季型禾本科牧草之一,在世界各地廣泛栽培[14],具有產量高、適應性強[15]、適口性好和碳水化合物含量高等特點,對畜牧業生產有著重要意義[16-17]。鴨茅根系發達,能夠固定表層土,提高土壤抗侵蝕能力,推進石漠化地區的生態修復[18]。然而,目前利用鴨茅內生真菌進行生物防治的研究較少。木霉是一類典型的植物內生菌,在農業、工業和生態應用中具有重要意義[19-21]。為進一步探索鴨茅內生生防菌株,課題組從鴨茅葉片中分離獲得32株內生木霉,經平板對峙實驗篩選得到的菌株TD-MM對多種植物病原真菌均具有強拮抗作用。本研究基于形態學以及rDNA-ITS,EF-1α,LSU rDNA和RPB2序列分析明確菌株TD-MM的分類學地位,對該菌株的抑菌活性和防治效果進行初步研究,并測定其生物學特性,以期為內生木霉菌資源的開發及其在植物病害生物防治領域的應用提供科學依據。
1 材料與方法
1.1 材料
供試內生菌株哈茨木霉TD-MM(Trichodermaharzianum);植物病原真菌雙核絲核菌(binucleateRhizoctonia)、立枯絲核菌(Rhizoctoniasolani)、交鏈格孢(Alternariaalternata)、膠孢炭疽菌(Colletotrichumgloeosporioides)、尖孢鐮刀菌(Fusariumoxysporum)和辣椒疫霉(Phytophthoracapsici)(表1),均來源于西南大學牧草微生物課題組。
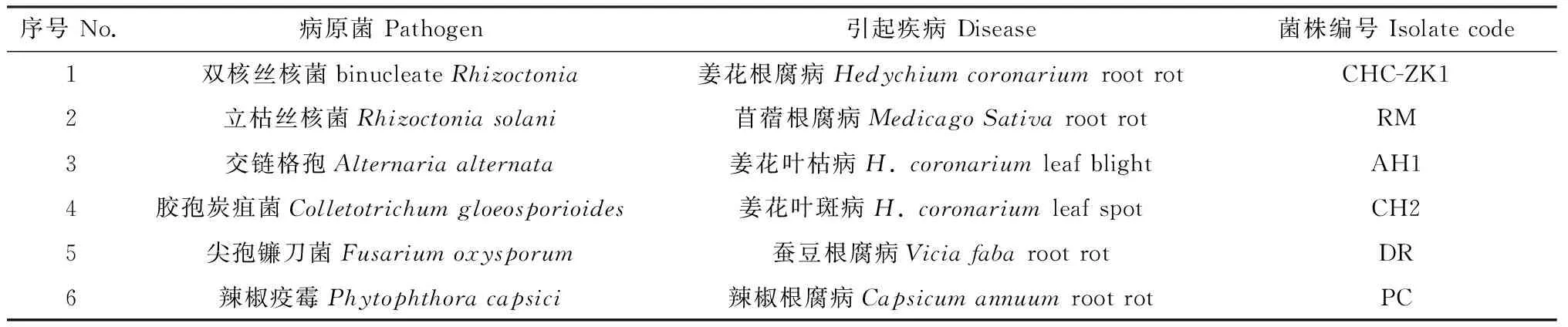
表1 供試植物病原真菌信息Table 1 Information of plant pathogens tested in this study
馬鈴薯葡萄糖瓊脂(Potato dextrose agar,PDA)培養基:馬鈴薯浸粉5 g、葡萄糖20 g、瓊脂20 g。
燕麥(Oatmeal agar,OA)培養基:燕麥片65 g、瓊脂15 g。
平板計數瓊脂(Plate count agar,PCA)培養基:胰蛋白胨5 g、酵母浸粉2.5 g、葡萄糖1 g、瓊脂20 g。
馬鈴薯蔗糖瓊脂(Potato sugar agar,PSA)培養基:馬鈴薯浸粉5 g、蔗糖20 g、瓊脂20 g。
麥芽浸膏瓊脂(Malt extract agar,MEA)培養基:麥芽浸膏30 g、大豆蛋白胨3 g、瓊脂20 g。
虎紅瓊脂(Rose bengal chloramphenicol agar,RBC)培養基:蛋白胨5 g、葡萄糖10 g、磷酸氫二鉀1 g、硫酸鎂1 g、孟加拉紅0.033 3 g、瓊脂20 g。
1.2 樣品采集及分離
2019年5月,從重慶市榮昌區西南大學種植基地采集鴨茅,裝入無菌袋中并編號,置于4℃冰箱保存備用。切取新鮮健康的鴨茅葉片(5 mm×5 mm),在70%酒精中浸泡1 min,置于3%次氯酸鈉溶液消毒2 min,隨后用無菌水沖洗3次,使用無菌吸水紙擦干后,接種至含0.1%氯霉素的PDA培養基。25℃下暗培養4 d后,挑取菌落邊緣少許菌絲接種至PDA平板純化培養,分離篩選得到32株木霉菌株。經對峙實驗獲得1株對多種病原真菌具有強拮抗作用的木霉菌株,命名為TD-MM。將純化后的TD-MM菌株轉接至PDA斜面保存備用。
1.3 菌株TD-MM的鑒定
1.3.1形態學鑒定 將菌株TD-MM接種于PDA平板上,在25℃恒溫黑暗條件下培養,每日觀察、記錄菌落培養特征,定期在光學顯微鏡下觀察菌絲、分生孢子梗以及分生孢子形態、大小等顯微結構特征,作為菌株鑒定的形態學依據。
1.3.2分子鑒定 刮取PDA培養基上的菌絲,按照真菌基因組試劑盒PlantGen DNA Kit (CW0553A) 的方法提取真菌DNA,保存于—20℃備用。分別選用引物ITS4/ITS5,EF1-728F/EF2,fRPB2-5F/fRPB2-7cR[22],LR0R/LR7[23]對真菌的ITS,EF,LSU和RPB片段進行PCR擴增,擴增產物送蘇州金唯智生物科技有限公司測序。得到的序列在GenBank上用BLAST進行同源性比較,利用MEGA 5.05軟件以最大似然法構建系統發育樹。
1.4 菌株TD-MM對植物病原真菌的抑菌活性
采用平板對峙培養法進行抑菌試驗,將PDA平板上培養3天的木霉菌株TD-MM和6種植物病原性真菌分別用直徑4 mm的打孔器制成菌餅,將菌株TD-MM菌餅與絲核雙核菌、立枯絲核菌、尖孢鐮刀菌、辣椒疫霉、膠孢炭疽菌、交鏈格孢的菌餅分別接種在直徑為90 mm的PDA平板兩側,2個菌餅相距4 cm。以只接種病原菌為對照,每組設3次重復,25℃恒溫培養3天后,觀察記錄病原菌和TD-MM菌落生長半徑,并計算抑菌率。拮抗等級參照Belll等[24]的分級標準。基于平板對峙實驗,挑取兩菌交界處及病原菌內部的菌絲,通過顯微鏡進行觀察,記錄菌株TD-MM和6株病原真菌相互作用的形態特征。

1.5 菌株TD-MM生物學特性的測定
1.5.1培養基對菌株TD-MM生長和產孢量的影響 將直徑為4 mm的木霉菌餅轉接到PDA,PSA,PCA,MEA,OA和RBC平板中央,于25℃黑暗培養,各試驗處理均設3次重復。每天用十字交叉法測量菌落直徑。3天后,在平板中加入10 mL無菌水混合均勻,獲得病原菌的孢子懸液,稀釋后用血球計數板計數,計算每mL孢子懸浮液中的孢子數。
1.5.2溫度對菌株TD-MM生長和產孢量的影響 將菌餅移至PDA平板中央,分別于15,20,25,30和35℃黑暗培養,各試驗處理均設3次重復。每天測量菌落直徑,3天后測量產孢量。
1.5.3pH值對菌株TD-MM生長和產孢量的影響 調節PDA培養基pH值為4,5,6,7,8和9,接種菌餅后于25℃黑暗條件下培養,各試驗處理均設3次重復。每天測量菌落直徑,3天后測量產孢量。
1.5.4光照對菌株TD-MM生長和產孢量的影響 將菌餅轉接至PDA平板中央,在人工氣候箱內設置24 h連續黑暗、24 h連續光照、12 h光照/12 h黑暗三種光照條件,于25℃下進行培養,各試驗處理均設3次重復。其中,光照強度為5 000 lx。每天測量菌落直徑,3天后測量產孢量。
1.5.5菌株TD-MM分生孢子的致死溫度測定 將TD-MM菌餅置于經高壓蒸汽滅菌的離心管中,每支離心管中加入500 μL無菌水。以10支離心管為一組,每組處理設3次重復。將離心管分別置于40,45,50,55,60,65,70和75℃的水浴鍋中加熱10 min,冷卻后吸取200 μL孢子懸液涂在PDA平板上,培養7天后觀察是否有菌絲出現。根據試驗結果縮小范圍,以1℃為單位設置溫度梯度,確定致死溫度,測定方法同上。
1.6 菌株TD-MM對姜花、蠶豆和辣椒根腐病的防效測定
試驗共設 3個處理:對照(CK)、只接種病原菌(P)、同時接種病原菌和生防木霉TD-MM(P+B),每個處理各重復8次。選取姜花、蠶豆和辣椒長勢健康的幼苗,使用滅菌針頭刺傷植株根部,挑取病原菌菌絲接種在P組與P+B組植株的創傷處,對照CK組則接種無菌瓊脂塊,而后用潤濕的無菌棉花包裹傷口。刮取PDA平板上的TD-MM菌絲,將其分散到0.1%吐溫-80溶液,制成2.0×107cfu·mL-1的孢子懸液。用無菌刀片劃出創傷面,針對P+B組的植株注射10 mL生防菌株TD-MM的孢子液,CK組和P組則注射無菌水。將接種后的姜花、蠶豆以及辣椒栽培至無菌土壤中,使用無菌水對植株進行澆灌,接種40 d后挖取植株并清洗根部,參照齊素敏等[25]的方法將發病程度分為6級,觀察記錄發病程度,測定其鮮重、根重和株高,評定植株的病情指數以及菌株TD-MM的防效。

1.7 數據分析
使用Excel 2016進行數據處理,采用DPS 2005軟件Duncan’s新復極差法進行差異顯著性檢驗。
2 結果與分析
2.1 菌株TD-MM鑒定
2.1.1菌株TD-MM的形態特征 菌落在PDA平板上生長快,菌絲叢茂密。菌落有不規則輪紋,初期呈白色,最終變為深綠色。顯微鏡觀察可見其瓶頸短,基部變細,中間膨大;孢子梗叢束疏松,環狀排列;分生孢子梗從菌絲的側枝上長出,主分枝呈樹狀,其上次級分枝多,分枝直角突出或向頂呈放射狀;產孢豐富,分生孢子球形或近球形,大小為(3.1~4.2)μm×(2.9~4.0)μm(圖1)。根據菌株TD-MM的培養特性和形態特征,初步鑒定該菌株為木霉屬(Trichodermaspp.)真菌。
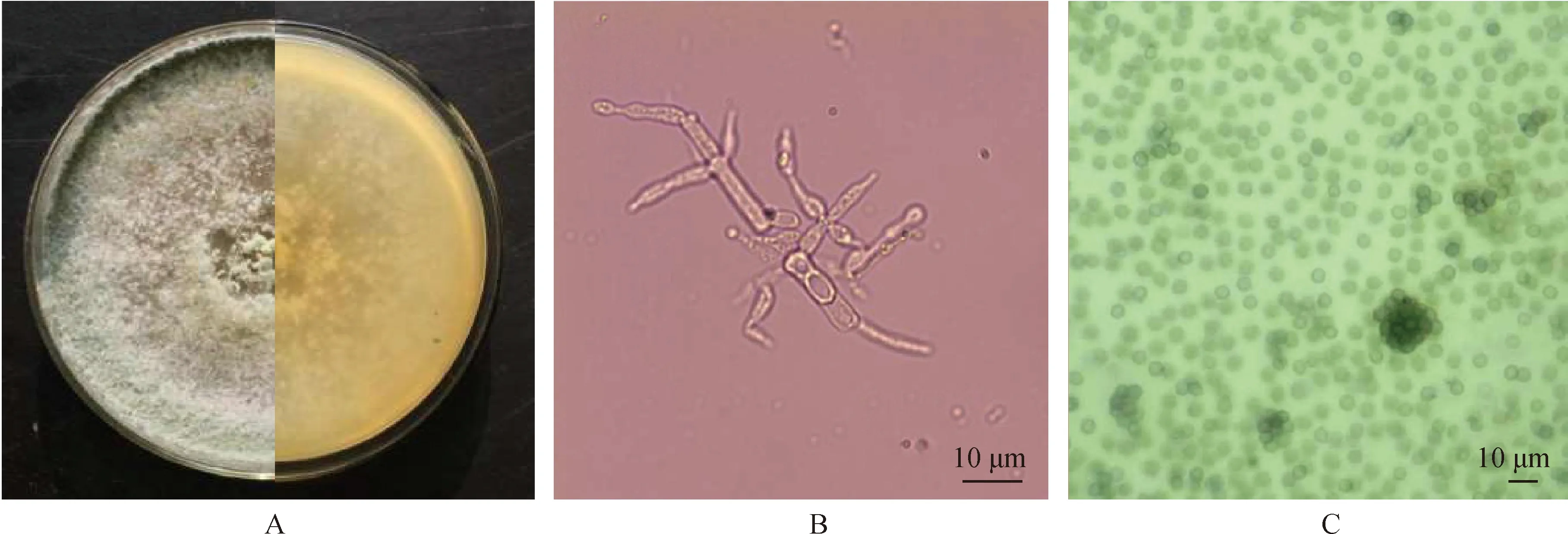
圖1 菌株TD-MM的形態特征Fig.1 Morphological characteristics of strain TD-MM注:A為PDA培養基上菌落形態;B為分生孢子梗形態;C為分生孢子形態Note:Panel A displays colony morphology on PDA plate;Panel B conidiophore;Panel C conidia
2.1.2菌株分子序列分析 提取菌株的DNA,對ITS,EF,RPB和LSU基因序列進行PCR擴增,獲得的片段大小分別為593,532,1 065和1 306 bp。序列提交至GenBank,獲得的登陸號分別為OK445673,OK501223,OK501222,OK445501。ITS序列(OK445673)與哈茨木霉VRU-Th137(KJ000320),G360(MH651386)以及CTCCSJ-G-HB40547(KY750324)的同源性均為100%。EF序列(OK501223)與哈茨木霉IMI 359823(AF348092),T139(MW803055)以及GJS 05-116(FJ463320)的同源性均為100%。RPB序列(OK501222)與哈茨木霉T11(KX632543),GJS 05-107(FJ442708)和T35(KX632561)的同源性分別為99.81%,99.81%和99.72%。LSU序列(OK445501)與MF13025(KC809921),BCC
基于EF-1α序列(OK501223)與Trichoderma屬的相關序列構建系統發育樹,其與哈茨木霉T11(KX632600),Thaum14(MT081434),DAOM242937(KX463434)和96E(MT732942)聚于同一分支,親緣關系最近(圖2)。結合形態學特征,明確菌株TD-MM為哈茨木霉(T.harzianum)。
2.2 菌株TD-MM對植物病原菌的抑菌活性
平板對峙培養的結果表明,內生木霉TD-MM對6種植物病原菌均有較好的抑制作用。菌株TD-MM對絲核雙核菌、立枯絲核菌和辣椒疫霉的抑菌效果最為突出(圖3),培養7天后抑菌率高達100%,拮抗等級達到I;對尖孢鐮刀菌、膠孢炭疽菌、交鏈格孢的抑菌效果明顯,7天時抑菌率分別為85.11%,78.86%和67.56%,拮抗等級達到II(表2)。

圖2 基于EF-1α序列構建菌株TD-MM及其相關菌株的系統發育樹Fig.2 Phylogentic tree of isolate TD-MM and other related isolates based on EF-1α sequences
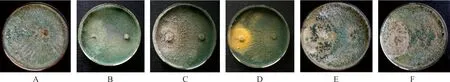
圖3 菌株TD-MM與多種病原菌的對峙實驗Fig.3 Strain TD-MM confronted against different pathogenic fungi注:A為菌株TD-MM對峙雙核絲核菌;B為菌株TD-MM對峙立枯絲核菌;C為菌株TD-MM對峙辣椒疫霉;D為菌株TD-MM對峙尖孢鐮刀菌;E為菌株TD-MM對峙膠孢炭疽菌;F為菌株TD-MM對峙交鏈格孢Note:Panel A shows TD-MM against binucleate Rhizoctonia;Panel B TD-MM against R. solani;Panel C TD-MM against P. capsici;Panel D TD-MM against F. oxysporum;Panel E TD-MM against C. gloeosporioides;Panel F TD-MM against A. alternata

表2 菌株TD-MM對植物病原菌生長的拮抗效果Table 2 Inhibititory effects of strain TD-MM on the growth of plant pathogens

續表2
基于顯微鏡檢的結果,推測哈茨木霉菌株TD-MM通過空間競爭和重寄生抑制6種植物病原菌的生長(圖4)。菌株TD-MM與病原菌接觸后,能夠迅速占領其生長空間,從而取得競爭優勢。而后TD-MM菌絲攀附、纏繞病原菌的菌絲,呈現螺旋狀的結構。該生防菌能夠濃縮病原菌菌絲的原生質,逐漸消解病原菌的菌絲,使其縊縮或斷裂,從而實現重寄生作用。

圖4 菌株TD-MM對病原菌菌絲生長的影響Fig.4 Effects of strain TD-MM on the hyphae growth of pathogens注:A為TD-MM纏繞絲核雙核菌;B為TD-MM使絲核雙核菌細胞原生質濃縮;C為TD-MM使交鏈格孢菌細胞原生質濃縮Note:Panel A displays TD-MM twined binucleate Rhizoctonia;Panel B TD-MM made binucleate Rhizoctonia protoplasm become blighted;Panel C TD-MM made Alternaria alternata protoplasm become blighted
2.3 哈茨木霉菌株TD-MM的生物學特性
2.3.1培養基對菌株TD-MM生長和產孢量的影響 菌株TD-MM在RBC和PDA平板上生長較快,培養2天平均菌落直徑分別達到5.42 cm和4.91 cm,3 d即長滿培養基;在OA,MEA和PCA平板上,培養4 d便達到9.00 cm;在PSA培養基上生長最慢。菌株在RBC培養基和PDA培養基上產孢量最大,為3.5×108個·mL-1和3.2×108個·mL-1;在PSA培養基上產孢量最低(表3)。
表3 培養基對菌株TD-MM生長和產孢的影響Table 3 Effects of medium types on the growth and sporulation of strain TD-MM
2.3.2溫度對菌株TD-MM生長和產孢量的影響 菌株TD-MM最適生長溫度和最適產孢溫度均為30℃,培養2 d平均菌落直徑達到6.72 cm,培養3 d即可長滿培養基,產孢量達3.7×108個·mL-1。當溫度低于20℃或者高于35℃時,菌絲生長速度和產孢數量明顯下降(表4)。

表4 溫度對菌株TD-MM生長和產孢的影響Table 4 Effects of temperature on the growth and sporulation of strain TD-MM
2.3.3pH值對菌株TD-MM生長和產孢量的影響 菌株TD-MM在pH值為4~9范圍內均可生長。在pH=5時菌絲生長較快,產孢量較多,培養2 d平均菌落直徑達到6.79 cm,培養3 d即可長滿培養基,產孢量達3.3×108個·mL-1(表5),表明該菌株生長和產孢更偏好弱酸性的環境。
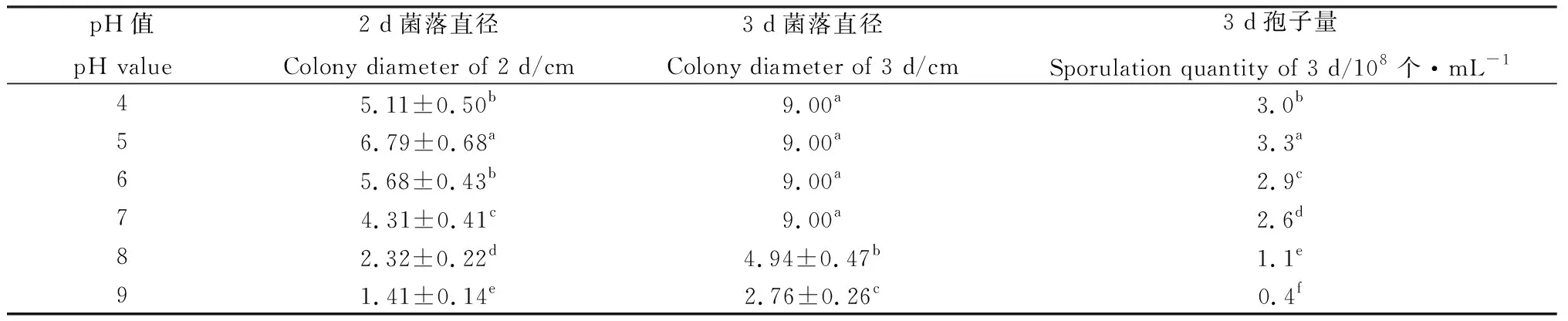
表5 pH值對菌株TD-MM生長和產孢的影響Table 5 Effects of pH value on the growth and sporulation of strain TD-MM
2.3.4光照對菌株TD-MM生長和產孢量的影響 菌株TD-MM在光暗交替條件下生長最快,產孢最多,培養2 d平均菌落直徑達到6.77 cm,3 d即長滿培養基;在完全黑暗條件下,培養2 d平均菌落直徑達到4.93 cm,其菌落生長速度和產孢量與連續光照條件下的菌落相近(表6)。
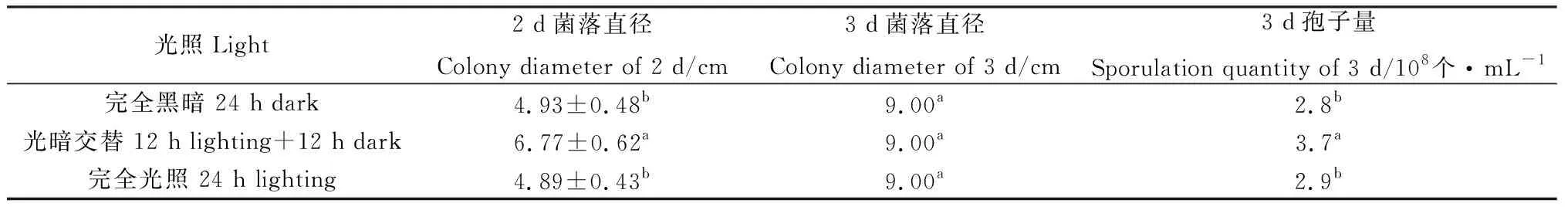
表6 光照對菌株TD-MM生長和產孢的影響Table 6 Effects of light conditions on the growth and sporulation of strain TD-MM
2.3.5菌株TD-MM致死溫度測定 菌株TD-MM孢子懸液在60~70℃的溫度處理10 min后,冷卻轉接到培養基上未觀察到菌絲出現。當水浴鍋溫度控制在55~59℃時,可見有菌落形成;但在60℃的溫度下未見有孢子萌發,由此確定分生孢子致死溫度為60℃。
2.4 菌株TD-MM對姜花、蠶豆和辣椒根腐病的防效測定
如表7所示,姜花致病處理(P)病情指數高達92.5,蠶豆和辣椒致病處理則分別達到66.67和68.75,致病處理下3種植株的鮮重、根部鮮重以及植株高度均顯著低于對照(CK)水平,其生長發育明顯受到抑制。接種生防菌株TD-MM的處理(P+B)病情指數在23.61~27.08之間。其中,菌株TD-MM對姜花根腐病的防效達到74.32%,對蠶豆和辣椒根腐病的防效分別為59.38%和65.66%(表7)。經內生木霉TD-MM處理后,3種作物的株重和根重均較對照顯著增加,表明菌株TD-MM具有促進根部生長的能力,有利于植物的生殖和發育。
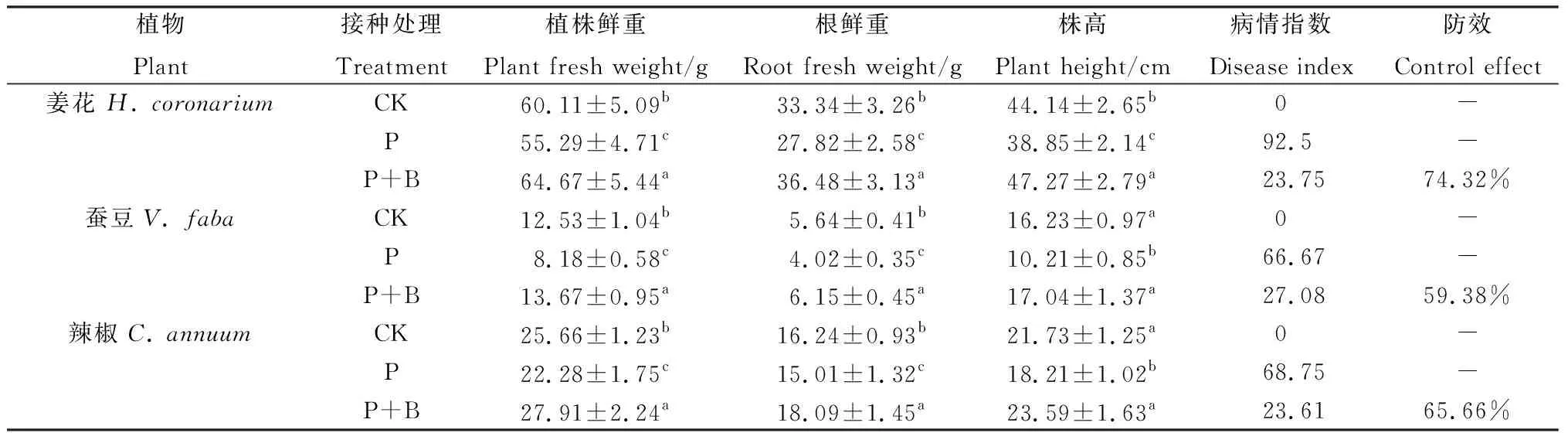
表7 菌株TD-MM對姜花、蠶豆和辣椒根腐病的防效Table 7 The control effect of strain TD-MM against H. coronarium,V. faba and C. annuum root rot
3 討論
本研究從重慶市榮昌區鴨茅葉片分離并篩選出一株強拮抗作用的生防菌株TD-MM,經形態特征與rDNA-ITS,EF-1α,LSU rDNA和RPB2序列分析,完成對生防木霉的鑒定。由于木霉中某些組的ITS序列相似度極高,EF-1α在識別木霉菌時更為可靠[26]。因此,本實驗基于EF-1α序列構建了菌株TD-MM的系統發育樹,結合形態學鑒定確定該菌株為哈茨木霉(T.harzianum)。
內生木霉TD-MM對雙核絲核菌(binucleateRhizoctonia)、立枯絲核菌(R.solani)以及辣椒疫霉(P.capsici)拮抗效果高達100%,對尖孢鐮刀菌(F.oxysporum)的抑制率達到85.11%,表現出極強的競爭力。這一結果說明菌株TD-MM對根腐病害的防治具有巨大的應用潛力。張建[27]研究表明,木霉NJAU4742能夠覆蓋6種病原真菌,顯微鏡下可觀察到木霉菌絲纏繞病菌菌絲,呈現出較好的重寄生能力。本實驗基于平板對峙以及顯微鏡檢,觀察到內生木霉TD-MM在抵御病原菌時能迅速擴展,包圍病原菌菌落,侵占生存空間,并在后期完全覆蓋或部分覆蓋病原真菌,推測其拮抗機制主要為空間競爭和重寄生。防效測定結果也印證了菌株TD-MM對姜花、蠶豆和辣椒根腐病顯著的防治能力。Rajani等[28]從藥用植物分離篩選得到的內生木霉主要通過競爭、重寄生和產生揮發性有機化合物實現抑菌效果。揮發性有機化合物能夠逸散到環境中,在抗真菌、促生和誘導抗性中起到舉足輕重的作用[29-31]。關于菌株TD-MM分泌揮發性代謝物的種類、含量及其功能還有待深入研究。
木霉的促生機制是多種機制協同的效果[32]。一方面,木霉可直接參與植物重要生理過程[33];另一方面,木霉通過改善土壤環境,間接促進作物營養吸收與生長發育[34]。課題組在前期研究中發現,鴨茅根際木霉有利于植株干物質、粗灰分、粗蛋白、粗脂肪及鈣、磷含量的增長,明顯提高鴨茅的營養品質[35]。此外,鴨茅內生哈茨木霉可通過分泌IAA、溶磷、固氮、解鉀來促進作物增產[36]。相關研究指出,木霉能夠刺激主根的生長以及側根和根毛的形成[37]。本文防效試驗表明,同時接種病原菌和生防木霉TD-MM后,姜花、蠶豆和辣椒的株高相較于空白對照分別增長了7.09%,4.99%和8.56%,根重則分別提高了9.42%,9.04%和11.39%。未來可對鴨茅葉片相關生理生化指標進行測定,如可溶性蛋白含量、可溶性糖含量與抗氧化酶活性等,以進一步探明菌株TD-MM的促生機理。
明確優良生防菌株的最佳培養條件,可為菌劑開發和生產應用提供數據支撐。內生木霉TD-MM在虎紅瓊脂(RBC)培養基上生長速度最快,產孢量最大,推測造成該結果的主要因素是培養基成分中的硫酸鎂。鎂元素作為生物體內的大量元素,不僅是細胞內一般分子成分,還可作為酶的激活劑調節微生物的生理過程。郭成等[38]的研究表明,以葡萄糖為碳源的培養基對短密木霉菌株GAS1-1的菌落生長和產孢效果最好,而蔗糖效果最差。本實驗中,相比起馬鈴薯蔗糖瓊脂(PSA)培養基,馬鈴薯葡萄糖瓊脂(PDA)培養基更有利于木霉菌株的營養生長和產孢,印證了上述結論。原因可能在于葡萄糖是單糖,更容易被微生物吸收、分解與利用。曾華蘭[39]從四川省簡陽市丹參根際土壤分離篩選獲得哈茨木霉T23。其研究結果表明,T23菌絲生長和產孢的最適溫度為25~30℃,最適pH值為5~7,光暗交替條件下菌絲生長最好、產孢量最多,與本課題分離自重慶市榮昌區的TD-MM結果相近。考慮到四川、重慶比鄰而居,氣候相近,因此,來自川渝地區的菌株在生物學特性上可能存在一定的相似性。綜上,菌株TD-MM具有較好的環境適應能力,能廣泛應用于土傳病害的防治。田間環境條件較為復雜,易受自然氣候等因素的影響,盡管本文的活體接種實驗取得較好的防治效果,但距離大規模的應用還存在一定的差距。后續研究可優化篩選木霉TD-MM菌劑發酵條件,并對其定殖能力和生物安全性作評估。
4 結論
本研究從鴨茅上分離篩選到一株哈茨木霉TD-MM,其生長速度快,產孢量大,生態適應性較強,對不同植物病原菌具有較強的抑制效果,生防價值高。推測哈茨木霉TD-MM通過生長空間競爭和重寄生作用抑制植物病原真菌。內生木霉TD-MM對姜花、蠶豆以及辣椒的根腐病防效較好,且有利于提高作物的生長性能。深入挖掘、利用我國的內生菌資源,能夠為生防菌劑的開發奠定新條件,為農牧產業的發展提供新思路。

