水稻惡苗病病菌鑒定及其對化學藥劑的敏感性分析
李廣勝 李月嬌 孫淑琴 李巖 朱祥茂 楊秀榮 馮學良

摘要:為進一步明確天津地區(qū)水稻惡苗病發(fā)病特點及引發(fā)該種病害的病原菌,同時摸清水稻惡苗病病原菌對目前生產(chǎn)上常用化學藥劑的抗藥性,以對天津地區(qū)水稻惡苗病的發(fā)生特點及化學藥劑防治提出解決方案和優(yōu)化措施。通過采集天津市不同地區(qū)不同栽培管理條件下水稻發(fā)病植株,依據(jù)發(fā)病植株的田間癥狀表現(xiàn),并通過病原菌分離觀察菌株形態(tài)特征和構(gòu)建系統(tǒng)發(fā)育樹等分子生物學鑒定方法,明確該病是由藤倉鐮刀菌(Fusarium fujikuro)引起的水稻惡苗病;通過對苯醚甲環(huán)唑、丙硫菌唑、多菌靈、福美雙、咯菌腈、咪鮮胺、氰烯菌酯、肟菌酯、戊唑醇等9種常用化學殺菌劑的敏感性測定,結(jié)果表明該病原菌對生產(chǎn)上使用頻率最高的氰烯菌酯、咯菌腈和咪鮮胺3種藥劑均產(chǎn)生了嚴重的抗藥性,其抗性倍數(shù)分別為730.16、107.27、326.73,而且8個不同來源菌株的抗藥性地域差異較大,根據(jù)其EC50可分成3、2、3、3、3、2、3、3、2個聚類組。結(jié)果表明,藤倉鐮刀菌是天津地區(qū)水稻惡苗病的主要侵染病原菌,由于抗藥性較嚴重近1~2年內(nèi)應(yīng)當停止使用氰烯菌酯、咪鮮胺、咯菌腈等3種殺菌劑,其他類型殺菌劑也應(yīng)交替、輪換使用,避免連續(xù)、單一用藥,以降低水稻惡苗病給水稻生產(chǎn)造成的損失。
關(guān)鍵詞:水稻惡苗病;藤倉鐮刀菌(Fusarium fujikuro);抗藥性;抗性倍數(shù);聚類分析
中圖分類號:S435.111.4+4? 文獻標志碼:A
文章編號:1002-1302(2023)24-0114-09
水稻惡苗病別稱徒長病,其主要傳播侵染途徑為種子帶菌傳播,使用化學藥劑對種子進行處理是最有效的方式[1]。近年來由于菌株的抗藥性問題造成該病普遍發(fā)生,其主要田間癥狀表現(xiàn)為帶病種子播種后不發(fā)芽或不能出土,苗期發(fā)病時表現(xiàn)為感病植株比正常植株細、高,可造成水稻減產(chǎn)3.0%~95.4%,甚至絕收[2]。在水稻惡苗病的藥劑防治過程中,最初多菌靈作為主要藥劑由于長期單一使用,造成了抗藥性,導致防治效果降低[3-5]。咪鮮胺作為多菌靈的代替藥劑在大規(guī)模推廣使用一段時間后經(jīng)相關(guān)學者研究發(fā)現(xiàn)該化學藥劑也存在一定的抗性風險,2012年氰烯菌酯由于較好的防效在生產(chǎn)中得到了推廣,在經(jīng)過一段時間的推廣使用后,有研究指出該病原菌的肌球蛋白突變可能導致對氰烯菌酯抗性的增加,并且能夠產(chǎn)生多個抗性生理小種,從而降低其防效[6-10]。
2022年7—8月天津市水稻種植區(qū)惡苗病發(fā)生嚴重,有些地塊病穴率為48%~74%,病株率為10.80%~22.40%,嚴重地塊造成10%~30%的產(chǎn)量損失,而且癥狀有多種表現(xiàn),發(fā)病時期也是參差不齊,嚴重威脅著天津市水稻的生產(chǎn),針對以上情況,本試驗開展病株采集、病原菌分離純化、病原菌鑒定及其對化學藥劑的敏感性測定,以便分析發(fā)病原因并尋找解決對策。
1 材料與方法
1.1 試驗材料
水稻惡苗病病株采自天津市寧河區(qū)的楊泗村(菌株編號2201)、東棘坨鎮(zhèn)(菌株編號2202)、苗莊村(菌株編號2203);津南區(qū)的西小站(菌株編號2204)、南辛房村(菌株編號2205);寶坻區(qū)的大鐘莊(菌株編號2206)、小辛碼頭(菌株編號2207)、王卜莊(菌株編號2208)等8個不同栽培管理條件下水稻種植田,分離獲得8個菌株。
1.2 供試藥劑
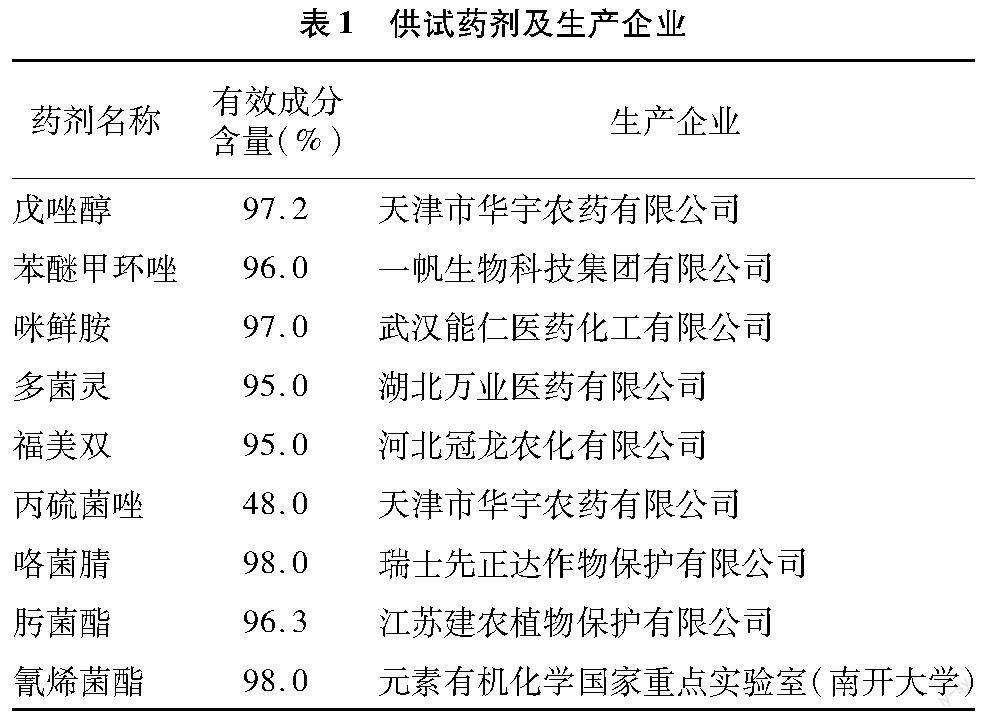
供試藥劑詳見表1。
1.3 試驗方法
1.3.1 樣品采集
2022年7—8月在天津?qū)幒印氎妗⒔蚰系人痉N植區(qū)采集水稻惡苗病發(fā)病植株樣品,觀察并記錄植株整體發(fā)病狀態(tài)及程度,將發(fā)病植株放入采樣袋,并按照不同采樣地點依次進行編號,當天帶回天津市農(nóng)業(yè)科學院植物保護研究所植物病害實驗室進行病原菌分離。
1.3.2 病原菌分離
病原菌的分離采取組織分離法,首先用滅菌后的蒸餾水清洗采集的植株,水分擦干將準備分離的組織剪成4 mm×4 mm的小塊,采用5%次氯酸鈉溶液進行浸泡處理10 min,再用滅菌后的蒸餾水進行沖洗,吸干水分后于每個PSA培養(yǎng)基平板中放置5塊,每個樣品重復分離3次,于25 ℃環(huán)境中使其自然生長約1周。待組織塊周圍長出大小形態(tài)一致的菌絲后,挑取菌落邊緣菌絲體對病原菌進行純化培養(yǎng),將分離的供試菌株單株分別轉(zhuǎn)移到PSA培養(yǎng)基平板上,在25 ℃環(huán)境中繼續(xù)培養(yǎng)7 d并觀察菌落大小和正反面顏色以及小型分生孢子形態(tài)特點,并根據(jù)鐮刀菌的形態(tài)特征進行菌株形態(tài)學鑒定[11]。
1.3.3 分子鑒定與系統(tǒng)發(fā)育樹構(gòu)建
將不同來源的菌株在培養(yǎng)基上培養(yǎng)7 d,刮取少量菌絲,采用北京索萊寶科技有限公司的真菌基因組DNA提取試劑盒對基因組進行提取,并用天根生化科技(北京)有限公司的2×Taq PCR Mix進行PCR擴增。采用通用引物EF1-728F(5′-CATCGAGAAGTTCGAGAAGG-3′)和TEF1LLErev(5′-AACTTGCAGGCAATGTGG-3′)擴增目標片段[12];擴增體系:模板DNA 2 μL,引物(10 μmol/L)各1 μL,2×Taq PCR Mix 25 μL,使用ddH2O將體系加到50 μL。擴增程序:94 ℃預變性3 min,94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸60 s(循環(huán)35次),72 ℃保持5 min。隨后將PCR產(chǎn)物進行1.0%瓊脂糖凝膠電泳,挑選目標條帶PCR產(chǎn)物進行測序,測序結(jié)果在NCBI基因庫進行BLAST比對,確定病原菌的種類。此外,自GenBank下載藤倉鐮刀菌[Fusarium fujikuroi NRRL 5338(MN193860.1)、F. fujikuroi IMI 58289(HC036627.1)]、尖孢鐮刀菌[F.oxysporum NM16 (MT565405.1)、F.oxysporum CBS:130302 (MT011000.1)]、新知鐮刀菌[F.andiyazi CBS:119857 (MT011007.1)、F.andiyaz NRRL 31727 (MN193854.1)]等標準參照菌株TEF1-α序列,以木賊鐮刀菌[F.equiseti KF1017 (JF966252.1)、F.equiseti MOS879(MN193854.1)]和禾谷鐮刀菌[F.graminearum 23-4 (MH572242.1)、F.graminearum N6-1 (MH572241.1)]為外群,采用軟件MEGA 5.05進行Clustal W比對,以鄰近相接法(neighbor-joining,NJ)構(gòu)建系統(tǒng)發(fā)育樹[13]。
1.3.4 室內(nèi)毒力測定
采用生長速率法評價惡苗病菌株對供試殺菌劑的敏感性。將所用藥劑原藥稱取0.2 g純品,加入二甲基亞砜和吐溫80,其體積分別為1 mL和10 μL進行溶解。將原藥按比例稀釋成10、1、0.1、0.01、0.001 μg/mL等濃度,將1 mL藥液與9 mL滅菌后40 ℃左右的PDA培養(yǎng)基在培養(yǎng)皿中進行充分混勻,每個濃度重復3次,以無菌水作為對照。將不同來源的病菌菌餅分別移入不同濃度的帶毒培養(yǎng)基中,25 ℃環(huán)境下培養(yǎng)96 h,并測定菌落直徑。計算出各藥劑對水稻惡苗病病菌菌絲生長抑制的回歸方程、抑制中濃度(EC50),比較供試藥劑對靶標病原菌的毒力大小,并依據(jù)EC50進行系統(tǒng)聚類分析。
1.3.5 抗藥性數(shù)據(jù)統(tǒng)計分析 抗性倍數(shù)的計算:RR=T/S。式中:RR表示測試種群的抗性倍數(shù);T表示測試種群的EC50;S表示敏感品系的EC50。
抗藥性水平的分級標準見表2。
1.3.6 不同地域菌株差異聚類數(shù)據(jù)統(tǒng)計
使用DPS 7.05軟件計算EC50,進行系統(tǒng)聚類分析,比較不同地方菌株對幾種化學藥劑的敏感性。
2 結(jié)果與分析
2.1 水稻惡苗病樣品的采集
2022年7月29日、8月3日,于水稻孕穗期、抽穗期在天津市寧河區(qū)楊泗村、東棘坨鎮(zhèn)、苗莊村;津南區(qū)的西小站、南辛房村;寶坻區(qū)的大鐘莊、小辛碼頭、王卜莊等8個不同栽培管理條件下采集水稻種植田惡苗病病株,分離獲得8個菌株,編號分別為2201、2202、2203、2204、2205、2206、2207和2208。通過田間調(diào)查發(fā)現(xiàn),發(fā)病早的植株節(jié)間明顯伸長,葉片變黃且分蘗少,有倒生根,植株甚至干枯死亡,葉鞘上有粉色或白色霉層;發(fā)病晚的,有些植株沒有明顯增高,但葉片發(fā)黃、莖稈上有褐色條斑,葉片批張度大,植株下部莖節(jié)有倒生須根(圖1)。
2.2 形態(tài)學鑒定
從發(fā)病植株上分離獲得的純化菌株,菌落正面為粉白色,背面黃色,小型分生孢子卵形或扁橢圓形,無色單孢,大小為4~5 μm(圖2、圖3)。根據(jù)菌落形態(tài)及分生孢子特征可確實其病原菌為鐮刀菌的一種。
2.3 分子鑒定及系統(tǒng)發(fā)育分析
從分離出的8株供試鐮刀菌DNA中擴增出約1 200 bp TEF1-α片段,不同菌株間擴增出的片段長度沒有明顯差異(圖4)。將PCR產(chǎn)物純化及測序,并將測序結(jié)果提交至GenBank進行BLAST比對分析得出,分離出的8株供試菌株均為藤倉鐮刀菌(F. fujikuroi)。基于以上8株供試菌株以及GenBank中8株標準參照菌株的TEF1-α序列,并以木賊鐮刀菌[F.equiseti KF1017 (JF966252.1)、F.equiseti MOS879 (MN193854.1)]和禾谷鐮刀菌[F.graminearum 23-4 (MH572242.1)、F.graminearum N6-1 (MH572241.1)]為外群,進行系統(tǒng)發(fā)育分析。8株供試鐮刀菌的TEF1-α序列與藤倉鐮刀菌[F. fujikuroi NRRL 5338(MN193860.1)、F. fujikuroi IMI 58289 (HC036627.1)]的序列聚在一起且親緣關(guān)系置信度為100%,其中菌株2201~2205、2208匯聚為一個子分支,2206和2207匯聚為一個子分支(圖5)。
2.4 水稻惡苗病病菌對9種化學藥劑的敏感性測定
水稻惡苗病病菌對9種化學藥劑的敏感性測定結(jié)果見表3。敏感性從大到小依次為苯醚甲環(huán)唑、戊唑醇、咪鮮胺、多菌靈、咯菌腈、丙硫菌唑、肟菌酯、福美雙、氰烯菌酯。但所測試的9種常用化學藥劑中,水稻惡苗病病菌對氰烯菌酯、咪鮮胺和咯菌腈的抗藥性水平表現(xiàn)較為明顯,平均抗性倍數(shù)從高到低依次為730.16、326.73、107.27,為高抗水平。對戊唑醇和丙硫菌唑的抗性倍數(shù)分別為13.26、10.37,屬于中等抗性水平;對苯醚甲環(huán)唑、多菌靈的抗性倍數(shù)低于10,為低抗性水平;肟菌酯用于防治水稻惡苗病的效果不是很好,報道很少。
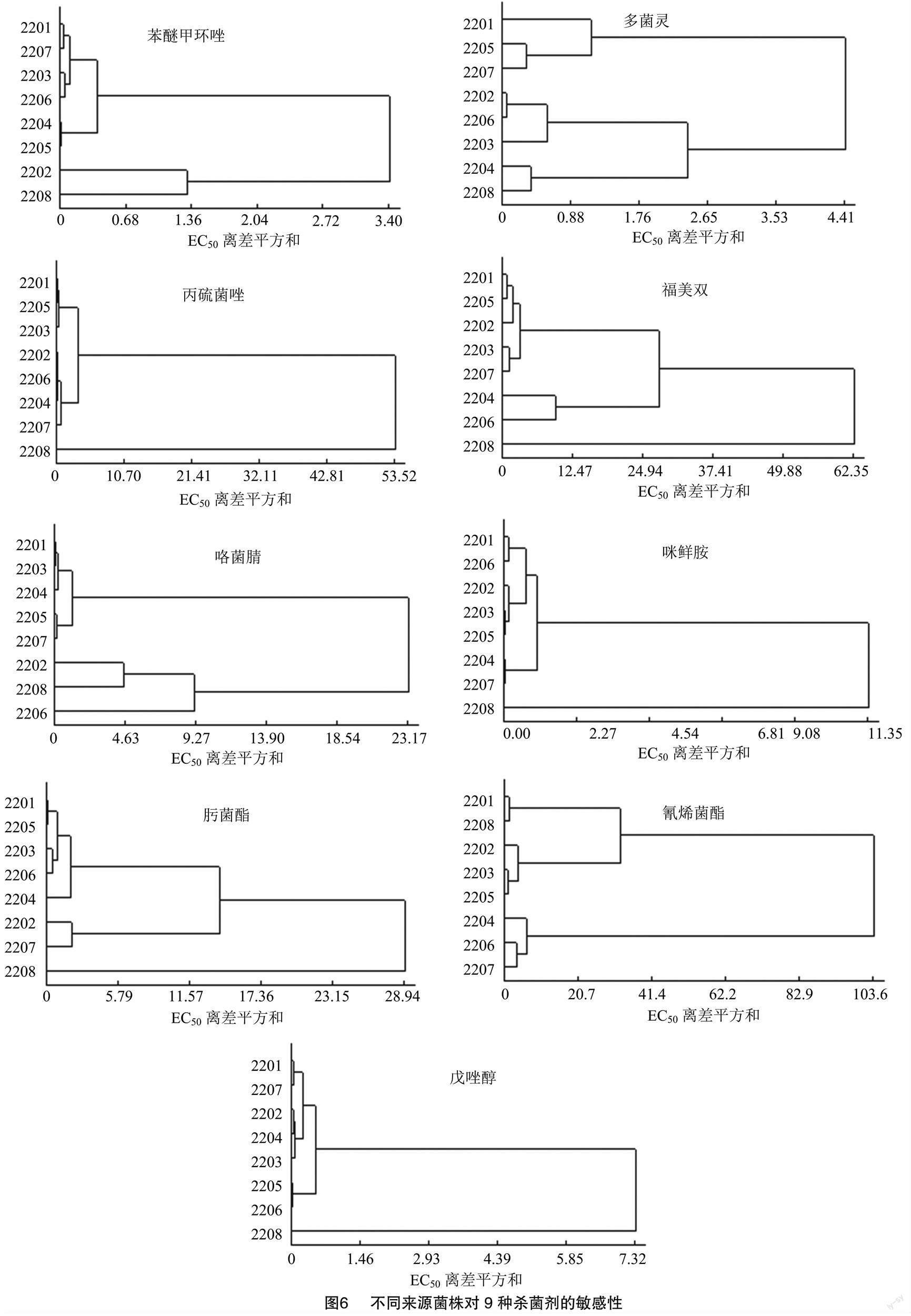
2.5 不同地理來源菌株對9種殺菌劑敏感性水平的系統(tǒng)聚類分析
由圖6可知,不同地區(qū)病原菌對苯醚甲環(huán)唑的敏感性可分為3個組別,其中2201、2207、2203、2206、2204、2205組成第1個聚類組,2202組成第2個聚類組,2208組成第3個聚類組。3個聚類組中菌株數(shù)分別占供試菌株數(shù)的75.0%、12.5%、12.5%,其中多數(shù)菌株分布在第1個聚類組中,表明不同來源的水稻惡苗病病菌對苯醚甲環(huán)唑的敏感性相似。
不同地區(qū)病原菌對丙硫菌唑的敏感性可分為2個組別,其中2201、2205、2203、2202、2206、2204、2207組成第1個聚類組,2208組成第2個聚類組,2個聚類組中菌株數(shù)分別占供試菌株數(shù)的87.5%和12.5%,其中多數(shù)菌株分布在第1個聚類組中,表明不同來源的水稻惡苗病病菌對丙硫菌唑的敏感性相似。
不同地區(qū)病原菌對多菌靈的敏感性可分為3個組別,其中2201、2205、2207組成第1個聚類組,2202、2206、2203組成第2個聚類組,2204、2208組成第3個聚類組,3個聚類組中菌株數(shù)分別占供試菌株數(shù)的37.5%、37.5%、25.0%,供試菌株在3個聚類組中分布較均勻,表明不同來源的水稻惡苗病病菌對多菌靈的敏感性差距較大。
不同地區(qū)病原菌對福美雙的敏感性可分為3個組別,其中2201、2205、2202、2203和2207組成第1個聚類組,2204、2206組成第2個聚類組,2208組成第3個聚類組。3個聚類組中菌株數(shù)分別占供試菌株數(shù)的62.5%、25.0%、12.5%,供試菌株多分布于第1個聚類組中,表明不同來源的水稻惡苗病病菌對福美雙的敏感性相似。
不同地區(qū)病原菌對咯菌腈的敏感性可分為3個組別,其中2201、2203、2204、2205、2207組成第1個聚類組,2202、2208組成第2個聚類組,2206組成第3個聚類組。3個聚類組中菌株數(shù)分別占供試菌株數(shù)的62.5%、25.0%、12.5%,供試菌株多分布于第1個聚類組中,表明不同來源的水稻惡苗病病菌對咯菌腈的敏感性相似。
不同地區(qū)病原菌對咪鮮胺的敏感性可分為2個組別,其中2201、2206、2202、2203、2205、2204、2207組成第1個聚類組,2208組成第2個聚類組,2個聚類組中菌株數(shù)分別占供試菌株數(shù)的87.5%、12.5%,供試菌株較集中分布于第1個聚類組中,表明不同來源的水稻惡苗病病菌對咪鮮胺的敏感性相似。
不同地區(qū)病原菌對氰烯菌酯的敏感性可分為3個組別,其中2201、2208組成第1個聚類組,2202、2203、2205組成第2個聚類組,2204、2206、2207組成第3個聚類組,3個聚類組中菌株數(shù)分別占供試菌株數(shù)的25.0%、37.5%、37.5%供試菌株在3個聚類組中均有相當數(shù)量分布,表明不同來源的水稻惡苗病病菌對氰烯菌酯的敏感性差距較大。
不同地區(qū)病原菌對肟菌酯的敏感性可分為3個組別,其中2201、2205、2203、2206、2204組成第1個聚類組,2202、2207組成第2個聚類組,2208組成第3個聚類組,3個聚類組中菌株數(shù)分別占供試菌株數(shù)的62.5%、25.0%、12.5%,供試菌株主要集中在第1個聚類組中,表明不同來源的水稻惡苗病病菌對肟菌酯的敏感性相似。
不同地區(qū)病原菌對戊唑醇的敏感性可分為2個組別,其中2201、2207、2202、2204、2203、2005、2006組成第1個聚類組,2208組成第2個聚類組,2個聚類組中菌株數(shù)分別占供試菌株數(shù)的87.5%、12.5%,供試菌株主要集中在第1個聚類組中,表明不同來源的水稻惡苗病病菌對戊唑醇的敏感性相似。
3 結(jié)論與討論
水稻惡苗病能夠?qū)е轮仓晖介L、死亡,產(chǎn)量和品質(zhì)降低,因此該病害一直是水稻生產(chǎn)上重點關(guān)注的對象[14-15]。調(diào)查發(fā)現(xiàn),發(fā)病早的植株節(jié)間明顯伸長,葉片變黃,下部莖節(jié)逆生不定須根,分蘗少或不分蘗,植株干枯死亡,葉鞘上有粉色或白色霉層;發(fā)病晚的,有些植株沒有明顯增高,但葉片發(fā)黃、莖稈上有褐色條斑,葉片批張度大,植株下部莖節(jié)有倒生須根。有的植株雖然看上去生長正常,沒有表現(xiàn)癥狀,但下部莖節(jié)有倒生須根,已有菌絲潛伏,該水稻植株收獲的種子也攜帶了病原菌,發(fā)病植株攜帶的孢子進行傳播引起再侵染,往往谷粒無明顯發(fā)病癥狀,但種子內(nèi)部已攜帶病原菌,這與人們所認知的田間癥狀差異較大。
水稻惡苗病作為一種重要的水稻種傳病害,對于其致病菌國內(nèi)外學者進行了大量研究,認為水稻惡苗病病原菌為藤倉赤霉復合種內(nèi)的3種鐮刀菌,分別為藤倉鐮刀菌、層出鐮刀菌、擬輪枝鐮刀菌,其中藤倉鐮刀菌為致病的優(yōu)勢種群[16-18],本研究結(jié)果與之一致。目前對于病原菌進行鑒定往往需要十分準確的方法,傳統(tǒng)的形態(tài)學方法存在很大的不確定性,容易造成誤判,因此只能作為鑒定的初步參考[11]。而借助于分子鑒定和系統(tǒng)發(fā)育樹的鑒定方式已廣泛應(yīng)用于植物病原菌,目前對于鐮刀菌屬的鑒定使用最多的是基于TEF1-α序列特征的分子鑒定及系統(tǒng)發(fā)育分析[19]。本研究借助于 TEF1-α 序列分析,結(jié)合形態(tài)學與生物學特征將8種不同地區(qū)采集的水稻惡苗病病原菌進行的精確鑒定,并且通過構(gòu)建系統(tǒng)發(fā)育樹將其分為2個不同分支,8株供試菌株均為藤倉鐮刀菌(F. fujikuroi)。
針對近年來水稻生產(chǎn)上出現(xiàn)的抗藥性問題,特別是水稻惡苗病病菌產(chǎn)生的抗藥性,合理選擇藥劑和定期更換藥劑是科學防治的關(guān)鍵[20-21]。 近幾年,生產(chǎn)上多數(shù)采用氰烯菌酯、咯菌腈、咪鮮胺等藥劑進行水稻種子處理[22-23],其在使用初期防效較好因此受到了大面積推廣,但隨著長時間不斷地單一用藥,有研究結(jié)果對此發(fā)出了預警,提示水稻惡苗病對氰烯菌酯和咯菌腈存在一定的抗性風險,在水稻生產(chǎn)中應(yīng)當給予足夠的重視[10]。肟菌酯作為一種甲氧基丙烯酸酯類殺菌劑,其在生產(chǎn)上應(yīng)用較少,因此其抗性倍數(shù)尚不明確。本研究結(jié)果表明,天津地區(qū)水稻惡苗病病菌對以上3種藥劑產(chǎn)生了嚴重的抗藥性,3種化學藥劑的抗性倍數(shù)分別為730.16、107.27、326.73,其中對氰烯菌酯的抗藥性最高,致使種子上存在的水稻惡苗病病菌沒有被有效控制;又由于2022年天津地區(qū)的特殊氣候條件,移栽后遇上連續(xù)高溫,同時農(nóng)戶于水稻分蘗期進行烤田(當土溫在30~35 ℃,利于該病發(fā)生),致使該病嚴重發(fā)生并進行多次侵染循環(huán)。另外,通過不同地區(qū)供試菌株對化學藥劑的敏感性分析,9種藥劑苯醚甲環(huán)唑、丙硫菌唑、多菌靈、福美雙、咯菌腈、咪鮮胺、氰烯菌酯、肟菌酯、戊唑醇對水稻惡苗病病菌菌株的EC50由低到高分別可分成3、2、3、3、3、2、3、3、2個聚類組,水稻惡苗病病菌對多菌靈、氰烯菌酯的敏感性地區(qū)性差異較大,而對其他試驗藥劑的敏感性地區(qū)性差異較小。此種差異的存在可能是由于不同水稻品種自身原因產(chǎn)生的,也可能與不同的水稻田間管理、氣候條件與施藥方式有關(guān),另外在水稻生產(chǎn)上育種家沒有針對惡苗病進行品種篩選,因此造成該病在天津地區(qū)大面積發(fā)生。
針對天津地區(qū)水稻惡苗病發(fā)病特點及對幾種化學藥劑的敏感性分析提出以下幾點建議:(1)選用優(yōu)良抗病品種,避免使用易感病品種。(2)對田間發(fā)現(xiàn)的發(fā)病植株及時進行清理。(3)播種前進行種子帶菌率檢測及每年進行病原菌抗藥性監(jiān)測,進行預測預報。(4)化學藥劑使用方面,近1~2年內(nèi)停止使用氰烯菌酯、咪鮮胺、咯菌腈,建議使用戊唑醇、苯醚甲環(huán)唑、丙硫菌唑、多菌靈、福美雙等化學藥劑,交替、輪換使用,避免連續(xù)、單一用藥,或者用四霉素、乙蒜素這類植物殺菌劑,進行種子處理或藥劑噴施,注意輪換使用,以降低水稻惡苗病對水稻生產(chǎn)造成的損失。
參考文獻:
[1]張春云,盧 毅,張 橋,等. 不同藥劑·方法和時間浸種對水稻惡苗病的防治效果[J]. 安徽農(nóng)業(yè)科學,2014,42(9):2590-2592.
[2]季芝娟,曾宇翔,梁 燕,等. 水稻惡苗病抗性研究進展[J]. 中國水稻科學,2021,35(1):1-10.
[3]何富剛,顏范悅,辛萬民,等. 水稻惡苗病菌抗藥性的產(chǎn)生及防除[J]. 遼寧農(nóng)業(yè)科學,1994(3):12-14.
[4]陳夕軍,盧國新,童蘊慧,等. 水稻惡苗病菌對三種浸種劑的抗性及抗藥菌株的競爭力[J]. 植物保護學報,2007,34(4):425-430.
[5]許 媛,肖 婷,褚姝頻,等. 江蘇省句容市葡萄炭疽病菌多樣性及對苯并咪唑類殺菌劑的抗藥性分析[J]. 南京農(nóng)業(yè)大學學報,2022,45(1):78-85.
[6]劉永鋒,陳志誼,周保華,等. 江蘇省部分稻區(qū)惡苗病菌對水稻浸種劑的抗藥性檢測[J]. 江蘇農(nóng)業(yè)學報,2002,18(3):190-192.
[7]周華飛,楊紅福,陳宏州,等. 江蘇鎮(zhèn)江地區(qū)水稻惡苗病菌分離鑒定與對咪鮮胺的抗性分析[J]. 西南農(nóng)業(yè)學報,2019,32(2):337-341.
[8]陳尤嘉. 氰烯菌酯浸種對水稻惡苗病的防效及安全性調(diào)查[J]. 中國植保導刊,2014,34(7):79-81.
[9]徐 瑤. 水稻惡苗病菌對咪鮮胺敏感性分析與藥劑防治研究[D]. 大慶:黑龍江八一農(nóng)墾大學,2015.
[10]Hou Y P,Qu X P,Mao X W,et al. Resistance mechanism of Fusarium fujikuroi to phenamacril in the field[J]. Pest Management Science,2018,74(3):607-616.
[11]陳宏州,楊紅福,姚克兵,等. 水稻惡苗病病原菌鑒定及室內(nèi)藥劑毒力測定[J]. 植物保護學報,2018,45(6):1356-1366.
[12]張廣志,張新建,陳 泉,等. 哈茨木霉復合種內(nèi)3個中國新記錄種的分離和鑒定[J]. 山東科學,2015,28(6):43-46,51.
[13]Kumar S,Stecher G,Li M,et al. MEGA X:molecular evolutionary genetics analysis across computing platforms[J]. Molecular Biology and Evolution,2018,35(6):1547-1549.
[14]Singh R,Kumar P,Laha G S. Present status of bakanae of rice caused by Fusarium fujikuroi Nirenberg[J]. Indian Phytopathology,2019,72(4):587-597.
[15]Hossain K S,Mia M,Bashar M A. Management of bakanae disease of rice[J]. Bangladesh Journal of Botany,2018,44(2):277-283.
[16]Wulff E G,Srensen J L,Lübeck M,et al. Fusarium spp. associated with rice bakanae:ecology,genetic diversity,pathogenicity and toxigenicity[J]. Environmental Microbiology,2010,12(3):649-657.
[17]Singh R,Sunder S,Kumar P,et al. Study of bakanae disease of rice in Haryana[J]. Plant Disease Research,2018,33(1):15-22.
[18]李風順,喬俊卿,張榮勝,等. 防治水稻惡苗病拮抗細菌的篩選、鑒定和評價[J]. 江蘇農(nóng)業(yè)學報,2022,38(4):907-914.
[19]陳子豪. 藤倉鐮孢菌對多菌靈抗藥性分子機制及檢測方法研究[D]. 南京:南京農(nóng)業(yè)大學,2014:17-32.
[20]陳宏州,楊紅福,饒鳴帥,等. 水稻惡苗病防治藥劑效果評價[J]. 中國農(nóng)學通報,2018,34(33):140-146. [HJ2mm]
[21]Choi H W,Lee Y H,Hong S K et al. Monitoring for the resistance to prochloraz of Fusarium species causing bakanae disease in Korea[J]. The Korean Journal of Mycology,2015,43(2):112-117.
[22]劉禹含,鄒佳營,何 博,等. 吉林省水稻惡苗病菌對咯菌腈的敏感性及抗藥性風險評估[J/OL]. 吉林農(nóng)業(yè)大學學報,(2020-09-16)[2023-01-03]. DOI:10.13327/j.jjlau.2020.5228.
[23]徐 瑤,李 鵬,劉洪亮,等. 水稻惡苗病菌對咪鮮胺的敏感性及生物學特性的研究[J]. 黑龍江八一農(nóng)墾大學學報,2016,28(3):12-16,55.

