早期宮頸癌患者C-E-CKC術后復發及妊娠結局的分析
王 娜 程心一 王絲雨
目前,宮頸癌成為影響女性的第二大腫瘤,宮頸癌是僅次于乳腺癌,結腸直腸癌和肺癌的世界第四大死亡原因[1]。現代宮頸癌治療的標準外科手術方法是Wertheim-Meigs方法[2],但僅限于少數早期病例,但針對晚期病例,還是基于放射治療,同時還會導致生殖功能的喪失[3]。 由于近年來子宮頸癌篩查項目的普及,許多患者已經進行了子宮頸癌的早期檢測和診斷,并且子宮頸癌患者的發病年齡也逐漸年輕化[4]。因此,關于保留生育力的研究是婦科醫學研究的一個新課題。ART、RVT和CKC是現在臨床應用最多的幾種術式[5]。但是,ART術式、RVT術式和CKC術式與邊緣細胞的電凝性損害相關,從而影響病理診斷結果。后者可確保邊緣細胞的完整性,但手術過程中的失血量很高,并會影響妊娠結局。冷刀-電刀-冷刀子宮頸錐切(C-E-CKC)手術是在錐體底部用冷刀進行的,然后用電刀將錐體部切除。這不僅保證了邊緣細胞的完整性,而且具有局部電凝和止血的作用[5]。目前,關于C-E-CKC手術對患者術后復發和妊娠結局的影響的報道很少。本研究觀察了C-E-CKC術,ART術和RVT術三種不同術式對術后復發和妊娠結局的影響,為臨床治療方案的選擇提供參考。
1 資料與方法
1.1 基本資料
我院婦產科于2015年1月至2018年1月期間收治60例子宮頸上皮內瘤變患者,根據患者意愿分為C-E-CKC 組(21 例)、ART組(19例)、RVT組(20例)。所有入選患者均接受了人乳頭瘤病毒(HPV),陰道鏡檢查和宮頸液基細胞學檢查,最后取病理活檢確診。比較C-E-CKC組、ART組和RVT組患者一般臨床資料,如年齡[(31.45±4.12)歲 vs.(31.56±4.28)歲vs.(32.01±4.35)歲]、術前高危型 HPV 感染率(81.32% vs.76.41% vs.76.41%)、平均孕次[(2.13±1.02)次 vs.(2.34±1.20)次 vs.(2.57±1.41)次]、平均產次[(0.78±0.67)次 vs.(0.81±0.64)次vs.(0.91±0.44)次]、平均住院時間[(8.04±2.14)d vs.(7.95±2.09)d vs.(8.11±2.31)d]等,差異無統計學意義(P>0.05),具有可比性。本研究獲得我院倫理委員會批準。納入標準:①符合《婦產科學》中有關宮頸癌的診斷標準[6],并經病理檢查證實;②臨床分期為Ⅱa期及以上;③年齡30~70歲;④治療前未接受過放射治療、化學治療或手術治療;⑤自愿簽署知情同意。排除標準:①臨床數據不完整;②隨訪不到一年;③術前病理非我院病理診斷;④診斷錐切后行子宮切除術;⑤有生殖器腫瘤和免疫系統疾病的患者;⑥有既往不孕癥或宮頸功能障礙和先天性子宮異常的患者。
1.2 治療方法
1.2.1 RVT與ART組手術方法 RVT主要包括腹腔鏡下腹膜后淋巴結清掃術+經陰道廣泛宮頸切除術,后者包括確定宮頸部上邊緣和去除宮頸旁組織等;ART與根治性子宮切除術相似,后者需要在切除宮頸的同時清掃腹膜后的淋巴結,再將陰道與剩余的子宮吻合;宮頸錐切術是用切刀由外向內以錐形切出一部分宮頸組織。 再將宮頸和陰道吻合[7]。
1.2.2 C-E-CKC 手術方法 常規消毒后,患者置于膀胱截石位以暴露子宮頸。 通過將子宮頸噴灑復雜的碘溶液來確定病變部位。 切除區域在子宮頸的無色碘區域外5 mm處。 為了確保切緣組織細胞的完整性,下一步是切換至冷刀-電刀行椎體切除。 在冷刀切割過程中,出血處被逐點局部電凝,以停止體內宮頸組織的出血。不影響通過錐切術獲得的宮頸組織的病理檢查。
到達圓錐形尖端時,繼續冷刀切除以確保圓錐形尖端處的組織細胞完好無損,不超過子宮頸的水平。除定期對切除的錐體組織進行病理學檢查外,在宮頸組織的3、6、9、12點和頸錐體的頂端進行活檢送病理檢查,以評估其是否出現累及等。可吸收縫合線縫合子宮頸以止血并恢復子宮頸的解剖結構。在沒有發現明顯的活動性出血后,患者在壓迫后48 h接受陰道填塞紗布,然后接受抗炎藥對癥治療5天。
1.3 隨訪
所有患者術后24個月內每3個月于門診進行隨訪,隨訪內容如下:主要是臨床問診和婦科檢查。每年進行定期門診隨訪。 隨訪內容包括液基細胞學檢查、HPV病毒、腫瘤標志物檢測和必要的影像學檢查[8]。在患者滿意度的隨訪期間,要注意患者的心理健康。 計劃妊娠和妊娠計劃過程中,需要更嚴格的隨訪來檢測子宮頸癌,并注意其產科護理。
1.4 統計學處理
所有數據應用SPSS 21.0統計軟件分析。連續型變量,采用t檢驗或方差分析;離散型變量,采用χ2檢驗。
2 結果
2.1 三組手術時間、出血量、椎體長度比較
三種術式中,C-E-CKC組手術時間、出血量、椎體長度明顯小于ART和RVT組,差異具有統計學意義(P<0.05)。ART與RVT組在手術時間、出血量、椎體長度等方面的差異,無統計意義(P>0.05),見表1。
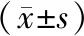
表1 三組手術時間、出血量、椎體長度比較
2.2 三組療效比較
3種術式的腫瘤復發率、病死率及2年生存率比較,無統計學意義(P>0.05),且患者滿意度都大于90%,組間差異無統計學意義(P>0.05),見表2。

表2 三組療效比較(例,%)
2.3 妊娠結局
C-E-CKC組患者妊娠人數顯著多于其他兩種術式(P<0.05),3種術式的足月妊娠次數,差異有統計學意義(P<0.05),行C-E-CKC術患者的足月妊娠率最高(85.7%),患者滿意率最高(85.7%),見表3。

表3 不同分組的妊娠結局比較(例,%)
2.4 術后病變情況比較
三組在術后的病變累腺情況、切緣陽性、病變殘留發生率差異無統計學意義(P>0.05),見表4。

表4 術后病變情況比較(例,%)
2.5 不良妊娠結果
C-E-CKC組患者不良妊娠率(9.5%)顯著低于其他兩種術式(P=0.008),其中RVT組的早期流產率最高(27.3%),ART組次之(25.0%),C-E-CKC組無早期流產,差異有統計學意義(P=0.041),見表5。

表5 不同組別不良妊娠結果比較(次,%)
3 討論
據WHO統計,全球每年宮頸癌新發病例約50萬,當年宮頸癌患者病死率高達60%[9]。隨著各國對女性生殖健康的關注,宮頸癌的發病率有所降低,但近年來逐漸出現低齡化趨勢,嚴重影響低齡化婦女的生殖健康。宮頸癌癌前病變是宮頸癌的早期階段[10]。宮頸癌癌前病變的干預和治療可以預防病變進一步發展并減少子宮頸癌。
經腹廣泛宮頸切除術(ART)、經陰道廣泛宮頸切除術(RVT)及宮頸冷刀錐切術(CKC)是最常見的治療宮頸癌前病變的手術方式,可以保證切緣細胞完整,以便更好的做出組織的病理診斷,在診斷浸潤癌方面有著不可替代的地位[11]。
但是,上述方法在手術過程中會有大量的出血,對子宮頸周圍的組織造成很大的損害,并且過多的切除組織會影響懷孕的結果。C-E-CKC不僅有CKC術切緣的完整性的優點,而且還可以保證病灶切除的完整性,減少術中出血量,減少對妊娠結局的影響并改善患者的預后結局,已達到更加合理的治療選擇[12]。
本研究使用C-E-CKC術治療癌前宮頸病變,結果顯示,C-E-CKC組的手術時間比其它組短,術中出血量也少于其他兩組(P<0.05)。可能是因為C-E-CKC術使用冷刀去除宮頸組織,并且局部點對點電凝可阻止人體宮頸組織內的出血,從而減少術中失血。并確保了更平滑,更清晰的手術視野,可以快速完成操作。 本研究結果顯示,行C-E-CKC術患者足月妊娠率(85.7%)高于ART組(33.3%)和RVT組(45.5%),患者滿意率(85.7%)也高于ART組(50.0%)和RVT組(45.5%),差異均有統計學意義(P<0.05)。本研究中,C-E-CKC術患者懷孕無早期流產,顯著低于其他兩種術式(P<0.05)。可能是因為C-E-CKC術對患者子宮頸的危害較小,可以幫助防止因宮頸松弛而引起的早期流產[13]。
本研究表明,三種手術方式在腫瘤復發率方面差異無統計學意義(P> 0.05),而三種手術方式治療的患者的妊娠率和足月妊娠率上的差異均有統計學意義(P<0.05)。足月妊娠率中,ART
綜上所述,在早期宮頸癌患者中使用C-E-CKC術可以有效降低復發率,降低早期流產率,提高患者滿意度。 此外,與傳統的頸椎切除術不同,C-E-CKC術不會增加切除邊緣的陽性率,病變累腺率和病變殘留率。

