miR-129-5p對非小細胞肺癌細胞增殖、侵襲的影響及其作用機制研究
孫永梅 焦 鵬
肺癌是常見惡性腫瘤之一,在所有腫瘤中致死率位居第一。非小細胞癌細胞與小細胞癌相比生長分裂慢,擴散相對較晚[1]。雖然臨床已采用手術、放化療等綜合治療手段,但治療效果并不理想。靶向治療近來在腫瘤治療中發揮重要作用[2]。有研究表明miR-129-5p異常表達與多種腫瘤細胞增殖密切相關[3-4]。但miR-129-5p在非小細胞肺癌中的生物學功能研究較少。本研究通過探討miR-129-5p對非小細胞肺癌細胞增殖、侵襲的影響及其可能的作用機制,分析其在非小細胞肺癌疾病進展中作用,為臨床靶向治療非小細胞癌提供新的理論依據。
1 材料與方法
1.1 材料
非小細胞肺癌細胞株A549、NCI-H157、GLC-82(中國醫學科學院細胞庫);Trizol提取試劑盒(賽默飛世爾科技中國有限公司);BCA蛋白試劑盒、Lipofectamin 2000試劑盒(瑞士Roche公司);RPMI 146、DMEM培養基(南通市百奧邁科生物公司);MTT實驗相關試劑(美國Promega公司);Transwell實驗相關試劑購(美國BioLEgend公司);兔源一抗(β-catemin、Cy-clin D1,MMP-2、MMP-9、JAK、p-STAT3、STAT3、c-myc、GAPDH)、辣根過氧化物酶標記的山羊抗兔二抗(美國Cell Signal Technology公司)。
1.2 研究方法
1.2.1 細胞培養及瞬時轉染 肺癌細胞株A549、NCI-H157、GLC-82均培養于含10%胎牛血清的RPMI 146培養基中,培養條件為37 ℃、5% CO2濃度。將第3代A549細胞以4×105/孔接種到12孔細胞培養板上培養,實驗當天取細胞培養箱于顯微鏡下觀察細胞密度,細胞80%融合更換不含胎牛血清的新鮮RPMI 146培養基即可進行轉染。將Lipofectamin 2000轉染試劑稀釋輕輕混勻,室溫孵育5 min記為混合物1。另將miR-129-5p mimics、miR-129-5p NC分別稀釋于500 μL無血清培養基中調整終濃度為20 μmol/l,室溫孵育5 min,記為混合物B。將A和B輕輕混勻,室溫孵育20 min,分別加入相應培養孔,另設不添加轉染試劑作為對照組。6 h后棄去培養基,更換含10%胎牛血清的RPMI 146培養基。48h后收集細胞供后續試驗。
1.2.2 熒光實時定量PCR(quantitative real time polymerase chain reaction,qRT-PCR)法檢測 收集各組已處理細胞,參照Trizol說明書提取總RNA,進行qRT-PCR操作。miR-129-5p和內參U6引物由生工生物工程(上海)股份有限公司合成,序列詳見表1。2-ΔΔCt算法計算miR-129-5p相對表達量。

表1 qRT-PCR引物序列
1.2.3 蛋白質印記(Westernblot)法檢測 將蛋白裂解buffer(含protease inhibitor Cocktail)加入1.2.1中各組細胞提取總蛋白。BCA蛋白試劑盒測定細胞中總蛋白含量,以GAPDH為內參,采用Western blot檢測各組細胞中增殖相關蛋白β-catemin、Cyclin D1,侵襲相關蛋白MMP-2、MMP-9及STAT3通路相關蛋白JAK、p-STAT3、STAT3、c-myc、GAPDH蛋白水平進行檢測,Tanon 600圖像分析系統拍照并進行定量分析。做3次重復,取平均值。
1.2.4 MTT試驗 將1.2.1中各組細胞接種96孔板,在0、24、48、72、96 h時間點每孔加入10 μl濃度為1.5 mg/ml的MTT,培養 4 h后各孔內加入150 μl DMSO,讀取各孔吸光度值(A),繪制細胞生長曲線,以未接種細胞只加培養基孔的A值為空白對照調零。
1.2.5 平板克隆試驗 收集對數期細胞接種在12孔板中,細胞密度調整為1×104個/ml,37 ℃、5%CO2培養10 d,PBS溶液清洗后采用4%甲醛固定菌落30 min,1%結晶紫溶液染色20 min,水洗干燥后拍照統計算細胞克隆數量。
1.2.6 細胞侵襲試驗 收集各組細胞,取100 μl的Matrigel膠平鋪于上層小室。上室每孔加入細胞懸液100 μl(細胞數約為1×105,無血清培養基稀釋),下室加入500 μl含10% FBS的完全培養基。37 ℃孵育24 h。取出小室,用PBS沖洗兩遍,用棉簽除去濾膜上室面的細胞和Matrigel膠,1% 多聚甲醛固定下室面細胞后加入Giemsa染色30min。用倒置顯微鏡隨機選取5個視野計算穿膜細胞數,并拍照。實驗重復3次,取平均值表示細胞的侵襲能力。
1.3 統計學方法
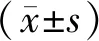
2 結果
2.1 非小細胞癌細胞系中miR-129-5p相對表達量
BEAS-2B、A549、NCI-H157、GLC-82細胞株中,miR-129-5p相對表達量分別為(1.01±0.21)(0.17±0.04)、(0.72±0.18)、(0.68±0.16),后三者均顯著低于正常細胞株BEAS-2B中miR-129-5p相對表達量(P<0.05),其中A549細胞株中miR-129-5p表達量下降最顯著。后續試驗選取A549細胞株。見圖1。

圖1 非小細胞肺癌細胞株miR-129-5p相對表達量
2.2 轉染效率檢測
倒置熒光顯微鏡下觀察miR-429 NC組、miR-429 mimics組細胞轉染效率均達90%以上,與空白組相比,miR-129-5p NC組miR-129-5p相對表達量差異不顯著(P>0.05),miR-129-5p mimics組miR-129-5p相對表達量升高(P<0.05);與miR-129-5p NC組相比,miR-129-5p mimics組miR-129-5p相對表達量升高(P<0.05),見表2。
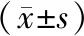
表2 三組miR-129-5p相對表達量
2.3 miR-129-5p過表達對非小細胞肺癌細胞增殖的影響
MTT試驗顯示,miR-129-5p NC組各時間點細胞OD值與空白組相比差異無統計學意義(P>0.05),miR-129-5p mimics組48 h 開始細胞OD值顯著低于空白組(P<0.05)及miR-129-5p NC組(P<0.05),見圖2。

注:a為與空白組相比,P<0.05;b為miR-129-5p NC組比較,P<0.05。
2.4 平板克隆法檢測miR-129-5p過表達對增殖能力的影響
與空白組相比,miR-129-5p NC組細胞形成數差異無統計學意義(P>0.05),miR-129-5p mimics組細胞形成數顯著降低(P<0.05);與miR-129-5p NC組相比,miR-129-5p mimics組細胞形成數顯著降低(P<0.05)。
2.5 miR-129-5p過表達對非小細胞肺癌細胞侵襲能力的影響
Transwell試驗顯示,miR-129-5p NC組侵襲細胞數與空白組相比差異無統計學意義(P>0.05),miR-129-5p mimics組侵襲細胞數與空白組相比顯著降低(P<0.05);與miR-129-5p NC組相比,miR-129-5p mimics組侵襲細胞數顯著降低(P<0.05),見圖3、表3。
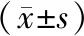
表3 Transwell實驗檢測miR-129-5p過表達對A549細胞侵襲能力的影響
2.6 miR-129-5p過表達對非小細胞肺癌細胞增殖、侵襲相關蛋白表達的影響
Western blot檢測顯示,與空白組相比,miR-129-5p NC組增殖相關蛋白β-catemin、Cyclin D1、侵襲相關蛋白MMP-2、MMP-9蛋白表達差異無統計學意義(P>0.05),miR-129-5p mimics組β-catemin、Cyclin D1、MMP-2、MMP-9蛋白表達顯著降低(P<0.05);與miR-129-5p NC組相比,miR-129-5p mimics組β-catemin、Cyclin D1、MMP-2、MMP-9蛋白表達顯著降低(P<0.05),見圖4、表4。
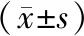
表4 miR-129-5p過表達對非小細胞肺癌細胞侵襲相關蛋白表達的影響
2.7 miR-129-5p過表達對STAT3通路相關蛋白表達的影響
Western blot檢測結果顯示,與空白組相比,miR-129-5p NC組JAK激酶、p-STAT3、STAT3、c-myc蛋白表達差異不顯著(P>0.05),miR-129-5p mimics組JAK激酶表達水平、STAT3磷酸化水平、c-myc表達水平降低(P<0.05);與miR-129-5p NC組相比,miR-129-5p mimics組JAK激酶表達水平、STAT3磷酸化水平、c-myc表達水平降低(P<0.05),見表5、圖5。

注:a為空白組,b為miR-129-5p NC組,c為miR-129-5p mimics組。

注:a為空白組,b為miR-129-5p NC組,c為miR-129-5p mimics組。
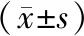
表5 Western blot檢測STAT3通路蛋白表達情況

注:a為空白組;b為miR-129-5p NC組;c為miR-129-5p mimics組。
3 討論
非小細胞癌是肺癌的一種,包括鱗狀細胞癌、腺癌、大細胞癌,約占所有肺癌的80%,因為缺乏對非小細胞肺癌早期有效診斷指標,約75%患者發現時已處于中晚期,5年內生存率很低[5-7]。因此尋求非小細胞癌的靶點具有重大意義。近年來,miRNA在惡性腫瘤發生發展中的重要作用受到廣泛關注[8]。有臨床研究表明,miR-129-5p在非小細胞癌中過表達,其表達水平與肺癌分期、淋巴結轉移情況和預后有關[9-10]。因此本研究通過轉染過表達miR-129-5p,研究miR-129-5p對非小細胞肺癌細胞增殖、侵襲能力的影響及其可能的作用機制。
Zhang等[11]研究發現miRNA-129-5p在非小細胞肺癌組織中表達水平顯著低于其對應正常黏膜組織,上調miR-129-5p表達后,癌細胞增殖速率降低,且c-myc及clyclinD1蛋白的表達明顯下降,猜測miR-129-5p上調可以有效地抑制非小細胞肺癌細胞的生長,并誘導其凋亡。You等[12]研究表明,亞油酸苯胺羥肟酸可通過上調miR-129-5p誘導硫氧還蛋白1介導肺癌細胞凋亡。Shen等[13]也表明,miRNA-129-5p在喉癌組織中低表達。Xu等[14]經研究顯示miRNA-129-5p在膠質母細胞瘤的組織和細胞系中呈下調狀態。本研究中選取正常細胞株BEAS-2B和三株非小細胞肺癌細胞A549、NCI-H157、GLC-82作為研究對象,經qRT-PCR法檢測,A549、NCI-H157、GLC-82細胞株miRNA-129-5p表達均低于BEAS-2B,推測miRNA-129-5p可能參與非小細胞肺癌的發生發展進程,其中A549細胞株miRNA-129-5p相對表達量最低,因此后續試驗均選用A549細胞株。A549細胞株轉染miR-129-5p mimics使之過表達后,miR-129-5p表達水平顯著高于空白組與miR-129-5p NC組,表明轉染效率較高。MTT和平板克隆試驗顯示,轉染后miR-129-5p mimics組48 h后OD值、克隆形成數顯著低于空白組,提示miR-129-5p過表達參與非小細胞肺癌增殖過程,增殖相關蛋白β-catemin、Cyclin D1表達也顯著降低,提示miR-129-5p過表達可抑制非小細胞肺癌細胞的增殖。腫瘤細胞具有高度的侵襲能力,可侵入鄰近區域,并通過降解細胞外基質成分轉移至遠處器官,MMP-2和MMP-9在腫瘤細胞的局部侵襲轉移中起重要作用。本研究顯示,miR-129-5p過表達顯著降低細胞侵襲能力,進一步研究顯示,miR-129-5p過表達后侵襲相關蛋白MMP-2、MMP-9蛋白表達顯著降低,推測miR-129-5p可能參與非小細胞肺癌癌細胞侵襲過程。
STAT3通路是近年來發現的一條參與細胞增殖、分化、凋亡等過程的信號通路[15]。STAT3是STAT家族的一員,大量研究表明STAT3在多種癌癥中被持續激活,其除受細胞因子、G蛋白偶聯受體、鈣黏著蛋白結合、Toll樣受體調節外,還受到miRNA的調節,在癌癥發生發展中具有至關重要的地位[16-18]。有學者[19]研究發現,miR-1181可能通過靶向STAT3參與胰腺癌細胞的侵襲和增殖。Shen等[13]研究表明,miR-129-5p對喉癌細胞具有抑制細胞增殖、遷移和侵襲,促進細胞凋亡作用,且miR-129-5p的抗腫瘤作用是通過調控STAT3信號通路下游靶基因c-myc實現,據此猜測,miR-129-5p對STAT3信號通路可能通過類似調控發揮作用。本研究顯示,miR-129-5p過表達使STAT3信號通路JAK激酶水平、STAT3磷酸化程度降低,致使c-myc表達水平下降。可能由于miR-129-5p過表達抑制JAK激酶表達,進而抑制STAT3蛋白轉錄,最終下調靶基因c-myc的表達水平,進而抑制腫瘤的增殖、侵襲過程。
綜上所述,本研究上調miR-129-5p可抑制非小細胞肺癌增殖、侵襲過程,可能通過抑制STAT3信號通路激活實現,有望成為非小細胞肺癌治療的靶點。

