五味子素通過調控FOXC1基因對結直腸癌細胞惡性生物學行為的作用機制
許亞坡 羅金鍵 夏 超 吳慧麗
全球范圍內結直腸癌(colorectal cancer,CRC)每年新發病例數約180萬,死亡人數約88萬[1],而近年我國CRC患病率及死亡率呈上升趨勢,患病率居惡性腫瘤第三位,死亡率居第五位[2],嚴重威脅國民生命健康。手術是治療早期CRC的有效手段,但進展、轉移等階段的CRC患者,生存情況不容樂觀,分子靶向機制是現階段臨床研究重點[3],故而探尋有效的基因治療靶點藥物對患者生存有積極意義。五味子素來源于五味子中分離的木脂素類活性成分,具有抗炎、神經保護、調節細胞代謝等多種藥理作用[4],近年研究表明其在腫瘤抑制方面顯示出確切效果[5]。另有研究發現,叉頭框轉錄因子C1(Forkhead boxC1,FOXC1)作為插頭框轉錄因子家族重要一員,與癌細胞分化、發育等過程密切相關,上調其水平可促進CRC癌細胞增殖[6]。但目前關于五味子素對CRC細胞增殖、侵襲及調控FOXC1基因的機制尚未明確,本研究以CRC HCT116細胞為研究對象,探討五味子素對HCT116細胞的影響,并進一步分析其作用機制,為臨床CRC治療提供參考依據。報告如下。
1 材料與方法
1.1 材料
1.1.1 細胞系 人CRC HCT116細胞,購自上海匹拓生物科技有限公司。
1.1.2 試劑與儀器 RPMI-1640培養基購自上海微科生物技術有限公司,Opti-MEM培養基購自賽默飛世爾科技(中國)有限公司;細胞計數試劑盒-8(CCK-8)購自上海澤葉生物科技有限公司,LipofectamineTM 2000試劑盒及Trizol溶液來自北京索萊寶科技有限公司,Transwell chamber購自廣州賽哲科技有限公司;五味子素、DEPC購自Sigma-Aldrich(上海)貿易有限公司,Binding Buffer緩沖液購自上海君瑞生物技術有限公司,膜聯蛋白V-異硫氰酸熒光素(Annexin V-FITC)購自北京冬歌博業生物科技有限公司,碘化丙啶(PI)及0.1%結晶紫購自上海麥克林生化科技有限公司,十二烷基硫酸鈉-聚丙烯酰氨凝膠(SDS-PAGE)購自上海群己生物科技有限公司;FOXC1、FOXC1-NC(模擬物陰性對照)均購自美國Sigma-aldrich公司;FOXC1(ab227977)、E-cadherin(ab16663)、MMP2(ab92536)、Vimentin(ab92547)抗體購自美國Abcam公司;Varioskan LUX型酶標儀購自賽默飛世爾科技(中國)有限公司,流式細胞儀(美國BD公司,FACSCalibur型),Avanti J-E離心機購自美國貝克曼庫爾特有限公司,Powerpac Universal型電泳儀購自美國BIO-RAD公司。
1.2 方法
1.2.1 細胞培養 人CRC HCT116細胞,生長于含10%滅活胎牛血清、100 U/ml鏈霉素及青霉素的RPMI-1640培養基,將培養基置于5% CO2、37 ℃的飽和溫度培養箱中,每2~3 d使用0.25%胰蛋白酶消化及傳代細胞1次,采用10% DMSO+90%血清凍存液來凍存細胞,用于后續實驗操作。
1.2.2 CCK-8檢測CRC HCT116細胞增殖 取對數生長期HCT116細胞,接種于96孔板(每孔2×104個),分別添加0、12.5、25、50 μmol/L濃度的五味子素(甲醇溶解),每個濃度設置5個復孔,將HCT116細胞在培養箱(5% CO2、37%)中分別培養12 h、24 h、48 h,細胞貼壁丟棄培養基,再添加10 μl CCK-8與200 μl培養基,37 ℃孵育2 h,490 nm波長下使用酶標儀測定吸光度值,計算不同濃度下細胞存活率,明確細胞增殖情況,重復3次,取平均值。并選擇細胞存活率接近50%的五味子素濃度進行后續實驗研究。
1.2.3 細胞轉染與分組 隨機分層法分為5組:對照組、FOXC1-NC組、FOXC1組、五味子素組、FOXC1+五味子素組。轉染前24 h,取長勢良好對數生長期HCT116細胞,倒置顯微鏡,觀察細胞增殖至60%~70%時,進行胰蛋白酶消化,收集CRC HCT116細胞,PBS重懸,調整細胞密度,以1×106個/ml接種到24孔板,每組設置5個復孔,每個復孔重復3次,之后進行細胞轉染:使用相關基因序列質粒(2.4 μl的FOXC1-NC及FOXC1)與5 μl的LipofectamineTM2000分別添加至245 μl的Opti-MEM培養基中,制成溶液備用,靜置5 min后,混勻,靜置30 min,37 ℃繼續培養(48 h),熒光顯微鏡下觀察轉染率,轉染成功標準為轉染率>85%,以便用于后續實驗。對照組不做任何處理,FOXC1-NC組轉染FOXC1-NC,FOXC1組轉染FOXC1,五味子素組HCT116細胞內加入50 μmol/L五味子素,FOXC1+五味子素組穩定轉染FOXC1 24 h后加入五味子素50 μmol/L。
1.2.4 流式細胞儀測定HCT116細胞凋亡情況 取HCT116細胞,添加預冷PBS緩沖液,離心6 min(4 ℃,1000 r/min,離心半徑10 cm),棄上清液,再次加入預冷PBS緩沖液,離心(離心條件同上),棄上清液,加入500 μl 1×Binding Buffer緩沖液來重懸細胞,之后依次加入5 μl Annexin V-FITC、10 μl PI,室溫下振蕩孵育,使用流式細胞儀測定細胞凋亡情況,CELL QUEST 3.0分析實驗數據。
1.2.5 Transwell實驗檢測細胞侵襲能力 預冷培養液,以1∶8比例稀釋Matrigel基質膠與培養基,加入Transwell chamber上室(40 μl/孔),培養箱孵育(37 ℃,5 h),選取對數期HCT116細胞,加入Transwell chamber上室,每孔3×104個,將100 g/L胎牛血清培養液加入Transwell chamber下室,每孔600 μl,培養箱培養24 h(37 ℃),PBS緩沖液洗滌,棉簽擦去微孔膜內層磁暴,多聚甲醛固定(20 min),PBS清洗,0.1%結晶紫染色(10 min),洗去表面結晶紫,選10個視野,顯微鏡下計算侵襲至微孔膜下層的細胞數,重復3次實驗,取平均數。
1.2.6 Realtime-PCR測定FOXC1、E-cadherin、MMP2、Vimentin mRNA表達 收集各組培養48 h的HCT116細胞,PBS緩沖液沖洗2次,吸盡PBS溶液后,予以Trizol溶液1 ml震蕩混勻(4 ℃,5 min),加入0.2 ml氯仿振蕩15 s,靜置(4 ℃,3 min),離心(4 ℃,12000 rpm,15 min),取上層水相至離心管,加入等體積異丙醇,-20 ℃靜置20 min,離心(4 ℃,12000 rpm,15 min),棄上清,1 ml DEPC處理后洗滌沉淀,離心機離心(4 ℃,8000 rpm,185 min),加入dd H2O水30 μl,溶解RNA;RNA逆轉錄合成cDNA,以逆轉錄cDNA為模板,進行PCR擴增,引物序列如表1,反應體系如下:總反應體系10 μl,2 μL模板cDNA ,各1 μl上下游引物,擴增條件(98 ℃反應5 min,95 ℃變性15 s,72 ℃延伸30 s,熔解曲線55 ℃~95 ℃,40個循環);以β-actin為內參,目的基因相對定量采用2-△△CT法計算。

表1 引物序列
1.2.7 Western blot檢測FOXC1、MMP2、E-cadherin、Vimentin蛋白表達 取各組細胞,加入蛋白裂解液,混勻,充分裂解20~30 min,提取蛋白質,之后予以離心(12000 r/min,離心半徑10 cm,5 min),取上清液,SDS-PAGE電泳,電轉緩沖液轉膜(50 min),轉移蛋白至硝酸纖維素膜上,將其放入50 g/L脫脂奶粉中,孵育2 h,TBST洗膜5 min,在加入稀釋(1∶1000)的FOXC1、MMP2、E-cadherin、Vimentin一抗與稀釋(1∶2000)的β-actin一抗中孵育過夜(4 ℃),次日洗膜,加入稀釋(1∶2000)二抗孵育(室溫,1 h),洗膜,暗室中曝光顯影,凝膠成像系統掃描,Image J 軟件分析灰度值,計算相對表達量:目的蛋白/內參β-actin灰度值。
1.3 統計學方法
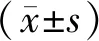
2 結果
2.1 不同濃度五味子素對HCT116細胞存活率的影響
使用不同濃度五味子素作用于HCT116細胞,檢測不同時間點細胞存活率,結果發現,與0 μmol/L五味子素處理HCT116細胞比較,在12 h、24 h、48 h時采用12.5、25、50 μmol/L五味子素處理的細胞存活率逐漸降低(P<0.05),其中采用50 μmol/L五味子素處理48 h時,細胞存活率最接近50%,后續實驗均選取此條件細胞。見圖1。
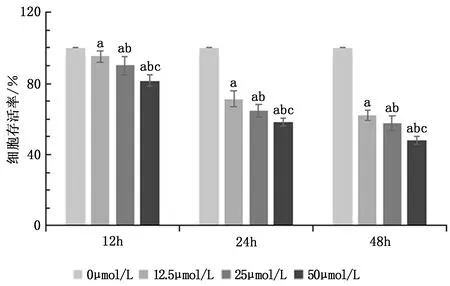
圖1 不同濃度五味子素處理不同時間的HCT116細胞存活率
2.2 各組細胞凋亡率比較
5組細胞凋亡率比較,差異有統計學意義(P<0.05);兩兩比較結果顯示,與對照組、FOXC1-NC組比較,FOXC1組細胞凋亡率降低(P<0.05);與對照組比較,五味子素組細胞凋亡率升高(P<0.05);FOXC1+五味子素組細胞凋亡率高于FOXC1組,低于五味子素組(P<0.05)。見表2。
表2 各組HCT116細胞凋亡率比較
2.3 各組細胞侵襲能力比較
5組侵襲細胞數比較,差異有統計學意義(P<0.05);與對照組、FOXC1-NC組比較,FOXC1組侵襲細胞數升高(P<0.05);與對照組比較,五味子素組侵襲細胞數下降(P<0.05);且FOXC1+五味子素組侵襲細胞數低于FOXC1組,高于五味子素組(P<0.05)。見表3、圖2。
表3 各組HCT116細胞侵襲細胞數比較
2.4 FOXC1、E-cadherin、MMP2、Vimentin mRNA表達水平
5組HCT116細胞FOXC1、E-cadherin、MMP2、Vimentin mRNA表達比較,差異有統計學意義(P<0.05);與對照組、FOXC1-NC組比較,FOXC1組FOXC1、MMP2、Vimentin mRNA表達水平升高,E-cad-herin mRNA表達水平下降(P<0.05);與對照組比較,五味子素組FOXC1、MMP2、Vimentin mRNA表達水平降低,E-cadherin mRNA表達水平升高(P<0.05);FOXC1+五味子素組FOXC1、MMP2、Vimentin mRNA表達水平低于FOXC1組,高于五味子素組,且E-cadherin mRNA表達水平高于FOXC1組,低于五味子素組(P<0.05)。見表4。
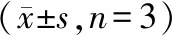
表4 各組HCT116細胞FOXC1、E-cadherin、MMP2、Vimentin mRNA表達水平
注:×200,A:對照組;B:FOXC1-NC組;C:FOXC1組;D:五味子素組;E:FOXC1+五味子素組
2.5 FOXC1、E-cadherin、MMP2、Vimentin蛋白表達水平
5組HCT116細胞FOXC1、E-cadherin、MMP2、Vimentin 蛋白表達比較,差異有統計學意義(P<0.05);與對照組、FOXC1-NC組比較,FOXC1組FOXC1、MMP2、Vimentin蛋白表達水平升高,E-cadherin蛋白表達水平下降(P<0.05);與對照組比較,五味子素組FOXC1、MMP2、Vimentin蛋白表達水平降低,E-cadherin蛋白表達水平升高(P<0.05);FOXC1+五味子素組FOXC1、MMP2、Vimentin蛋白表達水平低于FOXC1組,高于五味子素組,且E-cadherin蛋白表達水平高于FOXC1組,低于五味子素組(P<0.05)。見表5、圖3。
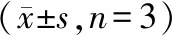
表5 各組HCT116細胞FOXC1、MMP2、Vimentin、E-cadherin蛋白表達水平
3 討論
目前研究認為CRC是環境、遺傳、飲食習慣、生活方式等多因素協同作用的結果,mi RNA基因突變或擴增,致使致癌信號激活,細胞發生惡變,產生大量利于自身生長的趨化因子,不加干預會不斷惡化、轉移,手術、化療雖可延長患者生存時間,但手術存在腫瘤分期限制,化療存在耐藥性及毒副作用,整體生存率仍有待提高[7],因此深入探索其他CRC治療機制十分必要。
注:A:對照組;B:FOXC1-NC組;C:FOXC1組;D:五味子素組;E:FOXC1+五味子素組
五味子素來源于木蘭科植物五味子,前期學者研究發現其具有廣泛的生物活性,如有學者[8]發現,五味子素B可轉導TLR4信號,減少神經元凋亡,以保護神經;另有學者發現[9]五味子素B可增強多西他賽的抗腫瘤作用,促進細胞凋亡。隨著臨床的應用逐漸發現,五味子素系列在腫瘤方面顯示出獨特優勢,研究表明[10]五味子素A可下調miR-155水平,抑制乳腺癌細胞增殖,且有研究發現[11]五味子素B能誘導人前列腺癌細胞凋亡,具有潛在藥理作用。而五味子素對CRC細胞的凋亡、侵襲能力影響尚不清楚。本研究采用不同濃度五味子素處理CRC HCT116細胞發現,不同濃度五味子素可不同程度降低細胞存活率,提示五味子素可降低HCT116細胞活性。為進一步評估五味子素對各組HCT116細胞的凋亡、侵襲影響,本研究采用流式細胞儀測定HCT116細胞凋亡情況,Transwell實驗測定細胞侵襲能力,結果顯示,經轉染FOXC1后,細胞凋亡率低于對照組、FOXC1-NC組,侵襲細胞數高于對照組、FOXC1-NC組,提示過表達FOXC1可抑制細胞凋亡,增強細胞侵襲力;在過表達FOXC1后使用五味子素干預,發現FOXC1+五味子素組細胞凋亡率低于五味子素組,而侵襲細胞數高于五味子素組,提示五味子素抑制促進細胞凋亡及抑制細胞侵襲,可能與降低FOXC1表達有關。
FOXC1定位于染色體6p25上,是FOX家族重要一員,已被證實在肝癌、肺腺癌等多種惡性腫瘤中高表達,參與癌細胞生物學行為,與細胞遷移、侵襲、耐藥性密切相關[12-14]。Seong-Hoon Yun等[15]國外學者發現,OUP-TFII敲低可上調FOXC1表達,促進大腸癌細胞增殖與侵襲;而劉健等[16]學者研究顯示,FOXC1可直接與靶基因整聯蛋白α7、成纖維細胞生長因子受體4結合,激活其表達,促進直腸癌轉移。上述表述提示FOXC1與CRC發展進程相關,本研究進一步進行Realtime-PCR及Western blot檢測,分析各組細胞FOXC1及其下游基因mRNA、蛋白表達變化,結果發現,FOXC1組FOXC1、MMP2、Vimentin mRNA及蛋白表達水平高于對照組、FOXC1-NC組,E-cadherin mRNA及蛋白表達水平低于對照組、FOXC1-NC組,而五味子素組上述表達水平相反,而FOXC1+五味子素組則可部分逆轉五味子素對FOXC1及其下游E-cadherin、MMP2、Vimentin mRNA及蛋白表達水平,以此驗證五味子素可下調FOXC1表達,調節相關mRNA、蛋白水平,進而抑制細胞侵襲能力,促進HCT116細胞凋亡。
綜上,FOXC1在CRC HCT116細胞中高表達,促進細胞增殖,而五味子素可降低細胞活力,抑制其侵襲,可能與五味子素下調FOXC1表達及調節相關mRNA、蛋白表達有關,可為臨床基因靶向治療提供實驗依據,但本研究尚存一定局限性,需動物體實驗來驗證上述結論。

