谷氨酰胺對腦出血小鼠神經保護和抗炎作用實驗研究
張百平,孫樹凱,于慶偉,王 鵬
(空軍軍醫大學唐都醫院神經外科,陜西 西安 710038)
腦出血(Intracerebral hemorrhage,ICH)是指自發性的腦血管破裂出血,是一種高發病率、高病死率及高病殘率的疾病[1]。根據流行病學調查資料統計,ICH占全部腦卒中的10%~15%,而我國這一比例則高達17%~55%[2-3]。ICH的損傷機制包括原發性和繼發性腦損傷,原發性腦損傷是指血腫對周圍腦組織造成的占位性效應引起的機械性損傷[4],但目前仍缺乏針對腦組織原發損傷的有效治療手段。繼發性腦損傷是指出血后伴隨的炎性反應、血-腦屏障破壞,以及血腫周圍水腫形成等造成的腦組織新發損傷等,與預后不良密切相關[5]。研究[6]表明,腦出血繼發性損傷的機制主要是炎性反應介導的神經損傷,如若能有效控制,則可以在一定程度上減輕繼發性損傷。谷氨酰胺(Glutamine,Gln)作為人體特殊營養素,不僅是體內核苷酸合成的主要能源物質,還可以代謝為谷胱甘肽,具有調控炎性反應和免疫因子表達的作用[7-9]。谷氨酰胺對ICH后神經組織的保護作用尚不清楚。鑒于此,本研究旨在探討小鼠腦出血模型下谷氨酰胺的神經保護作用及其對繼發性炎性反應的抑制作用。
1 材料與方法
1.1 實驗材料 實驗動物:健康成年雄性C57小鼠,5~6周齡,體重18~23 g,飼養溫度22~26 ℃,環境為室溫,濕度適宜,每天光照12 h,可自由進食進水。主要試劑及儀器:谷氨酰胺(美國Sigma公司)、ELISA試劑盒(上海瓦蘭生物科技有限公司)、TUNEL染色液(武漢博士德公司)、鼠腦立體定向儀、微量注射儀、光學顯微鏡等。
1.2 實驗方法
1.2.1 動物分組與給藥:利用隨機數字表法將30只小鼠隨機分成三組,假手術組(Sham組),腦出血+0.9%氯化鈉溶液組(ICH+Sal組),腦出血+谷氨酰胺組(ICH+Gln組),每組10只。各組做腦出血手術,ICH+Gln組術后第1天口服灌胃Gln 5 ml(2 g/kg),1次/d,連續7 d;ICH+Sal組在相同時間段給予等容量的0.9%氯化鈉溶液灌胃。
1.2.2 腦出血模型制備:根據許東等[10]的方法,術前12 h禁食,4 h禁水,在常溫(22±3)℃下,ICH+Sal組和ICH+Gln組的小鼠稱重后以10%水合氯醛按300 mg/kg體重腹腔麻醉后俯臥位固定于立體定向儀上,皮膚消毒后做一長度為0.5 cm的縱形切口,暴露出小鼠的顱骨以及前囟;于前囟前1.0 mm、中線右側2 mm處鉆一直徑約1.0 mm的圓孔,保持硬腦膜完整。然后利用微量注射器從鉆孔垂直顱骨表面進針,進針深度為4.0 mm,接著緩慢均速推注肝素化Ⅶ膠原酶0.15 μl,注射過程控制在5 min內,注射完成后微量注射器停留10 min,而后緩慢退出,縫合皮膚切口。Sham組小鼠以同樣的手術方法注入0.15 μl的0.9%氯化鈉溶液。
1.2.3 神經功能損傷(mNSS)評分:在ICH造模后的第1、3、7 天采用改良神經功能評分表對各組實驗小鼠的運動(肌肉狀態、異常動作)、感覺(視覺、觸覺、平衡覺)和反射進行檢查評估神經功能損害。得分越高,表示小鼠神經功能缺損越嚴重[11]。
1.2.4 腦組織含水量測定:ICH造模后第7 天取各組實驗小鼠麻醉斷頭處死,然后用干濕重法檢測各組小鼠的腦組織含水量(BWC)。具體方法為:實驗小鼠麻醉斷頭處死后,迅速取出腦組織置于冰盒中,然后用精密電子天平準確稱量新鮮腦組織的濕重。而后將其放置于電熱恒溫箱內100 ℃連續烘烤24 h,稱取實驗腦組織干重。其小鼠的BWC(%)即為:BWC(%)=(濕重-干重)/濕重×100%。
1.2.5 TUNEL染色檢測神經細胞凋亡:分別在三組中隨機抽選3只小鼠,于造模后第7天,麻醉后將小鼠仰臥位固定在實驗臺上。灌注取腦后進行多聚甲醛磷酸鹽液進行后固定4 h,然后進行蔗糖梯度脫水,繼而二甲苯透明、石蠟包埋后,冠狀切片完成切片制作,每組小鼠切片接受細胞凋亡檢測,計算TUNEL陽性細胞的百分比=(TUNEL陽性細胞數量/DAPI陽性細胞數量)×100%。
1.2.6 ELISA法測定ICH血腫周圍組織中腫瘤壞死因子-α(TNF-α)、白細胞介素-1β(IL-1β)的含量:造模后第7天,分別取Sham組、ICH+Sal組,ICH+Gln組小鼠各3只,在ICH不同時間點取腦血腫灶周組織0.5 g,加入預冷的PBS,使制成質量濃度10%的腦組織勻漿,4 ℃、4000 r/min,離心15 min,置-70 ℃低溫冰箱保存備用。ELISA法檢測TNF-α以及IL-1β的表達水平。
1.2.7 免疫熒光染色:在造模后第7天,隨機于各組中選取4只小鼠,取小鼠腦出血邊緣皮質,用多聚甲醛固定后以石蠟包埋,以厚度20 μm切片。切片用PBS(pH7.4)漂洗3次,每次5 min,牛血清封閉30 min后孵一抗Iba-1抗體(1∶500,Abcam)過夜,置于4 ℃冰箱中。取出切片后再用PBS漂洗3次,每次5 min,避光條件下孵二抗1∶500 稀釋的異硫氰酸熒光素(FITC) 標記的羊抗兔或羊抗鼠二抗(1∶500,Invitrogen) IgG 3 h,室溫即可。然后用PBS漂洗實驗腦片3次,每次漂洗5 min。加入Hoechst 15 min,封片,熒光顯微鏡觀察結果。
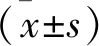
2 結 果
2.1 三組小鼠腦出血后mNSS評分比較 Sham組小鼠在ICH后第1、3、7天各時間段內其mNSS評分沒有明顯變化。而與Sham組相比,其余兩組小鼠各時間段mNSS評分明顯升高,差異具有統計學意義(均P<0.001)。對比ICH+Sal組,造模后第1天時,ICH+Gln組小鼠的神經功能差異無統計學意義(P>0.05),然而在第3、7天時,小鼠mNSS評分比較具有統計學差異(P<0.001),即Gln能夠有效改善小鼠的神經功能。見圖1。

注:各組兩兩比較,*P<0.05,**P<0.01,***P<0.001 ;ns,P>0.05
2.2 三組小鼠腦出血后各時點腦組織含水量比較 ICH后第7天,利用干濕重法檢測出血后腦組織含水量評估水腫程度,結果發現,與Sham組比較,ICH+Sal組在術后腦組織水含量明顯升高(P<0.001);而經Gln處理后,其實驗小鼠的腦組織水含量顯著降低,差異具有統計學意義(P<0.01),說明Gln可以明顯改善小鼠出血后的腦水腫情況。見圖2。

注:各組兩兩比較,**P<0.01,***P<0.001
2.3 三組小鼠腦出血后神經細胞凋亡情況比較 術后第7天,利用TUNEL染色方法檢測應用Gln對細胞凋亡情況的影響,研究結果顯示:Sham組小鼠的細胞凋亡率極低;而ICH后ICH+Sal組和ICH+Gln組小鼠的細胞凋亡率顯著增高,與ICH+Sal組相比,應用Gln后,細胞的凋亡百分率明顯下降,差異具有統計學意義(均P<0.001),提示Gln可以顯著抑制ICH后的細胞凋亡。見圖3。
2.4 三組小鼠腦出血后腦組織中炎癥因子表達水平比較 術后第7天,采用了ELISA法檢測各組小鼠腦出血后炎癥因子的表達水平變化,研究發現,與Sham組小鼠相比,ICH+Sal組小鼠腦組織中炎癥因子IL-1β和TNF-α表達均明顯升高(均P<0.001);給予Gln干預后,ICH+Gln組腦出血后炎癥因子IL-1β和TNF-α表達明顯下降(均P<0.001)。見圖4。
2.5 三組小鼠腦出血后小膠質細胞活化比較 術后第7天,免疫熒光染色檢測小膠質細胞標志物(Iba-1染色陽性,紅色)結果顯示,腦出血后,與Sham組相比,ICH+Sal組腦皮質Iba-1陽性小膠質細胞表達明顯增多,添加Gln治療后,明顯降低了Iba-1陽性小膠質細胞的數量及活化程度;從形態學觀察,相比于Sham組小膠質細胞的胞體較小,有大量細小分支突起,ICH+Sal組小鼠腦組織中小膠質細胞胞體大,突起短;而Gln干預后,ICH+Gln組小膠質細胞胞體變小,細小分支突起增多。見圖5、6。

圖5 三組小鼠小膠質細胞活化狀態比較

注:各組兩兩比較,***P<0.001

注:各組兩兩比較,***P<0.001

注:各組兩兩比較,**P<0.01,***P<0.001
3 討 論
ICH是一種臨床常見的嚴重急性腦血管疾病,多發于秋冬季,其病死率、致殘率均較高,嚴重威脅患者的生命健康[1]。大量研究表明,ICH后繼發炎癥級聯反應加速血腫周圍水腫的形成,加重腫塊效應,并加快細胞凋亡[12]。ICH發作后,破碎的腦組織以及血液成分浸潤在周圍腦組織中,這些均會激活顱內的免疫細胞——小膠質細胞,活化的小膠質細胞會產生大量的促炎因子,進而引起損傷后繼發炎癥的級聯反應,連同組織細胞的碎片,這些有害物質會破壞血-腦屏障及對周圍正常組織產生毒性作用,導致血腫周圍水腫等一系列繼發性損傷[13-14]。因此,控制出血后炎性反應已成為提高ICH治療效果,改善患者預后的重要手段。
在發生創傷、手術、感染等應激狀態下,這時機體需額外補充Gln,因此一直以來Gln被認為是條件必須脂肪酸[13]。研究證實,Gln不僅能夠發揮供能作用,而且還可代謝為谷胱甘肽,發揮抗氧化作用,調控機體內免疫因子和炎癥因子等的表達,通過調節機體免疫系統以及相關炎性反應,維持機體的免疫穩態[15-16]。現今多項臨床研究證實,谷氨酰胺注射液可有效治療ICH,具有很好的神經保護作用[17]。另外還有研究發現,患者在發生ICH后,與添加常規營養相比,添加Gln能有效提升神經功能恢復效果[18]。
本研究利用小鼠ICH模型,探究了Gln的神經保護作用及其對繼發性炎性反應的抑制作用。結果證實Gln能減輕小鼠ICH后腦組織水腫,抑制繼發性炎性反應,減輕出血后細胞凋亡,發揮神經保護作用。研究已經表明,腦出血后小膠質細胞的激活既有積極的保護作用,又有加重腦損傷的作用。出血后腦內激活的小膠質細胞會釋放大量的炎癥因子,這些因子會損害血管內皮細胞,進一步破壞腦內血-腦-脊液屏障,從而加重ICH后腦水腫,導致神經細胞死亡,加重神經功能障礙[19]。基于以上理論,我們根據許東等[10]的文獻制作小鼠腦出血模型,施加Gln干預后,研究結果顯示Gln能明顯降低Iba-1陽性小膠質細胞的數量及活化程度,小鼠ICH后炎癥因子TNF-α、IL-1β表達水平顯著提高,經Gln處理后,能抑制腦出血后炎癥因子的表達進而降低神經炎性反應,起到神經保護作用。此外,研究同樣發現TNF-α、IL-1β等炎癥因子能夠激活相關信號傳導通路,增加血-腦屏障的通透性,加劇腦水腫,導致神經細胞變性凋亡[20-21]。本實驗結果表明,與其他兩組相比,ICH+Gln組的凋亡百分率要明顯下降,提示Gln治療可能通過降低ICH后繼發的神經炎性反應,抑制了小膠質細胞的活化進而減少了炎癥因子的過度表達,進一步降低了出血后腦細胞的凋亡,發揮了神經保護的作用,改善小鼠預后。本研究還存在一定的局限性,如藥物的使用效果大都著眼于表象,具體機制還不夠清楚,有待進一步研究;另外,本實驗僅就Gln對腦出血模型小鼠的治療效果進行了初步觀察,具體的分子機制尚待進一步探索。
綜上所述,Gln處理腦出血后小鼠能有效改善小鼠的神經功能評分,減輕腦水腫,進一步發現其可減輕機體的神經炎性反應,抑制炎癥因子的分泌,并且可減少細胞凋亡,并起到神經保護作用。

