捻轉血矛線蟲PCR檢測方法的建立及其應用
鄒 敏,要慧中,楊冰可,周璐露,趙光明,楊文歡,吳 昌,林 青,4
(1. 西北農林科技大學 動物醫學院,陜西楊凌 712100;2. 陜西省動物疫病預防控制中心,西安 710299;3. 商南縣農業綜合執法大隊,陜西商南 726300;4. 家畜疫病病原生物學國家重點實驗室,中國農業科學院 蘭州獸醫研究所,蘭州 730046)
捻轉血矛線蟲(Haemonchuscontortus)是一種世界范圍內的反芻動物胃腸道高致病性吸血線蟲,特別是在熱帶、亞熱帶和溫帶等溫暖潮濕的地區,其危害程度更為嚴重[1-2]。主要寄生于山羊、綿羊等家養和野生反芻動物的皺胃和小腸[3],可導致宿主出現消瘦、貧血、下顎水腫、生理機能紊亂等慢性消耗性癥狀,甚至引起幼年動物急性死亡[4-7],給世界范圍內的山羊、綿羊等反芻動物養殖業帶來重大的經濟損失[2,7]。捻轉血矛線蟲病除了通過特征性的臨床病變以及尸檢時在胃腸道中發現大量的捻轉血矛線蟲蟲體來確診外[1],還可通過從糞便中檢測出的捻轉血矛線蟲蟲卵來確診。傳統的糞檢方法主要是顯微鏡檢查,臨床上通常是應用麥克馬斯特氏法(McMaster’s method)來計算每克糞便中的蟲卵數(EPG),對線蟲感染進行定性和定量測定[8]。傳統鏡檢方法通過形態準確鑒定線蟲卵的種類有一定難度,往往判定結果存在一定的主觀性,且在實際檢測時也常有漏診情況出現。
在過去的幾十年里,為了提高腸道蠕蟲病診斷的敏感性和特異性,分子診斷方法得到不斷發展和完善。目前,隨著線蟲基因組學研究的不斷深入,加之蛋白質組學和代謝組學的技術不斷發展[9],使得特異性生物標記物用來進行物種鑒別成為可能[10]。近年來,由于PCR技術快速、高效、便捷和特異性強等特點,同時又可以彌補傳統方法的一些缺陷,因此,基于PCR的一系列病原檢測技術已經在動物胃腸道線蟲的研究中得到廣泛應用[8,11-12]。本研究將基于捻轉血矛線蟲ITS2-28S基因序列,建立針對捻轉血矛線蟲卵的一種快速PCR分子檢測技術,為羊捻轉血矛線蟲病的診斷與防治提供有效方法,并為該病的監測預報提供技術支持。
1 材料與方法
1.1 材 料
1.1.1 蟲卵樣品 將采集于羊皺胃的捻轉血矛線蟲雌蟲在室溫下培養8~12 h以獲得成熟的蟲卵,同時將雌蟲蟲體置于體視顯微鏡下解剖其子宮,將子宮內尚未成熟的蟲卵擠出。所收集的蟲卵保存于生理鹽水內。細頸線蟲、粗紋食道口線蟲、似血矛線蟲、夏伯特線蟲、蘭氏毛尾線蟲、綿羊毛尾線蟲、尖尾線蟲、網尾線蟲、蛇形毛圓線蟲等蟲卵的DNA陽性樣品由西北農林科技大學寄生蟲實驗室提取并保存。
1.1.2 糞便樣品 120只奶山羊新鮮糞便樣品分別采自陜西省藍田縣(85只)、千陽縣(20只)、富平縣(15只)3 個某規模化奶山羊場。
1.1.3 主要試劑 普通瓊脂糖凝膠DNA回收試劑盒(DP209)和高純度質粒小提中量試劑盒(DP107)均購自天根生化科技(北京)有限公司;OMEGA糞便基因組DNA提取試劑盒(D4015)、大腸埃希桿菌JM109感受態細胞(G6014-20)、氨芐青霉素貯存液(A1170)、LB固體培養基干粉(L1015)、LB液體培養基干粉(L1010)等均購自北京索萊寶生物科技有限公司;TaKaRa ExTaq○R(RR001A)、T-vector pMD 19(Simple)載體(3271)、DNA標準DL 2000(3427A)均購自寶日醫生物技術(北京)有限公司。
1.2 方 法
1.2.1 捻轉血矛線蟲卵DNA的提取 按照 OMEGA糞便基因組DNA提取試劑盒說明書提取蟲卵的基因組DNA,并置于-20 ℃保存,備用。
1.2.2 捻轉血矛線蟲PCR檢測方法的建立引物設計 參考GenBank中的捻轉血矛線蟲序列(登錄號為KX829170.1),基于捻轉血矛線蟲ITS2-28S基因序列片段,利用ClustalX 1.83生物軟件篩選出捻轉血矛線蟲種內保守且種間高變的堿基序列,利用NCBI內的Primer-blast和oligo 7生物學軟件,設計捻轉血矛線蟲的上、下游特異性引物,引物相關的具體信息如表1所示。
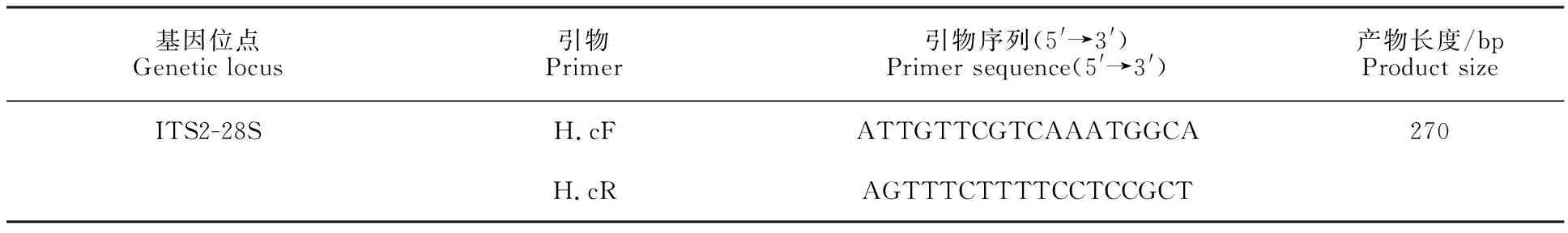
表1 捻轉血矛線蟲PCR引物Table 1 PCR primers for H.contortus
捻轉血矛線蟲PCR反應體系的建立和條件優化 PCR反應總體系設定為25 μL:10× ExTaqBuffer 2.5 μL,dNTP Mixture 2 μL,上下游引物(10 μmol/L)各1 μL,ExTaqDNA聚合酶 0.125 μL,模板DNA 1 μL,ddH2O 17.375 μL。反應條件為:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,35個循環;72 ℃ 5 min。
退火溫度優化:根據Oligo 7推薦的最佳退火溫度54.6 ℃,將溫度梯度設置為60 ℃、59 ℃、58 ℃、57 ℃、56 ℃、55 ℃、54 ℃、53 ℃、52 ℃、 51 ℃、50 ℃。
特異性試驗 利用建立的PCR方法對細頸線蟲、似血矛線蟲、夏伯特線蟲、蘭氏毛尾線蟲、綿羊毛尾線蟲、尖尾線蟲、網尾線蟲、蛇形毛圓線蟲、粗紋食道口線蟲等蟲卵的DNA進行擴增,設置捻轉血矛線蟲卵DNA為陽性對照,ddH2O為陰性對照。擴增后將PCR產物經10 g/L瓊脂糖凝膠電泳,觀察結果,為進一步確定擴增結果的準確性,將陽性PCR原液送測序驗證。
敏感性試驗 陽性標準品的制備:使用普通瓊脂糖凝膠DNA回收試劑盒(DP209),對捻轉血矛線蟲卵PCR擴增產物進行純化與回收。將膠回收產物利用T-Vector pMD 19載體系統連接到pMD-19T SimpleⅠ載體上。將連接產物轉化到感受態細胞,在LB固體培養基上過夜培養14~16 h后,觀察菌落。挑取培養基上的單個菌落于含有1.5 μL氨芐青霉素和1 mL LB液體培養基的離心管內,放置在37 ℃搖床中,于220 r/min培養12 h。
利用建立的PCR方法及電泳檢測對菌落進行鑒定后,將菌液PCR擴增產物送測序。對經測序結果正確的陽性質粒參考高純度質粒小提中量試劑盒(DP107)說明書進行DNA提取。經分光光度計測定核酸濃度后,按5倍比稀釋為9個濃度梯度分別作為模板,使用建立的PCR反應體系和反應程序進行擴增,每個梯度重復3次,以確保試驗的可重復性。
1.3 臨床樣品檢測
1.3.1 光學顯微鏡檢查 采用飽和食鹽水漂浮法進行糞便中蟲卵的形態學檢查,于400倍的光學顯微鏡下觀察蟲卵的大小、顏色、卵殼厚度、形狀及卵內容物等形態特征,對捻轉血矛線蟲卵進行鑒定并記錄結果。
1.3.2 糞便樣品PCR檢測 按照OMEGA糞便基因組DNA提取試劑盒說明書提取糞便樣品DNA并進行PCR擴增,對擴增產物進行凝膠電泳檢測,之后將所有陽性PCR產物送測,以確定目的基因片段的準確性。
1.3.3 兩種檢測方法結果比較 使用SPSS 24.0軟件對兩種檢測方法的結果進行一致性檢驗(Kappa vaule)和配對卡方檢驗(McNemar Test),分析計算結果。當Kappa值≥0.75,二者檢測結果一致性較好;當0.4≤Kappa值<0.75,二者檢測結果一致性一般;當Kappa值<0.4,二者檢測結果一致性較差。P<0.05為差異具有統計學意義。
2 結果與分析
2.1 PCR反應退火溫度優化
通過對PCR反應條件中的退火溫度進行優化,結果顯示,以53 ℃為退火溫度時,電泳檢測出的目的條帶最亮且無雜帶出現(圖1),即53 ℃為該PCR反應的最佳退火溫度。
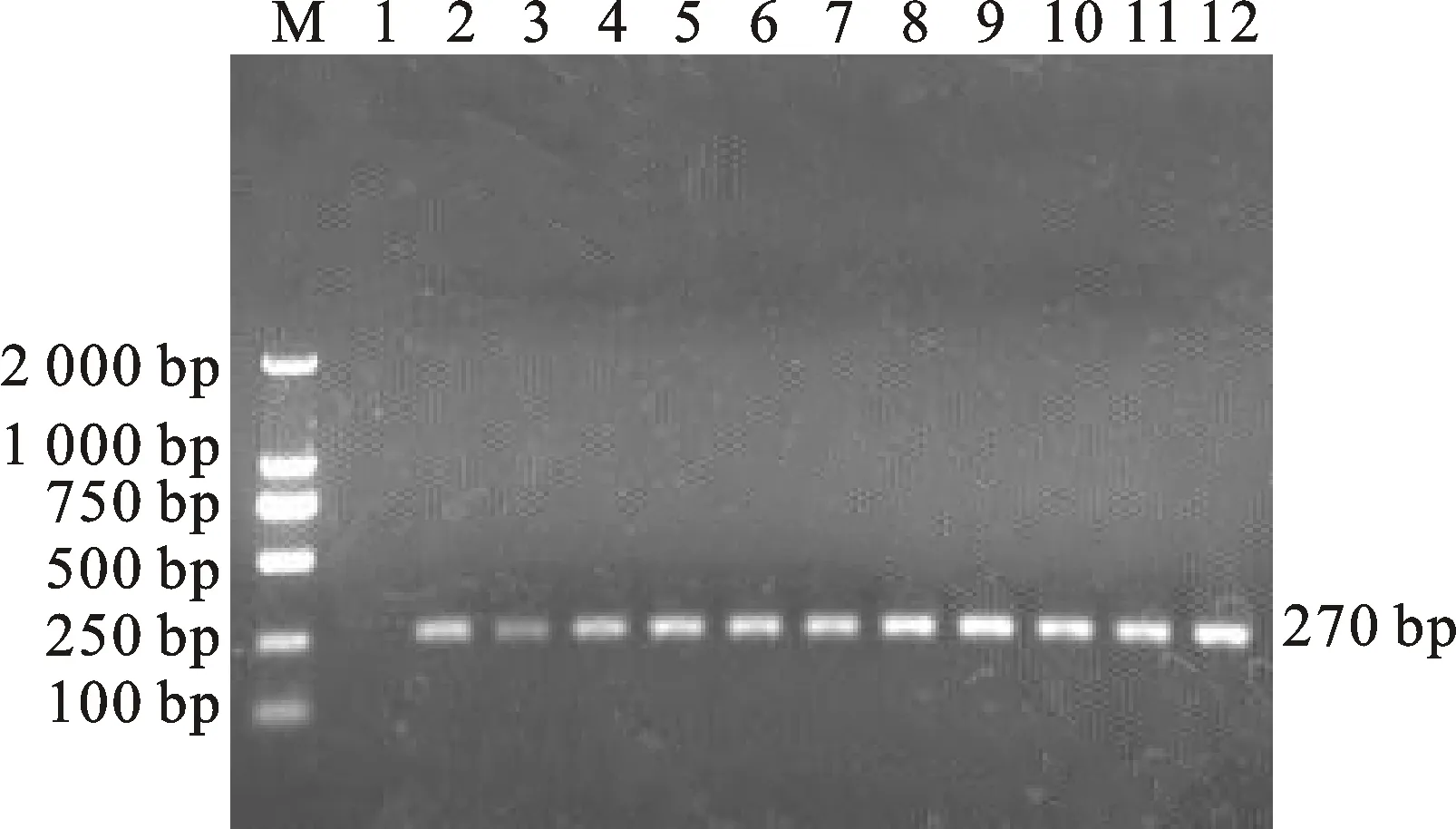
M.DNA 標準 DL 2000;1. 空白對照;2~12. 退火溫度分別為60 ℃、59 ℃、58 ℃、57 ℃、56 ℃、55 ℃、54 ℃、53 ℃、52 ℃、 51 ℃、50 ℃
2.2 PCR特異性試驗
電泳檢測結果顯示,僅以捻轉血矛線蟲卵DNA為模板的樣品出現一條270 bp的特異性條帶,其余線蟲卵DNA樣品電泳結果均為陰性(圖2)。將測序結果在NCBI上進行Blast比對,結果顯示,測序結果與GenBank中捻轉血矛線蟲基因參考序列(登錄號為KF176320.1)的相似度達到100%,與GenBank中多個捻轉血矛線蟲基因參考序列同源性均達99%以上。
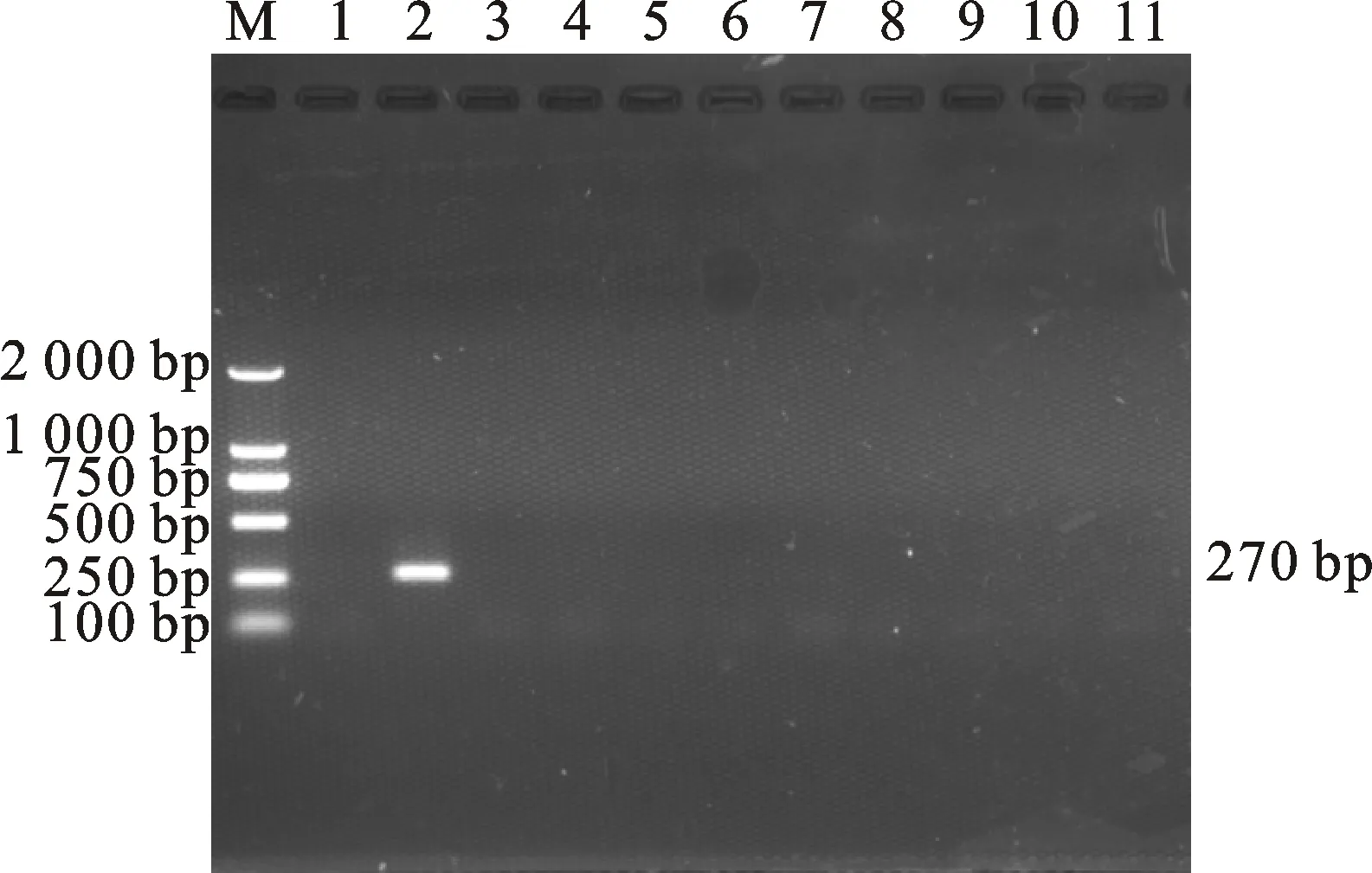
M. DNA 標準 DL 2000;1. 空白對照;2~11. DNA模板依次為捻轉血矛線蟲卵、細頸線蟲卵、似血矛線蟲卵、蘭氏毛尾線蟲卵、尖尾線蟲卵、網尾線蟲卵、夏伯特線蟲卵、蛇形毛圓線蟲卵、毛尾線蟲卵、粗紋食道口線蟲卵
2.3 PCR敏感性試驗
將DNA質量濃度為116.529 ng/μL的陽性質粒標準品,按5倍比例逐級稀釋至0.06 pg/μL后,以10個稀釋濃度梯度為DNA模板進行PCR擴增。結果顯示,該PCR方法能檢測到的DNA質量濃度最低為0.298 pg/μL(圖3)。
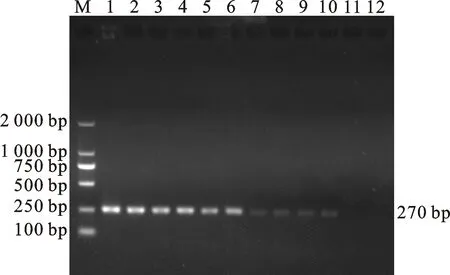
M. DNA 標準 DL 2000; 1~11. 捻轉血矛線蟲卵DNA質量濃度為116.529 ng/μL 、23.309 ng/μL、4.661 ng/μL、0.932 ng/μL、0.186 ng/μL、0.583 ng/μL、0.037 ng/μL、0.007 ng/μL、1.492 pg/μL、0.298 pg/μL、0.060 pg/μL;12. 空白對照
2.4 臨床樣品檢測
2.4.1 糞便樣品顯微鏡檢結果 120只奶山羊糞便樣品中共檢出捻轉血矛線蟲陽性29只(其中藍田縣、千陽縣和富平縣3 個某奶山羊場的陽性數分別為23、4和2),陽性檢出率為24.2%。
2.4.2 糞便樣品PCR檢測結果 120只奶山羊糞便DNA樣品中共檢出46只陽性樣品(其中藍田縣、千陽縣和富平3 個某奶山羊場的陽性數分別為38、5和3),陽性檢出率為38.3%。將46只奶山羊陽性糞便樣品的PCR產物測序后進行同源性檢索,結果顯示,與數據庫內收錄的捻轉血矛線蟲ITS2-28S 基因序列(MK300723.1)的相似度均為100%,由此判定,這46只奶山羊的糞便樣品為捻轉血矛線蟲感染陽性。
2.4.3 兩種檢測方法的結果比較 120只奶山羊糞便樣品經光學顯微鏡檢查檢出29只捻轉血矛線蟲陽性(其中2只經PCR檢測為陰性),而經PCR方法檢出46只陽性。經Kappa一致性檢驗顯示,兩種方法檢測結果之間存在一致性且一致性一般(Kappa=0.602,P<0.01);經配對卡方檢驗顯示,兩種方法檢測捻轉血矛線蟲卵陽性差異極顯著(P<0.01)。
3 討 論
PCR方法因其快速、高效、敏感和便捷等優點,在寄生蟲病原檢測及物種鑒定中發揮了重要的作用。核糖體DNA(rDNA)在真核生物中大量存在,且ITS2 rDNA序列因其具有低的種內變異性和高種間變異性,已經成為鑒定胃腸道線蟲的可靠遺傳工具[13-14],在線蟲新物種發現、種間鑒定和種群關系等方面具有重要意義。此外,28S 基因序列在物種內都非常保守,因此,可作為反向引物的合適設計位點[15]。本研究利用捻轉血矛線蟲ITS2-28S rDNA序列篩選設計了一對特異性引物,并通過優化PCR反應條件,建立了一種用于捻轉血矛線蟲的PCR檢測方法,該方法可以特異性地檢出捻轉血矛線蟲卵。
捻轉血矛線蟲感染羊,并在皺胃發育成熟后通過糞便向外排出蟲卵,甚至會排出死亡的蟲體或蟲體碎片,通過分子生物學方法檢測糞便當中的病原可以大大提高羊捻轉血矛線蟲病的檢出率。本研究選擇捻轉血矛線蟲ITS2-28S的基因片段為靶基因建立PCR檢測方法,在50 ℃~ 60 ℃的溫度梯度中均能成功擴增出270 bp的特異性單一條帶,且在退火溫度為53 ℃時電泳條帶最亮。選取羊易感的其他幾種胃腸道線蟲卵作為對照,結果顯示,僅捻轉血矛線蟲卵基因組DNA為陽性,其余線蟲卵DNA全部為陰性,表明所建立的PCR檢測方法特異性良好,可以有效避免受到其他常見病原的干擾。在最佳PCR反應條件下,通過對原始濃度的質粒DNA進行5倍比例稀釋分別作為DNA模板進行PCR擴增,最低可檢測到的DNA量為0.298 pg,說明該檢測方法具有較高的敏感性。此外,本研究建立的方法與Bott等[16]利用ITS2基因建立的Real-Time PCR方法檢測捻轉血矛線蟲的敏感性相當(0.1 pg),但由于Real-time PCR需要成本更高的設備與試劑,對檢測人員的專業素養要求也更高,因此,目前只適用于試驗研究,而在臨床診斷應用上受限。本研究建立的PCR方法與之相比,特異性和靈敏度相當,但成本更低。
本研究利用PCR方法對奶山羊的120只糞便樣品進行臨床檢測,同時與顯微鏡鏡檢結果進行對比發現,鏡檢和PCR方法檢測結果一致性一般(Kappa=0.602,P<0.01);PCR方法檢測糞便中陽性率為38.3%,明顯高于顯微鏡鏡檢結果的24.2%,且差異極顯著(P<0.01)。值得注意的是,本次有2只羊糞便樣品經鏡檢判定為捻轉血矛線蟲陽性,但經PCR檢測結果卻呈陰性,分析其原因,可能是檢驗人員在顯微鏡檢查時,誤將其他線蟲的蟲卵判定為捻轉血矛線蟲蟲卵,這也是在顯微鏡鏡檢時容易出現的失誤。綜上結果表明,本研究建立的捻轉血矛線蟲PCR鑒定方法具有較高的特異性和敏感度,并且在通過直接檢測糞便中捻轉血矛線蟲蟲卵來確定羊只感染情況時,較顯微鏡檢查更為準確,且不需要鏡檢后的糞便幼蟲培養進行進一步確診,更加省時省力,具有一定的臨床應用價值,為羊捻轉血矛線蟲病的臨床診斷提供了又一種可靠的技術選擇。

