腎素-血管緊張素-醛固酮系統檢測在醛固酮腺瘤中的診斷價值*
王來麗,宋洪斌,周 鋒△
(山東第一醫科大學第二附屬醫院:1.檢驗科;2.泌尿外科,山東 泰安 271000)
高血壓分為原發性高血壓和繼發性高血壓,原發性高血壓病因不明,繼發性高血壓常繼發于其他疾病,如內分泌性高血壓,其與體內激素分泌水平相關;血管的異常也可引起高血壓。原發性醛固酮增多癥是繼發性高血壓的主要原因之一,高血壓患者中原發性醛固酮增多癥發病率達5%~12%。腎素-血管緊張素-醛固酮系統(RAAS)影響水鹽代謝調節及血管收縮舒張,在高血壓發病中起著重要作用[1]。近年來,因檢查、檢驗診斷方法的改進,醫務人員對腎上腺相關高血壓的認識增強,特別是醛固酮腺瘤患病率呈明顯上升趨勢。本研究收集了本院泌尿外科住院治療的80例醛固酮腺瘤患者臨床資料,另選取 50例血壓正常健康者作為對照分析,旨在進一步提高醛固酮腺瘤的確診率,為該類患者的早期診斷、預防及治療提供依據。
1 資料與方法
1.1資料
1.1.1一般資料 選取2020年1 月至2021年11月本院泌尿外科住院治療的80例醛固酮腺瘤患者作為觀察組,同期選取 50例血壓正常的健康者作為對照組。患者或家屬簽署知情同意書,且經本院倫理委員會批準同意。2組研究對象一般資料比較見表1。

表1 2組研究對象一般資料比較
1.1.2觀察組納入標準 (1)影像學證明有腎上腺腺瘤,內分泌檢查醛固酮(ALD)、血漿ALD/血漿腎素活性(PRA)(ARR)證實為醛固酮腺瘤;(2)符合《中國高血壓防治指南2010》中高血壓的診斷標準;(3)入組前2周停用血管緊張素轉換酶抑制劑、血管緊張素Ⅱ(AngⅡ)受體拮抗劑及利尿劑等藥物。
1.1.3觀察組排除標準:(1)原發性高血壓;(2)合并心肺等器官功能障礙、惡性腫瘤、自身免疫性疾病等;(3)有酗酒史及藥物避孕史;(4)依從性差。
1.2方法
1.2.1研究方法 所有研究對象清晨6:00空腹臥位抽取靜脈血5 mL,然后采用站立位4 h,上午10:00 抽取立位血置于含有乙二胺四乙酸的抗凝管內,檢測血漿PRA、AngⅡ、ALD水平,試驗操作嚴格按照試劑盒說明書進行,計算ARR。
1.2.2觀察組治療方法 觀察組患者完善術前內分泌檢查,給予聯合應用降壓藥物,同時口服酚芐明擴張血管、補液擴容等治療。排除絕對手術禁忌,如急性腦梗死、心肌梗死、凝血功能障礙等。在氣管插管全身麻醉下行后腹腔鏡下腎上腺及腫瘤切除術。觀察組患者采用后腹腔鏡保留正常腎上腺手術或腎上腺全切術,醛固酮腺瘤多位于腎上腺的邊緣,多保留正常腎上腺;腺瘤切除困難,有惡性可能者則行腎上腺全切術。術后1周內復查相關指標。
1.2.3觀察指標 比較2組患者血漿PRA、AngⅡ、ALD 及 ARR水平。
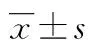
2 結 果
2.12組研究對象RAAS指標比較 觀察組患者血漿PRA較對照組顯著降低,血漿 AngⅡ、ALD及 ARR 較對照組顯著升高,差異均有統計學意義(P<0.05)。見表2。
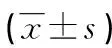
表2 2組研究對象RAAS指標比較
2.2觀察組患者手術前后RAAS指標比較 觀察組患者術前有低血鉀癥狀25例,術后低血鉀癥狀均得到改善。與術前比較,觀察組患者術后ALD水平明顯降低,腎素水平明顯升高,ARR明顯降低,差異均有統計學意義(P<0.05)。見表3。
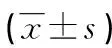
表3 觀察組患者手術前后RAAS指標比較
2.3觀察組患者治療結果及預后 觀察組80例患者腹腔鏡手術均順利完成,未發生嚴重的出血、感染、意外損傷、腎上腺危象等并發癥。術后病理證實為腎上腺腺瘤。術后隨訪3個月,65例醛固酮腺瘤患者停用口服降壓藥,10例患者減少口服降壓藥,僅有5例患者繼續原劑量口服降壓藥物。
3 討 論
腎上腺相關性高血壓發生率約占成人繼發性高血壓人群總數的20%,腎上腺增生或結節或腺瘤樣病變引起腎上腺皮質或髓質分泌升高血壓的激素或激素代謝產物過多所導致的繼發性高血壓。RAAS激活與腎上腺相關高血壓密切相關。正常生理狀態下,RAAS 是機體長期血壓調節的重要機制[2]。腎素是腎小球入球動脈的球旁細胞合成和分泌的蛋白水解酶,可水解肝臟所分泌的血管緊張素原,產生AngⅠ,AngⅠ在Ang轉換酶作用下,形成AngⅡ。AngⅡ可促進血管收縮,同時可刺激腎上腺皮質分泌ALD。ALD是一種類固醇激素,由腎上腺皮質球狀帶分泌,主要作用于腎臟,ALD可通過促進腎遠曲小管對鈉離子的重吸收來調控血壓,具有保鈉排鉀的功能。根據流行病學調查顯示,17%~23%的高血壓患者會并發原發性醛固酮增多癥[3]。MONTICONE等[4]在對1 672例高血壓患者的研究中,提示原醛占 5.9%,隨著高血壓程度的加重,原醛的總患病率增加,從1期高血壓的3.9% 增加到3期高血壓的11.8%。ALD促進鈉的重吸收,保鈉排鉀,促進交感神經遞質的分泌,升高血壓。ALD的大量分泌又可抑制腎素的分泌[5]。原發性醛固酮增多癥也被進一步分為不同的亞型,其中,分泌ALD的腺瘤是最常見的一種,占單側原發性醛固酮增多癥病例的絕大多數。產生ALD的彌漫性增生和產生醛固酮的小結節或結節是主要亞型[6]。醛固酮腺瘤患者表現為ALD水平升高,ALD抑制PRA,ARR 值明顯升高[7]。醛固酮腺瘤患者電解質紊亂的臨床表現主要包括低鉀血癥、低鈣血癥、高尿鉀、高尿鈣、低血磷及尿鎂排泄增多。血鈉與尿鈉的比值除以血鉀平方與尿鉀比值升高及鈣磷乘積下降也是典型原醛的綜合性電解質紊亂特征[8-9]。ALD可促進血管內皮的炎性反應,加速血管的纖維化[10],還會引起腎小動脈硬化,加重高血壓患者的靶器官腎臟及腦的損害[11]。心肌的纖維化可引起心室重構,血管壁增厚,大動脈順應性降低,心臟功能惡化,使組織傳導不均一,引發惡性心律失常,ALD水平過高時會誘發白細胞浸潤并會造成冠狀動脈損傷及心肌缺血性壞死[12]。有研究表明,低血PRA水平、高ARR值者心血管事件發生率較高血PRA水平、低ARR值者顯著增加[13]。與非原醛患者相比,醛固酮腺瘤患者更容易出現靶器官損害和心血管事件[14]。醛固酮腺瘤嚴重威脅患者生命健康,通過對RAAS相關指標的檢測可有效診斷醛固酮腺瘤。
本研究觀察組患者血漿 PRA水平較對照組顯著降低,血漿AngⅡ、ALD水平及ARR 較對照組明顯升高,血漿AngⅡ、ALD 水平及 ARR 隨著高血壓嚴重程度增加而顯著升高。血漿AngⅡ、ALD 水平的升高,提示RAAS的激活,且隨著惡性循環刺激,RAAS長期處于高活性狀態。有學者認為低血鉀是診斷醛固酮腺瘤的必要依據,在臨床醛固酮腺瘤患者中低血鉀發生率為9%~37%[15]。觀察組術前低血鉀患者占31.2%(25/80),術后低血鉀癥狀均緩解。低血鉀診斷醛固酮腺瘤缺乏敏感性和特異性,單純依靠低血鉀診斷醛固酮腺瘤意義有限[16-17]。而血漿AngⅡ、ALD 水平及ARR的升高更有助于診斷醛固酮腺瘤。
RAAS與醛固酮腺瘤相關高血壓密切相關,患者臨床表現大多為低PRA、高AngⅡ、高ALD,ARR升高可作為醛固酮腺瘤診斷的有效指標。我國醛固酮腺瘤患者以低腎素型居多,血漿 AngⅡ、ALD 水平的升高,RAAS高活性,ARR明顯升高[18]。所有ALD 水平升高的患者均進行腎上腺CT影像學檢查,并排除腎上腺惡性腫瘤。雙側腎上腺靜脈取樣診斷單側原發性醛固酮增多癥,如果確診,采用腹腔鏡腎上腺切除術[19]。這類疾病主要缺點是病例識別篩查率低,診斷挑戰性大,特別是腎上腺中央靜脈采血。因此,腎上腺中央靜脈采血對于疾病的診斷治療,預后比較關鍵[20]。醛固酮腺瘤首選治療是患側腎上腺切除術,隨著診療水平的提高,術前需給予糾正低鉀血癥、擴容等治療,通過微創手術腹腔鏡下腎上腺腫瘤切除術切除腫瘤,具有創傷小、恢復快等優勢[21]。AngⅡ、PRA、ALD、ARR 可作為醛固酮腺瘤診斷的有效指標,提高了診療效果[22],聯合檢測可有效指導醛固酮腺瘤的診斷治療。

