基于蛋白質半胱氨酸的活性蛋白表達譜分析
姜中堯,牛雅新,王楠,陳蓁蓁,唐波
山東師范大學化學化工與材料科學學院,分子與納米探針教育部重點實驗室,濟南 250014
1 活性蛋白表達譜分析(ABPP)
蛋白質作為細胞、組織的重要成分,是生命過程中生理功能的重要執行者和生命現象的直接體現者,對蛋白質功能活性的研究將有助于闡明其對生理或病理過程的調控機制。蛋白質組學能夠分析獲取生命過程中成千上萬種蛋白功能活性的信息,可以在大規模水平上鑒定蛋白質的表達水平、修飾水平、相互作用等。在后基因組時代,如何準確、快速地解析復雜生物體系內蛋白質的功能活性,揭示蛋白質參與生命活動的方式,了解這些功能活性的變化對生命過程產生的影響,已經成為蛋白質組學亟需解決的一個重要科學問題[1]。
半胱氨酸(Cysteine,Cys)是存在于多數蛋白質中頻次較低的氨基酸(1%–2%),但由于其側鏈巰基的化學活潑性使其展現出較強的內在活性,也成為多種蛋白質的功能活性位點[2]。蛋白質半胱氨酸殘基作為細胞內的還原性物質和與小分子介質作用的重要主體,對于維持和調控細胞內的氧化還原內環境起著重要作用[3]。它們參與調控細胞識別、信號轉導等多種生理過程,并與生物體內還原性物質變化的相關疾病有著密切的聯系[4]。此外,蛋白質半胱氨酸上的巰基對細胞內局部環境的變化很敏感,可以發生多種翻譯后修飾的類型[5],如硫巰化(S-sulfhydration,―SSH)、亞硝基化(S-nitrosylation,―SNO)、次磺酸化(S-sulfenylation,―SOH)、亞磺酸化(S-sulfinylation,―SO2H)、棕櫚酰化(S-palmitoylation)、異戊二烯化(S-prenylation)等(圖1)。這些翻譯后修飾能夠快速、動態地調控蛋白質的構型、活性,拓展生物體內蛋白質的功能多樣性,并能夠影響到人類許多重要疾病的發生發展。因此,對蛋白質半胱氨酸及其翻譯后修飾的研究具有十分重要的生物學意義,一直是持續不斷的科研熱點。
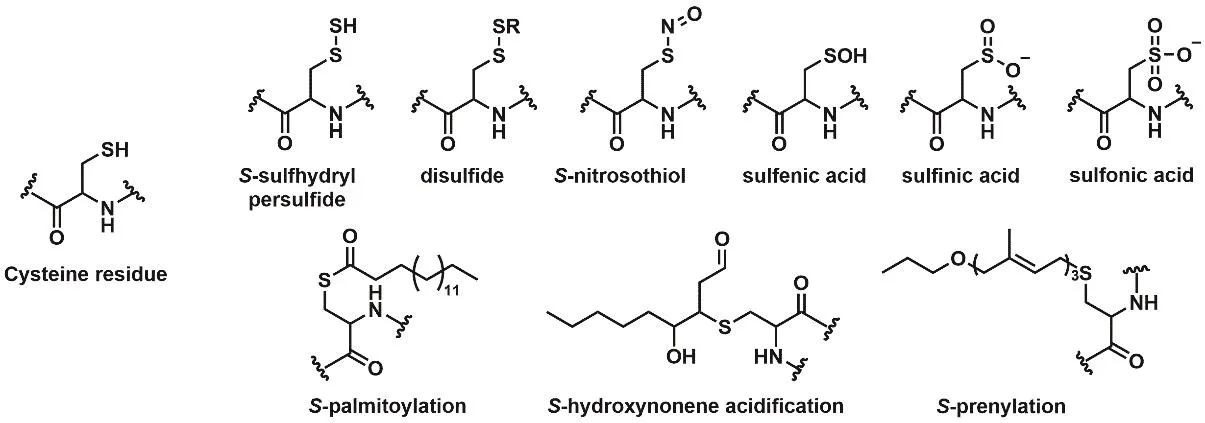
圖1 蛋白質半胱氨酸及其翻譯后修飾類型
近年來,質譜技術的迅速發展,為蛋白質研究提供了高通量、高靈敏和高分辨的分析平臺,并已成為研究蛋白質組學最具突破性、應用最廣泛的技術手段之一。利用不同化學探針對蛋白組中的活性位點進行標記,結合定量化學蛋白質組學的活性蛋白表達譜分析方法(ABPP)應運而生[6]。該方法致力于在復雜的生命體系中系統地鑒定某些具有特定功能的蛋白質分子(圖2),并且這些功能蛋白質的豐度往往不高,其他方法難以檢測。ABPP方法利用化學活性探針共價連接某些蛋白質中的氨基酸位點,進一步利用探針中的報告基團進行富集,用于凝膠電泳分析或質譜分析鑒定被化學探針標記的蛋白組分以及潛在功能位點,進而揭示它們的分子功能[7]。
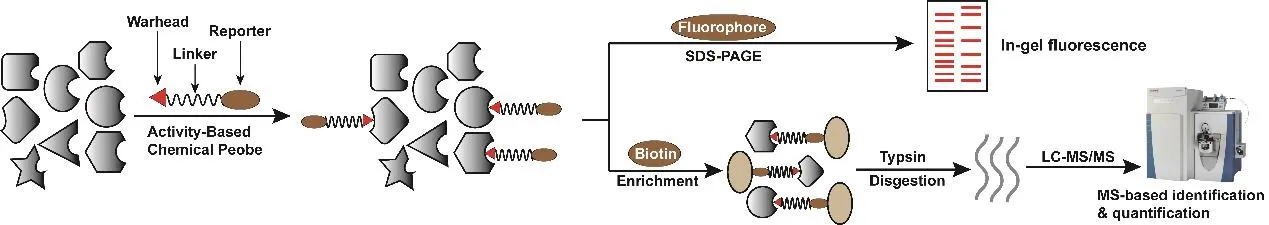
圖2 ABPP探針的結構以及用于蛋白質凝膠電泳分析與質譜檢測
近幾年,針對蛋白質半胱氨酸及其翻譯后修飾的ABPP方法的研究層出不窮。目前已有多種不同類型的化學探針被開發出來,用于捕獲蛋白質半胱氨酸及其翻譯后修飾的活性位點;同時研究人員也通過這些方法發現了一些蛋白質未被報道過的功能和翻譯后修飾類型,并對這些蛋白在體內發揮的作用有了更加深入的認識。本文將對近年來開展的基于蛋白質半胱氨酸及其翻譯后修飾的活性蛋白表達譜分析方法的進展情況進行綜述,詳細探討其作用原理、優缺點和應用范圍,并探討ABPP方法發展的走向及其未來可能的拓展應用。
2 針對蛋白質半胱氨酸的ABPP方法
2.1 IA-alkyne探針標記蛋白質半胱氨酸的isoTOP-ABPP
碘乙酰胺的炔基衍生化探針(IA-alkyne)是一種在ABPP中應用十分廣泛的親電小分子探針,其反應基團主要與蛋白質半胱氨酸殘基中的巰基共價交聯,標簽基團通過點擊反應偶聯熒光團或者生物素,進而對靶向的蛋白質進行可視化檢測與富集。同位素標記串聯正交水解酶-活性蛋白表達譜方法(isotopic tandem orthogonal proteolysis-ABPP,isoTOP-ABPP)是目前主要用于活性蛋白表達譜分析的定量方法,是一種在復雜的生物系統中直接探究蛋白質活性的開創性技術(圖3a)[8]。isoTOP-ABPP方法使用IA-alkyne探針標記蛋白質半胱氨酸進行定量化學蛋白組學分析主要包括以下步驟:(1) 用IA-alkyne處理細胞裂解物以標記活性半胱氨酸(圖3b);(2) 使用銅催化的疊氮-炔烴環加成反應(Copper-Catalyzed Azide-Alkyne Cycloaddition,CuAAC)將對照和實驗樣品中IA-alkyne標記的半胱氨酸蛋白與同位素化的可裂解生物素-疊氮化物標簽偶聯(圖3c);(3) 在鏈霉親和素珠上富集IA-alkyne標記的蛋白,然后進行胰酶消化,并進行linker切割以釋放IA-alkyne標記的肽;(4) 使用液相色譜-串聯質譜聯用技術(Liquid chromatography tandem-mass spectrometry,LC-MS/MS)分析所得的同位素標記的輕、重肽對,以輕重肽段的峰面積比值對兩個樣品的反應活性差異進行定量。
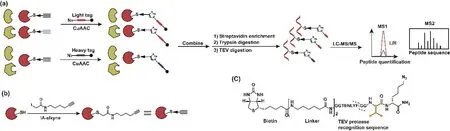
圖3 isoTOP-ABPP技術
2010年,Scripps研究所Benjamin F. Cravatt教授課題組利用不同濃度的IA-alkyne探針對生理條件下的蛋白組裂解液進行標記,通過isoTOP-ABPP方法(圖4)系統地分析了MCF-7等多種人類癌癥細胞系和小鼠組織的蛋白組內半胱氨酸的內在反應性,并發現半胱氨酸的內在反應活性與其功能具有非常明顯的關聯性[9]。該方法不僅可以對已知功能蛋白酶催化中心的半胱氨酸的活性進行監測,還發掘出一大批內在化學反應活性很高、功能尚待研究的半胱氨酸位點。基于之前的研究基礎,該課題組利用isoTOP-ABPP策略的位點特異性識別和定量能力,開發了一種競爭性的isoTOP-ABPP策略來鑒定脂質衍生親電試劑(lipid-derived electrophiles,LDEs)誘導的半胱氨酸修飾。LDEs能夠共價修飾蛋白質中的半胱氨酸,因此能夠與IA-alkyne探針進行競爭標記。LDEs對蛋白質中半胱氨酸的修飾程度最終通過isoTOP-ABPP策略的定量比值表示出來。研究人員通過幾組平行實驗的定量結果,精確地鑒定到了幾種LDEs修飾的半胱氨酸位點,并揭示出了一些對LDEs具有高反應活性的半胱氨酸殘基[10]。此外,該策略還被拓展到鑒定微生物衍生的活性代謝物二肽醛對蛋白組中半胱氨酸的修飾[11]。
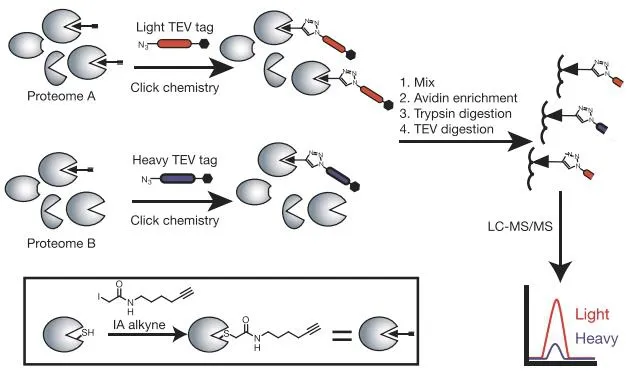
圖4 基于isoTOP-ABPP的方法測定蛋白質組中半胱氨酸反應活性[9]
值得注意的是,競爭性isoTOP-ABPP策略不僅可用于研究代謝產物對蛋白組中半胱氨酸的修飾,而且還可用于研究天然產物或共價藥物所修飾的半胱氨酸[12,13]。例如,Withaferin A是一種已知具有癌癥抗增殖活性的親電性天然產物。Grossman等人評估了Withaferin A的靶向蛋白組的反應活性,表明Withaferin A激活了腫瘤抑制酶磷酸酶PP2A[12]。Whitby等人通過isoTOP-ABPP方法研究了用肝毒性藥物如對乙酰氨基酚、曲格列酮、氯氮平和亞硝酸處理后,體內產生的反應性代謝產物對蛋白質組的標記[14]。同時該策略也被用來評估小分子片段庫中小分子標記半胱氨酸的反應活性,并從大量被認為不具有成藥性的蛋白質中發現了獨特標記位點,如Backus等人使用isoTOP-ABPP方法評估了包含氯乙酰胺和丙烯酰胺等親電基團的52個小分子對蛋白質半胱氨酸的反應活性[15]。
近些年,隨著生物質譜的飛速發展,研究人員在isoTOP-ABPP的基礎上融合了多種定量方法衍生出多種定量化學蛋白質組學策略用于鑒定蛋白質半胱氨酸活性,翻譯后修飾水平和藥物篩選等。如王初課題組結合穩定同位素二甲基化標記(stable isotope dimethyl labeling)開發了rd-TOPABPP策略[16]。楊靖等人利用一種碘乙酰胺類探針IMP結合iTRAQ (isobaric tags for relative and absolute quantification)標記定量法構建了多組分硫醇反應譜分析(multiplexed thiol reactivity profiling,MTRP)方法來鑒定一些親電天然產物的蛋白靶標[17]。Vinogradova等人利用脫硫生物素-碘乙酰胺探針(iodoacetamide-desthio-biotin,IA-DTB)結合串聯質譜標簽(Tandem mass tags,TMT)標記和三級質譜(MS3)定量模式繪制了人類初級T細胞中易受親電小分子共價修飾的蛋白質半胱氨酸圖譜[18]。這些新的定量化學蛋白質組學方法極大地擴展了針對蛋白質半胱氨酸的相關研究。
2.2 其他探針標記蛋白質半胱氨酸的ABPP
IA-alkyne探針標記蛋白質半胱氨酸的isoTOP-ABPP分析方法的局限性主要在于對細胞蛋白組半胱氨酸的覆蓋率較低。由于IA-alkyne探針本身和巰基反應類型的限制以及在isoTOP-ABPP策略中所使用的濃度(100 μmol?L?1)較低,導致在每次實驗中只能鑒定到蛋白組內的部分半胱氨酸。尤其是對低豐度蛋白質中的半胱氨酸殘基的標記的覆蓋率也會進一步降低,可能會限制isoTOP-ABPP在某些應用中的潛在用途。所以,人們又開發出一系列新的半胱氨酸反應活性親電試劑和分析方法來克服這些isoTOP-ABPP的局限性。
與IA-alkyne相比,光籠式溴代甲基酮(CBK)[19]和碘代甲基酮(CIK4)[20]顯示出較低的細胞毒性,并可通過對空間和時間的控制來分析活細胞中的半胱氨酸(圖5)。CBK被用來監測A431細胞在表皮生長因子(the epidermal growth factor,EGF)刺激下釋放活性氧時半胱氨酸反應性的變化。同時人們還開發了鹵代乙酰胺親電試劑的替代品,包括芳基鹵化物如對氯硝基苯RB2[21],和高價碘試劑如乙炔基苯并惡唑啉酮(JW-RF-010) (圖5)[22]。JW-RF-010在水中穩定,能夠在生理條件下對半胱氨酸進行烷基化,具有較高的化學選擇性。并且研究人員通過該探針成功地鑒定了姜黃素在HeLa細胞中的生物靶點,證明了其可作為與IA-alkyne探針標記結果互補的新型蛋白質半胱氨酸標記探針。近年來,研究人員還開發出能夠根據反應基團附近取代基的不同來調諧對蛋白質半胱氨酸的標記能力的探針。如Brent R. Martin教授課題組嘗試在苯并噻唑上修飾不同的取代基來探究是否能改良其反應活性,合成了一系列苯或砜上的取代衍生物。結果發現苯環的吸電子基團能夠使反應活性變強,而給電子基團則能夠減弱活性。隨后該課題組還利用兩種脫硫生物素化的探針(BT-desthiobiotin和IA-desthiobiotin)進行了HeLa細胞的活細胞標記,質譜檢測結果顯示兩者標記肽段僅有50%重疊,總共可標記約5000個獨立的半胱氨酸肽段,且對于Cys也有很強的選擇性[23]。Tokunaga等人利用雙環丁烷(BCB)的橋頭碳被親核試劑進攻時會發生開環的性質,設計合成了多種BCB類化合物,并應用化學蛋白質組學技術對BCB類型探針的反應特異性進行了評估。同時還通過對BCB類探針反應性的調節發現反應性較強的BCB酰胺可以用于半胱氨酸的廣譜標記,而較弱的BCB酰胺則適合進行共價抑制劑的開發[24]。近期還有課題組使用馬來酰亞胺激活的巰基反應探針(NPM)來探究位點特異性半胱氨酸反應性從超過800多個蛋白質中獲得了1500多個獨特的半胱氨酸位點的相對定量結果(圖5),提出了一種在氧化應激反應中測定半胱氨酸反應性的方法[25]。
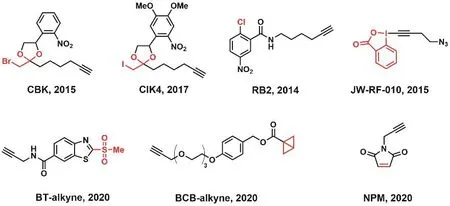
圖5 多種標記蛋白質半胱氨酸的ABPP探針
3 蛋白質半胱氨酸翻譯后修飾的ABPP方法
蛋白質翻譯后修飾(protein post-translational modifications,PTMs)是指一些基團通過酶或體內化學反應的方式被共價引入到蛋白質氨基酸側鏈或末端,它可以改變目標蛋白的物理化學性質,并導致結構變化、活性和蛋白間相互作用等,進一步促進了從基因組水平到蛋白質組復雜性的增加。因此,近些年科研人員開發了多種化學蛋白質組學的方法來對PTMs進行研究[26–28]。蛋白質半胱氨酸上的翻譯后修飾主要包括氧化還原依賴的修飾(redox dependent modification)、脂質修飾(lipidation)、脂質衍生親電分子修飾(LDEs)、其他代謝產物修飾等。其中氧化還原依賴的修飾主要通過兩種途徑實現,一是活性氧(reactive oxygen species,ROS)、活性氮(reactive nitrogen species,RNS)、活性硫(reactive sulfur species,RSS)介導半胱氨酸發生多種可逆修飾,如次磺酸化、亞磺酸化、亞硝基化、硫巰化等;二是利用復雜多樣的還原酶系統介導上述翻譯后修飾的還原,進而實現對諸多生物學進程與信號通路的精細調控[29]。脂質修飾主要是在相關酶的催化下將脂質分子轉移到蛋白質半胱氨酸上,如S-棕櫚酰化和S-異戊二烯化等。LDEs等是細胞代謝和脂質過氧化的產物,具有很高的生物反應活性,能與蛋白質半胱氨酸發生邁克爾加成反應,從而改變蛋白質的功能,甚至損傷細胞機制,如4-羥基壬烯醛(4-hydroxy-2-nonenal,HNE)修飾。除上述三種翻譯后修飾外,在細胞復雜的代謝過程中一些代謝產物也可能會與蛋白質巰基進行作用產生代謝產物修飾,比如衣康酸修飾、富馬酸修飾等。為了對這些種類豐富、形式多樣的蛋白質半胱氨酸翻譯后修飾進行研究,一系列用于組學鑒定、機制表征以及功能探究的定量化學蛋白質組技術相繼被開發出來。下面分別介紹針對蛋白質半胱氨酸翻譯后修飾的生物素置換、競爭標記、直接標記等不同方式的ABPP方法。
3.1 生物素置換法
蛋白質組學領域以生物素置換法(Biotin-Switch Assay,BSA)對蛋白質半胱氨酸翻譯后修飾進行檢測的應用較為廣泛(圖6a)。其工作流程一般是通過烷基化試劑如甲基硫代磺酸甲酯(S-Methyl Methanethiosulfonate,MMTS)封閉蛋白質中的游離半胱氨酸,再用選擇性試劑(如抗壞血酸)還原半胱氨酸翻譯后修飾基團產生新的半胱氨酸,然后用生物素化試劑如Pyridyldisulfide-biotin (Biotin-HPDP)標記新產生的半胱氨酸,之后將利用鏈霉親和素-生物素親和純化蛋白質,最后胰酶消化并進行質譜分析,得到修飾蛋白和位點信息。如Snyder, S. H.課題組在檢測半胱氨酸亞硝基化修飾時,先通過MMTS封閉游離半胱氨酸,之后用抗壞血酸還原亞硝基化半胱氨酸,使其還原后,將新形成的半胱氨酸與Biotin-HPDP反應,再檢測出發生亞硝基化修飾的蛋白質[30]。再如,硫化氫(H2S)作為信號分子氣體遞質,在心血管和神經系統中發揮著重要的調節作用,蛋白質半胱氨酸的過硫化修飾是將H2S信號轉化為生物反應的機制。Carroll, K. S.報道的檢測半胱氨酸過硫化修飾的研究中,蛋白質首先被MMTS烷基化,以封閉游離半胱氨酸,同時保留過硫化物。接著用Biotin-HPDP使過硫化物發生烷基化反應并形成蛋白質-生物素復合物以檢測過硫化修飾[31]。但是這類方法往往操作繁瑣,受多步反應的影響,富集效率較低;此外,內源性生物素化蛋白等可能會帶來背景干擾,而且富集材料的性質也會影響富集效果。
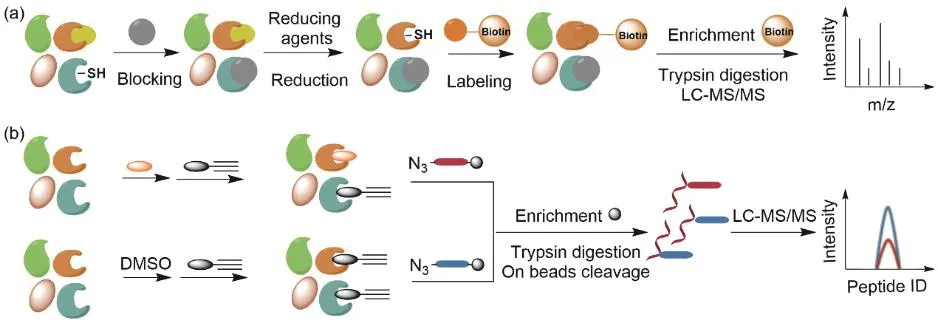
圖6 生物素轉換方式(a)和競爭標記方式(b)標記蛋白質的翻譯后修飾
3.2 競爭標記方式
蛋白質半胱氨酸發生翻譯后修飾后不會再被標記半胱氨酸的化學探針所標記,利用這種特性,可通過與化學探針“競爭”的方式,來間接反映特定蛋白質半胱氨酸位點上的修飾情況(圖6b)。最為經典的競爭標記方式是之前所介紹的競爭性isoTOP-ABPP策略。例如,富馬酸是一種與遺傳性平滑肌瘤病和腎細胞癌(hereditary leiomyomatosis and renal cell carcinoma,HLRCC)高度相關的腫瘤代謝產物,它可以通過邁克爾加成與蛋白質中的半胱氨酸共價反應。Meier, J. L課題組在富馬酸水合酶(fumarate hydratase,FH)突變的細胞模型中采用IA-alkyne競爭性isoTOP-ABPP方法,發現了對FH突變敏感的半胱氨酸[32]。衣康酸被認為是一種參與病原體-巨噬細胞界面的抗炎代謝產物。由于衣康酸弱的親電性,它可以修飾Kelch-like ECH-associated protein 1 (KEAP1)上的半胱氨酸和谷胱甘肽,從而發揮抗炎作用。但是,人們還尚未對巨噬細胞中衣康酸修飾的底物進行系統分析,這在很大程度上阻礙了對其在免疫反應中作用的理解。王初課題組和陳興課題組共同開發了一種特定的半胱氨酸反應性探針3,4,6-O-Ac3ManNAz (1-OH-Az),并通過競爭性的isoTOP-ABPP策略提供了其蛋白質組反應性的整體描述[33]。
3.3 直接標記方式
前面介紹的兩種檢測方法步驟比較繁瑣,耗時相對較長,最為重要的是這些方法不能更為真實、直接地獲得蛋白質半胱氨酸所發生的翻譯后修飾的信息。因此,利用化學活性探針與蛋白半胱氨酸翻譯后修飾位點直接進行作用,進行標記的方式應用越來越廣泛,以下介紹幾種利用該策略檢測蛋白質半胱氨酸翻譯后修飾的ABPP方法(圖7)。
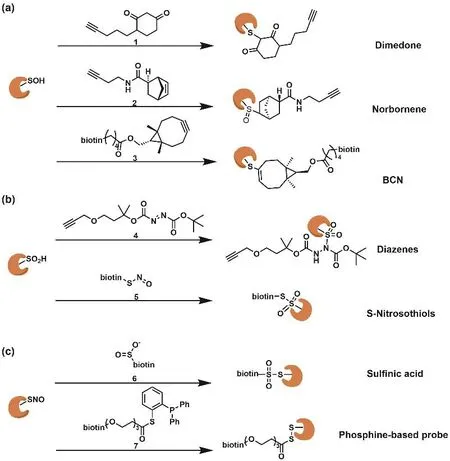
圖7 用于蛋白質半胱氨酸翻譯后修飾直接檢測的ABPP探針
次磺酸(RSOH)是氧化應激的重要生物標志物[34–36],它是半胱氨酸被過氧化氫氧化為亞磺酸、磺酸反應過程的中間體。目前用于蛋白質半胱氨酸的次磺酸化修飾檢測的探針有4-chloro-7-nitrobenzo-2-oxa-1,3-diazole (NBD-Cl)、環炔、二甲酮和降冰片烯等。Daniel C. Liebler課題組使用以雙甲酮為反應基團的ABPP探針1 (圖7a),選擇性標記了細胞中約1000個發生次磺酸化修飾的蛋白質[37]。受雙甲酮啟示,Carroll等人對各種以碳為中心的雙甲酮親核試劑進行了廣泛的研究,不斷提高它們與RSOH的反應速率,設計的五個化學探針(DYn-2,TD,PYD,PRD,BTD)共在761種蛋白質上發現了1283個―SOH位點[38]。Justin M. Chalker等人設計的降冰片烯衍生物探針2 (圖7a)一端帶有RSOH特異性響應的烯基基團,另一端帶有可進行點擊反應的炔基,用于探究蛋白質和活細胞中RSOH。與傳統的二甲酮試劑相比,該探針顯示出不同的反應活性和優越的化學選擇性,利用該探針發現的148個新―SOH蛋白促進了對于氧化還原信號和與氧化應激相關的疾病的研究與理解[39,40]。另外,S. Bruce King課題組提出的環炔烴可以與RSOH快速反應生成烯基亞砜加合物,環炔烴探針3 (圖7a)利用生物素進行免疫蛋白印跡驗證與RSOH的特異性響應,有助于發現未知的RSOH位點及其母蛋白[41]。
蛋白質半胱氨酸的亞磺酸化修飾(―SO2H)是活性氧進一步氧化RSOH為半胱氨酸亞磺酸(RSO2H)的產物,是由生理信號和氧化還原應激誘導的蛋白質天然發生的翻譯后修飾[42,43]。Carroll團隊設計了兩種基于與RSO2H形成穩定化合物的探針:一種是名為NO-Bio的亞硝基苯甲酸酯,另一種是名為Diazenes的含電子缺陷的二嗪探針4 (圖7b)[44–46]。后者具有優異的靈敏度和與質譜的兼容性,便于蛋白質RSO2H的位點定量分析。另外,基于RSO2H的親核性,Gregory R. J. Thatcher課題組根據亞磺酸與亞硝酸作用可以形成穩定的硫代磺酸鹽設計了含亞硝酸的探針5 (圖7b)和含亞磺酸的探針6 (圖7c)來分別研究蛋白質半胱氨酸的亞磺酸化和亞硝基化[47]。
蛋白質半胱氨酸的亞硝基化(―SNO)是一氧化氮作用于半胱氨酸殘基形成亞硝酸(RSNO)的過程,是介導一氧化氮生物活性的最重要的信號通路[48]。Tannenbaum等人將還原連接技術與生物素轉換策略相結合,利用一種基于磷化氫的ABPP探針7 (圖7c)直接檢測RSNO[49]。
3.4 含有生物正交基團的代謝標記方法
除了上述所說的三種標記方式,針對脂質修飾、脂質衍生親電分子修飾和其他代謝產物修飾等代謝標記,研究人員在原本的代謝物上引入正交基團合成相應的探針來對這些蛋白質半胱氨酸的翻譯后修飾進行研究。例如,蛋白質半胱氨酸的S-棕櫚酰化修飾(S-Palmitoylation),是16-碳飽和脂肪酸在S-酰基轉移酶的作用下通過硫酯鍵共價修飾到蛋白質半胱氨酸形成的動態可逆的脂質修飾,可增加蛋白質疏水性,調控蛋白質的結構功能等,在細胞信號轉導等方面發揮重要作用。Rami N.Hannoush課題組利用炔基棕櫚酸類似物代謝標記的方法,實現高通量的S-palmitoylation修飾蛋白質組的定性和定量研究[50]。蛋白質半胱氨酸的4-羥基壬烯酸修飾(S-HNE),由HNE和半胱氨酸發生邁克爾加成產生,能夠改變蛋白質的功能,甚至破壞細胞機制。Yang等利用一種含炔基HNE的類似物,利用輕重同位素選擇性標記HNE修飾的蛋白質,從RKO細胞中鑒定出386個含炔基HNE類似物的半胱氨酸的蛋白質[51]。另外,蛋白質異戊二烯化(S-Prenylation)也是一種半胱氨酸翻譯后修飾的脂質修飾類型,在細胞定位、信號傳導等方面發揮重要作用。Guillaume Charron等設計了炔基-法尼醇這類ABPP探針實現異戊二烯蛋白質組的分析[52]。在用競爭標記方法間接鑒定了衣康酸修飾的半胱氨酸位點后,王初課題組又開發了帶有炔基的新型衣康酸修飾探針工具,結合定量化學蛋白質組學技術,首次實現了炎癥巨噬細胞中衣康酸修飾半胱氨酸位點的大規模直接鑒定,并且進一步揭示了衣康酸對細胞程序性壞死過程的調節作用[53]。
3.5 蛋白質半胱氨酸翻譯后修飾的ABPP方法的比較
蛋白質半胱氨酸翻譯后修飾受到越來越多的關注,其分析方法層出不窮,各有千秋。利用生物素轉換方式的分析方法,能夠彌補翻譯后修飾形式探針缺乏或探針選擇性差的缺陷,間接得到修飾蛋白及其修飾位點信息,但這類方法操作繁瑣,富集效率受多步反應的影響,內源性生物素化蛋白等可能會造成背景干擾,而且富集材料的理化性質也會在很大程度上影響富集的效果。此外,基于半胱氨酸探針的競爭性標記技術已被廣泛應用于鑒定共價藥物和代謝物在蛋白質組中的半胱氨酸修飾位點,能夠最大程度地保持原代謝物的原有活性,可省去探針繁瑣的合成步驟。而利用成熟的商品化的探針間接地研究半胱氨酸翻譯后修飾原位標記,在受到背景標記影響的同時也會漏掉一些潛在的修飾靶點。探針直接標記翻譯后修飾位點的方法,可避免了耗時長且操作繁瑣的弊端,但要求探針高效專一。含有生物正交基團的代謝標記方法分析半胱氨酸上的修飾,能夠有效研究動態、可逆的修飾,減小對蛋白質的膜定位和下游信號傳導的干擾,但需要在代謝物上引入正交反應的基團并且在質譜分析過程中可能會產生中性丟失。因此,對于氧化還原依賴的修飾,設計相應的探針來對其進行直接標記檢測更能瞬時捕獲這些動態修飾,能夠最大程度地真實反映細胞在某些狀態下的氧化翻譯后修飾。對于脂質修飾、脂質衍生親電分子修飾和其他代謝產物修飾等代謝標記要根據特定的生物學問題或環境下來競爭標記或者含有生物正交基團的代謝標記方法,同時這兩種方法還可以同時應用,其結果相互補充,最大范圍內的鑒定出相應的修飾靶點。
4 總結與展望
蛋白質半胱氨酸及其各種翻譯后修飾形式在蛋白質功能的發揮中扮演著十分重要的角色,因此對它們的研究熱度一直居高不下。近些年,隨著生物質譜的更新換代和各學科間的交叉融合,化學蛋白質組學技術也被推上了新的高度。在諸多化學生物學方法中,ABPP技術因其是借助化學小分子從功能角度直接切入蛋白質組的研究,能夠直接對蛋白質組中感興趣的靶蛋白的活性進行檢測而得到很多化學生物學研究者的青睞。本文介紹了一些針對蛋白質半胱氨酸及其翻譯后修飾研究的代表性ABPP技術和分析策略,盡管它們各有長短,但都可作為相互補充的方法。研究人員應該根據研究對象所處的具體環境來選擇合適的技術來開展相關的研究,尤其是要選擇合適的蛋白組定量方法,才能盡可能地避免樣品制備過程中所帶來的誤差。面向未來,針對蛋白質半胱氨酸及其翻譯后修飾的ABPP技術的研究除繼續開發更為高效的探針與富集技術,以及更靈敏的質譜檢測方法外,還要更加針對具體的生物學問題、圍繞需求來發展,比如開發能夠在活細胞內靶向(亞)細胞器中蛋白質半胱氨酸及其翻譯后修飾的化學探針、將質譜的蛋白定量信息轉化為所需研究結果等。ABPP技術將繼續探索復雜生物系統中更多蛋白質半胱氨酸及其翻譯后修飾類型的蛋白靶點,以研究和闡明蛋白質半胱氨酸在生物學功能中的調節機制,深入挖掘這些蛋白靶點作為藥物治療靶標的潛力,為疾病治療提供重要的理論基礎。

