從學科發展史設計周環反應的課堂教學
馬忠華,項勇剛,曹秀芳,馬濟美
華中農業大學理學院,武漢 430070
有機化學基于電子分布和空間結構認知化合物,探究反應機理,進而闡述不同類別反應的特征和應用。電子的重新分布導致共價鍵可能發生異裂或均裂,對應則發生電荷反應或自由基的變化。周環反應的電子變化規律有所不同,它的基本理論認為,反應通過環狀過渡態協同進行,一步同時完成多個鍵的斷裂與生成,不能局限于從電子分布對價鍵變化進行描述,需要考慮軌道空間結構和能級,這無疑會加大教與學的難度。教學中一般注重于闡述周環反應的理論邏輯,內容容易顯得“骨感”。初學者難以將理論與實踐關聯起來,往往產生“能干什么”的困惑,這不利于學習接受新的理論。本文探究在教學中,如何幫助學生理解周環反應在有機反應中的地位,對周環反應發展歷史中的典型案例進行重構,結合基本知識點與歷史背景,提升學生學習興趣,讓學生辯證地認識理論和實踐在化學學科發展中相互促進、不可或缺的作用。
1 周環反應對認知學科發展的意義
有機化學是在研究生命活動現象、變化規律和物質性質的實踐中最早形成的學科分支之一,側重于指向實踐性的問題,為研究生命運動的規律提供必備的基礎知識與實踐條件[1],早期的化學學科極度注重“經驗性”知識。
周環反應理論,最具代表性的是在20世紀50–60年代形成的福井謙一(K. Fukui)的前線軌道理論和霍夫曼(R. Hoffmann)的軌道對稱守恒原理。量子力學理論被引入化學,解釋和指導研究復雜的化學變化,促使化學學科向“非經驗性”轉變,是現代有機化學發展史上的一個里程碑[2,3]。這兩個理論深受早期的有機電子學說(價鍵理論和分子軌道理論)的影響。尤其價鍵理論,在我們現在有機化學課程的各章節內容中,仍然被廣泛用于對官能團性質和化學反應的探究。前線軌道理論和軌道對稱守恒原理,使化學工作者無需經過復雜的理論計算,即能解釋主體選擇性等奇妙現象,預測復雜多環骨架的生物活性分子的合成機理。
因此,不同于按照官能團劃分的其他章節,周環反應的教學內容,呈現的是新的理論體系。這個體系是在有機電子學說基礎上的發展和創新,更接近于反應的本質,從這一點來說,周環反應內容傳遞給學生的信息是學科發展的軌跡和新的高度。
2 周環反應的基本教學內容和難點
2.1 基本教學內容
周環反應的教學內容主要涉及電環化、環加成和σ-遷移三類反應的選擇規則,如表1所示。前面章節中介紹過的雙烯合成反應屬于典型的一類環加成,這對學生本章節認知周環反應有利。本校基礎有機化學教學側重于環加成與電環化反應,對σ-遷移反應進行簡要介紹。
2.2 教學難點
前線軌道理論和軌道對稱守恒原理(表1)突破了有機電子學說中電子密度的局限,把分子軌道理論推到一個新的高度。如何簡要、準確、生動闡述軌道對稱守恒要點,是教學最大的難點。

表1 周環反應的選擇規則
周環反應理論具有強大的預測能力,前線軌道理論和軌道對稱守恒原理使復雜生物分子的“非經驗化”化學合成成為可能。如何將復雜實例簡化,幫助學生抓住周環反應選擇性規律的要點,認知其對于科學研究的現實意義,也是教學中要解決的難題。
3 教學處理與設計
我們主要通過化學史挖掘,將科學家的開創性研究進行改編,使其適用于課堂教學,結合“故事”,使“骨感”的理論與實踐緊密結合,豐富課堂形式,同時對學生進行科學意識的熏陶和培養。
3.1 結合發展史引入新理論
我們首先對福井謙一提出前線軌道理論的史實進行教學還原。文獻報道[3,4],福井謙一善于在紛繁復雜的化學變化中,對反應內在的奧秘進行邏輯推理,不推崇經驗性的性質總結。這種思想,與當時化學發展的趨勢相契合。福井謙一敏銳地捕捉到萘的芳香取代反應中的矛盾點:帶有相反電荷的兩種試劑,分別與萘發生取代反應時,在環上取代的位置相同(圖1)。這單純從電子效應是無法解釋的,因為萘的不同位置電子密度明顯存在差異。硝基的親電取代發生在1-和5-位的話,氨基的親核取代理應發生在2-位。福井謙一以此為突破點,提出模型,發展出前線軌道理論,先后在1952和1954年[5,6],預測了萘的硝化反應和氨基化反應的產物選擇性,都主要發生在1,5-位,與實驗結果一致[7]。
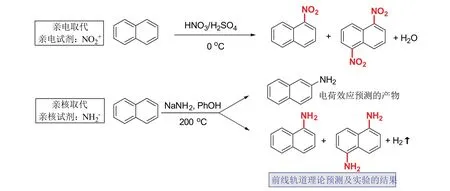
圖1 福井謙一對萘的硝化與氨化的理論預測及實驗結果對比
我們以此為背景進行教學設計,讓學生意識到,本章節的內容將不同于價鍵理論,新理論將探究電荷效應之外的其他因素。我們結合教材和文獻內容[8],給出簡練的結果展示(圖1)。其中,硝化反應是已學知識點,引導學生向新內容過渡。氨基化反應一般不會出現在教材中,我們通過三個問題引導學生切入:① 萘上各個位置的電子云分布與苯是否一樣,完全平均化?② 考慮電荷效應,NH2?負離子與NO2+正離子在萘環上的取代位置會不會一樣?③ 實驗結果表明氨化和硝化在同樣的位置發生,該修改實驗結論還是理論要點?問題①在于溫故,問題②在于溫故后的“經驗”推理,問題③促進學生“思新”。教學中點出經驗推理與福井謙一理論預測結果的不同,將枯燥的理論以案例的形式初步展現,激發學生進一步學習的興趣,但并不進一步展開理論要點。
3.2 理論難點的教學處理
3.2.1 電環化
采用原子軌道同相/異相重疊的方法,對電環化反應新形成的σ軌道進行示意,是教材及教學普遍認可的做法。前線軌道的對稱守恒示意圖如表1所示,表中也給出“4n熱順光對,4n + 2熱對光順”的選擇定律。應用理論快速、準確對產物分子的立體選擇性進行預測,對“旋轉”時成環碳原子上的基團“走位”進行判斷,是學生頗為頭疼的問題。
我們對選律進行數字簡化處理,利用簡單的數學符號“+/?”,對體系進行標識。這里以關環的過程為例,基本做法如下:
① 線性共軛體系的雙鍵數為偶數,用“+”表示;反之,雙鍵數為奇數,用“?”表示。周環反應分為4n體系和4n + 2體系兩類(n是線性共軛體系的碳原子數),對應的雙鍵數分別為偶數2n和奇數2n + 1。
② 觀察線性共軛體系的一頭一尾兩端兩個雙鍵碳上的基團位置,兩個基團處于相同位置時,用“+”標識;相反,兩個基團處于相對(背)位置時,用“?”標識(圖2)。相對(背)指兩個基團分別位于各自的雙鍵延長線的左、右兩側(或上、下兩側),相同則指兩個基團均位于延長線的左邊或者右邊(或上、下方)。圖2中,以氫為例進行了標識,也可以對―CH3進行標識。
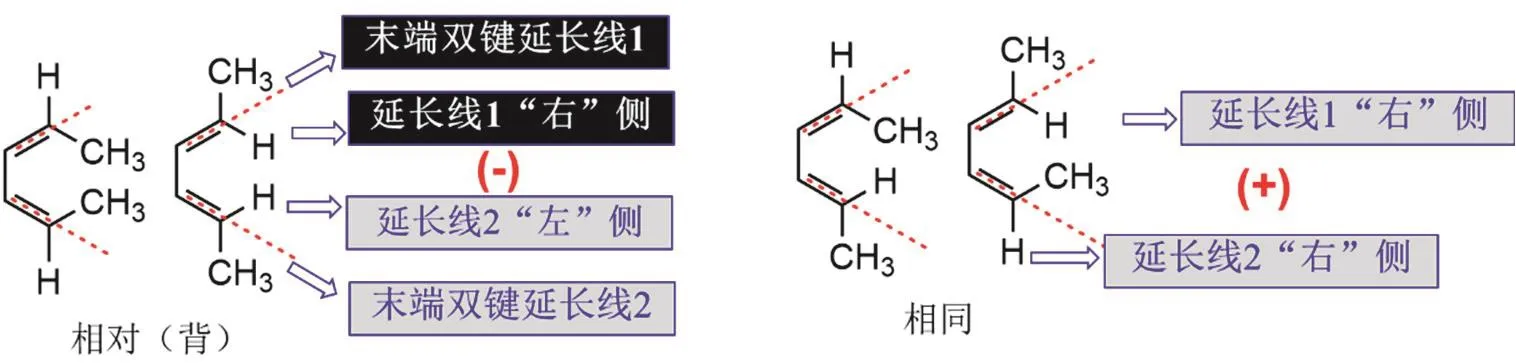
圖2 線性共軛體系末端雙鍵上官能團的簡化標識示意
③ 加熱條件用“+”表示(基態),光照條件用“?”表示(激發態)。
④ 綜合考慮上述①–③標識的三個正負號,利用數學中簡單的“負負得正”的符號運算的規律,最后為“+”,表示兩個考察的基團在產物中處于環同側(順式),為“?”則表示它們處于環的異側(反式)。
上面四條簡化的做法,學生可以利用最直觀的判斷,快速預測產物立體選擇性。這對于復雜分子的反應,更能體現出應用優勢。圖3所示是Havinga等1961年在研究維生素D時,預鈣化甾醇的關環產物的立體選擇性判斷[9]。預鈣化甾醇中,環化體系雙鍵數3,兩個末端雙鍵的兩個基團分別在延長線的左右兩側,條件為加熱,所以符號依次為“? ? +”,最終的符號運算結果為“+”,表示產物中,―CH3和―H這兩個考察對象,處在新形成的環的同側,同時向內(異焦鈣化甾醇)或者向外(焦鈣化甾醇)。

圖3 運用簡化標識的方法快速判斷復雜分子的環化反應立體選擇性
3.2.2 環加成與σ-遷移
環加成與σ-遷移的反應選律列于表1,標識的基本原則與電環化相同,具體如下:
環加成計算的雙鍵數包括兩個反應分子的雙鍵數的總和,雙鍵總數為奇數用“?”標識,總數為偶數用“+”標識;同樣地,“+”和“?”分別對應加熱和光照。不同的是,環加成涉及兩個反應分子的前線軌道,這與電環化只涉及單分子前線軌道有所不同,這一個不同之處,固定用“?”標識。最后同樣進行符號運算,結果“+”表示同面-同面加成允許,結果“?”表示同面-同面加成禁阻,據此快速判定產物立體選擇性。例如,經典的雙烯合成反應,底物雙鍵數分別為2和1,標識為“?”,加熱情況下(標識為“+”),符號運算為“+ ? ?”,結果為“+”,表示加熱時,雙烯合成是允許的(同面-同面加成允許)。
σ-遷移也是計算雙鍵總數后,分別用“+”和“?”標識偶數和奇數情況。σ-遷移可以看作近似于自由基軌道變化的協同反應,將自由基看作0.5個π鍵。例如,[1,3]-遷移為(1 + 3)/2 = 2個雙鍵,用“+”標識;[1,5]-和[3,3]-遷移為3個雙鍵,用“?”標識。與環加成類似,反應涉及兩個“分子”的前線軌道,用“?”標識。這樣,加熱條件下的[1,3]-遷移,用符號標識為“+ + ?”,運算結果為“?”,意味著[1,3]-遷移在加熱條件下,同面遷移禁阻。光照條件下的[1,3]-遷移則標識為“+ ? ?”,運算結果“+”,意味著同面遷移允許。同樣的方法可以快速判斷[1,5]-和[3,3]-遷移的結果。
這種快速的簡化處理的方法,對于應用周環反應的規則能提供方便,但教學中仍然需要根據實際情況,要求學生從前線軌道和分子軌道理論來進行理解,從而準確判斷產物的立體選擇性。
3.3 教學重點深化與拓展
周環反應的高立體選擇性是一個非常重要的特征,尤其是在具有多環骨架的生物活性分子的合成中,科學家經常推測通過周環反應途徑,實現相應的重要中間體或化合物的合成。
3.3.1 從Dewar苯實例強化軌道對稱性對立體選擇性的控制認識
在教學過程中,我們先從簡單的雙環[2.2.0]己-2,5-二烯(Dewar苯)與苯相互轉化的過程出發,強化學生對軌道對稱性的理解。文獻數據重構如圖4所示[10–12]。
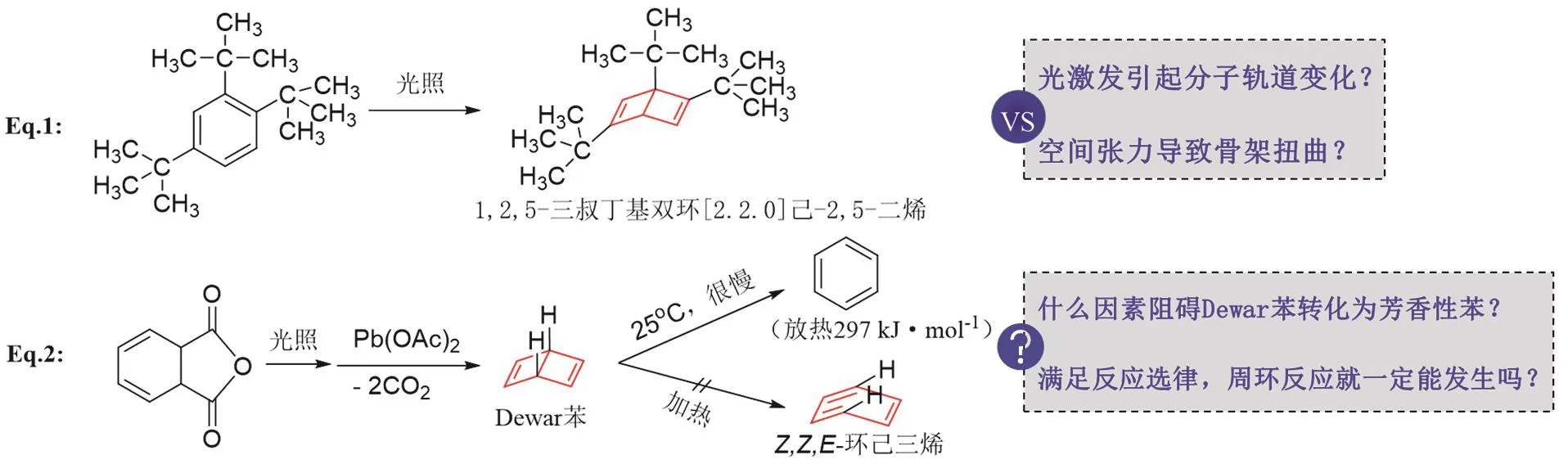
圖4 杜瓦苯及衍生物與苯骨架之間的轉化
教學中設計四個問題,逐步引導學生進行辯證思考:
(1) 反應式Eq. 1 (圖4)被報道于1962年[13],是由光照引發電環化反應,苯環骨架轉變為張力更大的雙環二烯結構(Dewar苯衍生物)。那么,究竟是叔丁基形成的空間張力導致苯環骨架的變化,還是光激發分子軌道變化導致電環化反應發生?能排除空間張力的影響嗎?
這個問題基于反應物中含有三個大體積的叔丁基,兩個處在鄰位,這很容易聯想到三個大基團的空間張力,可能造成苯環骨架扭曲,導致芳香性減弱。這樣,讓學生意識到,新的反應類型和理論,并不是與基本的化學變化規律不相關,仍然需要綜合考慮電荷效應、空間效應等影響到能量變化的因素。這是在知識層面引導學生新故結合,緩解新理論對學生心理的沖擊。
(2) 在問題(1)的基礎上,繼續設置第二個問題,“怎么證明光激發分子軌道變化是主要因素,引起電環化?”這個問題并不要求學生給出答案,旨在引導學生進行科學嚴謹的思考,培養學生的科研意識和思考習慣。
(3) 反應式Eq. 2 (圖4)初始報道于1963年,1971年有進一步的研究結果發表[13],是作者在Eq. 1基礎上的進一步工作,制備出簡單的Dewar苯,排除了大基團的空間張力效應,也是對問題(2)的解答。這是一個4n體系的光照電環化,產物中兩個氫原子處于順式,而且形成兩個含雙鍵的四元環。這個結構的穩定性明顯不如苯。結合熱力學的量化數據,從Dewar苯轉化為苯放熱約297 kJ?mol?1[12],這相當于C―Br鍵或Cl―H鍵的離解能,Dewar苯應該很容易轉化為苯。但是實際上,這個轉化在常溫下進行得極慢,兩天時間僅有50%轉化。那么,阻礙Dewar苯轉化為穩定的芳香苯的原因是什么?進而突出電環化選律的關鍵作用。
(4) 第4個問題是進一步的拓展,在教學中根據實際情況選用。反應式Eq. 2中,Dewar苯轉化為Z,Z,E-環己三烯是滿足電環化選律的,但是反應并不能發生,表明軌道對稱守恒的電環化過程不是影響反應進程的唯一因素。那么,周環反應的發生,除了滿足反應選律,還需要具備哪些條件呢?這可以引導學生辯證分析影響化學反應的因素。
3.3.2 從多環骨架的構建深化知識應用
教學中選用二苯乙烯這個代表性的實例[13],將對苯乙烯結構類比于己三烯衍生物,從簡單的鏈式底物過度到復雜的多環結構,深化學生對周環反應構建多環骨架的認識(圖5)。
制備馬兜鈴酸[14]等多環碳氫化合物是一個具體的例子,可以豐富學生對電環化反應構建多環骨架的認識(圖5)。圖3所示維生素D的研究,是通過己三烯電環化獲得多環骨架的另一個實例。
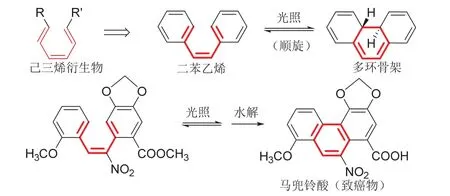
圖5 電環化反應從二苯乙烯衍生物構建多環骨架
環加成構建多環骨架的應用更為普遍,其中最有影響力的應該是現代有機合成之父Woodward合成維生素B12 (Vitamin B12,VB12)的工作[15]。其中構建B環前體(B’環)的過程使用SnCl4催化,后來被證明是一個周環反應,是一個典型的4 + 2過程。教學過程中對同面-同面的加成過程進行示意,如圖6所示。
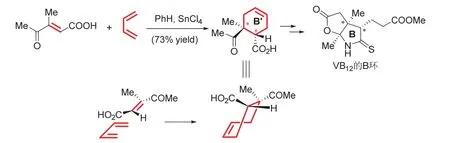
圖6 環加成制備VB12的B環前體及立體選擇性示意
環加成構成六元環,同時構成張力較大的三、四元或者七元環,在周環反應中也非常普遍。對張力環的有效構建,通過軌道對稱守恒進行解釋,對于學生理解立體選擇性很有幫助。圖4所示杜瓦苯骨架轉化,也是一個得到張力環的實例。另一個簡單的例子如圖7所示[16],是通過鏈狀前體分子內的4 + 2環化,得到含有七元環的雙環中間體,熱后轉化為倍半萜烯雪松烯。雙環中間體結構簡單,但是在制備七元環的同時精準控制環的立體化學結構,環加成表現出獨特的優勢,使反應能一步完成。
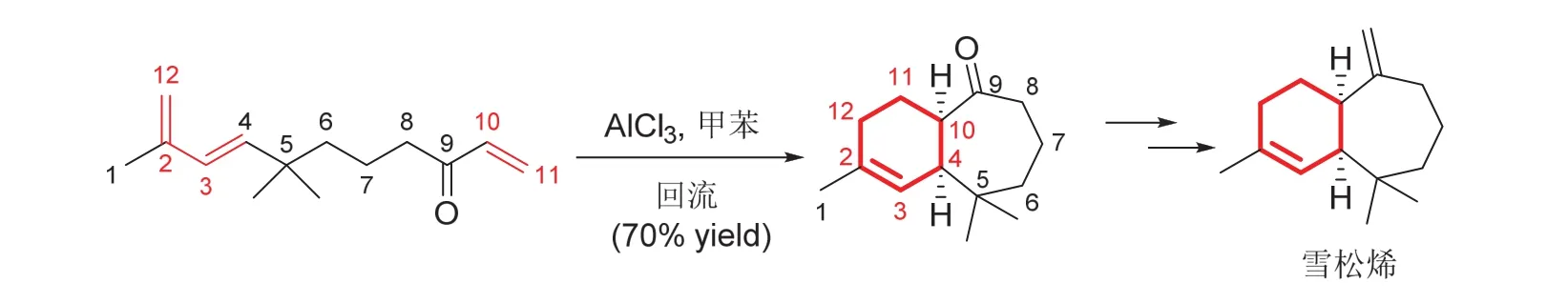
圖7 4 + 2環加成構成含張力環中間體(雪松烯的合成)
實際上,環加成構建多環骨架以合成天然產物分子的實例不勝枚舉,合成嗎啡的C環,甾族化合物D環前體(D’環)等,都是很好的實例,簡化的過程如圖8所示,可以在教學過程中,根據實際情況選擇使用。
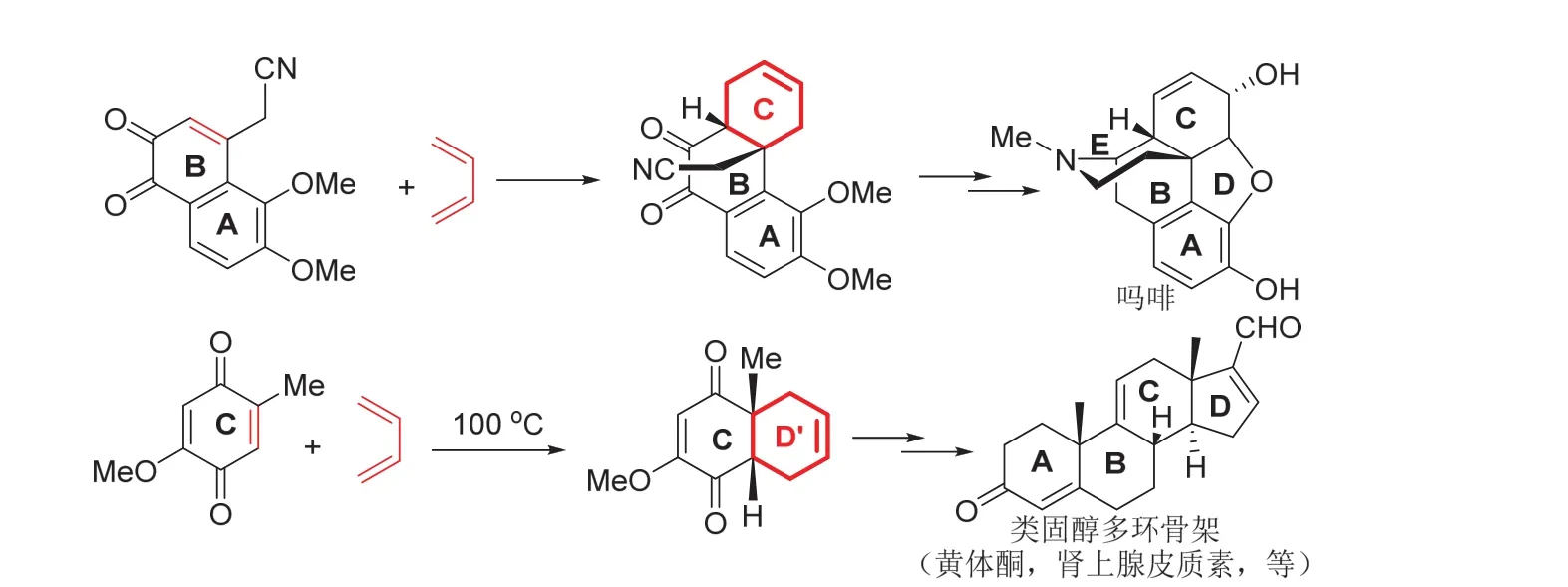
圖8 環加成制備多環骨架的實例(嗎啡和類固醇)
在對復雜結構的活性生物分子的舉例過程中,向學生傳遞兩個基本的信息:在化學方面,周環反應構建多環骨架是天然產物分子的全合成中重要的手段;在生物體內,這些復雜分子的產生是酶催化的生物反應,周環反應常被用于推測生物作用的機制。
4 思政元素的融合
作為一門自然學科,化學對求真、創新、協作的科學精神的培養是不可或缺的。周環反應的章節內容蘊含有豐富的思政元素[17],我們主要從以下幾個方面,將思政內容動態融合于全章節。
(1) 科學的質疑與求真精神。福井謙一敏銳捕捉萘的芳香取代反應中的矛盾點,發展前線軌道理論,以及杜瓦苯與Z,Z,E-環己三烯轉化的研究與發現,都是科學質疑精神的充分體現。杜瓦苯被鮑林假設為平面結構,并認定為苯的共振極限式。在這個權威理論的背景下,杜瓦苯及衍生物的成功制備,是不迷信權威、從實踐出真知的科學質疑精神的充分體現。
(2) 科學理論的重大進展促進學科發展。福井謙一的理論在早期并不受重視,但在Woodward應用他的理論,指導完成VB12的全合成之后,理論極大地推動了有機合成的發展,尤其在復雜結構天然產物分子的全合成方面,這對于探索生命活動的奧秘,具有現實意義。化學理論不僅僅是解釋實驗結果和事實,更能促進學科長足發展,進而促進社會經濟和文明的發展進步。因此,在學習有機化學的過程中,化學機理的學習是很有必要、很有意義的。
(3) 科學的協作與創新精神。Woodward組織了世界范圍內一百多個科學家團隊,分段進行VB12的重要片段的合成工作,歷經11年,最后完成全合成,得到這個含有9個手性中心的復雜分子,創造了“誘導不對稱”等合成策略。這個工作,是有機合成的案例寶庫,充分體現了科學的協作創新精神。
5 結語
結合化學發展史中的經典實例,梳理周環反應理論與實踐的發展脈絡,引導學生展開對周環反應實踐應用的思考、對學習反應機理必要性的思考、對化學“經驗性”和“理論性”的深層思考,有利于學生科學思維與創新意識的培養和發展,以及培養學生用理論指導實踐的創新意識。
同時,將復雜的多環化合物的合成案例適當簡化,使之適合于教學,促進學生在理解基本案例的基礎上,對更多復雜分子合成過程中的原理應用展開討論,對教學設計來說,也是具有挑戰性的。通過章節學習,培養學生實踐出真知的科學的實踐觀,理論指導實踐、學科交叉融合的科學的發展觀,從知識傳授、能力培養、價值引領三方面全面促進學生思維發展[18]。

