碳源、氮源和磷源對黃芩細胞懸浮培養的影響
楊 靜 陳 娜 崔曉雪
天津渤海職業技術學院環境與化工學院 天津 300042
黃芩是我國傳統中藥材之一,其次生代謝產物含量黃芩苷等具有清熱燥濕、消炎、抗病毒和抗菌等多種病理效用[1]。利用懸浮培養技術可以獲得高質量、高產量的黃芩替代品,具有次生代謝產物含量高、抗氧化活性較強的優點。近年來,國內對于植物細胞懸浮培養研究有較多報道。黃燕芬[2]等研究了碳氮磷營養對百蕊草懸浮培養細胞生長的影響。曲丹[3]考察了碳源對迷迭香懸浮培養細胞的生長、迷迭香酸積累及抗氧化酶活性的影響。本文通過考察黃芩細胞懸浮培養過程的碳源、氮源和磷源對黃芩細胞生長和黃芩苷產物合成的影響,為大規模利用黃芩懸浮培養細胞技術生產黃芩苷提供基礎數據和理論依據。
1 材料和方法
1.1 材料
黃芩種子購自河北省安國市藥材市場,黃芩苷對照品購自中國藥品生物制品檢定所;化學試劑均為分析純,購自國藥集團化學試劑有限公司。
1.2 儀器
TCYA ZYSA0351型搖床,202型電熱恒溫干燥箱,BCN-1360型超凈工作臺,Satorius BS 2202S型電子天平,UV-7500紫外分光光度計,HPG-280B強光照培養箱等。
1.3 方法
1.3.1 黃芩無菌苗的獲得
取飽滿的黃芩種子用75%的乙醇浸泡1min,用無菌水沖洗3次,在2%的次氯酸鈉溶液中進行表面消毒20min,再用無菌水沖洗5次。
將消毒滅菌的種子接種于添加0.2mg/L6-BA的MS培養基上,pH5.8,光照16h培養,4~5d種子萌發,20d后可得長勢良好的試管苗。
1.3.2 黃芩愈傷組織的誘導
取黃芩試管苗幼嫩莖段,用自來水沖洗干凈,75%的乙醇消毒30s,無菌水沖洗3次,切成0.5cm左右長的小段,接種于愈傷組織誘導培養基上培養。培養條件為MS培養基,附加有1.0mg/L6-BA、2.0mg/LNAA、3%蔗糖、1%瓊脂,pH5.8,培養條件為25±1℃,暗培養。培養大約6周后可得愈傷組織。
1.3.3 黃芩愈傷組織的增殖
挑選生長良好疏松的愈傷組織稱重后進行繼代培養,其培養條件同誘導培養基。繼代培養3次后獲得生長穩定、質地疏松的黃芩愈傷組織。
1.3.4 不同碳源種類對黃芩細胞懸浮培養的影響
將愈傷組織2g接種到250mL三角瓶中培養,三角瓶內含50mL液體培養基(MS+1.5mg/L6-BA+0.5mg/LNAA),培養基中分別添加3%蔗糖、3%果糖、3%葡萄糖、1.5%蔗糖+1.5%果糖,1.5%蔗糖+1.5%葡萄糖,1.5%果糖+1.5%葡萄糖。培養基pH5.8,搖床轉速120r/min,每組重復3~4瓶。
1.3.5 不同蔗糖質量濃度對黃芩細胞懸浮培養的影響
愈傷組織接種到1.3.4所述培養基中,培養基中添加2%、3%、4%、5%、6%的蔗糖。培養基的pH和搖床轉速如上,每組重復3~4瓶。培養20天后,分別測定培養過程中黃芩細胞懸浮系的生長環境、生物量及黃芩苷含量,重復試驗3次。
1.3.6 氮源對黃芩細胞培養的影響
愈傷組織接種到1.3.4所述培養基中,培養基中添加3%的蔗糖,原MS培養基中的NH4NO3用(NH4)2SO4代替,即KNO3提供硝態氮和(NH4)2SO4和銨態氮。設計MS培養基中其他基本成分及激素配比不變,固定氮源總量為60mmol·L-1改變,銨態氮與硝態氮的比例分別為0∶60、10∶50、20∶40、30∶30、40∶20、50∶10和60∶0。培養基的pH和搖床轉速如上,每組重復3~4瓶。
1.3.7 磷源對黃芩細胞培養的影響
愈傷組織接種到1.3.4所述培養基中,培養基中添加3%的蔗糖,同時向培養基中添加基本MS培養基1/2、1倍、2倍、4倍、8倍的KH2PO4。培養基的pH和搖床轉速如上,每組重復3~4瓶。
1.3.8 生物量的測定
取懸浮細胞液置于離心管中,轉速8000r/min,離心15min,棄去上清液,用蒸餾水洗滌細胞2~3次,棄去上清液,稱得到沉淀細胞質量,即為細胞鮮重,置于烘箱中60℃干燥7~8h以至恒重,稱其質量為細胞干重。干重增殖倍數=(收獲時細胞干重-接種時細胞干重)/接種時細胞干重。
1.3.9 黃芩苷含量測定
1.3.9.1 樣品溶液的制備
黃芩苷的提取在參照張進杰等[4]的方法,做出改進,將黃芪細胞培養物50℃下烘干至恒重,置于研缽內,研磨成粉末,取黃芩干細胞粉用95%乙醇超聲20min提取兩次,每次干細胞∶乙醇為1∶100(W∶V);將兩次混合提取液減壓濃縮至浸膏狀,用95%乙醇溶解定容至50mL備用。
1.3.9.2 黃芩苷含量測定
將制備好的溶液用紫外可見分光光度計在最大吸收波長278nm處測定吸光度A,根據標準曲線計算培養液中的黃芩苷含量。另取95%的分析乙醇作空白。
1.3.9.3 標準工作曲線的繪制
精密稱取0.0100g黃芩標準品,配制成100μg/mL黃芩苷標準品的乙醇溶液,用移液管分別移取0.5、1、1.5、2、2.5mL于5個10mL的容量瓶中,用95%的分析乙醇定容至刻度,充分搖勻,放置10min。以空白乙醇溶液為參比,在278nm處用紫外分光光度計測定其吸光度。以吸光度A為縱坐標、黃芩苷含量C(ug/mL)為橫坐標繪制標準工作曲線,曲線方程為A=0.5117C+0.0576,相關系數R2=0.9997。

圖1 黃芩苷標準曲線
2 結果與分析
2.1 不同種類碳源對黃芩細胞懸浮培養的影響
從表1中可以看出3%蔗糖為碳源時明顯有利于黃芩細胞的增殖,而以3%果糖為碳源時黃芩細胞合成的黃芩苷的含量達到了最高。綜合考慮細胞生長和經濟成本,選用蔗糖作為碳源。
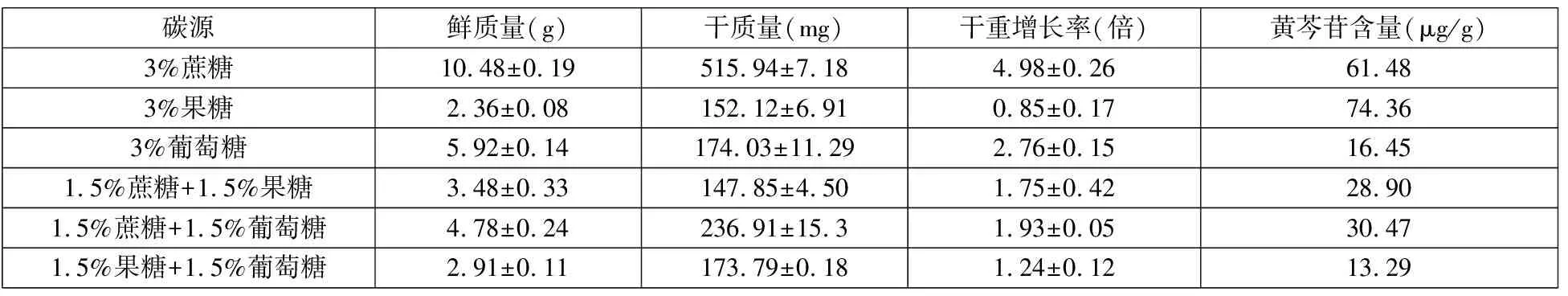
表1 不同碳源對黃芩細胞懸浮培養的影響
2.2 不同蔗糖濃度對黃芩細胞懸浮培養的影響
2.2.1 不同蔗糖濃度對黃芩細胞生長的影響

圖2 不同蔗糖濃度對黃芩細胞懸浮培養影響
如圖2所示,不同濃度蔗糖的培養條件下,隨培養時間增長,細胞干重逐漸增加,到20天的時候達到最大值,然后開始下降。添加3%蔗糖的培養基中細胞干重增長率最高,達到5.49。蔗糖濃度4%和5%相比,蔗糖濃度5%的黃芩細胞懸浮培養體系的生物量積累更穩定且在第20天時達到峰值。當添加蔗糖為6%時,培養20天時細胞干重增加較明顯,之后細胞干重下降不明顯,原因是培養基中仍有未消耗殆盡蔗糖。綜合分析,黃芩細胞培養最適合的蔗糖添加量是3%,當培養20天時可以得到最大干重產量。
2.2.2不同蔗糖濃度對黃芪苷合成的影響

圖3 不同蔗糖濃度對黃芩苷合成的影響
圖3為培養過程中黃芩苷合成的動力學曲線,結合圖2可以看出在培養周期內隨著黃芩細胞干重增加黃芩苷的合成也在逐漸增加,即黃芩細胞生長和次生代謝產物的合成存在一定的相關性。在20天的生長周期中,五個濃度的蔗糖細胞懸浮培養體系的黃芩苷合成趨勢是先緩慢穩定增加,然后迅速生長,直到生長周期的最后一天達到最高。在培養20天時,蔗糖濃度為3%的黃芩細胞懸浮體系的黃芩苷含量達到最高。
2.3 氮源對黃芩細胞培養的影響
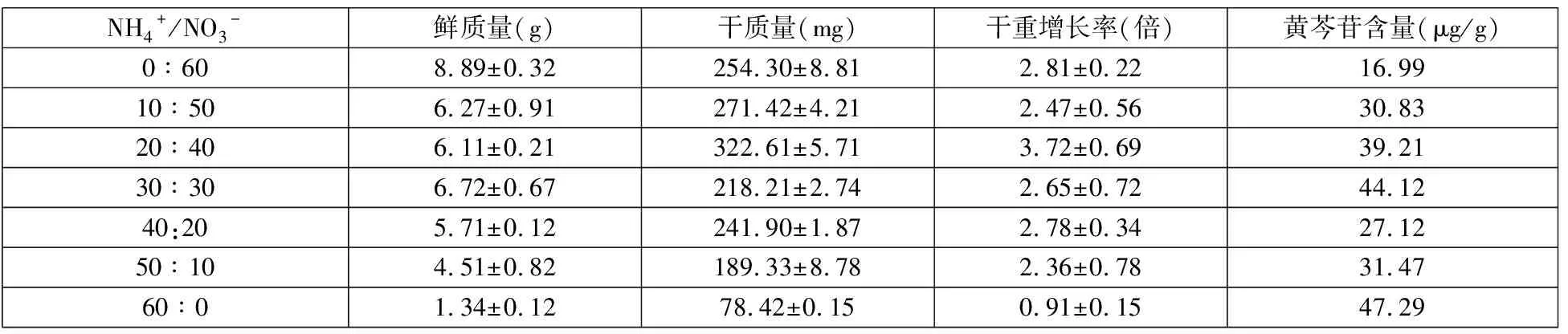
表2 氮源對黃芩細胞懸浮培養的影響
由表2可見不同的NH4+/NO3-對細胞生長量和黃芩苷成分含量均具有顯著的影響。較高比例的硝態氮有利于細胞生長量的積累,培養基里全部是硝態氮時,細胞鮮質量和干質量達到最大值,但此時黃芩苷含量相對較低。繼續增大NH4+/NO3-的比值,黃芩細胞鮮重和干重均在下降,當培養液中全部是NH4+時,黃芩細胞幾乎停止生長,而高濃度的硝態氮則更有利于黃芩類成分積累。當銨態氮為唯一氮源時細胞內黃芩苷含量達到最大值47.29μg/g。考慮細胞的生長和黃芩苷的合成,當NH4+/NO3-為30∶30時,細胞生長較好,黃芩苷含量較高。
2.4 磷源對黃芩細胞培養的影響
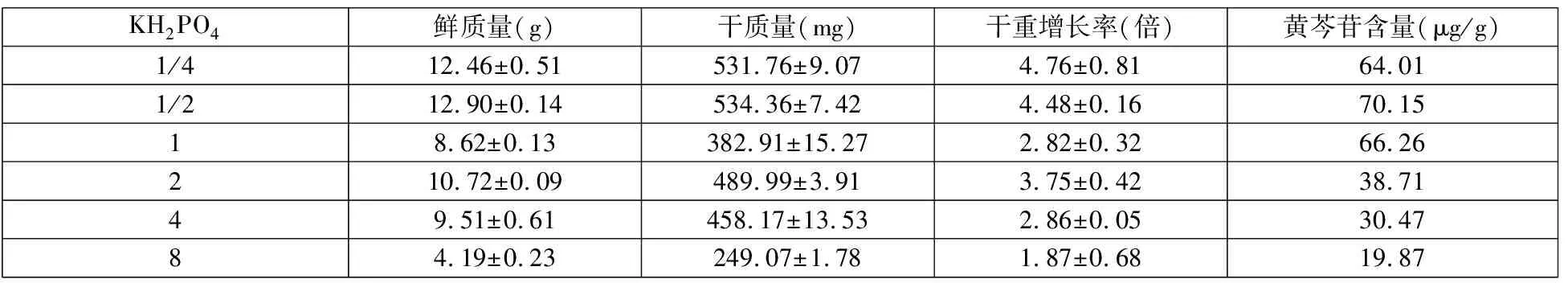
表3 磷源對黃芩細胞懸浮培養的影響
從表3中可以看到,KH2PO4的濃度的變化會影響黃芩細胞生長和黃芩苷的合成。當KH2PO4濃度增加到基本培養基1/2時,黃芩苷的合成量達到了最高。當KH2PO4濃度繼續升高時,黃芩苷的含量開始下降,可見高濃的KH2PO4會抑制黃芩苷的合成實驗表明,向培養基中添加基本MS培養基1/2倍的KH2PO4時,黃芩細胞生長量和黃芩苷合成達到最大。
3 結論
植物組織培養過程中一般是添加蔗糖、葡萄糖或果糖,其中以蔗糖最常用。岳建華等[5]采用蔗糖、葡萄糖和麥芽糖等碳源對早花百子蓮愈傷組織進行誘導,愈傷組織誘導率分別為86.00%、72.00%和59.67%。在研究秦艽細胞懸浮培養時發現,30g/L的蔗糖濃度有利于秦艽懸浮細胞的生長及龍膽苦苷積累[6]。可見,對于不同的植物,適合其生長和次生代謝產物積累的碳源種類和濃度也有較大差異。蔗糖除了為細胞懸浮系提供能量之外,還能夠誘導愈傷組織進行再分化,在植物細胞懸浮培養基中還具有滲透調節劑的作用。
氮植物細胞生長、發育及次生代謝物產生必不可少的營養物質,對懸浮細胞生長具有重要影響。研究發現,硝態氮和銨態氮比例為5∶1時,甘草細胞獲最大生物量,以銨態氮為氮源,黃酮類物質積累量最高[7]。高比例下的硝態氮有利于細胞生物量積累,高比例下銨態氮則有利于黃芩苷的合成,而過量銨態氮對細胞生長有抑制作用。這可能是培養基中較低濃度的銨鹽進入細胞會被及時代謝掉,銨態氮過量時會蓄積傷害細胞,從而影響細胞的生長。
磷是植物體內的核酸、核蛋白、磷脂和多種酶的組成成分,對次生代謝物的生物合成也有非常重要的作用。在太子參不定根培養中,低磷酸鹽濃度有利于生物量的產生,而高磷酸鹽濃度則能顯著提高太子參不定根培養中多糖的含量[8]。

