寬口裂腹魚尾鰭細胞系的建立及其應用
代金彩,李 麗,2,李學濤,魏 杰,聶竹蘭
( 1.塔里木大學 動物科學學院,新疆建設兵團塔里木畜牧科技重點實驗室,塔里木珍稀魚類研究中心,新疆 阿拉爾 843300; 2.塔里木大學 生命科學學院,新疆 阿拉爾 843300 )
寬口裂腹魚(Schizothoraxeurystomus)屬裂腹魚屬,又名寬口臀鱗魚[1-2],與其他裂腹魚比較其顯著特征為下顎有角質,主要分布于新疆阿克蘇河、木扎提河、克孜爾河、渭干河、葉爾羌河[3]。因人為活動干擾、環境變化、其自身繁殖力低下等影響,寬口裂腹魚的數量急劇減少。新疆維吾爾自治區擬將其列為保護魚類[4]。目前,寬口裂腹魚的研究主要集中在其種群生態學[5]、形態學[6]、生物學[7]等方面,還有少量關于其RNA及線粒體基因的研究[8],但關于其細胞培養系建立的研究尚未見報道。細胞培養技術是體外人工模擬體內環境,細胞經過大量培養成簡單的單細胞或極少分化的多細胞的技術。1962年建立了世界上第一株魚類細胞系——虹鱒(Oncorhynchusmykiss)性腺細胞系RTG-2[9]。1981年建立了我國第一個魚類細胞系——草魚(Ctenopharyngodonidellus)吻端組織細胞系[10]。目前,我國建立的魚類細胞系已超過70種,以淡水魚類細胞系為主[11]。魚類細胞系建立后可應用于病毒學、細胞生物學、環境毒理學等領域[12-13]。鰭條組織本身具有很強的再生能力,細胞遷出成功率高,同時取鰭條組織時無需將魚處死,因此有很多魚類細胞系建立都是來源于鰭條組織,如紅鰭東方鲀(Takifugurubripes)鰭細胞系[14]、石鰈(Kareiusbicoloratus)鰭細胞系[15]、大菱鲆(Scophthalmusmaximus)鰭條細胞系[16]、綠腹麗魚(Etroplussuratensis)尾鰭細胞系[17]。
水體中鹽堿度水平對魚類的存活有顯著的影響,鹽堿度過高或過低均會使魚類的存活率顯著降低[18-19]。在鹽度為20時,尼羅羅非魚(Oreochromisniloticus)僅少數個體能存活至96 h,堿度為12 g/L(以NaHCO3計)時,96 h全部死亡[20];鹽度為5.0~22.1時,小黃魚(Larimichthyspolyactis)10 d內存活率極高,隨著鹽度降低或者升高,小黃魚的存活率持續下降[21]。
筆者擬建立塔里木裂腹魚尾鰭組織細胞系,測定以NaCl模擬的鹽度和NaHCO3模擬的堿度對其相對增殖率的影響,以期為保護其種質資源及探究其耐鹽堿機理提供基礎數據。
1 材料與方法
1.1 試驗魚
2019年9月在克孜勒河采捕野生寬口裂腹魚,飼養于新疆建設兵團塔里木畜牧科技重點實驗室,取健康寬口裂腹魚,體質量92.88 g、全長18.54 cm。
1.2 試驗試劑
DME/F12、L-15、MEM、RPMI-1640、M199培養基購自Hyclone公司;胎牛血清購自Gibco公司;磷酸鹽緩沖液、青霉素-鏈霉素雙抗、二甲基亞砜購自Solarbio公司;臺盼藍和0.25%胰酶購自Biotopped公司;麻醉劑(MS-222)購自漁夫寶公司;基因組DNA提取試劑盒購自天根生化科技有限公司;其他化學試劑均為分析純。
1.3 試驗方法
1.3.1 原代培養與傳代培養
取寬口裂腹魚,注入0.1 μL/g的間氨基苯甲酸乙酯甲磺酸鹽進行麻醉。剪取上尾鰭,用75%乙醇清洗。取4個培養皿,其中1個培養皿中加75%乙醇,另3個培養皿均加入含有500 IU/mL的青霉素和500 μg/mL的鏈霉素的磷酸鹽緩沖液。剪取尾鰭鰭末端組織,放入75%的乙醇浸泡30 s后,依次放入另外3個培養皿中浸泡1 min。經處理的尾鰭組織放入2 mL無菌離心管中,用無菌眼科剪刀剪至1~2 mm3的組織碎塊。在已剪好的組織碎塊中加入0.25%胰酶溶液消化組織2 h,收集消化的組織離心,用磷酸鹽緩沖液沖洗3次。將消化的組織移入25 cm2細胞培養瓶,放入25 ℃的CO2培養箱中,觀察貼壁情況,過4 h后反相放置。6 h后,加入1 mL含20%胎牛血清、500 IU/mL青霉素、500 μg/mL鏈霉素的DME/F12培養液,正相放入25 ℃、5% CO2培養箱中進行培養。每日觀察組織生長的情況。2~3 d更換1次培養液,當細胞密度達106個/mL時按照1∶2進行傳代培養。第5代后,將培養液中的鏈霉素質量濃度、青霉素含量和胎牛血清體積分數分別調整為200 μg/mL、200 IU/mL和15%,第8代后,培養液換為含10%胎牛血清和1%青霉素-鏈霉素雙抗的DME/F12培養液。
1.3.2 細胞生長曲線
將一定密度的第10代細胞接種在24孔板上,分成8組,每組6孔,接種一定密度的細胞進行連續7 d的常規培養,用血球計數板進行計數,每日記為1組,分析數據并繪制細胞生長曲線。細胞生長曲線的縱坐標為每日計數的細胞平均數量,橫坐標為時間。根據下式計算出細胞的群體倍增時間[22]:
T=t×lg 2/lg (nt/n0)
式中,T為群體倍增時間,nt為細胞培養時間t后的細胞數,n0為接種細胞數。
1.3.3 細胞最佳生長條件的選擇
用傳至第6代的細胞。使用4種培養基DME/F12、L-15、MEM和RPMI-1640。設置20、25、30、37 ℃ 4個溫度梯度。設置0、10%、20%、25% 4個胎牛血清體積分數。分別在不同條件下培養0、24、48、72、96 h,用血球計數板對細胞進行計數,并繪制不同條件下細胞的生長曲線。
1.3.4 細胞凍存與復蘇
凍存:配制含20%磷酸鹽緩沖液、70% DME/F12和10%二甲基亞砜的細胞凍存液,置于4 ℃冰箱中進行預冷以備用。取生長旺盛的細胞,經離心去掉上清液,加入磷酸鹽緩沖液再次重懸,再次離心去掉上清液,重復操作3次。取沉淀并加入細胞凍存液,重懸,調整細胞密度至2.0×106個/mL,并轉至凍存管中。
復蘇:取凍存40、90和180 d的第6代細胞,于25 ℃水浴鍋快速解凍,操作臺內將細胞轉移至15 mL離心管,逐滴加入5倍體積的預冷培養液,懸浮細胞,離心棄上清液,加入磷酸鹽緩沖液重懸,再次離心棄上清液,重復3次。取適量細胞采用臺盼藍染色,進行細胞計數并計算存活率;加入10 mL培養液,置于25 ℃、5% CO2培養箱中培養,細胞復蘇36 h后需首次換液。
1.3.5 細胞污染與檢測鑒定
選用觀察法與PCR法檢測細胞是否被細菌、真菌、支原體污染。所用引物見表1。細菌、真菌的DNA模板為環境中細菌、真菌培養樣品提取所得,作為陽性對照組,支原體DNA模板為新疆生產建設兵團塔里木動物疫病診斷與防控工程實驗室贈予。PCR擴增細菌DNA,25.0 μL反應體系:12.5 μL 2×Taq PCR MasterMix,引物各1.0 μL,5.0 μL模板DNA,5.5 μL的滅菌超純水。PCR反應條件:95 ℃預變性3 min;95 ℃變性30 s,56 ℃退火30 s,72 ℃延伸30 s,循環35次。PCR擴增真菌DNA,25.0 μL反應體系:12.5 μL 2×Taq PCR MasterMix,引物各1.0 μL,5.0 μL模板DNA,5.5 μL的滅菌超純水。PCR反應條件:94 ℃預變性5 min;94 ℃變性1 min,50 ℃退火1 min,72 ℃延伸1 min,循環30次。PCR擴增支原體DNA,25.0 μL反應體系:12.5 μL 2×Taq PCR MasterMix,引物各1.0 μL,2.0 μL模板DNA,8.5 μL的滅菌超純水。PCR反應條件:94 ℃預變性10 min;94 ℃變性1 min,55 ℃退火30 s,72 ℃延伸1 min,循環34次。PCR擴增反應結束后,取8.0 μL PCR產物在1%瓊脂糖凝膠中進行電泳檢測。
表1 通用引物序列
1.3.6 細胞來源鑒定
用基因組DNA試劑盒提取寬口裂腹魚尾鰭細胞DNA。根據寬口裂腹魚線粒體16S rRNA設計引物(表2)。通過PCR擴增,50.0 μL反應體系:25.0 μL 2×Taq PCR MasterMix,引物各2.5 μL,5.0 μL模板DNA,15.0 μL的滅菌超純水。PCR反應條件:95 ℃預變性3 min;94 ℃變性30 s,48.9 ℃退火30 s,72 ℃延伸40 s,循環35次。PCR擴增反應結束后,取8 μL PCR產物在1%瓊脂糖凝膠中進行電泳檢測。PCR產物測序,比較并獲得與GenBank中已發表序列的一致率。

表2 16S rRNA基因的PCR擴增和序列引物
1.3.7 鹽堿度對寬口裂腹魚尾鰭細胞系相對增殖率的影響
以NaCl模擬鹽度環境,設置NaCl質量分數1‰、2‰、4‰、6‰、8‰和10‰ 6個梯度。稱取NaCl溶質加入DME/F12培養液溶解,溶解后溶液再用0.22 μm過濾篩過濾。
以NaHCO3模擬堿度環境,設置NaHCO3質量濃度2、3、4、5、6、7、8、10 g/L 8個梯度。稱取NaHCO3溶質加入DME/F12培養液溶解,溶解后溶液再用0.22 μm過濾篩過濾。
細胞鋪板:取第6代對數生長期的寬口裂腹魚尾鰭細胞系細胞用含體積分數為10%胎牛血清DME/F12培養液調整密度為1×104個/mL的細胞懸液,鋪置于96孔培養板上,每種材料鋪6孔。每孔加入100 μL細胞懸液,25 ℃、5% CO2培養箱培養12 h后。按分組分別加入不同含量鹽堿試劑,每孔20 μL,空白對照組不加試驗試劑為0,其他條件同試驗組。繼續培養24、48、72 h。之后將每個含液體孔加入噻唑藍20 μL后繼續培養4 h,小心吸出各孔內液體后每孔加入150 μL二甲基亞砜。搖床搖培養板20 min,酶聯免疫檢測儀490 nm波長條件下測定各孔光密度值[D(490 nm)]。細胞相對增殖率(R,%)的計算公式如下:
R=D(490 nm)試驗組/D(490 nm)對照組×100%
1.4 數據分析
SPSS 20軟件包對結果數據進行統計學分析,數據以平均值±標準差表示,多組間比較采用單因素方差分析,兩組間比較采用t檢驗,顯著性水平設為0.05。
2 結果與分析
2.1 寬口裂腹魚尾鰭細胞原代培養與傳代培養
每天觀察細胞瓶,第3天后,寬口裂腹魚的尾鰭組織塊周圍開始遷出細胞,由組織塊向周圍溢出;第6、12天細胞繼續遷出;第16天,細胞呈懸浮生長,當細胞密度約為106個/mL時按照1∶2進行傳代培養,每天觀察細胞生長狀況,生長速度較快(圖1)。

圖1 寬口裂腹魚尾鰭細胞原代培養
2.2 寬口裂腹魚尾鰭細胞生長曲線
繪制寬口裂腹魚尾鰭細胞生長曲線(圖2)。接種一定數量的細胞,在最適條件下生長,在1~4 d時細胞生長的速度較快,5~6 d時生長速度放緩趨于平穩,之后細胞數量下降。經計算,細胞群體倍增的時間為24.94 h。
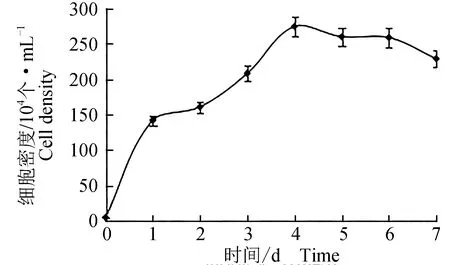
圖2 寬口裂腹魚尾鰭細胞生長曲線
2.3 寬口裂腹魚尾鰭細胞最佳生長條件
寬口裂腹魚尾鰭細胞在L-15、MEM、RPMI-1640和DME/F12培養基中同條件培養96 h。當培養基是MEM、RPMI-1640時,寬口裂腹魚尾鰭細胞基本不生長;在L-15培養基中,細胞進入指數期延遲;DME/F12培養基生長趨勢最好,最佳培養基為DME/F12。在溫度20、25、30 ℃下,細胞生長均比較好,25 ℃生長最好;當溫度升至37 ℃時,細胞生長狀態明顯的低于20、25、30 ℃下的生長狀態。 在體積分數0%、10%、20%、25%胎牛血清中同條件培養,除在0%的血清中生長較緩,在10%、20%和25%的血清中均生長較好,20%中生長最好(圖3)。
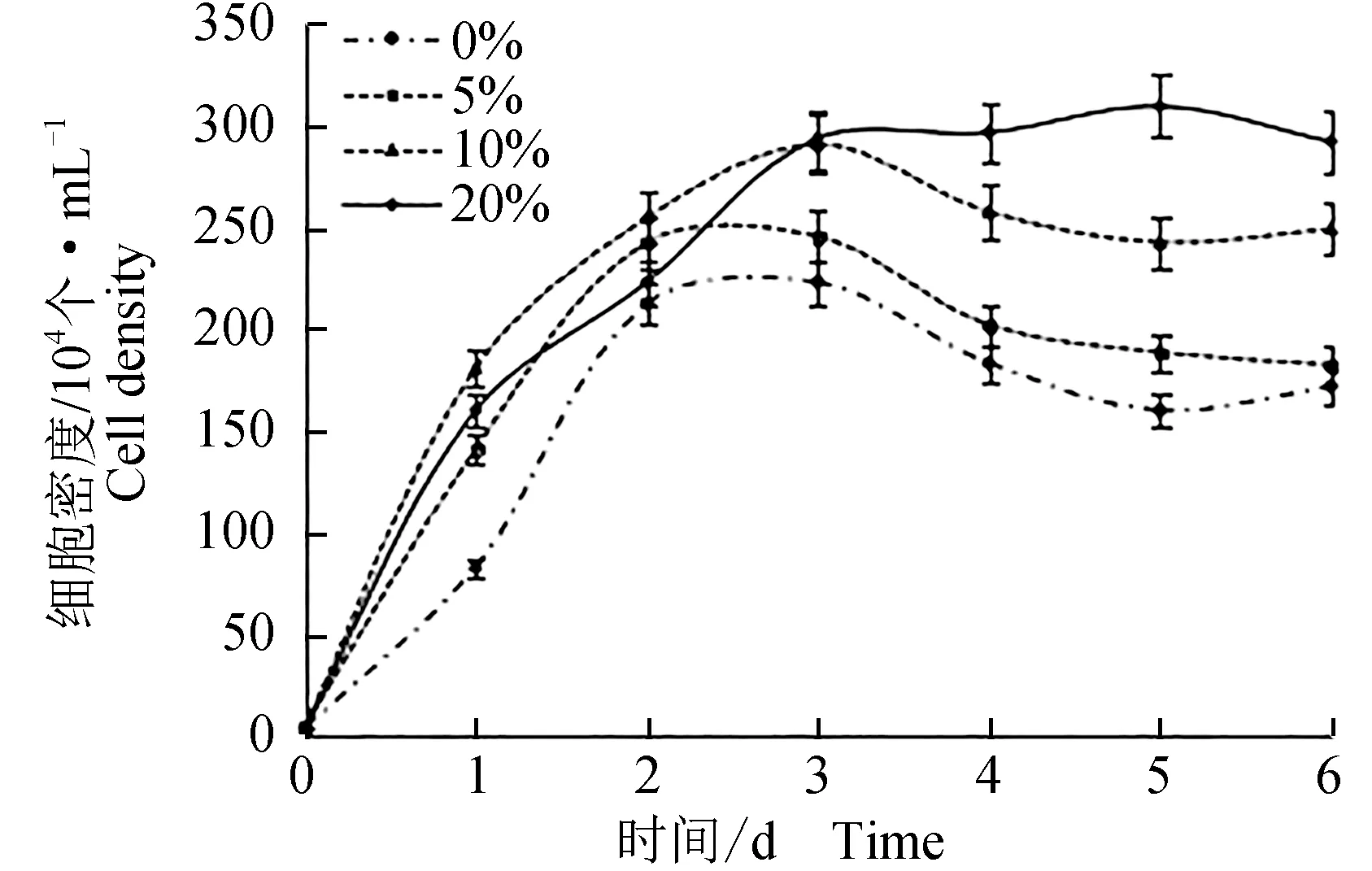
圖3 寬口裂腹魚尾鰭細胞生長的胎牛血清條件
2.4 寬口裂腹魚尾鰭細胞凍存與復蘇
寬口裂腹魚尾鰭細胞凍存復蘇后,經臺盼藍染色,進行細胞計數并計算存活率,重復10組取平均值。對第6代細胞液氮冷凍保存后,復蘇經臺盼藍染色并計數統計,180 d后復蘇存活率達(88.72±0.99)%(表3),90 d和180 d存活率差異不顯著(P>0.05)。180 d后細胞復蘇,細胞具有活性,且復蘇后增殖速度快(圖4),可正常傳代(圖5)。
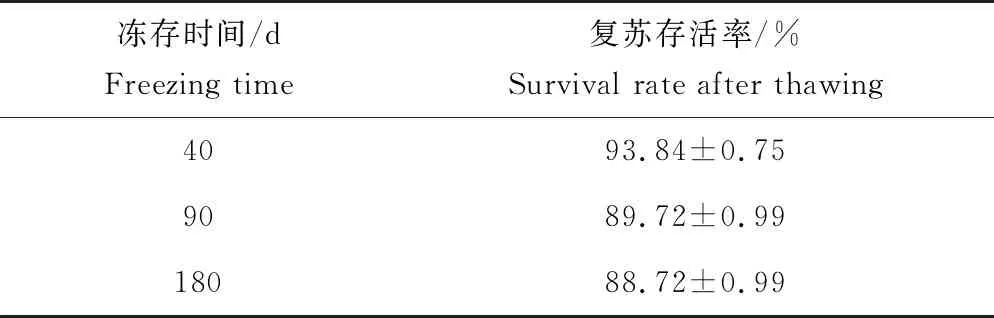
表3 凍存后復蘇的存活率
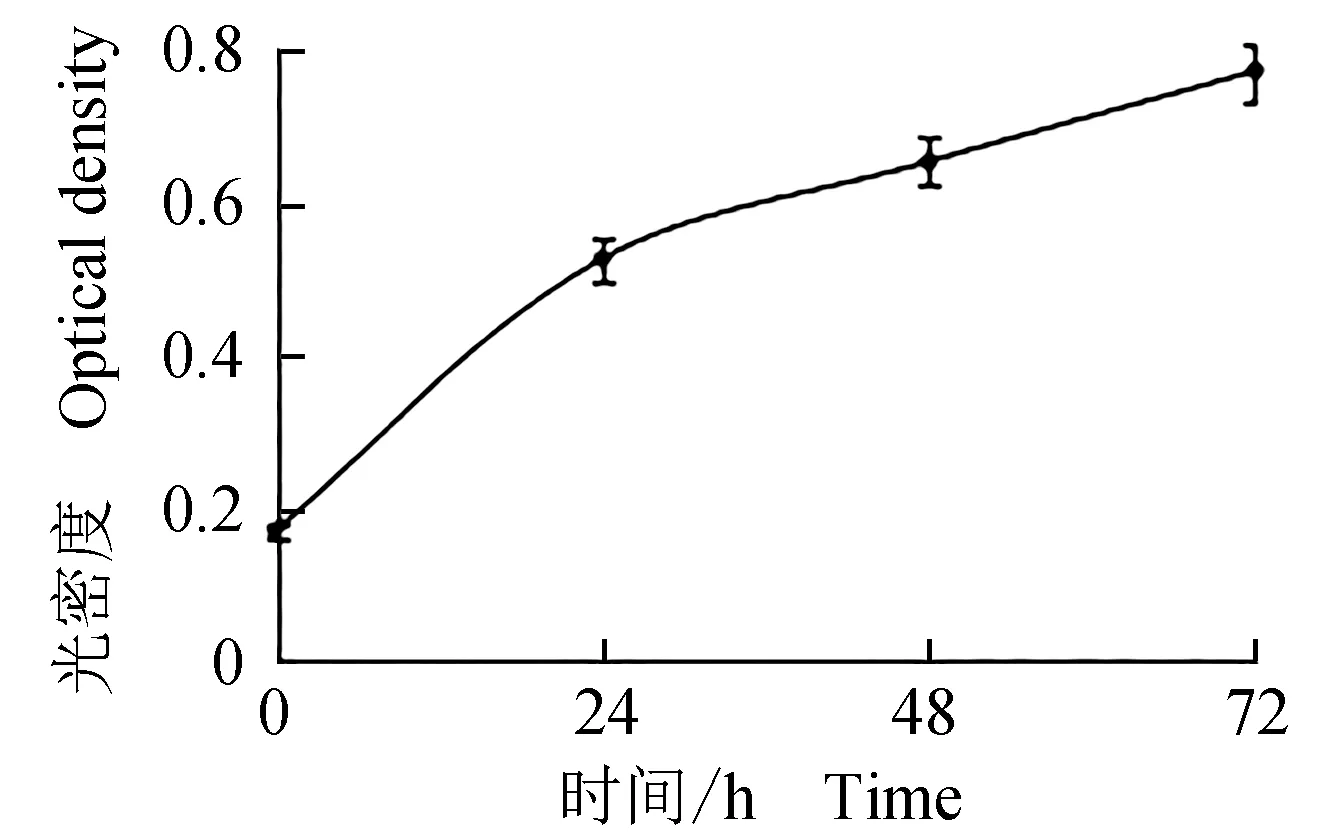
圖4 噻唑藍法測定復蘇細胞增殖

圖5 寬口裂腹魚尾鰭細胞復蘇培養
2.5 寬口裂腹魚尾鰭細胞污染與檢測鑒定
寬口裂腹魚尾鰭細胞中提取細菌、真菌、支原體DNA,經過PCR法鑒定細菌、真菌、支原體污染。1、3、6泳道分別為細菌、真菌、支原體PCR產物陽性對照,2、4、5泳道分別為尾鰭細胞中提取細菌、真菌、支原體的DNA進行PCR的產物,樣品均無與陽性對照組一致的條帶,表明樣品中無細菌、真菌、支原體,寬口裂腹魚尾鰭細胞未被污染(圖6)。
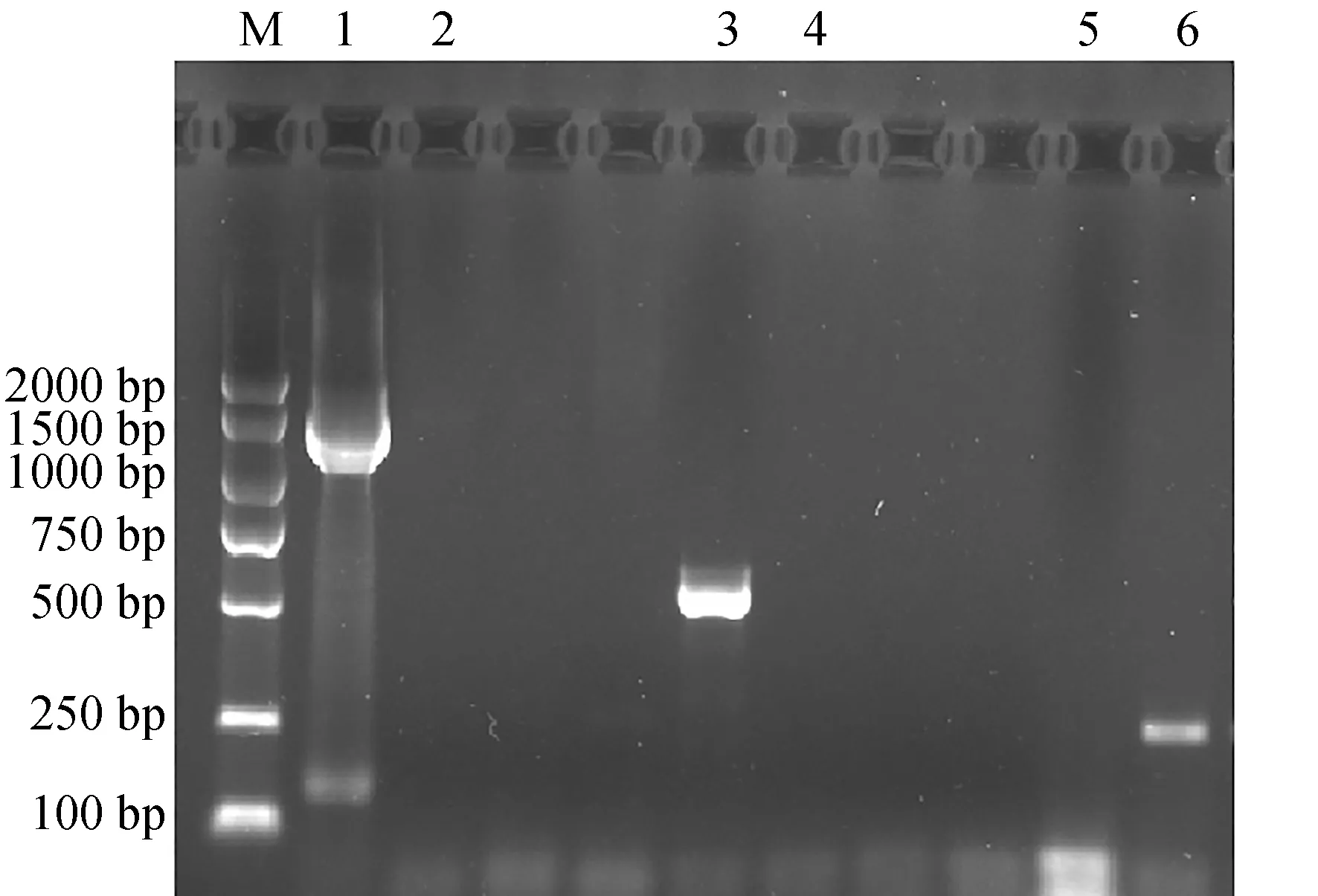
圖6 細菌、真菌、支原體PCR鑒定結果
2.6 寬口裂腹魚尾鰭細胞來源鑒定
基因組DNA試劑盒提取寬口裂腹魚尾鰭細胞DNA,經PCR擴增,在瓊脂糖凝膠中電泳檢測,PCR產物目的條帶大小符合16S rRNA的大小(圖7)。經測序后的序列片段與GenBank數據庫中的序列進行BLAST比對。尾鰭細胞同源性與GenBank中發布的寬口裂腹魚線粒體基因(NC036933.1)的序列達到99.91%的一致率,在第1522位點有1個位置發生突變(圖8)。

圖7 寬口裂腹魚尾鰭細胞16S rRNA基因PCR擴增產物

圖8 寬口裂腹魚尾鰭細胞系測序序列和寬口裂腹魚16S rRNA序列(NC036933.1)比對分析
2.7 噻唑藍法檢測不同鹽質量分數下的細胞增殖情況
2.7.1 NaCl質量分數對寬口裂腹魚尾鰭細胞增殖的影響
在NaCl質量分數一致情況下,寬口裂腹魚尾鰭細胞系的相對增殖率隨時間延長而下降,由此可知,NaCl質量分數對寬口裂腹魚尾鰭細胞系增殖的抑制可隨時間延長而增強。在同一時間點上,1‰、2‰、4‰、6‰、8‰ NaCl依次使寬口裂腹魚尾鰭細胞系相對增殖率上升,8‰、10‰ NaCl依次使寬口裂腹魚尾鰭細胞系相對增殖率下降,8‰ NaCl時相對增殖率最高,寬口裂腹魚尾鰭細胞系相對增殖率隨NaCl質量分數增加呈先升后降的趨勢(表4)。
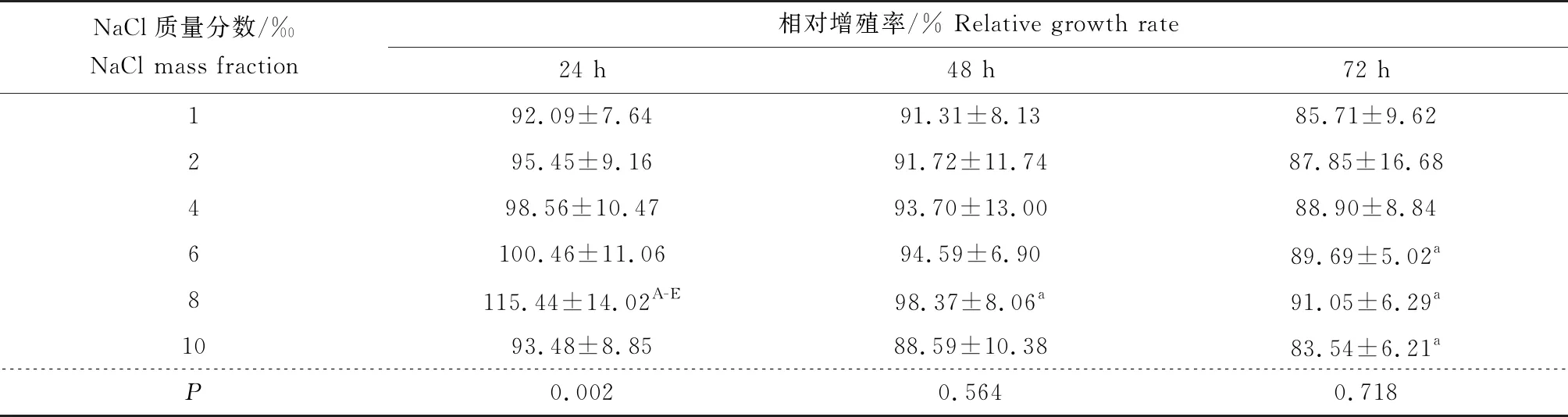
表4 NaCl質量分數對寬口裂腹魚尾鰭細胞系增殖的影響(平均值±標準差)
2.7.2 NaHCO3質量濃度對寬口裂腹魚尾鰭細胞增殖的影響
在NaHCO3質量濃度一致情況下,寬口裂腹魚尾鰭細胞系的相對增殖率隨時間延長而下降,由此可知,NaHCO3質量濃度對寬口裂腹魚尾鰭細胞系增殖的抑制可隨時間延長而增強。在同一時間點上, 2、3、4、5、6、7 g/L NaHCO3依次使寬口裂腹魚尾鰭細胞系細胞相對增殖率上升,7、8、10 g/L NaHCO3依次使寬口裂腹魚尾鰭細胞系相對增殖率下降,7 g/L NaHCO3時寬口裂腹魚尾鰭細胞系相對增殖率最高,寬口裂腹魚尾鰭細胞系增殖隨NaHCO3質量濃度增加呈先升后降趨勢(表5)。
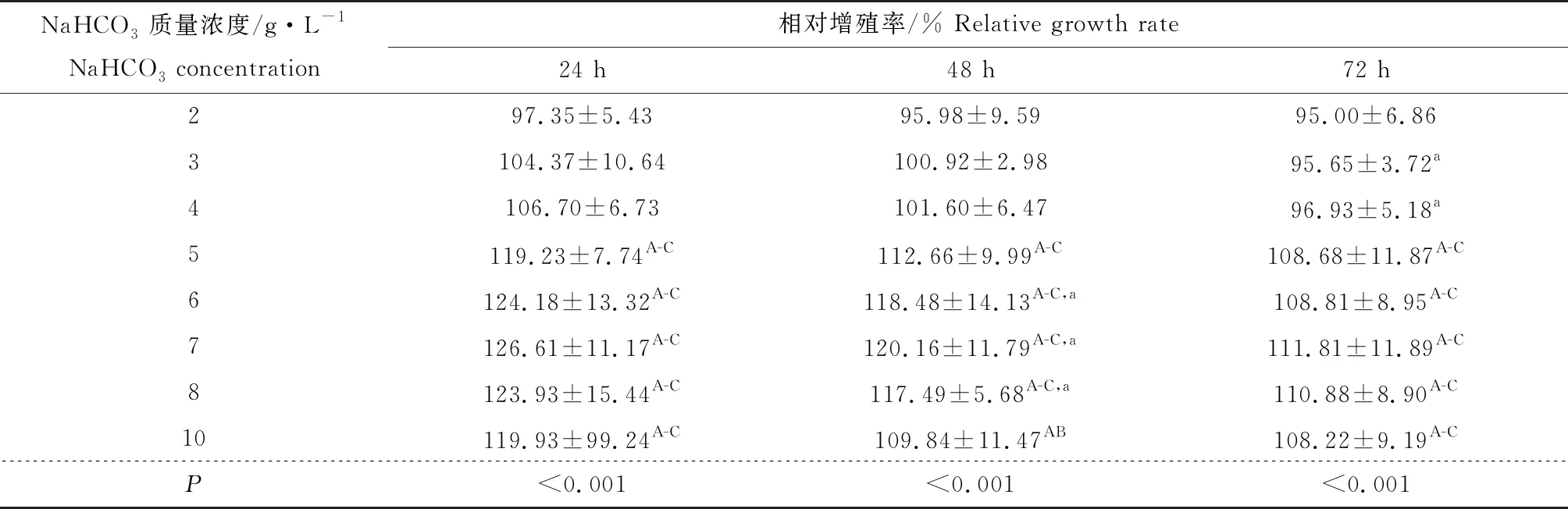
表5 NaHCO3質量濃度對寬口裂腹魚尾鰭細胞系增殖的影響(平均值±標準差)
3 討 論
3.1 寬口裂腹魚尾鰭細胞系的建立
筆者以寬口裂腹魚尾鰭組織為材料,用組織塊移植法進行了寬口裂腹魚尾鰭組織細胞原代培養,命名寬口裂腹魚尾鰭細胞系。寬口裂腹魚尾鰭細胞系在20%胎牛血清的DME/F12培養液中生長良好。細胞培養常用的培養液有L-15、MEM、RPMI-1640和M199,但不同的魚類對環境要求不盡相同,因此,不同魚類的最適培養基亦不同。褐點石斑魚(Epinephelusfuscoguttatus)鰭細胞系[26]、真鯛(Pagrusmajor)細胞系[27]的最佳培養液為DMEM/F12。筆者選用DEM/F12、L-15、MEM和RPMI-1640培養液作為試驗培養液,結果表明,DME/F12為最佳培養液。魚類組織細胞生長溫度范圍與哺乳類組織細胞比較,適宜溫度范圍較廣。寬口裂腹魚尾鰭細胞系在20~30 ℃細胞均能正常生長,其中25 ℃為最適生長溫度,與已報道真鯛和圓斑星鰈(Veraspervariegates)的細胞溫度適應范圍一致[27-28],這與魚類是變溫動物有很大關系。在0%、10%、20%和25%的體積分數胎牛血清培養基中同條件培養,在未加血清的培養基中的生長速度顯著低于添加血清的培養基,在20%胎牛血清時生長最快,胎牛血清體積分數對細胞生長有明顯的影響,與已報道的研究相似[29]。
寬口裂腹魚尾鰭細胞系呈懸浮生長。貼壁培養型的細胞,細胞膜表面含有大量黏附因子。這些黏附因子可激活不同的信號通路調節貼壁細胞的活性和增殖,如整合素活化黏著斑激酶激活信號通路抑制細胞內源性的凋亡[30-31]。懸浮培養的細胞一般為淋巴細胞等血液系統來源的細胞,這種細胞體積小,缺乏黏附分子的表達[32-33]。用物理方法進行貼壁型細胞的懸浮馴化時使細胞產生失巢凋亡[34],無血清與生物反應器馴化使貼壁細胞產生失巢凋亡的拮抗[34]。Ana等[35]用舌齒鱸(Dicentrarchuslabrax)腸細胞研究其失巢凋亡。猜測寬口裂腹魚尾鰭細胞呈懸浮生長的狀態,可能與其體積和細胞膜表面黏附分子的表達及存在與類似于失巢凋亡的調節有關,具體原因有待于進一步研究。
細胞來源的鑒定通常采用16S rRNA、12S rRNA和Cyt b等基因片段,其中16S rRNA基因屬于進化緩慢的保守序列,因此筆者選擇16S rRNA基因進行鑒定,序列分析結果與寬口裂腹魚基因序列一致性達99.91%,證明該細胞系來自于寬口裂腹魚。
3.2 鹽堿度對寬口裂腹魚尾鰭細胞增殖的影響
水體中鹽堿度水平對魚類的存活有顯著的影響,鹽堿度過高或過低都會使魚類的存活率顯著的降低[18-19]。在尼羅羅非魚鹽堿度的耐受性研究中,鹽度為20時僅少數個體能存活到96 h,堿度為12 g/L(以NaHCO3計)時,96 h全部死亡[20];對小黃魚進行鹽度脅迫試驗時,鹽度為5.0~22.1時,小黃魚10 d內存活率極高,隨著鹽度降低或者升高,小黃魚的存活率持續下降[21]。寬口裂腹魚是塔里木河水系的土著魚類,1958年博斯騰湖測定的pH為 8.1~8.4,礦化度為0.39 g/L,1981年博斯騰湖測定的pH為8.5~8.7,礦化度為180 g/L[36],2013年塔里木河流域Cl-和Na+濃度明顯增大[37],2021年塔里木河流域pH為7.58~8.32,Cl-/(Cl-+HCO3-)的平均比率為0.23,Na+/(Na++Ca2+)的平均比率為0.39[38]。鹽堿度無規律的變化是導致物種資源衰竭的原因之一,鹽堿度對塔里木河葉爾羌高原鰍(Triplophysayarkandensis)影響的結果顯示,其從原來的趨淡水性轉變為趨咸水性[39]。本試驗中,1‰、2‰、4‰、6‰、8‰ NaCl依次使寬口裂腹魚尾鰭細胞系相對增殖率上升,8‰、10‰ NaCl依次使寬口裂腹魚尾鰭細胞系相對增殖率下降,8‰ NaCl時寬口裂腹魚尾鰭細胞系相對增殖率最高; 2、3、4、5、6、7 g/L NaHCO3依次使寬口裂腹魚尾鰭細胞系相對增殖率上升,7、8、10 g/L NaHCO3依次使寬口裂腹魚尾鰭細胞系相對增殖率下降,7 g/L NaHCO3時寬口裂腹魚尾鰭細胞系相對增殖率最高。本試驗結果表明,鹽堿度過高或過低均會導致寬口裂腹魚尾鰭細胞的存活率降低。
4 結 論
筆者初步建立寬口裂腹魚尾鰭細胞系,尾鰭細胞傳至45代。呈懸浮生長,最適培養液為DME/F12,最適胎牛血清體積分數為20%,最適溫度為25 ℃。在最適條件下,第10代寬口裂腹魚尾鰭細胞系細胞系細胞的群體倍增時間為24.94 h,細胞分裂旺盛,呈“S”型。第6代細胞液氮冷凍保存180 d后復蘇,經臺盼藍染色計數,寬口裂腹魚尾鰭細胞系有(88.72±0.99)%的細胞具有活性;復蘇后增殖速度快,可正常傳代。寬口裂腹魚尾鰭細胞系第10代細胞線粒體16S rRNA序列分析結果與寬口裂腹魚基因序列一致性為99.91%,從分子水平證明該尾鰭細胞系來自寬口裂腹魚。寬口裂腹魚尾鰭細胞系相對增殖率隨NaCl質量濃度增加呈現先升后降趨勢,8‰NaCl時寬口裂腹魚尾鰭細胞系細胞相對增殖率最高;寬口裂腹魚尾鰭細胞系相對增殖率隨NaHCO3質量濃度增加呈先升后降趨勢,7 g/L相對增殖率時寬口裂腹魚尾鰭細胞系相對增殖率最高。

