TMED10在膠質瘤發生發展中的作用及表達情況
王志浩,劉浩昂,蘭 凱,廉 婷,張旭東
(1.西安醫學院臨床醫學院中尼友好拉吉姆醫學實驗室,陜西 西安 710021;2.西安醫學院臨床醫學院陜西省呼吸病預防與診治工程中心,陜西 西安 710021)
膠質瘤(glioma)占成人原發惡性腦腫瘤的75%,是人類最常見的原發性中樞神經系統惡性腫瘤[1]。目前認為膠質瘤源自神經膠質干細胞或祖細胞,根據惡性程度不同,國際上將其分為WHOⅠ、Ⅱ、Ⅲ、Ⅳ級[2]。據相關研究統計,高級別的膠質母細胞瘤(GBM,WHOⅣ級)因生長迅速、侵襲性強、發病率、致死致殘率高,其患者中位總生存期(OS)僅14.4個月,且5年生存率不足10%[3]。目前臨床上膠質瘤的治療主要為手術大范圍切除、放化療、基因靶向治療、免疫治療及電場療法等,但其治療效果不佳[4,5]。因此,研究膠質瘤的發生發展機制對膠質瘤患者的早期干預及尋找治療新方法十分重要。10跨膜P24販運蛋白10(transmembrane P24 trafficking protein,TMED10)又稱TMP21,是一種定位于內質網-高爾基體中間體(ERGIC)上的參與蛋白轉運的膜蛋白。近年來我國學者研究發現,TMED10在非經典蛋白分泌(unconventional protein secretion,UPS)過程中發揮重要作用[6-8]。此外,有研究表明,其還與細胞增殖[9]、細胞自噬[10,11]有關。近年來有許多學者研究TMED10與阿爾茲海默癥[12-14]、甲狀腺癌[15]、原發性肝癌[16]、自身免疫性疾病[17]等疾病的關系及可能存在的作用機制,但TMED10在膠質瘤中的研究還很少。因此,本研究旨在分析TMED10在膠質瘤中的表達情況,為研究TMED10在膠質瘤的發生發展中的作用及尋找治療膠質瘤的新靶點提供參考。
1 資料與方法
1.1 資料來源 研究數據來源于癌癥基因組圖譜(The Cancer Genome Atlas,TCGA)在線數據庫(GEPIA,http://gepia.cancer-pku.cn/);中國腦膠質瘤基因組圖譜數據庫(Chinese Glioma Genome Atlas, CGGA, http:/www.cgga.org.cn);String數據庫(https://www.string-db.org/)。
1.2 方法 使用 CGGA、GEPIA數據庫分析 TMED10在膠質瘤不同臨床病理條件下的差異性表達情況,檢索方法:①Analyze-mRNA data;性別(Male vs Female),年齡(>42歲 vs<42歲),不同級別狀態(WHOⅡvs WHOⅢ vs WHOⅣ),發展狀態(原發 vs 復發);②Data type:mRNA;③ Dataset:mRNAseq_325;④Gene:TMED10;⑤臨界值設定P-value<0.05。利用CGGA、GEPIA 數據庫分析 TMED10 相關基因的表達與膠質瘤患者生存預后的影響,檢索方法:①AnalyzemRNA data;②Survival;③Dataset:mRNAseq_325;④Gene:TMED10。通過 String數據庫對TMED10表達蛋白相互作用網絡進行分析。檢索方法:①Proteinname:TMED10;②Organism:Homo sapiens,并利用Kaplan-Meier、Kruskal-Wallis 進行統計學分析。
2 結果
2.1 TMED10在膠質瘤組織和正常對照組織中的表達比較 基于GEPIA數據庫過表達基因篩查發現TMED10在膠質瘤中的表達高于正常組織(P=2.66E-98),見圖1、圖2。
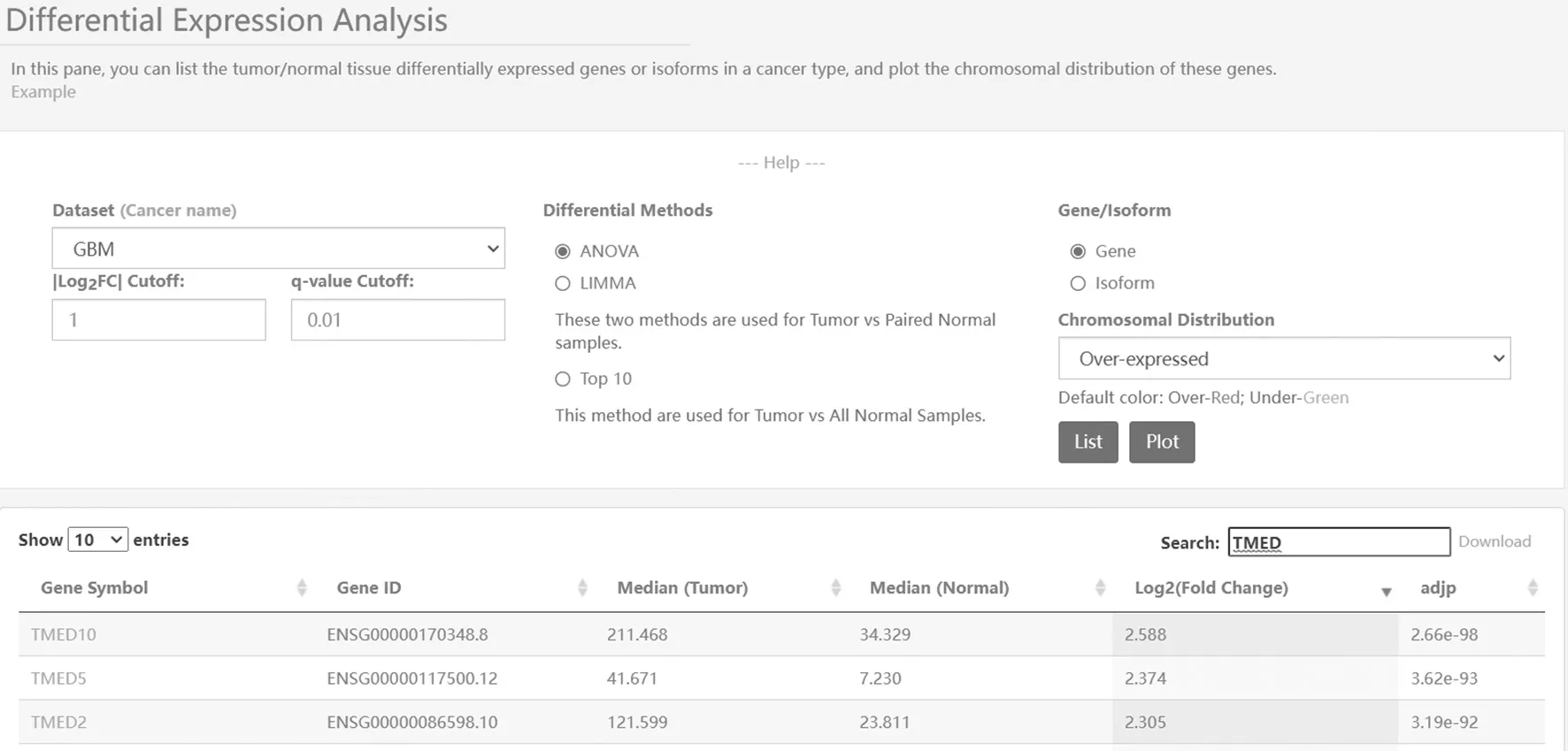
圖1 膠質瘤中TMED10的差異性分析
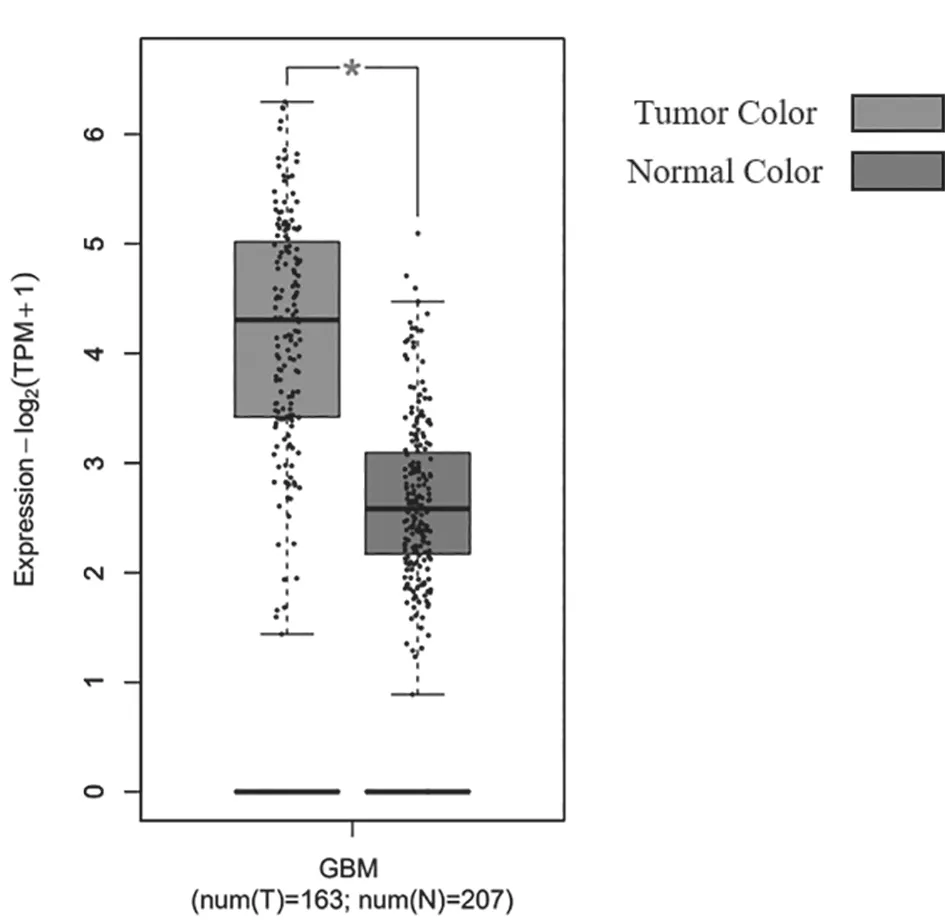
圖2 TMED10在膠質瘤組織和正常對照組織中的表達
2.2 TMED10在不同膠質瘤亞型中的表達比較TMED10在高級別的原發性膠質瘤和復發性膠質瘤組織中呈較高表達(P=1.1e-07),見圖3。
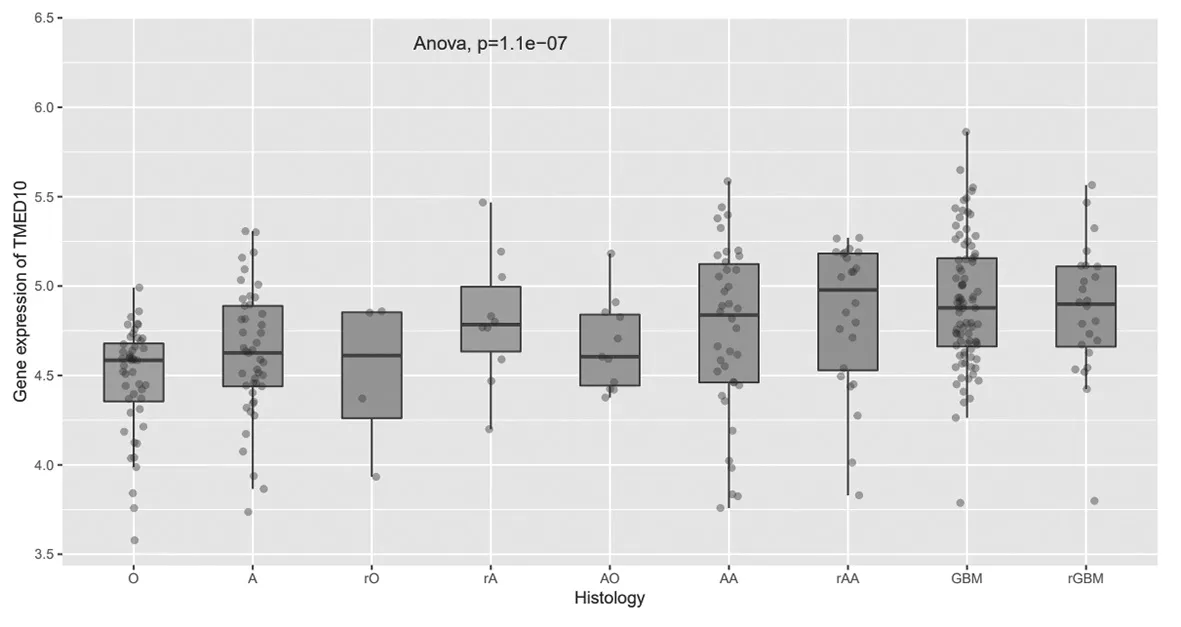
圖3 TMED10在不同類型膠質瘤中的表達情況
2.3 TMED10在不同性別膠質瘤組織中的表達比較不同性別膠質瘤患者中TMED10的表達比較,差異無統計學意義(P=0.083),見圖4。
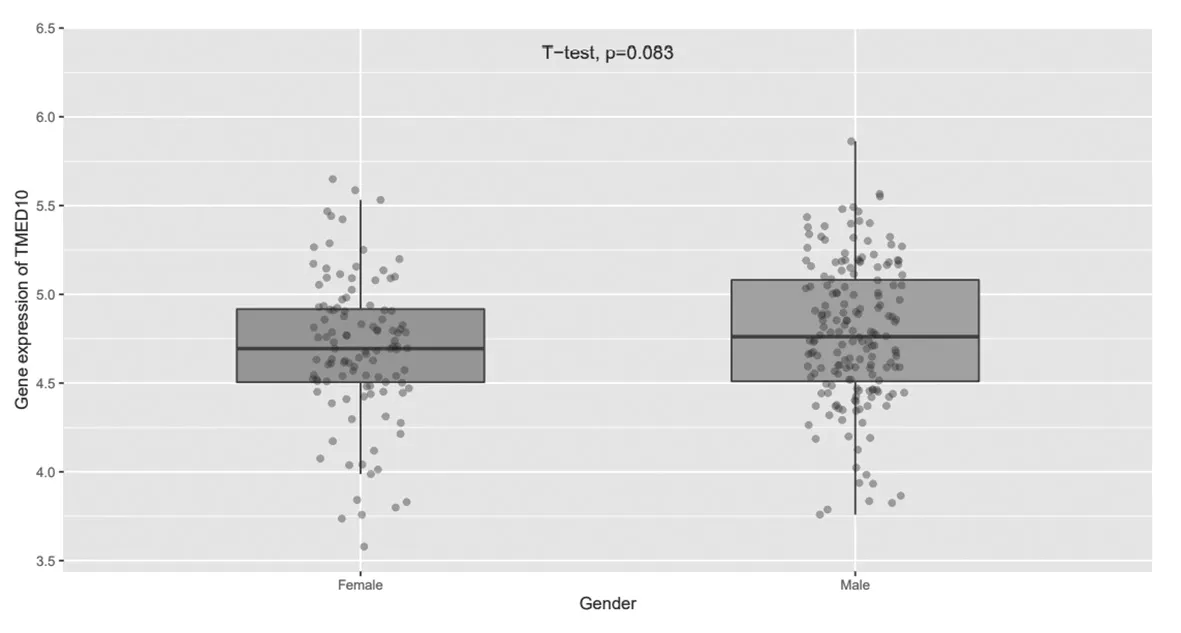
圖4 MED10在不同性別膠質瘤組織中的表達
2.4 TMED10在不同年齡膠質瘤組織中的表達比較TMED10在42歲以上與42歲以下膠質瘤患者組織中的表達比較,差異無統計學意義(P=0.2),見圖5。
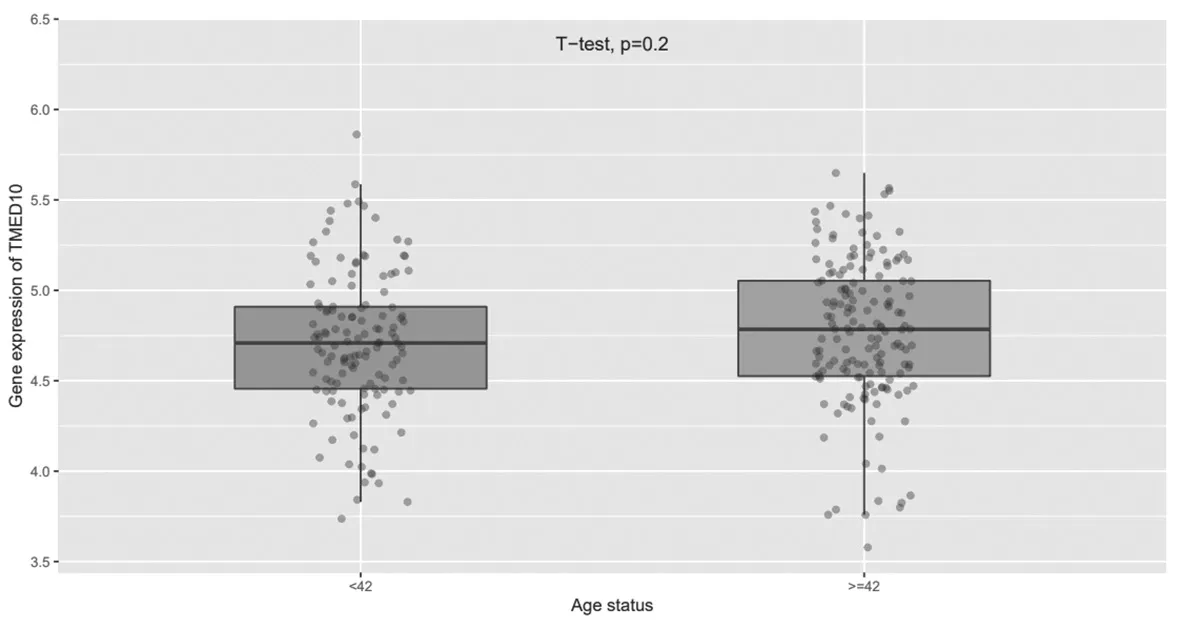
圖5 TMED10在不同年齡膠質瘤組織中的表達
2.5 TMED10在不同級別膠質瘤組織中的表達比較TMED10與膠質瘤的發生發展呈正相關;不同級別的膠質瘤TMED10表達比較,差異有統計學意義(P=7e-09),見圖6。
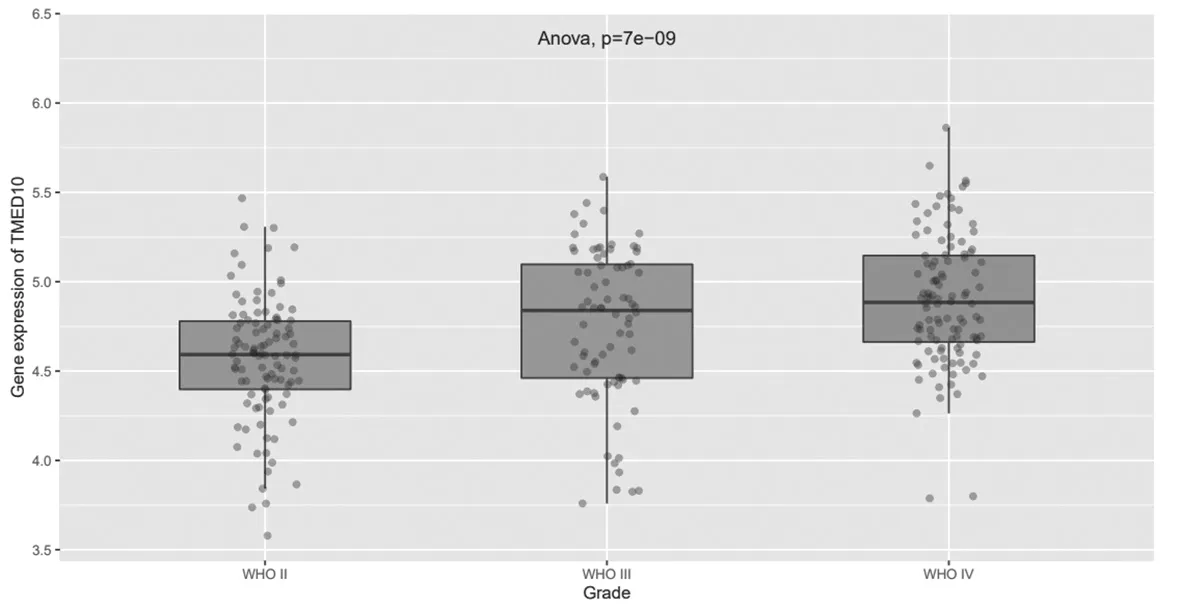
圖6 TMED10在不同級別膠質瘤組織中的表達
2.6 TMED10在不同進展狀況的膠質瘤組織中的表達比較 TMED10在原發性、復發性膠質瘤組織中的表達比較,差異無統計學意義(P=0.075),見圖7。
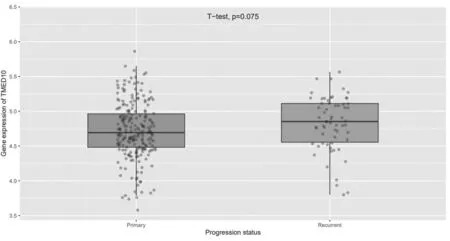
圖7 TMED10在不同進展狀況的膠質瘤組織中的表達
2.7 TMED10在不同年齡、性別、發病階段的膠質瘤中的表達比較 TMED10在WHOⅡ、Ⅲ、Ⅳ級膠質瘤中的表達比較,差異無統計學意義(P>0.05);在WHO Ⅳ級男性膠質瘤患者中TMED10的表達高于女性(P=0.027),TMED10在原發型、復發性膠質瘤患者組織中表達比較,差異無統計學意義(P>0.05),見圖8~圖10。
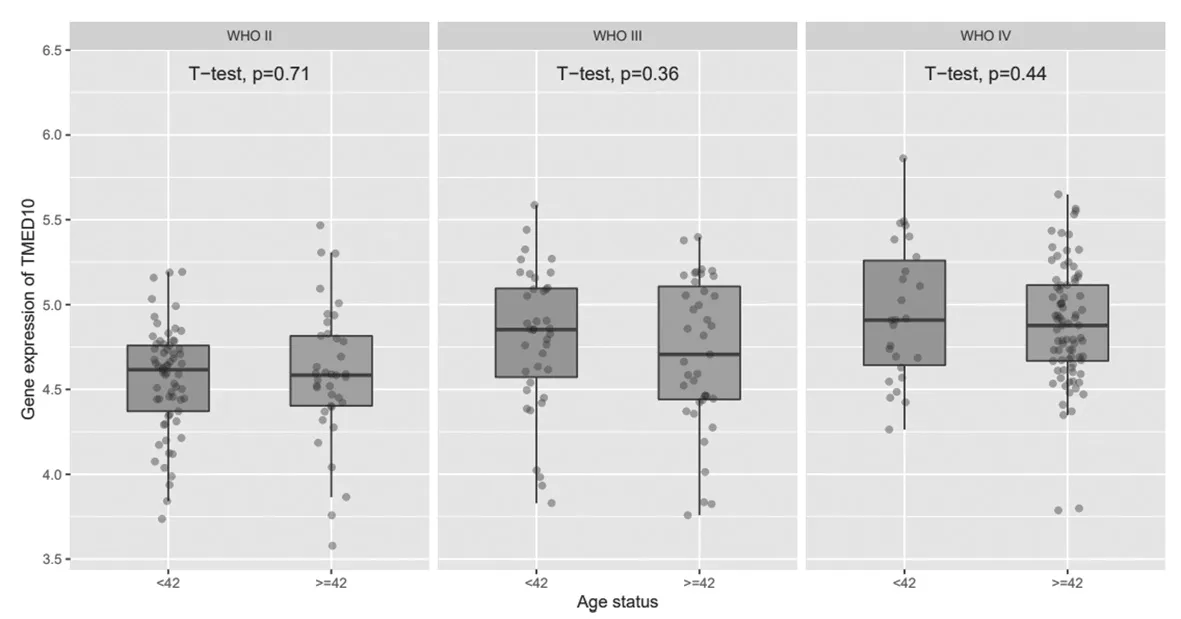
圖8 TMED10在不同年齡階段的膠質瘤中的表達
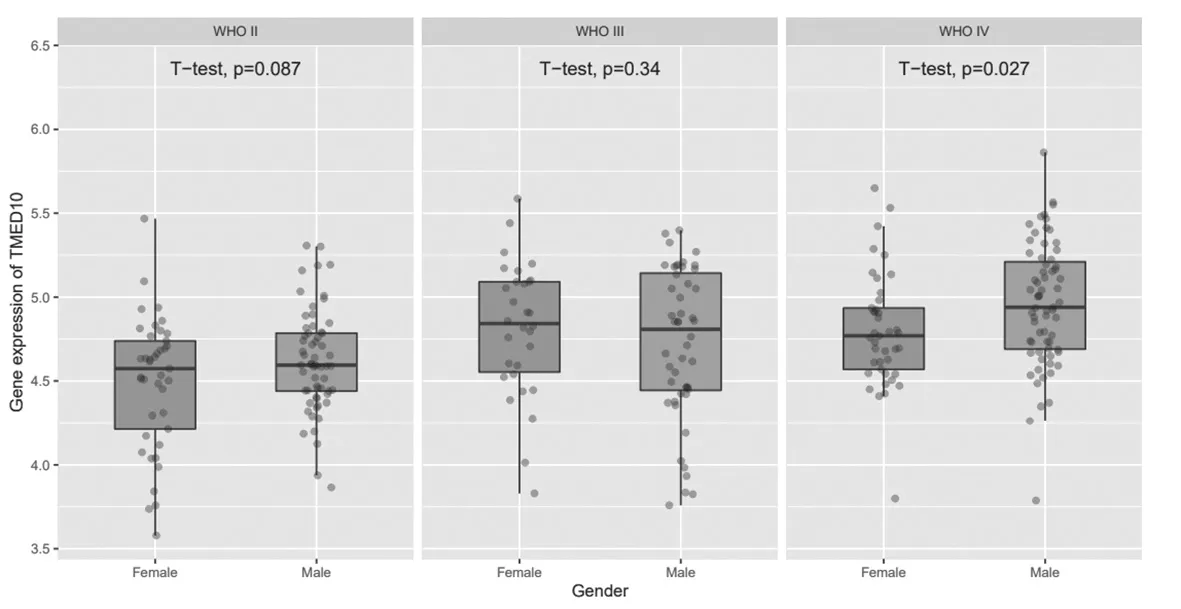
圖9 TMED10在不同性別膠質瘤中的表達
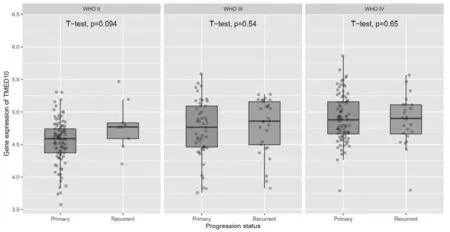
圖10 TMED10在不同發病階段膠質瘤中的表達
2.8 TMED10的表達與患者生存率的相關性 TMED10在原發性、復發性膠質瘤中的表達與患者生存率呈負相關(P<0.0001;P=0.0081),見圖11。
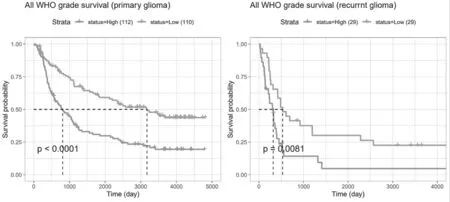
圖11 TMED10的表達與患者生存率及生存時間的關系
2.9 TMED10表達蛋白相關作用網絡分析 TMED10與TMED2、NCSTN、APH1A等多個蛋白有相互作用,見圖12。
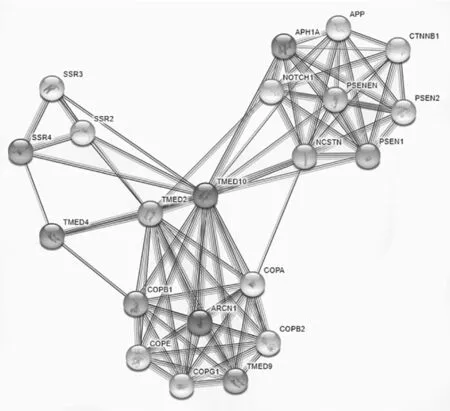
圖12 TMED10表達蛋白相關作用網絡分析
3 討論
目前,TMED10作為一種介導UPS的分子備受關注。越來越多的研究證明TMED10調控細胞增殖、自噬,并且與神經退行性疾病、自身免疫性疾病及癌癥發生發展有關。研究發現,無信號肽蛋白(leaderless cargo)在胞質中HSP90A蛋白的幫助下去折疊后,必須與TMED10相互作用并使其發生寡聚化形成蛋白通道才能進入ERGIC內并通過囊泡包裹分泌到細胞外[6,7]。同時,還有研究發現TMED10是自噬調節分子,抑制TMED10的表達會嚴重影響甲狀腺癌的生長,可能是通過激活AMPK/mTOR通路誘導自噬來調節癌細胞的生長[15]。研究發現[16],TMED10在原發性肝細胞癌(HCC)中呈現高表達狀態,聯合使用SiTmed10、SiTMBIM4、SiDtd2(D-tyrosyl-tRNA deacylase 2)可以顯著促進肝癌細胞系Huh7、HepG2凋亡,而正常肝細胞系THLE-2幾乎不受影響,這一結果表明TMED10的小分子抑制劑可能是肝癌治療的新靶點。最新的研究發現[17,18],TMED10能阻礙TGF-βⅠ型(ALK5)和 Ⅱ型受體(TβRⅡ)復合物的形成,從而抑制TGF-β信號通路,進而抑制TGF-β介導的生長抑制現象。還有研究報道[19],巨細胞病毒免疫逃逸素m152/gp40可以通過TMED10錨定在宿主細胞的內質網上進而產生免疫逃逸現象。這些發現提示TMED10在膠質瘤發生發展中可能發揮重要的作用,然而TMED10在膠質瘤中的作用目前仍不明確。
本研究基于GEPIA、CGGA數據庫分析發現,TMED10在膠質瘤組織中表達高于正常對照組織(P=2.66E-98);在不同級別的膠質瘤中,TMED10的表達量比較,差異有統計學意義(P=7e-09);同時TMED10在原發性、復發性膠質瘤組織中的表達與患者生存期呈負相關(P<0.0001;P=0.0081)。表明TMED10在膠質瘤的發生發展過程中具有促進作用,可能是TMED10通過調控內質網應激過程,促進膠質瘤細胞的惡性增殖。最后通過String數據庫分析發現TMED10有TMED2、NCSTN、APH1A等多個相互作用蛋白,可為后續的進一步研究提供相關依據。
綜上所述,TMED10在膠質瘤組織中呈高表達狀態,且與患者的生存率密切相關;并且TMED10在細胞自噬、增殖、疾病的發生發展等方面的重要作用。因此,TMED10可能成為治療膠質瘤的潛在靶點。

