丁苯酞聯合腦蛋白水解物治療中晚期帕金森病的臨床研究
谷偉,馮英慧,楊繼雷,趙寶民
(河北北方學院附屬第一醫院全科醫學科,河北 張家口 075000))
帕金森病(Parkinson’s disease,PD)是臨床常見的中樞神經系統退行性疾病,病理變化主要是黑質多巴胺(dopamine,DA)能神經元變性壞死[1-2],目前PD以藥物綜合治療為主[3]。腦蛋白水解物為活性肽類水解物,有營養及保護神經元的作用[4];丁苯酞是一種常用的腦保護劑,有抗氧化應激、抗炎癥反應、保護線粒體、抑制細胞凋亡等神經保護作用[5]。目前兩種藥物在PD患者中均有使用,但二者聯合使用的報道較少。本研究旨在探討丁苯酞聯合腦蛋白水解物治療中晚期PD的療效。
1 資料與方法
1.1 一般資料
選取2020年1月至2022年1月河北北方學院附屬第一醫院收治的120例中晚期PD患者為研究對象,按照治療方案不同分為觀察組與對照組,每組各60例。觀察組中,男性34例,女性26例;年齡(64.22±7.48)歲;病程(6.85±1.34)年;Hoehn-Yahr分級:3級39例,4級21例;癥狀分型:肌強直型28例,震顫型17例,混合型15例。對照組中,男性37例,女性23例;年齡(63.57±8.22)歲;病程(6.44±1.48)年;Hoehn-Yahr分級:3級42例,4級18例;癥狀分型:肌強直型27例,震顫型19例,混合型14例。本研究經院倫理委員會審核批準,患者及家屬知情同意。兩組患者一般資料比較,差異無統計學意義(P>0.05)。納入標準:(1)根據癥狀、影像學等確診為PD[6];(2)口服多巴胺能藥物>3年,目前療效不佳;(3)年齡40~80歲;(4)Hoehn-Yahr分級3~4級(即病情處于中晚期);(5)無腦蛋白水解物使用禁忌證。排除標準:(1)帕金森綜合征;(2)帕金森疊加綜合征;(3)存在精神分裂癥等嚴重精神類疾病;(4)伴有嚴重認知障礙;(5)患有嚴重心腦血管疾病;(6)既往有藥物或酒精濫用史;(7)對丁苯酞氯化鈉注射液中任何成分過敏;(8)既往有癲癇病史、腦出血或腦部手術史。
1.2 方法
所有患者均常規給予多巴絲肼片(上海羅氏制藥)口服,0.125 g/次,3次/d,根據癥狀適當調整劑量。在此基礎上,對照組采用腦蛋白水解物(河北智同生物制藥)30 mg+0.9%生理鹽水100 mL靜脈滴注,1次/d。觀察組在對照組基礎上采用丁苯酞氯化鈉注射液(石藥集團恩必普藥業)100 mL靜脈滴注,2 次/d。療程均為6周。
1.3 觀察指標
(1)臨床療效:參照Webster量表評分減分情況進行療效評估[7],包括肌強直、姿勢、步態、起坐障礙、震顫、生活自理能力等10個項目,每個項目計0~3分,總分30分。其中1~10分為輕度障礙,11~20分為中度障礙,21~30分為重度障礙。顯效:Webster量表評分降低>60%;有效:30% 觀察組患者治療總有效率高于對照組,差異有統計學意義(P<0.05)。見表1。 表1 兩組患者臨床療效比較 [n(%)] 治療前,兩組患者UPDRS Ⅰ、Ⅱ、Ⅲ部分評分比較,差異無統計學意義(P>0.05)。治療后,兩組兩組患者評分UPDRS Ⅰ、Ⅱ、Ⅲ部分評分均降低(P<0.05),且觀察組低于對照組(P<0.05)。見表2。 表2 兩組患者精神活動、情感障礙、日常生活能力及運動功能比較分) 治療前,兩組患者Th17百分比、Treg百分比及Th17/Treg比值比較,差異無統計學意義(P>0.05)。治療后,兩組患者外周血Treg百分比均升高(P<0.05),且觀察組高于對照組(P<0.05);外周血Th17百分比和Th17/Treg比值降低(P<0.05),且觀察組低于對照組(P<0.05)。見表3。 表3 兩組患者免疫功能指標比較 治療前,兩組患者MDA、8-OHdG、GSH-Px及SOD水平比較,差異無統計學意義(P>0.05)。治療后,兩組患者血清MDA、8-OHdG水平均降低(P<0.05),且觀察組低于對照組(P<0.05);血清GSH-Px、SOD水平均升高(P<0.05),且觀察組高于對照組(P<0.05)。見表4。 表4 兩組患者血清氧化應激指標比較 兩組患者不良反應總發生率比較,差異無統計學意義(P>0.05)。見表5。 表5 兩組不良反應比較[例,n(%)] 本研究顯示,觀察組患者在聯合采用丁苯酞氯化鈉注射液與腦蛋白水解物治療后總有效率達到了95.00%,明顯高于單純給予腦蛋白水解物治療(P<0.05)。腦蛋白水解物是用豬腦白蛋白經酶水解后得到的肽制劑,可促進腦蛋白質合成,降低腦內乳酸水平,調節神經元代謝,改善認知功能,對神經細胞可發揮有效保護作用,使其免于遭受神經毒性損害[9]。劉文萍等[10]報道顯示,腦蛋白水解物能有效提高老年帕金森的臨床療效,并能有效改善患者的生活質量。丁苯酞是人工合成的消旋體,結構和左旋芹菜甲素相同,可促進腦細胞鈣離子濃度下降,減少自由基釋放,改善線粒體功能,保護神經細胞[11]。本研究還顯示,治療后觀察組UPDRS中各部分(Ⅰ、Ⅱ、Ⅲ)評分均較對照組改善更明顯(P<0.05),表明丁苯酞氯化鈉注射液聯合腦蛋白水解物治療中晚期PD能有效改善患者的精神活動和情感障礙,恢復運動功能,增強日常生活活動能力,進而提高治療效果,原因與丁苯酞聯合腦蛋白水解物具有的調節神經元代謝、保護神經細胞等作用密切相關。趙曉陽等[12]研究表明,丁苯酞可能通過上調沉默信息調節因子1蛋白表達,抑制帕金森模型小鼠神經元凋亡與氧化應激。此外,周海艷等[13]對收治的PD患者在初始藥物治療方案基礎上聯合丁苯酞治療后能有效改善患者的運動和非運動癥狀。 研究[14]發現,免疫炎癥反應在中腦黑質DA能神經元變性、壞死中起著重要作用,可能介導了PD的發病及病情進展過程。大量研究[15]證實,Th17、Treg細胞可通過多途徑參與機體免疫功能的調節,Th17細胞及其分泌的細胞因子IL-6、IL-17等可活化中性粒細胞,從而介導機體免疫炎癥反應,而Treg細胞發揮的是免疫抑制作用。研究[16]表明,PD患者機體內存在Th17/Treg免疫失衡,表現為外周血Treg細胞表達下調,而Th17細胞表達增多,Th17/Treg比值升高,原因可能與神經炎癥等有關。PD患者外周血Treg細胞表達降低可能與以下因素有關:(1)PD患者DA能神經元變性壞死過程中可釋放出α-突觸核蛋白,有激活小膠質細胞的作用,膠質細胞激活后可分泌多種炎性介質,誘導一氧化氮、前列腺素、自由基等致病介質生成,進而影響Treg細胞活性;(2)PD進展過程中,黑質DA能神經元大量丟失后可造成黑質紋狀體D1樣受體功能上調,使Treg細胞活性下降,數目減少,神經保護功能減弱。一項研究[17]表明,PD可致血腦屏障功能障礙,Th17細胞可透過血腦屏障進入到腦實質內,誘發神經毒性作用,參與PD病情進展。Th17細胞可介導神經炎癥反應,導致腦組織吞噬細胞激活,引發炎癥應激反應,炎性因子大量釋放,抗氧化酶大量消耗,進而造成神經元損傷[18]。本研究中,治療后兩組患者外周血Treg百分比均升高(P<0.05),且觀察組高于對照組(P<0.05),外周血Th17百分比和Th17/Treg比值均降低(P<0.05),且觀察組低于對照組(P<0.05),提示在腦蛋白水解物基礎上聯合丁苯酞氯化鈉注射液治療中晚期PD能更有效地調節患者外周血Th17/Treg免疫平衡,從而有利于保護DA能神經元,抑制其變性、壞死,延緩病程進展。研究[19]證實,氧化應激反應與PD關系密切。PD發病過程中可生成大量的氧自由基,從而引發神經元氧化應激損傷,導致中腦黑質內DA能神經元損傷及凋亡。動物實驗研究[20]表明,PD小鼠模型黑質區與紋狀體區有大量脂質過氧化產物堆積。PD患者機體內過度的氧化應激反應可能與線粒體功能障礙有關,氧化應激與線粒體功能障礙是引起衰老與神經退行性變性疾病的重要原因。正常情況下,人體內的抗氧化酶足以清除氧自由基,然而當線粒體功能出現障礙后,可導致大量氧自由基生成,抗氧化酶合成不足,從而引發氧化應激反應。黑質DA能神經元容易受到氧自由基攻擊進而發生氧化應激損傷,造成線粒體脫氧核糖核酸突變,而線粒體功能障礙反過來會增加PD的患病風險,二者間形成惡性循環。MDA、8-OHdG、GSH-Px、SOD均是重要的氧化應激指標。其中MDA是脂質過氧化的分解產物,8-OHdG是DNA氧化損傷的修飾產物,二者均可間接反映組織氧化損傷程度。GSH-Px與SOD均是重要的抗氧化酶,具有清除氧自由基的作用,其水平降低表明體內清除氧自由基的能力下降,組織細胞更易受到氧化應激損傷。本研究結果顯示,治療后兩組患者血清MDA、8-OHdG濃度均降低(P<0.05),且觀察組低于對照(P<0.05);血清GSH-Px、SOD水平均升高(P<0.05),且觀察組高于對照組(P<0.05),表明丁苯酞與腦蛋白水解物聯合使用治療中晚期PD能有效減輕患者機體內氧化應激反應,進而減少DA能神經元損傷,促進DA能神經元修復,延緩病情進展,可能是丁苯酞聯合腦蛋白水解物治療中晚期PD的重要機制之一。 綜上,在腦蛋白水解物基礎上聯合丁苯酞治療中晚期PD可安全有效地提高臨床療效,調節外周血Th17/Treg免疫平衡,緩解體內氧化應激水平,保護DA能神經元,值得臨床推廣應用。1.4 統計學分析

2 結果
2.1 兩組臨床療效比較

2.2 兩組患者精神活動、情感障礙、日常生活能力及運動功能比較

2.3 兩組患者免疫功能指標比較
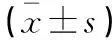
2.4 兩組患者血清氧化應激指標比較
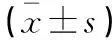
2.5 兩組患者不良反應發生情況比較

3 討論

