納米硒對犬腎衰中腎組織離子轉運體表達及凋亡的影響
高海航,張嘉賓,張夢迪,李 浩,楊小琦,史菁菁,劉 鑫,周東海*
(1.華中農業大學動物醫學院,武漢 430070; 2.塔里木大學動物科學與技術學院,阿拉爾 843300)
急性腎衰作為發病率死亡率最高的腎疾病嚴重危害犬的健康[1],以往研究主要集中在急性腎衰所致的腎實質性損傷引起腎功能的改變,對治療中離子代謝與凋亡關聯性研究甚少。本研究以腺嘌呤為急性腎衰造模藥物、納米硒為急性腎衰治療與預防藥物,以急性腎衰犬腎組織為研究對象,旨在探究納米硒對犬腎衰中重吸收與凋亡作用的影響。
硒(Se)是動物機體不可或缺的一種微量元素[2],近些年來,納米硒(nano-Se)因其生物利用度、催化效率、吸附能力較亞硒酸鹽高,在影響綿羊與山羊[3]、小鼠[3]、大鼠[4]及家禽[5]機體代謝中廣為研究。納米硒治療與預防以往作用主要針對敏感組織和器官的氧化應激損傷,例如口服2 mg·kg-1的納米硒通過減輕雄性小鼠睪丸組織氧化應激來抑制BPA引起的生殖毒性[6];提前口服0.5 mg·kg-1的納米硒可通過上調轉錄因子Nrf2和血紅素加氧酶-1(HO-1)表達來減輕氧化應激同時抑制腦組織炎癥反應與凋亡級聯反應,延緩戊四唑注射后小鼠全面性癲癇發作的持續時間[7]。急性腎衰治療主要圍繞恢復電解質、酸堿平衡,抗炎利尿進行,而其治療策略本身需要評估具體腎排泄功能情況,防止過度補液導致的鹽、水超負荷[8]。急性腎衰的特征是腎小球濾過率(glomerular filtration rate,GFR)急劇下降及急性腎小管壞死(acute tubular necrosis,ATN);與之有關的病理生理機制包括由腎小管上皮細胞從基底膜上脫離引起的腎小管阻塞,以及由于上皮細胞層破壞導致腎小球濾液回流重吸收功能受阻。SLC12A1基因是一種腎特異性的 Na+-K+-2Cl-協同轉運蛋白同種型,僅在髓袢升支粗段(thick ascending limb, TAL)的頂膜中表達。它的主要作用是介導 Na+、K+和Cl-通過哺乳動物腎中的TAL頂膜的共轉位[9]回收25%的超濾NaCl負載[10]。間質鈣濃度升高會激活基底外側CaSR直接調節細胞旁鈣通透性[11],除了Ca2+運輸系統,CaSR (鈣敏感性受體)信號傳導影響相關的腎小管遠端NKCC2和NCC。NKCC2和NCC由包含無賴氨酸激酶 (lysine deficient protein kinase, WNK)和兩種同源Ste20相關激酶SPAK和OSR1的激酶級聯激活[12]。WNK家族一方面感知細胞內Cl-濃度、細胞外滲透壓和細胞體積的變化,并將這些信息最終傳遞給眾多離子轉運蛋白,以維持細胞和有機體的穩態并影響細胞形態和行為[13]。除腎小管上皮細胞外,神經細胞對體積變化同樣敏感,以往的研究表明,抑制WNK-SPAK/OSR1信號通路可通過減少NKCC的磷酸化來緩解腦中風時滲透壓變化引起的腦細胞腫脹引起的腦水腫[14],此外通過RNA干擾抑制內源性WNK3蛋白可加速細胞凋亡反應并促進Caspase-3的活化[15]。
1 材料與方法
1.1 實驗動物
本研究所使用的年齡1歲左右,體重約4 kg的20只健康貴賓犬均購自華中農業大學(武漢)實驗動物中心。
1.2 儀器與試劑
腺嘌呤(G1924214)購自Aladdin生物制品有限公司。納米硒(純度≥99%)購自Macklin生化有限公司。呋塞米注射液購自廣東萬事達動物藥業有限公司。葡萄糖NaCl注射液購自武漢濱湖雙鶴藥業。肌酐測試盒(C011-1-1)、血尿素氮測試盒(C013-1-1)、鈣測試盒(C004-2-1)、無機磷測試盒(C006-1-1)購自南京建成科技有限公司。Trizol Reagent(15596-026)購自Invitrogen Life Technologies公司。cDNA合成試劑盒、RT-qPCR試劑盒購自北京擎科新業生物技術有限公司。BCA蛋白定量試劑盒購自大連美侖生物技術有限公司。NKCC2、Caspase3、Caspase9、BAX、BCL-2抗體購自沈陽Wanleibio 試劑公司。WNK1、WNK3、CaSR、ACTB抗體、HRP標記山羊抗兔二抗及蛋白Marker購自ABclonal試劑公司。PAGE凝膠快速制備試劑盒(8%)購自上海雅酶生物科技公司。
LightCycler96 熒光定量PCR儀購自瑞士Roche集團,URIT-150Vet尿液分析儀購自桂林優利特醫療公司,OLYMPUS YCX41 光學顯微鏡購自日本奧林巴斯光學株式會社。
1.3 試驗設計及飼養管理
20只體重約4 kg年齡1歲左右的貴賓犬在做基本健康檢查并適應性喂養兩周后隨機分為空白對照組(Control,飼喂基礎日糧30 d)、急性腎衰造模組(Model,15 d基礎日糧+15 d腺嘌呤75 mg·(kg·d)-1)、常規輸液治療組(Infusion,15 d腺嘌呤75 mg·(kg·d)-1+15 d葡萄糖氯化鈉注射液60 mL·(kg·d)-1、呋塞米2~4 mg·kg-1、納米硒治療組(Nano-Se,15 d添加飼喂腺嘌呤,75 mg·(kg·d)-1+15 d添加飼喂納米硒0.5 mg·(kg·d)-1)、納米硒預防組(Prevention,15 d添加飼喂納米硒0.5 mg·(kg·d)-1+15 d添加飼喂腺嘌呤,75 mg·(kg·d)-1),每組4只犬,試驗周期為30 d。
1.4 樣本采集與處理
跟蹤記錄30 d治療周期內犬臨床狀態變化,包括精神狀態、食欲飲欲、排尿排便情況、尿液糞便顏色狀態變化,完成30 d造模與治療流程周期后對實驗犬進行靜脈采血5 mL,用于血液生化檢測,膀胱穿刺取尿用于尿常規檢測,麻醉安樂死后腎組織取樣用于石蠟切片、免疫組化以及核酸與蛋白提取等后續試驗。
1.5 犬急性腎衰判斷
參考國際急性腎衰造模試驗標準,在造模后犬7~15 d內出現穩定的血清CRE,BUN上升且超出正常范圍,其中,血肌酐濃度需達到三級腎衰CRE 180~440 μmol·L-1標準。
1.6 血清肌酐與血清尿素氮含量的測定
全血分離血清后分,別使用肌酐測定試劑盒(除蛋白法)及血清尿素氮測定試劑盒(二乙酰肟比色法)進行檢測。
1.7 血清鈣離子與磷離子濃度測定
全血分離血清后,分別使用鈣測試盒與無機磷測試盒測定濃度。
1.8 尿常規檢測
將5 mL注射器收集到的尿液轉移到無菌離心管中,將尿常規檢測試紙完全浸于尿液中1 min,將浸潤的試紙條置于尿液分析儀中進行檢測并記錄。
1.9 RT-qPCR檢測離子轉運及凋亡相關基因表達水平
Trizol法提取腎組織總RNA,并測定其濃度與純度,根據cDNA合成試劑盒說明將RNA反轉錄為cDNA,最后根據RT-qPCR試劑盒說明測定離子轉運及凋亡相關基因mRNA表達水平。引物序列見表1。
1.10 Western blot檢測離子轉運及凋亡相關蛋白表達水平
提取腎組織蛋白,BCA試劑盒測定總蛋白濃度,用SDS-PAGE Loading Buffer將其稀釋至同一濃度并煮沸。SDS-PAGE(8%)電泳分離蛋白樣品,轉膜,用5%脫脂奶粉封閉。一抗統一于4 ℃孵育過夜,TBST洗滌3次后,二抗常溫孵育1 h,TBST洗滌后,ECL顯色。用Image J(National Institutes of Helth,America)計算蛋白條帶灰度值。
1.11 數據處理
2 結 果
2.1 納米硒犬腎衰治療對比試驗中血清、尿液檢測
如圖1A、B所示,造模組CRE與BUN較空白組顯著上升,且CRE達到三級腎衰標準判定為造模成功;補液治療組、納米硒治療組、納米硒預防組對比造模組CRE與BUN均出現極顯著(P<0.01)或顯著(P<0.05)下降。由圖1C、D顯示,對比造模組,納米硒治療組血清鈣濃度顯著上升(P<0.05),納米硒治療組與預防組血清磷濃度顯著下降(P<0.05)。如圖1E、F所示,對比造模組,納米硒治療組與預防組尿比重顯著升高(P<0.05),納米硒治療組尿pH顯著升高(P<0.05)。
2.2 腎組織離子轉運相關RT-qPCR、Western blot與切片免疫組化分析
如圖2A~C所示,對比造模組,納米硒治療組CaSR mRNA表達量顯著增加(P<0.05),納米硒預防組WNK1 mRNA表達量顯著減少(P<0.05),納米硒治療組NKCC2 mRNA表達量極顯著減少(P<0.01)。如圖2D、E~G顯示,對比造模組,納米硒治療組CaSR蛋白表達量顯著上升,WNK1、NKCC2蛋白表達量顯著下降(P<0.05),納米硒預防組WNK1蛋白表達量顯著下降(P<0.05)。
如圖3所示,NKCC2蛋白在造模組表達量明顯升高,且在壞死腎小管上皮細胞、腎小管間隔周圍高表達,腎小管間質炎性細胞增多,補液治療組、納米硒治療組、納米硒預防組NKCC2蛋白表達量相比造模組均下降,且各治療組腎小管間質炎性細胞數量下降。
2.3 腎組織凋亡相關RT-qPCR與Western blot檢測
如圖4A~D所示,相對造模組,納米硒治療組與預防組BCL-2/BAX相對轉錄量為增加趨勢,納米硒治療組WNK3 mRNA極顯著增加(P<0.01),Caspase3與Caspase9 mRNA顯著降低(P<0.05)。如圖4E、F~I所示納米硒治療組BCL-2/BAX表達量較造模組相對增加,WNK3與Caspase9表達量較造模組極顯著(P<0.01)或顯著(P<0.05)增加,Caspase3表達量相對造模組極顯著下降(P<0.01)。
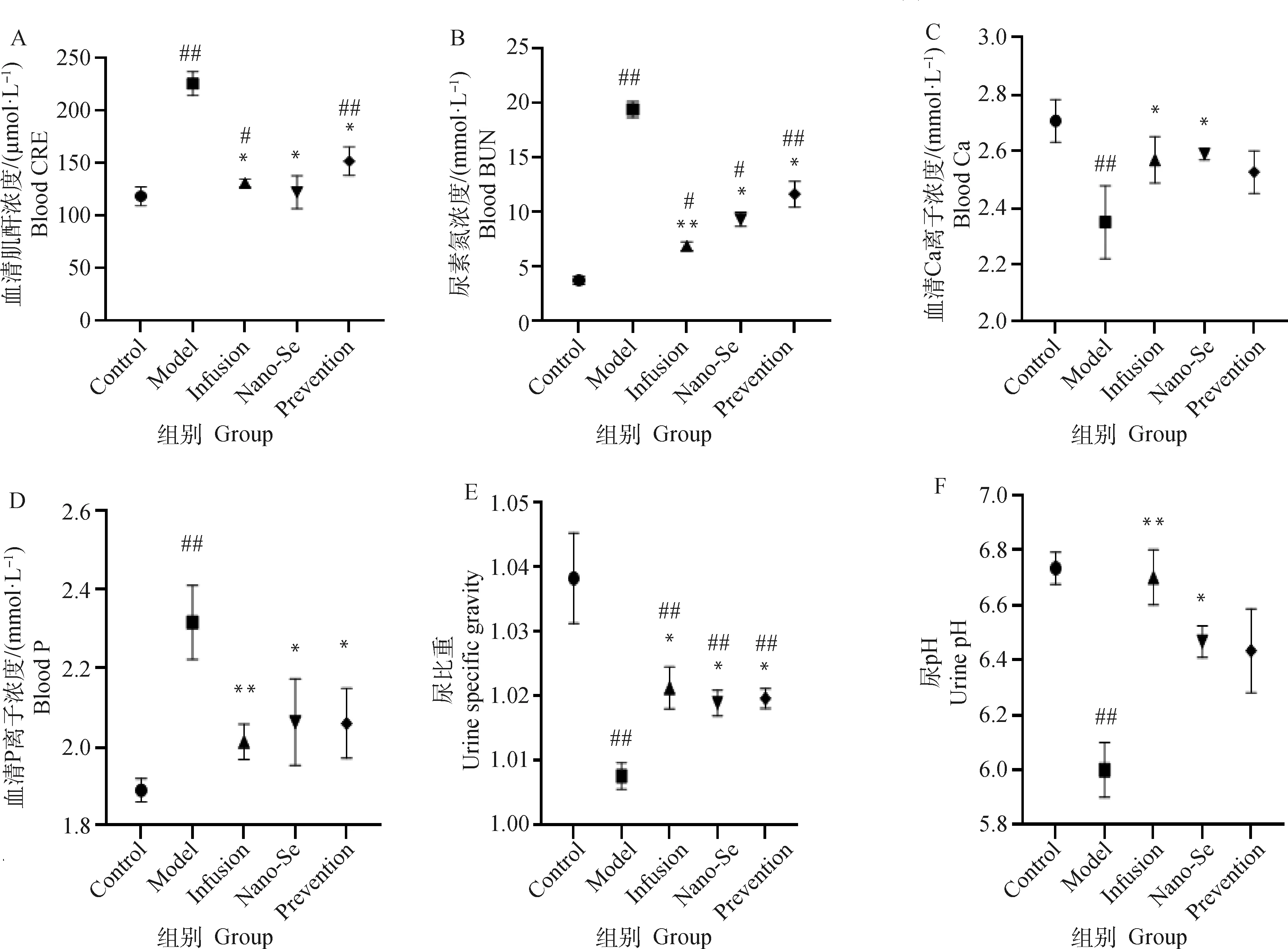
A、B.各組犬血清肌酐和尿素氮深度;C、D.各組犬血清鈣離子、磷離子濃度;E、F.各組犬尿比重、尿液pH;Control. 空白對照組;Model. 腎衰造模組;Infusion. 輸液治療組;Nano-Se. 納米硒治療組;Prevention. 納米硒預防組;對比造模組,*. P<0.05,**. P<0.01;對比空白對照組,#. P<0.05,##. P<0.01,下同;參考正常范圍:CRE(44~159 μmol·L-1),BUN(2.9~7.5 mmol·L-1),尿比重(1.015~1.045),尿pH(5.4~7.4),血鈣(2.25~3.00 mmol·L-1),血磷(0.97~1.76 mmol·L-1)A, B. Differences in serum creatinine (μmol·L-1) and blood urea nitrogen (mmol·L-1) of dogs in each group;C, D. Differences in serum calcium ion and phosphorus ion concentrations (mmol·L-1) in each group of dogs;E, F. Differences in urine specific gravity and urine pH of dogs in each group;Control. Blank control group; Model. Renal failure modeling group; Infusion. Infusion treatment group; Nano-Se. Nano-selenium treatment group; Prevention. Nano-selenium prevention group; Compared with modeling group, *. P<0.05, **. P< 0.01; Compared with blank control group, #. P<0.05, ##. P<0.01, the same as below; reference normal range: CRE (44-159 μmol·L-1), BUN (2.9-7.5 mmol·L-1), urine specific gravity (1.015-1.045), urine pH (5.4-7.4), blood calcium (2.25-3.00 mmol·L-1), blood phosphorus (0.97-1.76 mmol·L-1)圖1 血清、尿液檢測結果Fig.1 Serum and urine test results
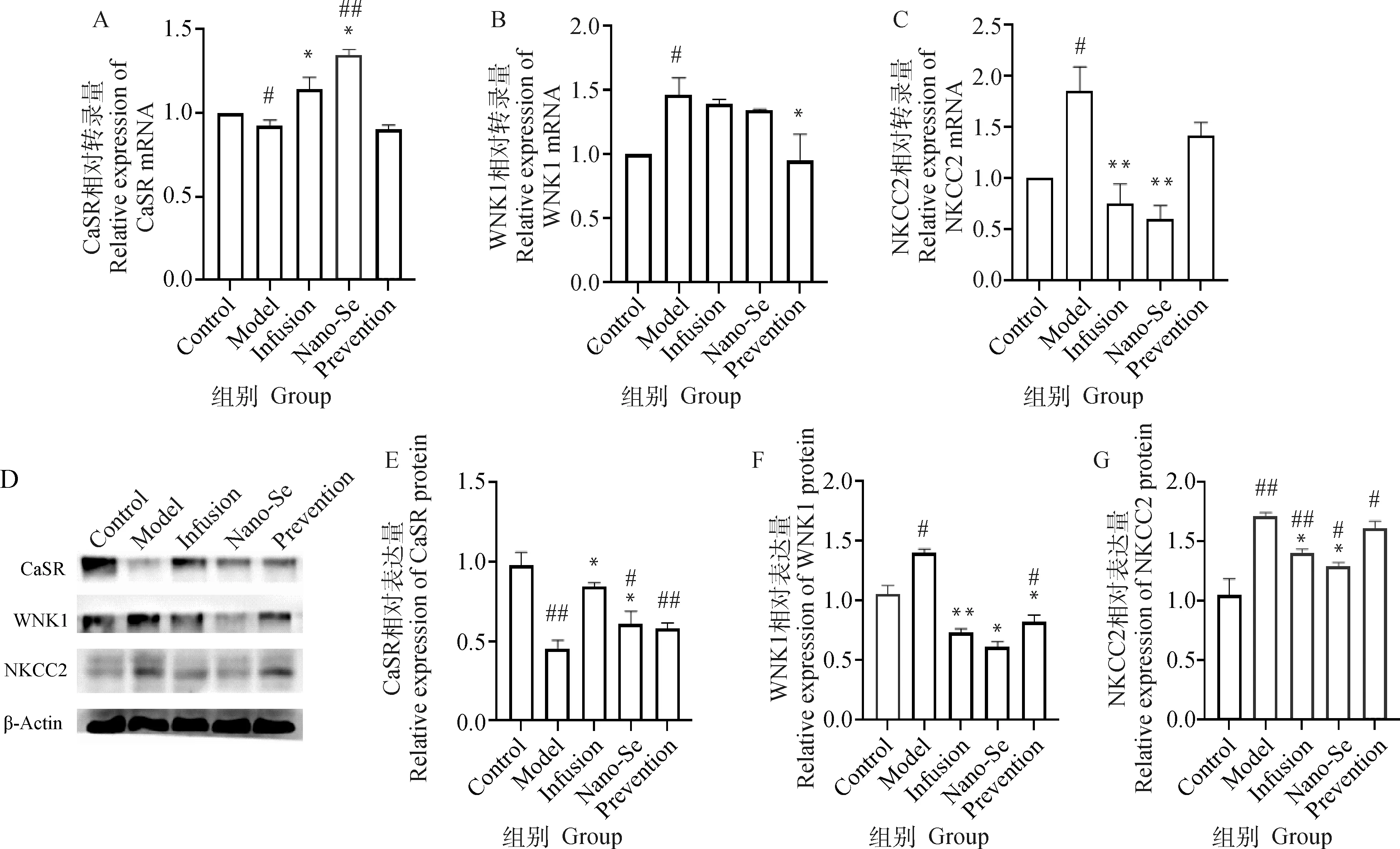
A~C. 各組犬腎組織CaSR、WNK1、NKCC2 (mRNA)表達差異;D、E~G.各組犬腎組織CaSR、WNK1、NKCC2蛋白的Western blot檢測結果與灰度值分析結果A-C. Differences in the expressions of CaSR, WNK1, NKCC2 (mRNA) in kidney tissue of dogs in each group; D, E-G. Western blot detection results and gray value analysis results of CaSR, WNK1, NKCC2 proteins in dog kidney tissues of each group圖2 腎組織離子轉運相關RT-qPCR與Western blot結果Fig.2 Results of RT-qPCR and Western blot related to ion transport in renal tissue
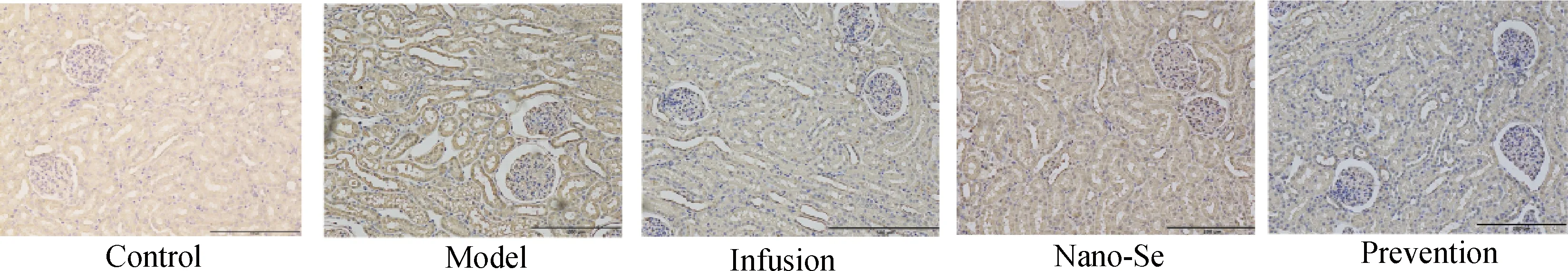
圖3 犬腎組織切片NKCC2抗體免疫組化結果 (200×)Fig.3 Immunohistochemical results of NKCC2 antibody in canine kidney tissue sections (200×)
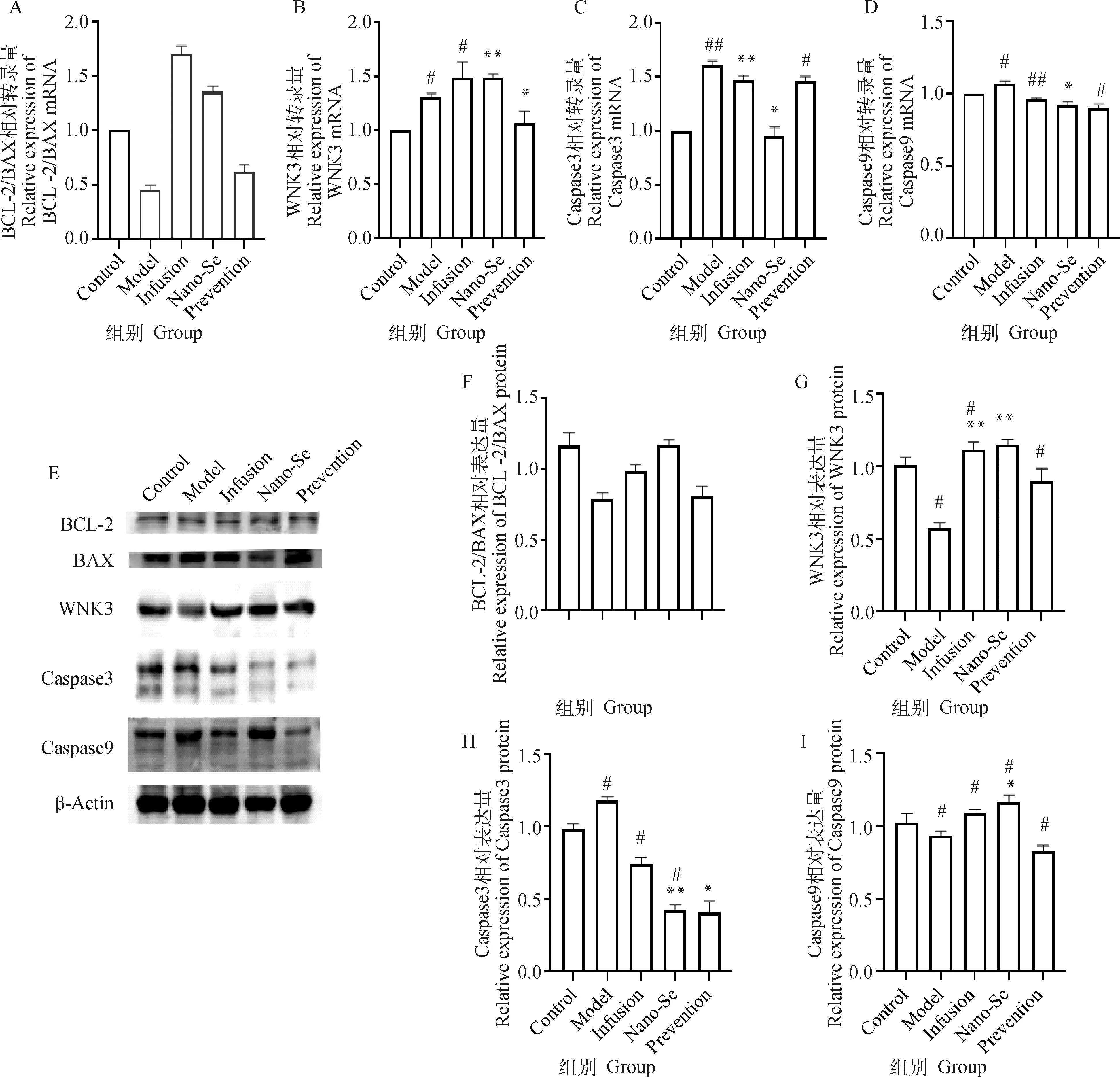
A~D.各組犬腎組織BCL-2/BAX,WNK3、Caspase3、Caspase9 (mRNA)表達差異;E、F~I.各組犬腎組織BCL-2/BAX,WNK3、Caspase3、Caspase9蛋白的Western blot檢測結果與灰度值分析結果A-D. Differences in the expressions of BCL-2/BAX,WNK3,Caspase3,Caspase9 (mRNA)in kidney tissue of dogs in each group; E, F-I. Western blot detection results and gray value analysis results of BCL-2/BAX,WNK3,Caspase3,Caspase9 proteins in dog kidney tissues of each group圖4 腎組織凋亡相關RT-qPCR與Western blot結果Fig.4 Results of RT-qPCR and Western blot related to apoptosis in renal tissue
3 討 論
治療周期結束時,各組犬血清生化檢測結果顯示,補液治療組、納米硒治療組與納米硒預防組的CRE與BUN較造模組均有數值上的顯著下降;尿常規檢測結果也顯示,補液治療組、納米硒治療組與納米硒預防組的尿比重較造模組顯著上升,尿pH較造模組顯著下降。從腎血清生化指標與尿常規指標變化來看,補液利尿與納米硒治療對于犬急性腎衰的治療均有積極作用且效果顯著。
造模組發生腎衰時表現出明顯的血鈣含量下降,血磷含量上升,在腎功能正常的患者中,鈣和磷酸鹽的循環水平通過甲狀旁腺激素、1,25-二羥基維生素D和成纖維細胞生長因子23三者與鈣磷鹽通過多個內分泌反饋通路相互作用,這三種激素的主要靶器官為腎、骨骼、腸道與甲狀旁腺[16],高磷血癥可以直接刺激甲狀旁腺使PTH過度分泌,一方面,增加腎鈣轉運蛋白的表達促進鈣離子重吸收,另一方面,可以通過下調腎鈉依賴性磷酸鹽轉運蛋白表達增加磷酸鹽排泄以此調節鈣磷代謝失衡。試驗結果顯示,補液治療組、納米硒治療組、納米硒預防組的血磷相對造模組均顯著降低,并增加血鈣含量,3種方法均可以減輕由急性腎衰引起的鈣磷代謝失調。
CaSR是一種G偶聯蛋白受體,通常在甲狀旁腺與腎小管中表達[17],其活化效應通過響應細胞外液鈣離子濃度,增加細胞內液Ca2+作為第二信使調控下游信號通路,腎小管上皮細胞內Ca2+信號通過激活鈣調神經磷酸酶參與調控WNK1/SPAK通路最終促進或抑制腎小管頂膜上NKCC2的磷酸化[18]。Western blot結果顯示,造模組CaSR相對空白對照組表達量降低而最終調控的NKCC2過表達,此時生理效應可能為腎在組織受損的情況下通過感應機體內血清Ca2+濃度下降CaSR-WNK1/SPAK-NKCC2通路過表達來補償受損腎小管上皮細胞對尿液的重吸收功能;由于NKCC2是一類布美他尼類敏感受體蛋白故補液利尿治療中利尿劑的選擇為速尿,通過速尿特異性刺激NKCC2蛋白表達與納米硒治療效果進行對比,在補液治療與使用納米硒后,CaSR表達量較造模組明顯增加,WNK1與NKCC2表達量相比造模組顯著減少,其原因可能為血清鈣離子的上升帶動激活腎組織中CaSR表達量的增加,通過WNK/SPAK-NKCC2通路最終減少了下游NKCC2的表達量,減弱了急性腎衰中過度代償的重吸收功能,進一步促進腎與機體的電解質水平衡。
腎組織凋亡效應增強伴隨急性腎衰的發展,在急性腎衰病程中調往與壞死效應既有積極作用也有其帶來的消極作用。通過Western blot驗證了治療周期BCL-2與BAX的表達量,結果發現,通過補液治療與添加納米硒治療后促凋亡基因BAX的表達相比造模組顯著下降,抗凋亡基因BCL-2的表達顯著增加,從一方面證明了兩種治療方法對腎組織凋亡趨勢都具有抑制作用;治療組CaSR表達量增加,進而下游WNK家族整體表達量增加,而低WNK3表達對下游Caspase-3具有直接效應,當WNK3被抑制時可加速細胞凋亡,并促進Caspase-3的活化[15]。首先在造模組可以看到明顯的Caspase3表達增強,說明細胞凋亡效應的增加,納米硒治療后,WNK3表達量增加,同時Caspase-3表達量減少,Caspase-9作為凋亡的觸發劑可激活Caspase 3直接通過自身介導的信號傳導途徑導致細胞發生凋亡,而治療組Caspase9 mRNA減少進一步反映了此時活化Caspase-3效應減弱,從另一方面證明了兩種治療方法均可以下調急性腎衰中的調亡效應。
4 結 論
納米硒可能在發生急性腎衰時改善機體鈣磷代謝,一方面,通過CaSR-WNK/SPAK-NKCC2通路間接地降低腎組織由于急性腎衰發生而過表達的離子轉運蛋白從而調節腎的重吸收功能,另一方面,通過CaSR-WNK-Caspase3通路減少腎組織促凋亡蛋白的表達從而減輕腎損傷,納米硒在機體內具體代謝及作用機制需進一步研究。

