純水和二甲基亞砜溶液中冰晶生長特性可視化研究
潘平安 張宏彬 黃永華 韓 廈 陳 威 李 錚
(1 上海交通大學制冷與低溫工程研究所 上海 200240;2 上海交通大學附屬第一人民醫院泌尿外科中心男科 男性健康評估中心 上海 200080)
生物樣本的低溫凍存是指通過降低溫度的方式抑制細胞代謝活動,實現樣品長期保存,并在需要時復溫解凍樣本,使其恢復到正常生理狀態的技術。低溫凍存技術的出現,消除了獲取和使用生物樣本之間的時間、空間差距[1-2],緩解了生物樣本在輔助生殖、干細胞治療、再生醫學等生物醫學應用中的供需矛盾[3],在推進臨床醫學、生物科學等學科發展的同時,也創造了可觀的社會價值和經濟價值。以輔助生殖為例,精子、卵母細胞等人類配子的成功凍存成為不孕不育輔助生殖治療的重要手段,有效緩解了全球范圍內因人類不孕率升高所帶來的各類社會問題[4],其全球市場價值預計在2025年超過454億美元[5]。在細胞低溫凍存過程中,冰晶生長被認為是導致細胞受損甚至死亡的主要影響因素之一[6]。冰晶生長造成的冷凍損傷主要可分為兩類[7-9]:1)胞內冰晶損傷,在快速降溫過程中,細胞外溶液生成的冰晶尖端刺破細胞膜造成機械損傷;2)溶質損傷,在緩慢降溫過程中,由于細胞內外溶液的凝固溫度不同,細胞外溶液因水分結晶濃度增大而產生較大的內外滲透壓,使細胞膜發生破裂。因此,對細胞凍存技術而言,通過研究細胞內外冰晶的生長特性從而降低冷凍損傷尤為重要。
配子凍存操作通常將細胞置于冷凍保護劑溶液中,以液滴或冷凍麥管的形式進行冷凍保存,因此必然涉及水、冷凍保護劑及細胞內液的冰晶生長過程。為深入研究冰晶生長機制,研究者們利用各種類型的生物低溫顯微鏡系統,對不同細胞的冷凍過程進行了可視化實驗研究。K. R. Diller等[10-11]研制了早期的生物低溫顯微鏡系統,以低溫氮氣為冷源,樣品冷卻速率約達100 ℃/min;K. R. Diller等[12-14]還利用該系統觀察了兔腎皮質細胞、人體紅細胞凍結過程中的胞內結晶現象。孫仲秋等[15]開發了類似的系統并研究了降溫及復溫速率對奶牛胚胎存活率的影響。郝保同等[16]研制了用于觀察方向性冰晶的定向固化冷凍平臺,并用顯微鏡觀察了不同濃度MeSO2低溫保護劑在不同降溫速率下的冰晶生長情況。T. Buttersack 等[17]利用聲波懸浮裝置,觀察了不同過冷度時純水液滴凍結時樹枝狀冰的生長過程并對其進行了參數化研究。A. A. Shibkov等[19]結合冰晶生長動力學,研究了過冷純水薄層的冰晶生長過程中冰晶尖端生長速率、半徑等主要特征參數的變化情況。
上述研究中的冷卻速度通常無法達到大于等于1 000 ℃/min的快速冷凍條件,且在同等工況下,對某種冷凍保護劑與純水冰晶形成規律的對比研究較少。
本文研制了基于瞬態接觸法的快速冷凍新型低溫顯微成像系統,對純水、二甲基亞砜(DMSO)溶液分別以平板面自由液滴和模擬凍存管槽道內冰晶生長特征進行了可視化研究,并對比了鼠生精小管在純水和質量分數為10% DMSO溶液中的冰晶形成特性。
1 實驗系統及控溫方法
1.1 實驗系統
考慮到生殖細胞實際凍存過程中樣本通常以液滴和凍存管形式凍存,設計了圖1中的部件11薄片載物臺。該載物臺為藍寶石玻璃材質,低溫下的導熱系數在600 W/(m·K)以上,上表面布置了直徑為2 mm和0.5 mm的兩條半圓管槽來模擬凍存管環境;另一個側邊槽用于嵌接熱電偶溫度計。載物臺密封壓接在環境艙底部中心處,其底面相比環境艙底面微凸0.1 mm,使得在接觸瞬間來自液氮熱沉的冷量可以集中傳遞到載物臺而不是環境倉底面。
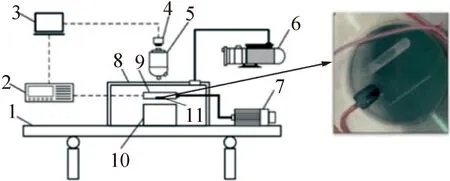
1 氣浮隔震平臺;2 數據采集儀;3 控制計算機;4 相機;5 金相顯微鏡;6 真空泵;7 步進電機;8 真空腔體;9 環境艙;10 液氮熱沉;11 藍寶石載物臺。圖1 基于瞬態接觸法的新型低溫顯微成像系統Fig.1 A new cryomicroscopy system based on the instant contact method
實驗系統主要由溫度測量系統、壓力測控系統和顯微成像系統組成。溫度測量系統主要包含精度為0.1 K的TT-36-T型熱電偶溫度傳感器(頭部直徑約為0.5 mm)、Keithley 2700六位半數據采集儀以及基于LabVIEW環境搭建的采集程序。壓力測控系統通過執行機構和設置的應變片(位于圖1中部件7和部件9之間)形成負反饋PID控制載物臺與液氮熱沉之間的壓強。顯微成像系統主要包括光學顯微鏡和CCD相機兩部分,光學金相顯微鏡的最高放大倍率為50倍,高速工業相機有效像素為130萬,最高分辨率為1 280×1 024、幀率為211幀/s。
1.2 控溫方法
上述低溫顯微成像系統主要通過控制環境艙底部載物臺與液氮熱沉之間的壓強來控制樣品的降溫速率。不同壓強條件下載物臺的降溫曲線如圖2所示(對應壓力分別為150、100、50 N)。在室溫220~300 K這一跨越液體結冰點的關鍵溫度區間內,當壓強超過3.2×105Pa時,載物臺的降溫速率平均約達1 600 K/min,遠高于文獻報道的對流型相關設備或實驗臺數據[19-23],克服了對流型設備在冷卻初期液氮進入載物臺前受熱汽化,攜帶冷量小的問題。而冷凍操作啟動的最初幾秒時間正是影響冷卻效果最關鍵的部分。由圖2可知,載物臺在60 s內溫度可降至約100 K;當壓強減小后,載物臺的降溫速率減小。
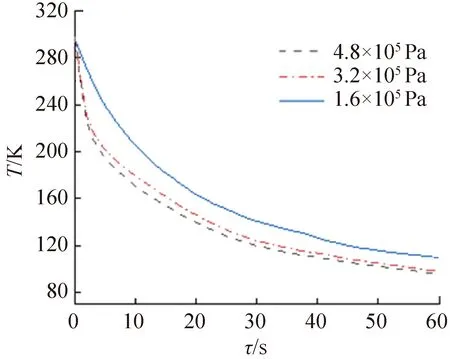
圖2 不同壓強條件下載物臺的降溫曲線Fig.2 Cooling rates of the stage under different pressures
2 結果與分析
基于上述瞬態接觸法低溫顯微成像系統,開展了自由平板面和半圓管內純水、DMSO溶液液滴在不同液滴直徑、液滴過冷度條件下的冰晶生長過程特性可視化研究。
2.1 平板面純水及DMSO溶液過冷液滴冰晶生長
純水液滴的凍結一般可分為兩個階段[24-26],第一階段由于液體過冷狀態不穩定,冰晶的凍結前端會產生一些小的隆起并不斷發展形成樹枝狀冰網,該階段持續時間非常短,當冰網最終布滿整個液滴時進入第二階段,第二階段中冰網間隙剩余的液態水繼續凍結,整個過程由相對穩定的傳熱主導,可視為持續時間較長的準等溫過程。本實驗系統捕捉到的一個直徑為2 mm純水(雜質質量分數小于10 mg/kg)液滴的典型凍結過程如圖3所示。拍攝圖像中的亮斑是由于液滴凸面反射光源形成,通過對比0 ms和33 ms的瞬時圖像可知,液滴整體亮度瞬間發生顯著變化。這是由于樹枝狀冰網的產生改變了冰水混合物的折射率及密度,被樹枝狀冰網覆蓋的區域在視覺上呈現出變暗的特點,此時液滴內已經形成較為完整的樹枝狀冰網,而這一過程僅發生在33 ms內。

圖3 直徑為2 mm純水液滴凍結過程Fig.3 Freezing process of a pure water droplet with 2 mm diameter
圖3中132 ms時已經可以看到清晰的凍結前端由外向內的推進過程。該由外向內的凍結過程指的并不僅是水平方向從液體邊緣到液體中心,事實上,由于局限于單一的俯視觀測方向,實驗僅能觀察到液滴投影范圍內的明暗變化,而實際是水平和垂直兩個維度的特征疊加。理論上,凍結過程應該是由熱通量的負方向即液滴底面與載物臺接觸的部分開始向液滴頂部進行。圖3中167 ms時凍結的第二階段已經完成,從此角度觀察并未發現液體邊緣凍結前后的位移變化,故推測液滴凍結時體積的膨脹主要發生在垂直方向,期間液滴的表面張力起到了關鍵作用。
對3種不同直徑(2、3、4 mm)的純水液滴在不同過冷度條件下進行了凍結實驗,冰晶生長的平均速率(定義為單位時間內冰晶邊緣移動的位移)如圖4所示。由圖4可知,3個直徑規格的純水液滴冰晶平均生長速率均隨過冷度的增加呈現先增后減的趨勢,且均在15~20 ℃的過冷度范圍內達到最大值。出現該現象的原因是由于純水的黏度隨溫度的降低而增加,在-15 ℃時其黏度已達到0 ℃時的3倍,黏度的增加在一定程度上阻礙了剩余水分子的移動,從而導致冰晶生長速率變緩。
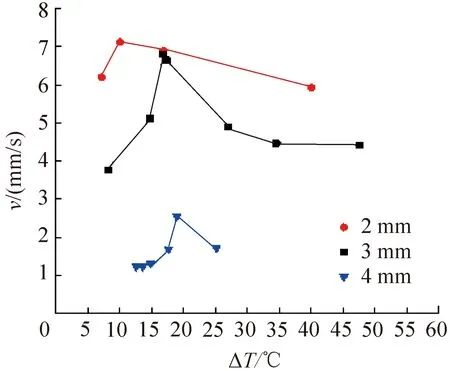
圖4 純水液滴在不同過冷度條件下的冰晶生長速率Fig.4 Ice formation rates of pure water droplets under different degree of subcooling conditions
不同直徑純水液滴的冰晶平均生長速率差異顯著,總體上在一定直徑范圍內冰晶生長速率隨液滴直徑的減小顯著提升。從傳熱學角度分析可得:當液滴直徑較小時,凍結過程由導熱主導,可近似于一維固化過程。當忽略液滴與周圍氣體的自然對流換熱時,冰晶生長速率較大程度上取決于液體的熱擴散系數及與載物臺的換熱量[16]。其中換熱量與液滴底面積即液滴直徑的平方成正比,液滴凍結所需的冷量又與液滴體積即液滴直徑的三次方成正比,即冰晶的平均生長速率與液滴直徑成反比。因此,選用直徑較小的液滴在約20 ℃過冷度條件下進行細胞冷凍可獲得較高的冷凍速率從而減少細胞損傷。
對3種不同直徑(2、3、4 mm)的DMSO溶液液滴也進行了類似冷凍實驗,不同過冷度條件下的冰晶生長速率如圖5所示。由圖5可知,在實驗過冷度范圍內,3個尺度的DMSO溶液液滴冰晶生長速率與過冷度的依變關系無明確的規律,且存在同一直徑的液滴,在相近的過冷度范圍內冰晶生長速率也具有顯著差異的現象。但與純水相比,DMSO溶液的冰晶生長速率顯著低于純水。因此,若要達到相同級別的冰晶生長速率,DMSO溶液總體趨勢上需要更大的過冷度。
在1970年代,美國地質調查局首先使用先進的測量技術來測定圣安德烈斯斷層系上應變積累的位置和速率。今天,許多研究小組每年使用足夠精確的全球衛星定位接收器進行幾個月的連續觀測來采集應變數據,以便確定每年幾厘米的長期水平應變積累速率。
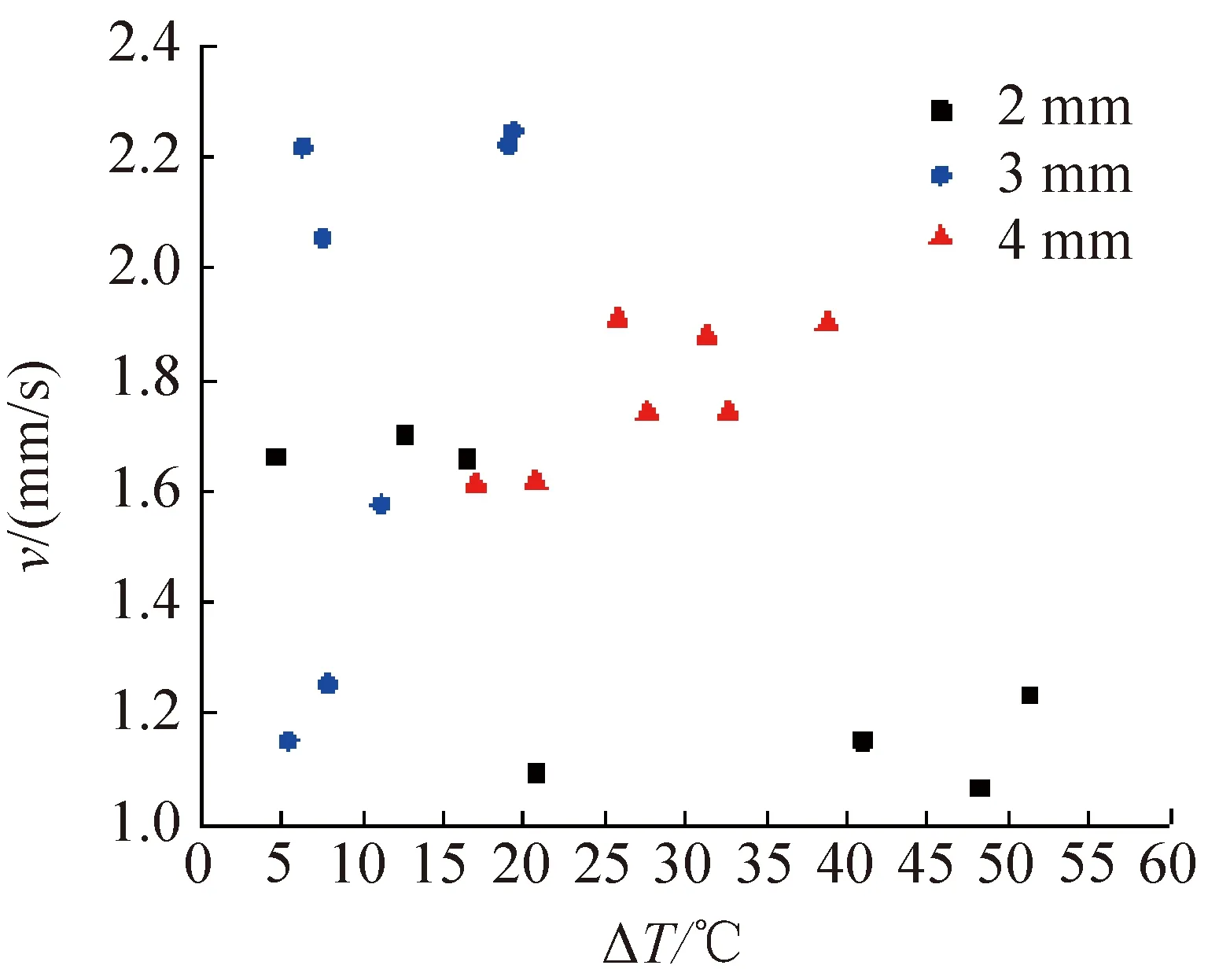
圖5 DMSO溶液液滴在不同過冷度條件下的冰晶生長速率Fig.5 Ice formation rates of DMSO solution droplets under different undercooling conditions
通過對比直徑為2 mm的DMSO溶液在過冷度為7~8 ℃范圍內冰晶的生長過程可知,該冰晶生長速率的巨大差異是由DMSO溶液液滴獨特的結晶方式引起的。圖6和圖7所示分別為液滴在過冷度為7.8、7.5 ℃兩個非常接近工況下的凍結過程。不同于純水液滴的結晶方式,DMSO溶液液滴結晶不再由液滴底部均勻開始,而是在液滴整體區域內的隨機位置發生。由圖6可知,過冷度為7.8 ℃工況下,29 ms時液滴區域內首次出現點狀晶核,隨后冰晶不斷擴散生長,496 ms時在另一位置出現晶核,隨后兩者進入同步并行生長過程。由圖7可知,過冷度為7.5 ℃工況下,點狀晶核出現在液滴中心位置附近,并向四周擴散推進,并在251 ms已基本處于生長末期。

圖6 過冷度為7.8 ℃,直徑為2 mm DMSO溶液液滴的凍結過程Fig.6 Freezing process of DMSO solution droplet with 2 mm diameter when degree of subcooling is 7.8 ℃

圖7 過冷度為7.5 ℃,直徑為2 mm DMSO溶液液滴的凍結過程Fig.7 Freezing process of DMSO solution droplet with 2 mm diameter when degree of subcooling is 7.5 ℃
綜上所述,DMSO溶液液滴中冰晶的生長過程相比純水液滴具有誘發點隨機性強的特點。冰晶生長初期,晶核在DMSO溶液液滴底部溫度最低處隨機生成,隨后呈輻射狀向三維空間內生長,在此過程中有可能與其他位置的冰晶發生交匯,導致相同情況下的DMSO溶液液滴中冰晶生長速率差異較大。此外,DMSO溶液液滴中冰晶的生長速率顯著低于純水液滴,表明采用DMSO保護劑有助于減小冰晶對溶液中細胞的損傷。
2.2 半圓槽道內純水冰晶生長
臨床應用中的精子樣本通常置于冷凍管載體中進行凍存,因此有必要進行液體在圓管內的冷凍實驗。為消除細管自身的透明度及對光學觀察的影響,本實驗采用半圓槽道的載體進行液體裝載。圖8所示為直徑為2 mm半圓槽道(圖1部件11)內純水在不同過冷度條件下的冰晶生長速率。由圖8可知,過冷度在0~10 ℃時,冰晶生長速率基本與過冷度呈線性相關,但冰晶生長較慢。主要原因是槽內純水沿槽道方向也有分布,其體積和熱容遠大于上述液滴,結晶前端推進單位長度所需的冷量一般是液滴的數倍。同時圓形槽道壁面也對冰晶在水平方向的擴展起到限制作用。

圖8 不同過冷度條件下半圓槽道內純水的冰晶生長速率Fig.8 Ice formation rates of pure water in groove under different degree of subcooling conditions
槽道內純水的冰晶生長一般由壁面開始。圖9~圖11所示為在不同過冷度條件下,冰晶生長的形貌變化。過冷度在0~4 ℃時,凍結前端呈現寬大圓潤的無分叉冰枝形態,冰晶生長平均速率為24 μm/s。單個冰枝的形態寬度和生長方向均無顯著規律,該結論與A. A. Shibkov等[19]在薄層水凍結實驗中觀察到凍結尖端的分裂即分叉的樹枝狀冰晶現象不同。當過冷度進一步升至4~6 ℃時,冰枝尖端顯著變尖且整體變窄,冰枝的分布更均勻,冰晶生長的平均速率為86 μm/s;當過冷度超過6 ℃時,冰枝已經形成極窄的細針狀,在一定范圍內具有一致的生長方向。無論從冰晶生長速率還是冰枝形態來看,低過冷度下純水的冰晶生長過程較溫和,而高過冷度條件下冰晶生長不僅具有更大的動量,且其尖端更鋒利,應力更集中,更容易穿透細胞膜并對細胞造成損傷,此時冰晶生長平均速率已達到240 μm/s。因此,推測A. A. Shibkov等[19]的測試結果可能是在過冷度較大的條件下獲得。

圖9 0.5 ℃過冷度條件下槽道內純水凍結過程Fig.9 Freezing process of pure water in groove when degree of subcooling is 0.5 ℃

圖10 4.3 ℃過冷度條件下槽道內純水凍結過程Fig.10 Freezing process of pure water in groove when degree of subcooling is 4.3 ℃

圖11 9.5 ℃過冷度條件下槽道內純水凍結過程Fig.11 Freezing process of pure water in groove when degree of subcooling is 9.5 ℃
2.3 生精小管的冰晶生長
在上述實驗的基礎上,進一步開展了鼠生精小管的冷凍實驗,過冷度設定為20 ℃。鼠生精小管在純水和質量分數為10% DMSO溶液中的凍結過程如圖12、圖13所示。由圖12和圖13可知,純水中生精小管的凍結分為小管內外兩部分,管外的純水冰晶呈細針狀快速生長,在達到管壁后,管內靠近壁面部分也開始結晶,呈現零散的黑色點狀區域。在管內冰晶生長的同時,管壁的另一側也觀察到細針狀冰晶從管壁處開始生長。但在質量分數為10%DMSO溶液中,水分子通過與DMSO的作用使溶液黏性增加,冰點降低,顯著弱化了管外的冰晶生長,使其不再具有窄長細針狀的形態,降低了其對生精小管的機械損傷風險,使生精小管得以維持較完好的生理形態。

圖12 生精小管在純水中冷凍實驗Fig.12 Freezing process of seminiferous tubules in pure water

圖13 生精小管在質量分數為10%DMSO溶液中冷凍實驗Fig.13 Freezing process of seminiferous tubules in 10% DMSO solution
3 結論
本文研制了一套基于瞬態接觸冷卻方法的新型低溫顯微成像系統,觀察了平板面和圓形槽道內純水、DMSO溶液及鼠生精小管的冰晶形成現象,分析了水和冷凍保護劑在不同過冷度條件下的冰晶生長特征,得到結論如下:
1)在平板面上的液滴冷凍實驗中,冰晶由純水液滴的熱通量負方向開始較均勻地生長,而DMSO溶液液滴內的冰晶生長則呈現隨機性多點生長特征;DMSO溶液液滴內的冰晶生長速率顯著低于純水,表明采用DMSO保護劑有助于減小冰晶對溶液中細胞的損傷。
2)在槽道內的液滴冷凍實驗中,純水冰晶生長速率隨過冷度增加近似呈線性增長,生長形態總體上為無分叉的樹枝狀冰晶,但其幾何形貌隨過冷度不同而呈現顯著差異。低過冷度時,冰枝尖端圓潤且間隔較寬,高過冷度時,冰枝呈細針狀。
3)在生精小管冷凍實驗中,由于水分子與DMSO作用弱化了冰晶生長,鼠生精小管外的冰晶即使在大過冷度下也未出現在純水實驗中觀察到的細針狀形態,降低了冰晶對生精小管的機械損傷風險,使生精小管得以維持更為完好的生理形態。
本文受上海市科委創新行動計劃(20S31903400)、上海市申康促進創新能力三年行動計劃 (SHDC2020CR3077B)和上海交通大學醫工交叉研究基金(YG2021QN86)項目資助。(The project was supported by Innovation Action Plan of Shanghai Science and Technology Commission(No.20S31903400), Three-year Action Plan of Shanghai Shenkang to Promote Innovation Ability(No.SHDC2020CR3077B) and Biomedical Engineering Interdisciplinary Fund of Shanghai Jiao Tong University (No.YG2021QN86).)

