SPP1在頭頸部鱗狀細胞癌的免疫浸潤及臨床相關性分析
楊開炎 ,黃蘭誠 ,林鉆平 ,唐鳳珠*,李旭祥,馮大益
(1.廣西中醫藥大學瑞康臨床醫學院,南寧 530000 ;2.廣西壯族自治區人民醫院 耳鼻咽喉頭頸科,南寧 530000;3.廣西百色市人民醫院 耳鼻咽喉頭頸外科,廣西 百色 533000;4.廣西百色市人民醫院 病理科,廣西 百色 533000)
頭頸部鱗狀細胞癌(HNSC)是全球第八大常見癌癥[1],主要起源于口腔、口咽、下咽、喉和鼻咽內的亞解剖部位[2]。在全球范圍內,2020年報告的HNSC新病例約880 000例,死亡病例約440 000例[1]。在臺灣和東南亞,口腔鱗狀細胞癌占HNSC的主要比例[3]。根據TNM分期和原發部位,HNSC主要采用不同組合的手術、放療和化療的方法[4]。盡管技術和支持治療的進步提高了HNSC患者的生活質量,但由于術后局部復發和遠處轉移,整體預后仍然較差[5]。接受同步放化療的 HNSC 患者的5年總生存(Overall survival,OS)率約為50%[6],中位OS時間為 66.3個月[7]。
免疫治療作為一種新的治療方法已經應用于多種惡性腫瘤的研究,并在一些惡性腫瘤取得較好療效。盡管免疫檢查點抑制劑在癌癥治療中顯示出巨大的應用前景,但不同腫瘤和同一腫瘤不同患者中的治療效果存在較大的異質性[8]。惡性腫瘤的免疫逃避機制和腫瘤微環境免疫抑制狀態,構成了免疫治療的障礙。HNSC患者的不良臨床結果可能取決于其腫瘤免疫浸潤的特征[9]。因此,迫切需要了解影響HNSC腫瘤免疫微環境的分子標志物,以進行個體化治療及改善預后。
分泌型磷蛋白1(Secreted Phosphoprotein 1,SPP1),也稱為骨橋蛋白(Osteopontin,OPN),是由SPP1基因編碼的一種鈣結合糖磷蛋白,存在于許多正常組織中[10]。SPP1既可以充當細胞粘附蛋白,又可以充當細胞因子,通過多種細胞表面受體(包括多種整聯蛋白和CD44)將信號傳遞至細胞內[11]。SPP1與這些細胞表面受體的結合可引起細胞功能的廣泛變化,例如移動性和粘附性增強、生長和分裂加速、細胞存活時間延長和血管生成[12]。SPP1參與許多生理和病理過程,包括骨和骨基質重塑、血管生成、癌變、炎癥和自身免疫[13]。Zhang等[14]研究發現SPP1可能促進膀胱癌的增殖,抑制細胞凋亡并加速侵襲,從而促進膀胱癌的發展和轉移。臨床研究表明,在許多類型的人類癌癥中,SPP1水平與惡性程度或患者存活率之間存在相關性[15]。Overgaard等[16]對 320 例頭頸癌病例進行了研究,報告稱SPP1高表達的患者局部復發率比低表達患者高2.85倍。目前SPP1在HNSC中的免疫浸潤相關性研究較少,通過TCGA的HNSC數據,分析了SPP1在HNSC中對免疫浸潤的影響及其與臨床預后的相關性,以明確SPP1在HNSC預后和個體化治療中的作用。
1 材料和方法
1.1 數據來源及數據處理
數據來源自UCSC官網(https://xenabrowser.net/datapages)下載的TCGA HNSC的RNA測序數據,以及對應樣本的臨床、預后數據和批次效應注釋文件。使用R語言讀取HNSC的counts數據,并根據TCGA官網(https://portal.gdc.cancer.gov)下載的泛癌樣本注釋文件過濾樣本,將不合格樣本剔除(活檢前有放化療病史、合并多種腫瘤,以及為復發或轉移的腫瘤患者),同時提取其中的mRNA表達矩陣。根據過濾的樣本,篩選對應樣本的臨床數據及預后數據。
1.2 表達差異分析
使用R語言的DESeq2[17]包對mRNA表達矩陣進行表達差異分析,分析過程納入批次效應,以lgFC絕對值>0.5,校正后P值<0.05為界值,以獲得差異基因用于下游分析。
1.3 臨床相關性分析
使用R語言將TCGA HNSC的mRNA表達矩陣counts數據轉換為TPM格式數據,以用于后續分析。使用UCSC官網下載的HNSC的臨床數據,結合TCGA HNSC的mRNA表達矩陣,將TCGA HNSC患者按SPP1表達量的4分位數分組,高于表達量75%分位數為高SPP1表達組,低于表達量25%分位數為低SPP1表達組,分析SPP1表達與臨床病理特征的相關性,使用Cox回歸模型進行單變量及多變量分析,并繪制Kaplan-Meier生存曲線。
1.4 相關性分析及基因富集分析
基因富集分析是分析基因功能的一種方法,主要包括基因本體論(Gene Ontology,GO)[18]分析和信號通路分析。其中GO分析包括3個部分,分別為分子功能(Molecular Function,MF)分析、生物過程(Biological Process,BP)分析和細胞組成(Cellular Components,CC)分析。KEGG[19]的全稱為京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG),是從分子水平信息,特別是基因組測序和其他高通量實驗技術產生的大規模分子數據集,了解細胞、生物體和生態系統等生物系統的高級功能和實用性的綜合性數據庫。GSEA[20]全稱是基因集富集分析(Gene set enrichment analysis,GSEA),利用測序或芯片獲得的全基因組表達譜進行分析,不需要指定差異基因閾值,得出的結果更加可靠。使用R語言的cor.test函數對SPP1與差異基因中其他mRNA分子進行相關性分析,計算Pearson相關系數,并將與SPP1最正相關的前200個基因用于下游分析。使用R語言clusterProfiler[21]包中的EnrichGO及EnrichKEGG函數對SPP1最正相關的前200個基因進行GO及KEGG分析,使用gseKEGG函數對整個mRNA表達矩陣進行基于GSEA算法的KEGG分析。
1.5 腫瘤浸潤免疫細胞分析
CIBERSORT (https://cibersort.stanford.edu)是一種準確且穩健的算法,用于根據基因表達譜計算組織的細胞組成[22]。使用R語言的CIBERSORT函數對HNSC的mRNA的表達矩陣進行腫瘤浸潤免疫細胞分析,獲得所有樣本的腫瘤浸潤免疫細胞表達比例矩陣,并將腫瘤免疫浸潤矩陣結合HNSC的 mRNA的表達矩陣中SPP1的表達量數據進行SPP1表達與腫瘤浸潤免疫細胞關聯性分析。
1.6 統計分析
對測序數據的清洗和分析使用R語言(版本 4.0.3)進行,對臨床數據的統計分析使用 IBM SPSS 23.0版本進行。繪圖使用R語言及GraphPad Prism 8.0軟件。使用卡方檢驗分析SPP1表達與患者臨床病理特征之間的關聯。使用單變量和多變量Cox回歸分析評估生存數據。生存曲線使用 Kaplan-Meier方法繪制,并使用log-rank檢驗進行比較。在所有分析中,小于0.05的雙尾P值被認為具有統計學意義(*P<0.05, * *P<0.01, * * *P<0.001)。
2 結 果
2.1 數據來源及數據處理
為了獲取清潔的數據來源,使用R語言讀取HNSC的RNA測序counts格式數據,并根據TCGA官網的樣本注釋文件過濾樣本,將不合格樣本剔除(活檢前有放化療病史、合并多種腫瘤,以及為復發或轉移腫瘤患者),同時提取其中的mRNA表達矩陣,從而獲得了包含466個腫瘤組織樣本,39個正常組織樣本,以及18 498個編碼基因的mRNA表達矩陣。使用R語言讀入并合并下載自UCSC官網的相應樣本的臨床及預后數據,剔除臨床資料缺失的樣本后,獲得433個具有完整臨床病理分期及預后數據的腫瘤組織樣本信息。處理后的數據將用于后續分析。
2.2 表達差異分析
為了獲得TCGA HNSC mRNA表達矩陣中的差異基因,使用R語言的DESeq2包對mRNA表達矩陣進行表達差異分析,分析過程納入批次效應,以lgFC絕對值> 0.5,校正后P值< 0.05為界值,通過腫瘤組織樣本與正常組織樣本比較,獲得了8 146個差異基因,其中上調基因3 631個,下調基因4 515個,并以火山圖展示基因集差異表達情況(見圖1a)。在獲得的差異基因中,SPP1在腫瘤組織樣本表達較正常組織樣本顯著增高(見圖1b,P<0.001),lgFC值為2.53。進一步通過GEPIA網站[23]的生存曲線繪制,發現SPP1在HNSC中具有預后價值。因此,推測SPP1可能在HNSC發生與發展過程起重要作用。我們在表達差異分析中以lgFC絕對值> 0.5為界值,獲取了8 146個差異基因,目的是為了獲取更多的與SPP1相關性高的差異基因用于后續分析。

圖1 TCGA HNSC數據集的基因差異分析Fig.1 Analysis of gene differential expression in TCGA HNSC data set
2.3 臨床相關性分析
為了探索SPP1表達與HNSC患者臨床病理特征的相關性及其預后價值,將TCGA HNSC患者按SPP1表達量的4分位數分組,高于表達量75%分位數為高SPP1表達組,低于表達量25%分位數為低SPP1表達組,兩組共包含202例腫瘤樣本(見表1)。分析了SPP1與臨床病理特征的相關性,結果(見表2),SPP1 表達與年齡(P= 0.003)、臨床分期(P= 0.013)及T 分期(P= 0.001)顯著相關。然而,SPP1的表達與性別(P= 0.555)、N分期(P= 0.191)及M分期(P= 0.507)無關。Cox回歸分析用于確定SPP1表達水平是否可以作為影響生存的危險因素。通過單變量Cox回歸分析,與SPP1低表達者相比,SPP1高表達患者死亡風險顯著增加(P=0.022)(見表3)。將單變量分析中對生存影響有統計學意義(P<0.05)的變量納入多變量Cox回歸分析,結果顯示當SPP1表達(P=0.037)、性別(P=0.024)及M分期(P=0.004)包括在內時,SPP1可能是預測不良生存的獨立危險因素(見表4)。Kaplan-Meier生存曲線表明SPP1高表達患者的總生存期明顯短于SPP1低表達患者(見圖2,P=0.020 4),SPP1高表達患者中位生存時間為993 d,而低表達患者中位生存時間為4 856 d。總的來說,這些結果表明,SPP1在HNSC患者中的高表達與腫瘤的進展及較短的存活期相關。

表1 TCGA HNSC患者基線資料表Table 1 Baseline data of TCGA HNSC patients
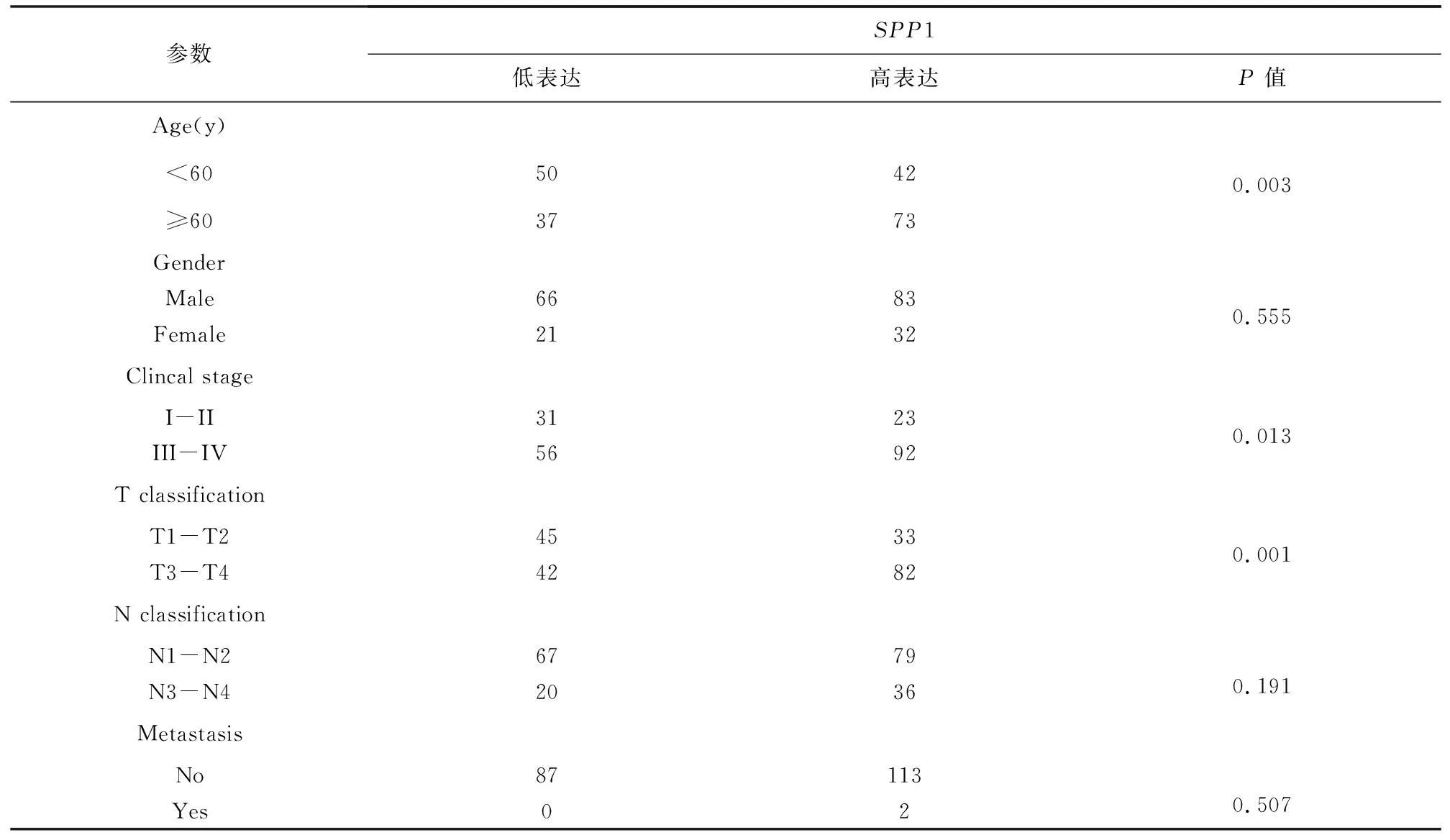
表2 SPP1表達與TCGA HNSC 患者臨床病理特征的相關性Table 2 Correlation between SPP1 expression and clinicopathological characteristics of TCGA HNSC patients

表3 TCGA HNSC患者各種預后參數的單變量Cox回歸分析Table 3 Univariate Cox regression analysis of various prognostic parameters of TCGA HNSC patients

表4 TCGA HNSC患者各種預后參數的多變量Cox回歸分析Table 4 Multivariate Cox regression analysis of various prognostic parameters of TCGA HNSC patients
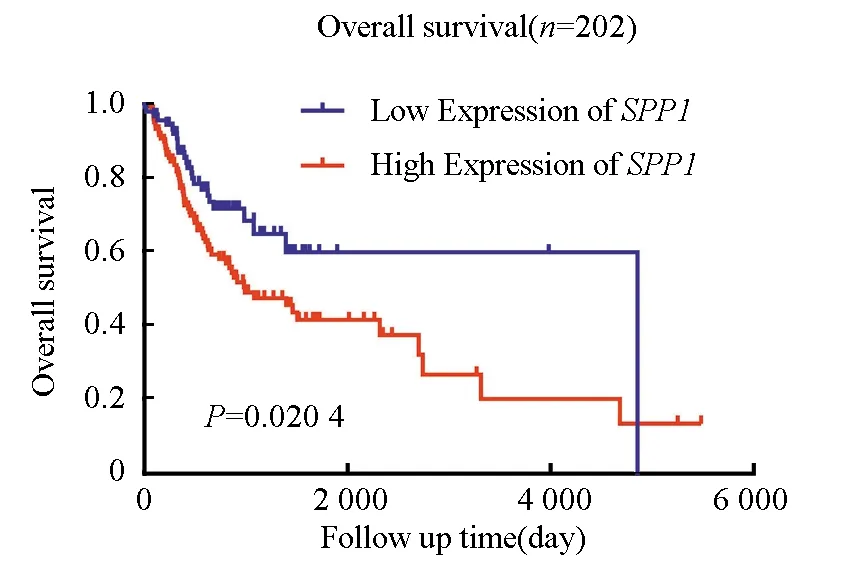
圖2 按SPP1的高表達和低表達分組,202名HNSC患者的Kaplan-Meier總生存曲線Fig.2 Kaplan-Meier overall survival curve of 202 HNSC patients grouped by high and low expressions of SPP1
2.4 相關性分析及基因富集分析
為了解SPP1在HNSC中的生物學功能,包括相關通路,使用R語言的cor.test函數對SPP1 與差異基因中其他mRNA分子進行相關性分析(見圖3a),圖中展示了相關系數最高的15個正相關及15個負相關的差異基因。選擇與SPP1 最正相關的前200個基因進行富集分析。使用R語言的 clusterProfiler包進一步探索了基于這200個基因的潛在功能途徑。GO分析顯示SPP1最正相關的前200個基因主要富集于細胞外基質組成、膠原纖維組成、膠原蛋白結合、中性粒細胞脫顆粒、免疫反應中涉及的中性粒細胞活化、三級顆粒、IgG結合、清道夫受體活性及免疫球蛋白結合等條目(見圖3b-3d)。此外,KEGG通路分析表明SPP1最正相關的前200個基因主要富集于吞噬體、補體凝血級聯、中性粒細胞胞外陷阱形成等免疫相關信號通路(見圖3e)。GSEA分析用于探索KEGG通路,結果顯示補體凝血級聯、吞噬體、細胞粘附分子、中性粒細胞胞外陷阱形成及細胞因子-細胞因子受體相互作用信號通路顯著富集(見圖3f)。這些結果表明SPP1在HNSC中與細胞外基質及膠原纖維形成等生物學過程有關,并與免疫學功能及免疫相關通路有關聯。

圖3 SPP1在TCGA HNSC中與其他差異表達基因的相關性分析及功能和通路富集分析Fig.3 Correlation analysis of SPP1 with other differentially expressed genes and function and pathway enrichment analysis in TCGA HNSC
2.5 腫瘤浸潤免疫細胞分析
為了明確SPP1與腫瘤浸潤免疫細胞的關系,進一步使用R語言的CIBERSORT函數評估了TCGA HNSC的免疫細胞浸潤比例,獲得了TCGA HNSC樣本中包含22種腫瘤浸潤免疫細胞的浸潤比例矩陣(見圖4a)。通過結合TCGA HNSC mRNA表達矩陣中SPP1表達量進行分析,發現M2巨噬細胞在SPP1高表達組中浸潤比例高于SPP1低表達組(見圖4b,P=0.001 1),未活化樹突狀細胞在SPP1高表達組中浸潤比例高于SPP1低表達組(見圖4c,P=0.005 5),活化肥大細胞在SPP1高表達組中浸潤比例高于SPP1低表達組(圖4g,P=0.048 8),而活化記憶性CD4+ T淋巴細胞在SPP1高表達組中浸潤比例低于SPP1低表達組(見圖4d,P<0.001),漿細胞在SPP1高表達組中浸潤比例低于SPP1低表達組(見圖4e,P=0.026 6),未活化肥大細胞在SPP1高表達組中浸潤比例低于SPP1低表達組(見圖4f,P=0.038 6)。這些結果表明SPP1的表達與HNSC中腫瘤浸潤免疫細胞狀態密切相關。

圖4 TCGA HNSC中與SPP1相關的腫瘤浸潤免疫細胞分析Fig. 4 Analysis of tumor infiltrating immune cells related to SPP1 in TCGA HNSC
3 討 論
SPP1是一種糖磷蛋白,主要與整合素結合發揮作用,它在多種腫瘤中高表達,例如肝癌、肺癌、前列腺癌、乳腺癌、結直腸癌及頭頸部鱗狀細胞癌等[24]。Staibano等研究發現,在喉鱗狀細胞癌中,SPP1表達與異型增生程度呈正相關,與生存率呈負相關[25]。通過對TCGA的HNSC數據分析,發現SPP1在HNSC中高表達,與之前的研究一致。推測,SPP1在HNSC中的高表達,可能與HNSC的發生與發展相關。分析了SPP1與HNSC患者的臨床病理特征的關系,發現SPP1與年齡、T分期及臨床分期有關,且高表達SPP1患者具有較短的生存期,通過Cox回歸模型,發現SPP1表達水平是影響患者生存的獨立危險因素。因此,研究結果表明SPP1的高表達,促進HNSC的進展,并且預示較差的預后,可能成為潛在的預測HNSC預后的生物標志物。
作為一種基質細胞蛋白,SPP1充當細胞-細胞外基質相互作用的調節劑,通過與細胞表面受體、生長因子、結構基質蛋白及蛋白酶結合,使它們成為細胞外基質環境的重要組成部分[26]。SPP1調節金屬蛋白酶的分泌以及成纖維細胞的增殖和分化,在傷口愈合中發揮著重要作用[27]。成纖維細胞也與炎癥密切相關,它們在腫瘤微環境中產生膠原蛋白和其他細胞外基質成分,刺激癌細胞增殖和血管生成[28]。通過GO分析發現,SPP1與細胞外基質組成、膠原纖維組成及膠原蛋白結合等生物學過程及分子功能有關,與此前的研究一致。上述結果表明SPP1涉及多種生物學功能,包括細胞外基質形成、組織重塑和修復、炎癥反應及腫瘤進展等。隨著免疫治療方法的興起,SPP1在免疫學方面的功能研究也逐漸開展。SPP1在多種免疫性疾病,如系統性紅斑狼瘡、多發性硬化癥和類風濕性關節炎中高表達,具有免疫調節特性[29]。在腫瘤方面,Wei等[30]研究發現,SPP1是一種有效的巨噬細胞趨化因子,沉默SPP1明顯削弱了膠質瘤細胞募集巨噬細胞的能力。在結腸癌中,SPP1通過與CD44結合負調節T細胞活化并促進癌癥進展[29]。但目前SPP1在HNSC中免疫學功能研究較少,尤其在腫瘤免疫微環境方面。通過GO分析顯示SPP1與中性粒細胞脫顆粒、免疫反應中涉及的中性粒細胞活化、三級顆粒、IgG 結合、清道夫受體活性及免疫球蛋白結合等免疫相關條目有關。此外,KEGG通路分析表明SPP1與吞噬體、補體凝血級聯、中性粒細胞胞外陷阱形成等免疫相關信號通路有關。基于GSEA算法的KEGG分析還顯示SPP1與細胞粘附分子及細胞因子-細胞因子受體相互作用信號通路有關。這些結果表明SPP1在HNSC中與免疫學功能及免疫相關通路有關聯。但SPP1在這些免疫相關功能及通路中的具體分子機制還有待進一步研究。
SPP1對多種免疫細胞具有趨化性,包括巨噬細胞、樹突細胞和 T 細胞等,SPP1主要通過與這些免疫細胞表面的整合素及CD44分子相互作用,通過不同的細胞信號通路,調節免疫細胞的存活、極化與遷移等;根據細胞所處的病理環境不同,SPP1可能會表現為促炎或抗炎作用(免疫抑制)[28,31]。巨噬細胞被識別為兩種不同的極化狀態,經典激活的M1型(促炎)和選擇性活化的M2型(免疫抑制)[32]。M1巨噬細胞傾向于促進抗腫瘤免疫反應,而M2巨噬細胞發揮促腫瘤作用。樹突狀細胞(Dendritic cells, DCs)通過加工和呈遞腫瘤抗原給T細胞,在抗腫瘤免疫反應中發揮關鍵作用。誘導瘤內DCs的成熟以激活T細胞介導的抗癌免疫可能是一種有效的抗腫瘤策略[33]。腫瘤內CD4+ T細胞負責抗腫瘤免疫反應。Al-Shibli等[34]研究發現,CD4+T細胞數量的增加與非小細胞肺癌疾病特異性存活率的改善顯著相關,并且高密度的基質CD4+ T細胞是非小細胞肺癌患者的有利獨立預后因素。漿細胞分泌對特異性抗原具有高親和力的抗體,在介導特異性細胞免疫和體液免疫中起重要作用[35]。漿細胞還可以通過細胞因子和免疫調節因子的表達發揮其抗腫瘤作用,創造更有效的抗腫瘤微環境[35]。肥大細胞傳統上與過敏和炎癥有關,但現在已經認識到肥大細胞對腫瘤細胞和腫瘤微環境具有重要影響[36]。肥大細胞在一些腫瘤中與不良預后有關,如胃癌[37]、肺癌[38]和乳腺癌[39]。通過CIBERSORT算法評估的22種腫瘤浸潤免疫細胞在TCGA HNSC樣本中的浸潤情況,發現SPP1表達與巨噬細胞、樹突狀細胞、肥大細胞、漿細胞及記憶性CD4+ T淋巴細胞浸潤水平顯著相關,在SPP1高表達組M2巨噬細胞、未活化樹突狀細胞及活化肥大細胞浸潤比例顯著增加,而活化記憶性CD4+ T淋巴細胞、漿細胞及未活化肥大細胞浸潤比例顯著減少。因此,認為SPP1可能通過影響HNSC中各種腫瘤浸潤免疫細胞的浸潤水平以及它們的活化狀態,從而影響免疫抑制微環境的形成,進而導致HNSC的進展,并影響患者的預后。但SPP1在HNSC中影響腫瘤浸潤免疫細胞浸潤水平的具體分子機制尚未清楚,有待進一步研究。
4 結 論
總之,SPP1具有免疫調節的特性,在腫瘤免疫微環境中起重要作用,并且可能作為HNSC有價值的預后生物標志物及免疫治療靶標。為深入研究HNSC的發生發展機制、治療和預后靶點提供了理論依據。但目前的研究主要基于數據庫生物信息學分析,SPP1與腫瘤浸潤免疫細胞的直接關系仍需要組織樣本及細胞實驗進一步研究。靶向SPP1改善免疫抑制微環境以增強免疫治療效果的方法需要在未來的基礎及臨床試驗中進一步驗證。

