豬傳染性胸膜肺炎防控及凈化策略探討
趙月橋 ,胡耀方 ,于學祥 ,陸時娟 ,王久紅 ,李文濤 ,何啟蓋
(1.華中農業大學動物科技學院動物醫學院,湖北 武漢 430070;2.廣西揚翔股份有限公司,廣西 貴港 537000;3.湖北金林原種畜牧有限公司,湖北 武漢 430200)
豬傳染性胸膜肺炎(Porcine Contagious Pleuropneumonia,PCP)是由胸膜肺炎放線桿菌(Actinobacillus pleuropneumoniae,APP)感染引起的一種傳播迅速、傳染性強的豬呼吸道傳染病。最急性型和急性型時,病豬無先兆癥狀,突然死亡。耐過豬只可能轉歸為亞臨床感染,不表現臨床癥狀,但持續排出病菌,導致感染豬群中很難控制和根除該病(Bosse等,2002)。
1 病原學
胸膜肺炎放線桿菌(APP)是一種典型球桿狀菌體、有莢膜的革蘭氏陰性菌。根據體外生長時是否依賴煙酰胺腺嘌呤二核苷酸(NAD),APP可分成生物Ⅰ型(NAD依賴型)和生物Ⅱ型(NAD不依賴型)兩種。根據細菌細胞壁外莢膜中莢膜多糖(CPS)的成分不同,APP分為19個血清型,但仍有一些菌株無法分型(Stringer等,2021)。
2 流行病學
在大多數案例中,豬傳染性胸膜肺炎是由亞臨床感染的豬只排菌引起(Klinkenberg 等,2014)。本病一年四季皆可發生,但在冬春(寒冷)季節發病率高;各階段豬只均對APP易感,但90日齡左右豬只最為易感。APP在豬群內主要是通過口腔或是鼻腔分泌物接觸傳播,或通過0.5~3 μm大小的氣溶膠液滴在2 m內短距離傳播。根據Zhang(2019)和李倩倩(2022)等人對國內規模化豬場細菌性疾病的流行病學調查顯示,近十年內APP的流行率約為0.3%~2.7%,且呈逐年上升趨勢。
3 臨床癥狀
根據臨床癥狀,豬傳染性胸膜肺炎病程包括最急性型、急性型和慢性型三類。
最急性型:豬只突然發病,體溫迅速升高至41.5℃,精神沉郁、厭食等。病豬虛弱,鼻部、耳朵、四肢皮膚發紺。在疾病后期,出現嚴重呼吸障礙并張口呼吸,呈犬坐姿勢且肛溫下降。死亡前,通常口腔和鼻腔排出有大量泡沫狀帶血的分泌物。最急性型從感染到死亡,病程最短只有6 h。
急性型:同一或不同豬圈的多頭豬只出現感染,體溫迅速達到40.5~41℃左右,出現皮膚發紅、精神沉郁、食欲廢絕等癥狀。病豬出現明顯的呼吸困難、咳嗽等呼吸系統癥狀,有時張口呼吸。從感染到死亡,病程在48 h左右。
慢性型:發生在急性癥狀消失后、治療或預防措施沒有完全控制感染時,或中等毒力血清型菌株引起的感染。表現為輕微發熱或不發熱,并出現不同程度的持續性或間歇性咳嗽。同時,因食欲減退導致增重率降低(張立昌,2001)。
4 病理學診斷
4.1 病理剖檢變化
該病病變程度取決于豬只感染菌株的毒力和機體的載菌量。豬傳染性胸膜肺炎的病理變化局限于胸腔。病豬患有纖維素性出血性或纖維素性壞死性肺炎,且以肺葉和小葉雙側性的纖維性胸膜肺炎為特征性病變。彌漫性纖維性滲出物分布在胸膜和肺漿膜表面。病程較長的豬,可見胸腔積液、渾濁,有時混有血液,肺與胸腔高度粘連(張立昌,2001)。
4.2 病理組織學變化
在該病的早期,肺臟組織學變化包括出血、壞死,并有纖維素性滲出物。局部嗜中性粒細胞浸潤。病程后期可見巨噬細胞浸潤、壞死灶周圍有大量的白細胞,肺泡中有變性的肺泡上皮細胞、巨噬細胞及嗜中性粒細胞,血管嚴重變性導致出血,擴張毛細血管中可見紅細胞、血小板栓塞及纖維素性滲出(Bosse等,2002)。
5 危害
主要包括急性暴發時引起的豬只突然死亡,慢性、隱形感染時導致的生產、治療成本增加,增重率及出欄重下降。此外,該病主要導致豬只肺臟損傷,呼吸機能受損,可能易繼發其他疾病。
6 診斷
6.1 病原學診斷
6.1.1 樣品采集
(1)肺臟、氣管和扁桃體的采集 優先選擇發病后死亡豬只或者具有咳喘等明顯癥狀的豬只進行解剖。保定豬只,充分放血后,打開豬只咽喉部、胸腔,鈍性分離肺臟,保證肺臟及氣管的完整性。扁桃體位于豬只口腔上顎的后部,取氣管時可以一同取下。
(2)鼻拭子的采集 可選取有咳喘等癥狀的豬只進行采集。鼻腔拭子為活體監測常用樣品,但存在其他細菌污染的情況,導致APP分離難度較高。保定豬只,先將鼻部明顯的污物清理后,再用棉簽拭子或者植絨拭子伸入豬只鼻腔內4~5 cm位置,將拭子停留直到豬只打噴嚏后取出拭子,放在EP管中保存,盡可能兩邊鼻腔都采集。
血液樣品不宜作為病原檢測樣品,可作為抗體檢測樣品。
6.1.2 病原分離
(1)肺臟、氣管 選擇肺臟的病變交界處,用酒精消毒表面,使用無菌剪刀在消毒區域剪出2 cm×2 cm的組織塊,用內表面在巧克力瓊脂平板上劃線接種并培養。
用無菌組織剪在氣管近肺臟端剪開缺口,將無菌接種環伸入氣管內,粘到黏液后取出在巧克力瓊脂平板上劃線。
(2)扁桃體 將扁桃體表面用酒精棉擦拭消毒,用無菌剪刀從側面剪開扁桃體,用暴露出的截面在巧克力瓊脂平板上涂抹。
(3)鼻拭子 用滅菌鑷子將鼻拭子在巧克力瓊脂平板上按壓涂抹。
為了觀察菌株的溶血性和“衛星現象”,按照無菌操作標準,將樣品接種到血瓊脂表面,同時將金黃色葡萄球菌(Staphylococcus aureus,S. aureus)作交叉劃線接種,于37℃含5%二氧化碳的恒溫箱中分離,隨后用巧克力瓊脂平板和PPLO瓊脂平板進行傳代培養。
6.1.3 病原鑒定
APP于血瓊脂培養基劃線接種培養24~48 h后,菌落形態呈現露珠樣,直徑約1~2 mm。可產生β溶血環和“衛星現象”(即APP的菌落大小與靠近金黃色葡萄球菌菌落的距離呈反比關系)。
革蘭氏染色可見APP呈現革蘭氏陰性小球桿菌,繼代培養APP菌落可呈現多種形態,早期偶見絲狀形態。
6.1.4 判定
具有以下四個特點,即可初步判定為APP:
(1)革蘭氏染色鏡檢呈現革蘭氏陰性小球桿菌或多形態;
(2)于血瓊脂平板上生長具有溶血現象;
(3)生長依賴Ⅴ因子,即存在“衛星現象”;
(4)生化特性:尿素酶試驗為陽性,能分解D-木糖,不分解棉子糖、阿拉伯糖。
6.2 血清學診斷
6.2.1 豬胸膜肺炎放線桿菌 Apx抗體檢測
可參考劉建杰(2004)、梁望旺(2004)及Jung(2019)等 建立的ELISA方法分別檢測ApxI、ApxII和ApxIII毒素抗體。
6.2.2 豬胸膜肺炎放線桿菌ApxⅣ抗體檢測
用商業化試劑盒ApxⅣ-ELISA檢測豬血清樣品中APP ApxⅣ抗體。APP分泌的外毒素ApxIV毒素具有種屬特異性,且ApxIV只能在APP感染豬只體內產生,體外培養的APP不分泌此毒素(Jacobsen等,1996)。滅活疫苗免疫豬的ApxⅣ抗體為陰性,而感染豬的ApxⅣ抗體為陽性,因此,檢出ApxIV抗體,可區分滅活苗免疫豬與自然感染豬。如果基因缺失活疫苗是缺失了ApxIV基因,商業化ApxⅣ-ELISA也可實現鑒別診斷。
LPS-ELISA試劑盒可檢出APP抗體,但無法實現鑒別診斷。
6.3 聚合酶鏈反應(PCR)檢測
6.3.1 模板制備
菌落:挑取可疑菌落于pH 7.2、0.01 M PBS中,制成約108CFU/mL菌懸液(液體稍渾濁)。離心后取沉淀加入50 μL PBS,-20℃冷凍15 min,取出立即置100℃水浴中煮沸5 min。重復凍融、煮沸兩次。10 000 g離心5 min,取上清,可作為模板直接擴增。
組織樣品及鼻拭子:將0.5~1 g組織(取病變交界處、深處的肺臟組織,扁桃體組織)剪碎,加入1 mLPBS緩沖液,勻漿。鼻拭子在1 mLPBS緩沖液中反復震蕩,以充分釋放細菌。按照商品化試劑盒推薦方法提取總核酸。
6.3.2 多重PCR檢測
對分離的菌株和核酸樣品,可采用陳凡等(2004)建立的可對胸膜肺炎放線桿菌生物Ⅰ 型13個標準菌株中的8個血清型進行區分的多重PCR方法,直接用于臨床病料的檢測,縮短檢測時間。Oliver等(2021)基于ApxIV基因和血清特異性莢膜基因建立多重PCR方法,能快速鑒定已知的19個血清型。
6.3.3 熒光定量PCR檢測
楊利等(2010)建立了實時熒光定量PCR方法檢測APP,能特異性地檢測出APP感染,還能定量反映APP在不同組織中的分布差異。2021年,馮逸雪建立了檢測胸膜肺炎放線桿菌、副豬格拉瑟菌和肺炎支原體的多重熒光定量PCR方法,可檢測鼻拭子、環境樣品(水槽、料槽和生產區土壤)和肺臟樣品中的APP核酸。
7 預防與治療
良好的環境管理可將疫病暴發的可能性降至最低,包括保持適宜的環境溫度、減少刺激、根據不同季節適當的通風、全進全出和適當的飼養密度以及更早的斷奶日齡
(<21 d)。
對于APP陰性的豬群,應嚴格采取生物安全措施,防止外源APP的引入。應從沒有臨床癥狀和病變且APP抗體陰性的豬場引種,避免引入帶有APP菌株的豬只。
針對感染豬的治療,選擇抗菌藥物要根據其最低抑菌濃度(MIC)及其藥代動力學和藥效學(PK/PD)特性為基礎。最好使用對分離菌敏感性的藥物。通常使用氟苯尼考、替米考星、恩諾沙星等藥物。群體給藥方式可使用泰樂菌素1 kg/t和強力霉素1.5 kg/t拌料飼喂,連用7 d;個別重癥發病個體可肌注頭孢噻呋與解熱鎮痛藥物。受威脅豬群可進行藥物預防,具體是替米考星400 g/t并強力霉素1 kg/t,拌料飼喂,連用5~7 d(陳瓊等, 2015)。
個體治療以肌注為主。由于病豬食欲下降,拌料給藥效果較差。病程早期使用抗生素治療才能見效,可使死亡率下降。對于感染嚴重或病程過長的豬只,即使治療也可能無法恢復健康(肺臟已與胸腔粘連),應實施淘汰。
8 凈化策略
8.1 凈化策略
需要采取綜合措施,核心技術是免疫預防、藥物治療、淘汰感染豬、引種檢疫和全進全出等5個措施。具體凈化方案依據豬群感染狀態來確定。
8.2 感染狀態普查
8.2.1 采樣技術
病原學樣品:用一次性植絨拭子伸入豬只鼻腔一定深度,在鼻腔中稍作停留,豬只有噴嚏反射時取出拭子,放入無菌EP管中保存,每側鼻腔分別用不同拭子采集。
血清學樣品:使用無菌注射器采集豬只血液,每份血液樣品不少于3 mL。樣品可放于4℃靜置析出血清,無菌分離血清后分裝于無菌EP管中保存在4℃,長期保存可放置于-20℃保存。
樣品運輸:當天采集的樣品應24 h內檢測,若無條件當天檢測可置于4℃短期保存。
8.2.2 抽樣數量
按照估算比例的樣本量公式設計抽樣量,根據感染抗體陽性率高低,確定具體凈化方案。
8.3 種豬場分類標準
種豬場根據感染情況,分為重度感染場、中度感染場和輕度感染場和陰性場,如表1。

表1 不同程度感染場ApxIV抗體陽性率、APP核酸陽性率、發病率和死亡率
8.4 凈化方案的確定
重度感染場:不具備凈化條件。執行藥物治療措施,待豬群不出現死亡后、生產指標正常,開始凈化。
中度感染場:執行藥物干預后,使用疫苗免疫。實行強化免疫—檢測淘汰—補充陰性后備豬—監測與認證維持的分步凈化方案。
輕度感染場:可直接實行檢測—淘汰—監測與認證維持的凈化方案。
陰性場:依賴生物安全措施和全進全出,加強生豬轉群、銷售環節的車輛消毒;只引入抗體陰性豬。
8.5 強化免疫階段
8.5.1 疫苗選擇
目前市場上主要有亞單位疫苗和滅活苗兩種。
亞單位苗主要以APP外毒素為主要成分,輔以外膜蛋白等因子為抗原。國外已有默沙東豬胸膜肺炎放線桿菌亞單位滅活疫苗,該疫苗成分包含APP菌株幾種毒力因子:外膜蛋白(OMP)和3種毒素(ApxⅠ、ApxⅡ、ApxⅢ),可提供較好的交叉免疫保護。
通常采用滅活疫苗預防PCP,我國先后用免疫性良好的APP研制成功多種滅活疫苗,經現場試驗證明疫苗是安全有效。目前有中國農業科學院蘭州獸醫研究所研制的APP(1、3、7型)三價滅活苗和華中農業大學等研制的APP(1、2、7型)三價滅活苗等獲得國家新獸藥注冊證書,已經商業化生產和推廣使用。但由于滅活后APP的交叉保護力比較弱,使用某幾個血清型的多價疫苗不能抵抗所有血清型的APP的攻擊,因此用從當地分離的APP菌株制備而成的滅活苗,對當地流行株的防控比較好。
8.5.2 免疫程序
采用ELISA方法監測群體的感染時間,根據疫苗免疫后抗體的產生時間,制定合理的免疫程序。通常情況下,仔豬35—40日齡進行第1次免疫接種,4周加強免疫1次。母豬產前6周和2周各注射1次,以后每6個月免疫1次。
8.5.3 抗體水平評估
免疫后3周檢測ApxⅡ毒素抗體,抗體效價≥1∶1 280可具有完全保護效力。90%以上的豬群產生合格抗體,認為群體免疫合格。
8.5.4 臨床評估
通過強化免疫后,豬群應無豬傳染性胸膜肺炎臨床癥狀。
8.6 檢測與淘汰階段
8.6.1 商品豬隔離淘汰
每6個月檢測抗體,每次抽樣檢測10%~20%的豬只。將APP抗體陽性的豬只與陰性豬只隔離到不同欄舍飼養,防止交叉感染。逐步淘汰陽性豬只,降低陽性豬只比例。同時也要加強陰性群的隔離與監測,最后建立APP陰性豬群。
8.6.2 種豬群檢測與淘汰
種豬群APP抗體陽性率小于10%時,檢測到抗體陽性豬可直接淘汰,采取藥物治療,直至出欄;若有可疑樣品時,可對樣品復檢,或者在兩周后抽樣檢測,若依舊為可疑,可直接淘汰。
8.6.3 后備種豬檢測與淘汰
可分別在5月齡(或進入后備舍前)和配種前1個月對選擇留種的后備種豬采集血清樣品,檢測ApxⅣ抗體,如為陰性,即可作為種豬使用;如檢出APP ApxⅣ抗體陽性或出現兩次可疑陽性結果,應作淘汰處理。
8.7 強制凈化階段
(1)對全群豬群進行APP ApxⅣ ELISA普檢,淘汰全部抗體陽性豬只。
(2)在淘汰全部APP ApxⅣ抗體陽性豬1個月后,按10%的比例對母豬群采血。種公豬全體采血,進行抗體檢測。
(3)如抽檢種豬群胸膜肺炎放線桿菌ApxⅣ抗體全部陰性可視為豬傳染性胸膜肺炎假定陰性群。
8.8 假定凈化階段
在陽性豬淘汰1年后,種豬群持續保持胸膜肺炎放線桿菌ApxⅣ抗體陰性,且豬群生產持續平穩,便認定豬群達到假定凈化階段。
8.9 凈化場的評估
8.9.1 評估時間
達到“假定凈化階段”后,按照免疫凈化標準、非免疫凈化標準進行凈化場評估。
8.9.2 免疫凈化標準
(1)在生產母豬群和后備種豬群中按比例采集血清樣品,抽檢Apx毒素抗體,合格率不低于
90%;
(2)在種公豬群、生產母豬群和后備種豬群中按比例采集血清樣品,抽檢APP ApxⅣ抗體,檢測結果均為陰性;
(3)連續兩年以上無臨床病例。
8.9.3 非免疫凈化標準
種公豬、生產母豬和后備種豬抽檢,APP ApxⅣ 抗體檢測均為陰性,疑似病例或者屠宰育肥豬的扁桃體不能分離到APP。停止免疫兩年以上,無PCP臨床病例。8.9.4 評估抽樣
評估抽樣方法見表2。
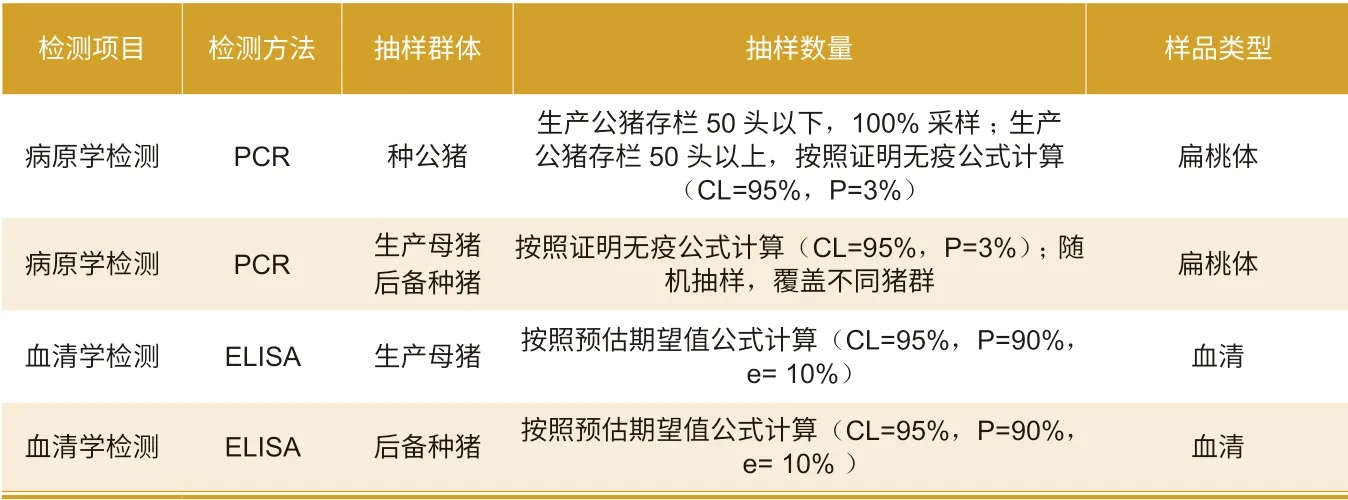
表2 評估抽樣
8.10 凈化場的維持階段
8.10.1 免疫
種豬場要選用合格的豬胸膜肺炎放線桿菌疫苗制訂合理有效的免疫程序,并嚴格執行。
8.10.2 監測
(1)種豬群監測:每年監測陰性種豬群的APP ApxⅣ 抗體水平。置信度95%,預期流行率3%。保證基礎群、后備群維持陰性狀態。
(2)后備豬群監測:在后備豬選留時進行APP ApxⅣ抗體和APP核酸檢測,確保轉入種豬群的豬只ApxⅣ抗體為陰性并且APP核酸為陰性,即無APP感染豬只。后備豬入群必須逐頭檢測。
8.10.3 引種檢疫
(1)引種時嚴格檢疫監測。逐頭檢測種豬,確保豬只ApxⅣ 抗體為陰性和APP抗原陰性后才能引進。
(2)建造獨立隔離舍,引進后隔離飼養45 d以上,經檢測APP核酸和抗體雙陰性后才可混群飼養。
8.10.4 疑似病例診斷
要及時剖檢疑似病死豬,檢測APP病原,如果病原檢測為陽性,則檢測同群接觸豬只。若同欄豬均帶菌,建議全部淘汰。
8.11 綜合生物安全措施
8.11.1 合理的豬場選址
按《標準化規模養豬場建設規范》(NY/T 1568-2007)規定執行,避免豬舍的進風口與出風口的空氣交叉混合,避免細菌在棟舍之間經空氣傳播,交叉污染。
8.11.2 生產模式
參照《集約化豬場防疫基本要求》(GB/T 17823-2009)執行。實行自繁自養、全進全出、提前斷奶及“兩點式”或“三點式”的生產模式,阻斷豬場間、豬群間、批間、引種、轉場等環節的疫病傳播。
8.11.3 飼養管理
嚴格依照《規模豬場生產技術規程》(GB/T 17824.2)執行,加強飼養管理,減少應激。做好通風、保溫、適宜的飼養密度。種豬場的凈道與污道要分開。母豬分胎次飼養、分階段飼養,隔離、阻斷疫病傳播。科學規范用藥,種豬禁用皮質類固醇類藥物。
8.11.4 消毒措施
嚴格對人員、物品、用具、車輛、豬舍內外環境以及糞污等進行消毒。按《豬場消毒技術規范》(DB13/T 991-2008)執行。
8.11.5 無害化處理措施
(1)病死豬及母豬所生產的弱仔豬、死胎、流產胎兒按農醫發〔2017〕25號《病死及病害動物無害化處理技術規范》的規定處理;
(2)糞污無害化處理嚴格按《畜禽糞便無害化處理技術規范》(NY/T 1168-2006)的規定執行。
8.11.6 有害生物防治措施
禁止在豬場內飼養犬、貓等其他動物。每6個月至少開展1次全方位徹底滅鼠。定期殺蟲、防蠅。
8.11.7 其他生物安全措施
(1)保障獨立、隔離的公豬站的生物安全,加強人工授精檢測與管理,防止精液被污染而傳播;
(2)加強生產流程管理。重點在容易轉陽的階段,全部清空1~2批,徹底消毒,空欄;
(3)保持凈化工作的連續性。
8.11.8 檔案管理
(1)嚴格做好免疫程序記錄、獸藥使用記錄、圈舍消毒記錄、生產記錄、病死豬無害化處理記錄、獸醫診療記錄、飼料記錄、飼料添加劑使用記錄、防疫監測記錄、運輸車輛記錄、銷售記錄和糞污無害化處理記錄等;
(2)記錄保存不少于2年。
9 挑戰
由于APP可在機體具有低水平抗體或亞臨床感染的情況下定植于扁桃體隱窩中,常規檢測可能為“假陰性”,導致豬群中APP持續流行。因此,如何提高檢測敏感性,研發靶向扁桃體中APP的藥物,是實施凈化面臨的挑戰。

