不同熱處理方式脫除草莓植株體內草莓輕型黃邊病毒的研究
劉羽豐 閆哲 王志 封林林 于翠 任俊達* 尚巧霞*
(1 北京農學院生物與資源環境學院,農業農村部華北都市農業重點實驗室,北京 102206;2 北京開心格林農業科技有限公司,北京 102200)
草莓(Fragaria ananassaDuch.)營養價值豐富,富含維生素、有機酸、礦物質等營養成分(楊波 等,2018)。目前草莓栽培主要通過匍匐莖進行繁殖,導致病毒世代傳播(Jana et al.,2019)。草莓病毒病癥狀表現為植株變色、畸形、矮化、根系弱,直接降低果實的品質和產量(Bonneau et al.,2019)。草莓輕型黃邊病毒(strawberry mild yellow edge virus,SMYEV)、草莓鑲脈病毒(strawberry vein banding virus,SVBV)、草莓斑駁病毒(strawberry mottle virus,SMoV)、草莓皺縮病毒(strawberry crinkle virus,SCV)和黃瓜花葉病毒(cucumber mosaic virus,CMV)是影響草莓生產的常見病毒(陳柳 等,2015;尚巧霞,2015;王佳 等,2020)。病毒單獨侵染時,草莓植株往往無明顯癥狀,單獨侵染率為33.7%,草莓果實減產30%;而復合侵染時草莓植株常表現變色、畸形等典型癥狀,復合侵染率僅為7.2%,但減產可高達99%(劉雅 等,2021;王佳 等,2021)。目前病毒病是制約草莓產量和品質的重要因素。
使用脫毒種苗是控制草莓病毒病最有效的措施。與帶毒苗相比,脫毒種苗在田間生長勢更好,葉片、匍匐莖和花更多;還能通過影響根系生長提高養分利用率(Quiroz et al.,2017;Yang et al.,2022)。草莓病毒脫除通常采用莖尖培養法、熱處理法、超低溫處理法等(孫崇波 等,2008;盛宏亞 等,2016)。切取長度小于0.3 mm 的草莓莖尖進行培養,紅顏脫毒率達到93%以上;大于0.5 mm 則無法保證脫毒效果(楊肖芳 等,2015;鄧淵,2018)。經超低溫處理,紅顏脫毒率可達100%,但莖尖成活率不高(羅婭 等,2016)。熱處理是脫除草莓植株體內病毒的有效途徑。在熱處理前進行預培養會提高處理植物的存活率(Hu et al.,2018)。逐步升溫至38 ℃培養組培苗30 d,切取長度為0.3~0.5 mm 莖尖進行培養,紅顏組培苗脫毒率為100%,但存活率不到30%(陳英 等,2017;聶園軍 等,2019)。草莓種苗脫毒處理除了要保證脫毒率外,還應注重組培苗的存活率,因此深入研究熱處理脫毒方法的處理溫度和處理時間在草莓脫毒種苗的生產中顯得格外重要。
病毒檢測是脫毒效果評價的重要環節,主要檢測方法包括指示植物法、酶聯免疫吸附測定法(ELISA)和分子生物學檢測法等。指示植物法檢測周期長(尚巧霞,2015),ELISA 易出現假陽性反應(王佳,2021),皆存在局限性,目前在草莓病毒檢測中應用較少。分子生物學檢測法主要包括RT-PCR、實時熒光定量PCR(RT-qPCR)、環介導等溫擴增技術(LAMP)和高通量測序技術等(Ding et al.,2019;Dullemans et al.,2020;Ren et al.,2021),具有靈敏度高、檢測速度快等優點。
本試驗采用不同熱處理方式對北京地區紅顏草莓組培苗進行病毒脫除,并利用RT-PCR 和RTqPCR 檢測病毒的脫除率,以期通過簡單、快捷的方式獲得脫毒苗,保障草莓脫毒種苗的生產。
1 材料與方法
1.1 試驗材料
草莓組培苗為2014—2022 年于北京地區收集的市售品種紅顏,草莓匍匐莖為2021 年于北京地區草莓農業園采集的紅顏。
1.2 試驗方法
1.2.1 莖尖組織培養 將采集到的生長健壯的草莓匍匐莖帶回北京農學院植物病理實驗室,剝去外層苞片,用流動自來水沖洗1 h,75%乙醇浸泡30 s,4%次氯酸鈉消毒6 min,無菌水沖洗4 次,吸水紙吸干。無菌環境中,在雙筒解剖鏡下采用直尺測量快速切取長度為0.3 mm 的莖尖,接種至初代培養基(MS+6-BA 1 mg·L-1+NAA 0.2 mg·L-1+PVP 1 g ·L-1)中。30 d 后將萌發的不定芽接至繼代培養基上(MS+6-BA 0.4 mg·L-1)。25 ℃培養,光照時間為16 h·d-1。
1.2.2 熱處理脫毒 將莖尖組培苗分成單株,接種于繼代培養基上,25 ℃預培養10 d 后進行熱處理,保持16 h·d-1光照。設置3 種熱處理:36 ℃恒溫培養30 d(R1);起始溫度32 ℃,按1 ℃·d-1升至38 ℃后培養30 d(R2);40 ℃恒溫培養4 d(R3)。每處理10 株,3 次重復;熱處理后在25℃條件下繼續培養。
1.2.3 草莓總RNA 提取和cDNA 合成 使用EASYspin 植物RNA 快速提取試劑盒提取草莓組織總RNA。取1.5 μL RNA,dNTP 2 μL,Oligo(dT)18 Primer 和Random Primer(9 mer)各0.5 μL,加入DEPC 水至15.5 μL。65 ℃ 5 min,冰浴5 min,加入5× M-MLV 逆轉錄反應緩沖液4 μL、M-MLV反轉錄酶和RRI 抑制劑各0.5 μL;42 ℃ 1 h,70 ℃15 min,合成cDNA,于-20 ℃保存。
1.2.4 RT-PCR檢測利用RT-PCR進行病毒檢測,包括SMYEV、SVBV、SMoV、SCV 和CMV,各種病毒檢測相應的特異性引物見表1。以2 μL cDNA 為模板,加正、反向引物各0.5 μL,2×TaqPCR Mix 12.5 μL,加ddH2O 至25 μL。反應條件為:94 ℃ 2 min,94 ℃ 30 s,退火1 min(退火溫度見表1),72 ℃ 1 min,35 個循環;72 ℃ 10 min。PCR 產物采用1%瓊脂糖凝膠電泳進行檢測。

表1 用于RT-PCR 檢測的引物信息
1.2.5 SMYEV RT-qPCR 檢測 檢測引物為SY5289F1(5 ' -CGCTGCTGCCAGTAATAAGG-3')和SY5434R1(5'-CGAGGGCGAGGAACCAA T-3'),以cDNA 為模板進行PCR 擴增后,目的片段長度為145 bp(王建輝 等,2016)。采用瓊脂糖凝膠純化回收試劑盒回收PCR 產物,連接到pBM-23 載體上,轉化感受態細胞BMMach1-T1,37 ℃過夜培養,通過以上引物進行菌落PCR 篩選,陽性菌落進行克隆測序。將測序序列正確的陽性克隆用高純度質粒小量快速提取試劑盒提取質粒,于-20 ℃保存。
應用Nanodrop 2000 測定質粒濃度,計算質粒濃度拷貝數。
拷貝數=(質粒濃度× 10-9× 6.02 × 1023)/〔(載體長度+插入目的片段的長度)× 660〕
使用ddH2O 稀釋SMYEV 質粒標準品。取稀釋倍數為1 × 102~1 × 107的標準品,在QuantStudioTM6 Flex 實時熒光定量PCR 儀上進行RT-qPCR 檢測,每組試驗3 次技術重復,制定標準曲線。
利用實時熒光定量PCR 檢測體系,對草莓葉片中的SMYEV 進行檢測。以1 μL cDNA 為模板,加 入SY5289F1、SY5434R1和ROX矯正染料各0.4μL,GenFQ SYBR qPCR Master Mix 10 μL,加ddH2O 至20 μL。反應條件為:95 ℃ 3 min,95 ℃10 s,60 ℃ 10 s,40 個循環。
2 結果與分析
2.1 市售草莓組培苗病毒的RT-PCR 檢測
2014—2022 年共檢測450 份紅顏組培苗樣品,病毒陽性樣品的總檢出率為20.2%。不同年份的病毒檢測結果不同,根據檢測出的病毒種類不同,將檢測結果進行了匯總(表2)。2014—2017 年,北京地區紅顏組培苗共檢測出5 種病毒,分別為SMYEV、SVBV、SMoV、SCV 和CMV。SVBV的檢出率最高,為15.0%;SMoV、SCV 和CMV的檢出率依次為10.2%、8.4%和3.0%;SMYEV 的檢出率僅為1.8%;復合侵染率6.6%。2018—2021年僅檢測到3 種病毒,分別為SMYEV、SVBV 和SMoV。其中SMYEV 的檢出率為4.1%,SVBV的檢出率為6.6%,SMoV 的檢出率為0.8%,復合侵染率0.8%。2022 年僅檢測出2 種病毒,即SMYEV 和SVBV,檢出率分別為24.4%和2.4%,且復合侵染率為0。
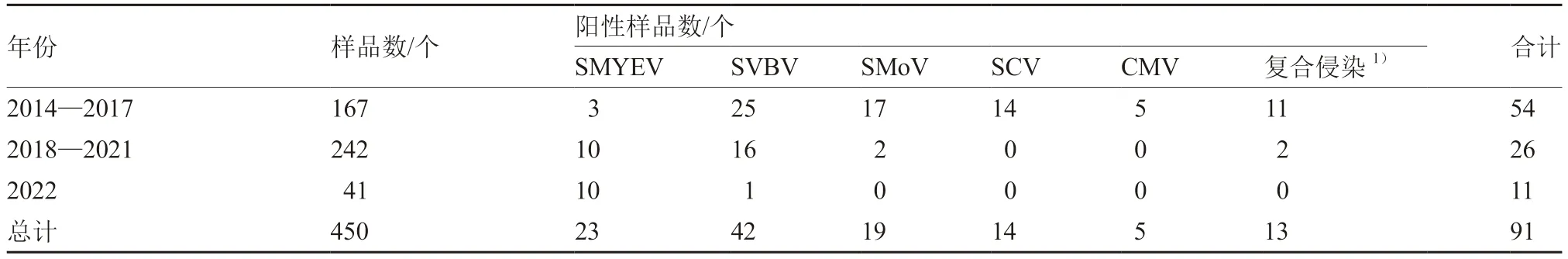
表2 紅顏組培苗病毒的RT-PCR 檢測結果
可見,近9 年SMYEV 的檢出率明顯上升,SVBV 和SMoV 檢出率逐漸下降,2018 年后未在紅顏組培苗中檢測出SCV 和CMV。2022 年紅顏組培苗中SMYEV 的檢出率高達24.4%,遠超其他病毒。
2.2 草莓莖尖組織培養和病毒的RT-PCR 檢測
2021 年對北京地區草莓農業園內紅顏病毒病的發生情況進行調查,采集經RT-PCR 鑒定攜帶SMYEV 的匍匐莖16 個、攜帶SVBV 的匍匐莖21個。在解剖鏡下切取長度為0.3 mm 的莖尖進行組織培養,莖尖萌發率為100.0%。
提取上述經莖尖組培的紅顏組培苗新葉RNA,進行RT-PCR 檢測。結果表明,SMYEV的脫除率為25.0%,SVBV 的脫除率為100.0%,表明莖尖組織培養無法有效脫除紅顏組培苗中的SMYEV。
2.3 不同熱處理對草莓莖尖組培苗生長的影響
將上述不能通過莖尖組織培養脫除SMYEV 的組培苗分成單株,接種于繼代培養基上,進行不同熱處理后的紅顏莖尖組培苗存活率見表3。36 ℃恒溫培養30 d 后,紅顏莖尖組培苗下部葉片全部枯死,出現大量全株死亡現象,存活率為43.3%。32 ℃逐步升溫培養7 d 時,紅顏莖尖組培苗葉片稍有萎蔫;38 ℃培養30 d 后,紅顏莖尖組培苗下部葉片出現枯死,有個別全株死亡現象,存活率為63.3%。40 ℃恒溫培養4 d 后,紅顏莖尖組培苗僅一半植株長出新芽,存活率為50.0%。
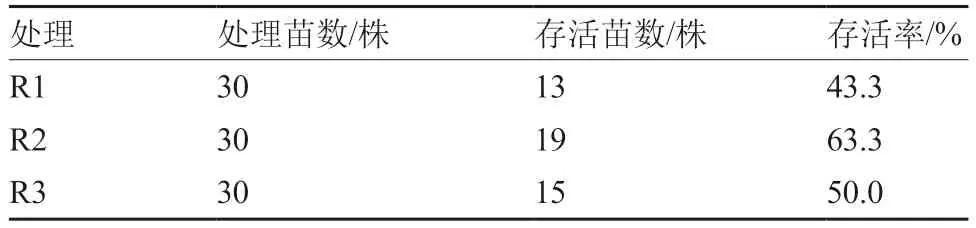
表3 不同熱處理方式對紅顏莖尖組培苗存活率的影響
2.4 SMYEV RT-qPCR 標準曲線的建立
SMYEV 質粒濃度為193.6 ng·μL-1,換算成拷貝數為4.49 × 1010個·μL-1。在拷貝數為4.49×103~4.49 × 108個·μL-1范圍內,Ct 值與質粒標準品濃度間呈線性關系(圖1)。標準曲線方程為y=-3.197 1x+35.387,決定系數R2=0.998 6,擴增效率為105%,該標準 曲線可用于SMYEV 含量的測定。

圖1 實時熒光定量PCR 的標準曲線
2.5 不同熱處理脫除SMYEV 的效率
待熱處理的紅顏莖尖組培苗長出新葉后,通過RT-PCR 和RT-qPCR 進行病毒檢測,以確認SMYEV 的脫除率。結果表明(圖2、表4),RTPCR 和RT-qPCR 的檢測結果一致,3 種熱處理方式的SMYEV 脫除率皆為100.0%。

圖2 熱處理前后紅顏莖尖組培苗中SMYEV 的RT-PCR檢測結果
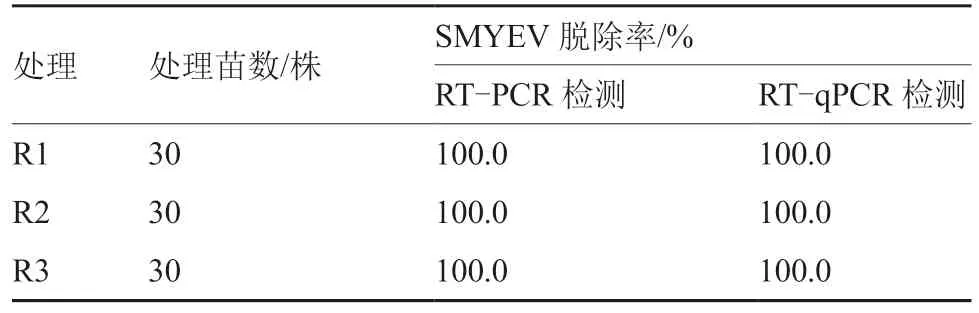
表4 不同熱處理方式對紅顏莖尖組培苗SMYEV 脫除率的影響
3 結論與討論
脫毒種苗的應用是草莓安全生產的基礎。目前生產上的一個認識誤區是將草莓莖尖組培苗視作脫毒苗,但市場上的組培苗大多沒有經過病毒檢測。本試驗對近9 年市售紅顏組培苗進行了病毒檢測分析。2014—2022 年市售紅顏組培苗受到5 種草莓病 毒(SMYEV、SMoV、SVBV、SCV 和CMV)的侵染,陽性樣品的總檢出率為20.2%。而2022年侵染紅顏組培苗的病毒僅為SMYEV 和SVBV。經過多年對紅顏組培苗的病毒檢測,發現病毒的種類和檢出率有明顯變化。病毒種類減少、檢出率降低與草莓莖尖組織培養技術的應用有關,故推測通過莖尖組織培養可脫除某些病毒,但無法達到完全脫毒的效果。
本試驗采集攜帶SMYEV 和SVBV 的紅顏匍匐莖進行莖尖組培,發現不能有效脫除草莓體內的SMYEV。組織培養時減小莖尖長度能提高病毒脫除率,但會大大降低莖尖萌發率,影響生產效率且不易操作(Bettoni et al.,2022)。熱處理能降 解病毒,抑制病毒的復制和擴散,但處理不當會影響組培苗的存活率(Krizan et al.,2009;Xiang et al.,2020)。本試驗測定了3 種熱處理方式對紅顏莖尖組培苗體內SMYEV 的脫除效果,發現莖尖組培苗的存活率不同,但SMYEV 的脫除率均為100.0%。
結合組培苗存活率和病毒脫除率來看,熱處理脫毒應使用逐步升溫法,而不是恒定的高溫。采用起始溫度為32 ℃,按1 ℃·d-1升至38 ℃后培養30 d,可有效脫除紅顏莖尖組培苗中的SMYEV,對 于草莓脫毒種苗的生產有重要意義。
降低繼代培養基中細胞分裂素6-BA 的濃度,能提高草莓組培苗的存活率;而施加水楊酸(SA)能提高病毒的脫除率(Magyar-Tábori et al.,2021)。不同品種同一病毒的脫除效果差異較大(Hu et al.,2019)。如,蘋果莖溝病毒(apple stem grooving virus,ASGV)經熱處理后在嘎拉和瑞雪2 個蘋果品種的分生組織都能檢測到,但瑞雪的脫毒效果比嘎拉好(Wang et al.,2020)。故SMYEV侵染不同草莓品種的分生組織能力也可能不同。今后應進一步提高熱處理草莓組培苗的存活率和脫毒率,并對不同草莓品種的熱處理脫毒方式進行探究。

