大黃炮制前后的化學成分變化及其減毒研究
王 敏 韓 婷 李春帥 徐文娟 楊琳琳 張姝妍 程水清 王 璇 文 佳 李向日
(北京中醫藥大學中藥炮制研究中心/北京市中藥品質評價重點實驗室,北京,102488)
大黃是蓼科植物掌葉大黃(PalmatumL.)、唐古特大黃[RheumtanguticumMaxim,ex Bal(F)]或藥用大黃(RheumofficinaleBaill.)的干燥根和根莖[1]。其藥用歷史悠久,最早見于《神農本草經》。“主下瘀血,血閉,寒熱,破癥瘕積聚,留飲,宿食,蕩滌腸胃,推陳致新,通利水谷,調中化食,安和五臟”,列為下品。大黃臨床應用極其廣泛,有“將軍”之稱,目前在臨床上多用于胃腸道疾病和慢性肝病等的長期治療。研究發現,大黃具有良好的保肝作用,可使肝臟免受纖維化、肝硬化、肝癌以及各種類型的肝炎等的發病[2-7]。統計《中華人民共和國藥典》(2020年版)、中醫方劑數據庫、藥智網,得到以大黃入藥的古方7 000多首和現代中成藥處方700多條[8]。目前,大黃被歐洲各國、美國等許多國家所認可,它已作為一種世界性藥物被列入19個國家的藥典[9]。
然而,有報道稱,長期服用大黃制劑可能存在肝損傷的風險[10-11]。盡管大黃安全性引起了公眾的質疑,但其仍是臨床肝病治療的常用藥物,因此,對大黃的肝毒性評估是必不可少的。同時,大黃生品苦寒,藥性峻烈,易損傷脾胃功能,耗損元氣,對于久病體弱、年老患者可選用藥性緩和的炮制品,以降低不良反應[12]。關于大黃的炮制最早見于漢代張機的《金匱玉函經》,“皆去黑皮、或炮或生,清酒洗,酒浸”[13]。傳統用藥常根據辨證選擇不同炮制品施治,目前大黃有多種炮制規格,其中臨床以熟大黃較為常用。
斑馬魚與人類的基因具有87%的同源性,其基因的傳導通路和代謝通路與哺乳動物也有高度的相似性[14-15]。作為一種新興模式生物,斑馬魚兼具體外細胞模型的高通量性和嚙齒類動物模型的生物復雜性等優勢,同時基于其發育迅速、繁殖快、操作簡單等特點[16-18],近些年,作為一種替代模型被廣泛應用于藥物誘導肝毒性的評價。為了更深入地探討大黃肝毒性,本研究以不同批次的生大黃、熟大黃為研究對象,利用斑馬魚幼魚肝毒性評價方法和現代化學技術分析大黃及其炮制品的化學成分差異和毒性大小,探討大黃炮制減毒的物質基礎和科學內涵,為臨床合理用藥和早期監測、診斷病情提供參考。
1 材料與方法
1.1 材料
1.1.1 動物 野生型斑馬魚(品系:AB品系)、轉基因型斑馬魚[品系:CZ16(gz15Tg,Tg(fabp10a:dsRed;ela3l:EGFP)]均購置于中國科學院水生生物研究所,養殖于集中式斑馬魚養殖系統(水溫28.5 ℃、光照周期為14 h光照/10 h黑暗)。
1.1.2 藥物 蘆薈大黃素對照品(成都瑞芬思生物科技有限公司,批號:RFS-L01411810008);大黃酸對照品(成都瑞芬思生物科技有限公司,批號:RFS-D01002010012);大黃素對照品(成都普思生物科技有限公司,批號:PS010624);大黃酚對照品(成都普思生物科技有限公司,批號:PS011322);大黃素甲醚對照品(成都普思生物科技有限公司,批號:PS0291);沒食子酸對照品(成都普思生物科技有限公司,批號:PS000688)
1.1.3 試劑與儀器 4%多聚甲醛(北京拜爾迪生物技術有限公司,貨號:DE-0094);磷酸緩沖鹽溶液(美國康寧公司,貨號:21-040-CVR);干酪素(北京奧博星生物技術有限責任公司,貨號:S12002);無水碳酸鈉(上海麥克林生化科技有限公司,貨號:S818014);磷鉬鎢酸(天津市光復精細化工研究所,貨號:20220111);NaCl(北京化工廠,貨號:A1060005)、KCl(北京化工廠,貨號:A1049003)、Na2HPO4(北京化工廠,貨號:A1060056)、CaCl2(北京化工廠,貨號:A1011002)、K2HPO4(北京化工廠,貨號:A1049021)、MgSO4(北京化工廠,貨號:A1037009)、NaHCO3(北京化工廠,貨號:A1060001);吖啶橙(上海源葉生物科技有限公司,貨號:S47568);分析純甲醇(上海易恩化學技術有限公司,貨號:67-56-1);純水(杭州娃哈哈集團有限公司)。
體式熒光顯微鏡(卡爾·蔡司公司股份公司,型號:V16);體視顯微鏡(卡爾·蔡司公司股份公司,型號:Stemi508);光學倒置顯微鏡(徠卡顯微系統(上海)貿易有限公司,型號:TE-2000-S);微型漩渦混懸器(上海振榮科學儀器有限公司,型號:WH-90A);高速臺式冷凍離心機(長沙湘儀離心機儀器有限公司,型號:TGL-16M);滅菌鍋(日本松下公司,型號:MLS-3751L);熒光成像系統(伯樂生命醫學產品(上海)有限公司,型號:BIO-RAD ChemiDoc MP);斑馬魚養殖系統(北京愛生生物科技有限公司,型號:集中養殖與發育系統設備);細胞移液器(Eppendorf,規格:200 μL、1 mL和5 mL);分析天平(北京賽多利斯儀器系統有限公司,型號:SARTORIUS AG);數控超聲波清洗器(昆山市超聲儀器有限公司,型號:KQ-600DE);紫外可見分光光度計(上海美譜達儀器有限公司,型號:P7雙光束型);高效液相色譜儀(沃特世科技(上海)有限公司,型號:Waters 2695);Agilent ZORBAX SB-C18色譜柱(北京賽普瑞斯科技有限公司,型號:250 mm×4.6 mm,5 μm)。
1.2 方法
1.2.1 樣品的收集和炮制
1.2.1.1 生大黃的收集 收集7批生大黃樣品,經北京中醫藥大學李向日教授鑒定,為掌葉大黃(RheumpalmatumL.)的干燥根莖。產地和批號信息見表1。

表1 生大黃樣品信息
1.2.1.2 熟大黃的炮制 本研究根據《中華人民共和國藥典》(2020版)和《北京市中藥飲片炮制規范》(2008版),將7批生大黃飲片分別炮制成熟大黃,具體方法如下:取大黃片,加黃酒拌勻(100 kg大黃片用黃酒50 kg),悶潤1~2 h至黃酒被吸盡,裝入不銹鋼可蒸制飯盒內,密封,蒸制24 h,此時,其表面和內部均呈黑色,取出,晾干。
按照以上方法炮制得到的炮制品置于干燥器中,陰涼處避光保存。
飲片呈橢圓形或不規則塊片狀,直徑大小不等,外表皮黃棕色或棕褐色,有縱皺紋,切面黃棕色有明顯散在或排列成環的星點,有空隙;熟大黃形如生品,表面和內部均呈黑色,質堅硬,氣微香。見圖1。

圖1 大黃炮制前后的性狀(代表性樣品)
1.2.1.3 水提物的制備 稱取生、熟大黃飲片150 g,加入10倍量的蒸餾水浸泡30 min后,煎煮30 min,過濾,藥渣中再加入8倍量的蒸餾水繼續煎煮1 h,合并水煎液,3 500 r/min,離心半徑8.7 cm,離心5 min,過濾,取上清液,濃縮,冷凍干燥后得到各生大黃及熟大黃炮制品的水提物粉末。于4 ℃冰箱保存,備用。
藥物儲備液的配制:精確稱取適量大黃水提取物粉末,溶于含50 mL胚胎培養水的離心管中,超聲30 min,根據實驗需要,分別配置成2 000、1 000和400 μg/mL的母液,-20 ℃冰箱中保存,在實驗前將母液稀釋成一系列的藥物濃度進行實驗。
1.2.2 鞣質的含量測定
1.2.2.1 對照品溶液的制備 精密稱取沒食子酸對照品25.04 mg,置50 mL棕色量瓶中,加水溶解并稀釋至刻度,精密吸取5 mL,置50 mL棕色量瓶中,用水稀釋至刻度,搖勻,即得沒食子酸對照品溶液(49.08 μg/mL)。
1.2.2.2 供試品溶液的制備 取藥材粉末(過四號篩)約0.25 g,精密稱定,置250 mL棕色量瓶中,加水150 mL,放置過夜,超聲處理10 min,放冷,用水定容至刻度,搖勻,靜置,濾過,棄去初濾液50 mL,精密量取續濾液20 mL,置100 mL棕色量瓶中,用水稀釋至刻度,搖勻,即得供試品溶液。
1.2.2.3 方法學考察
1.2.2.3.1 線性關系考察 精密量取對照品溶液0.5 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL,分別置25 mL棕色量瓶中(使溶液中沒食子酸含量分別為0.98 μg/mL、1.96 μg/mL、3.93 μg/mL、5.89 μg/mL、7.85 μg/mL、9.82 μg/mL),各加入磷鉬鎢酸試液1 mL,再分別加水11.5 mL、11.0 mL、10.0 mL、9.0 mL、8.0 mL、7.0 mL,用29%碳酸鈉溶液稀釋至刻度,搖勻,放置30 min,同時制備相應的空白對照溶液,在760 nm波長處測定吸光度。
1.2.2.3.2 儀器精密度實驗 分別取沒食子酸對照溶液(49.08 μg/mL)和供試品溶液(編號:生大黃-3),采用所確定的檢測條件,連續測定吸光度值6次。
1.2.2.3.3 穩定性實驗 精密吸取供試品溶液(編號:生大黃-3)1.0 mL,采用所確定的檢測條件,顯色30 min后放置0、10、20、30、40、60 min,并分別測定吸光度。
1.2.2.3.4 重復性實驗 精密稱取同一批大黃樣品6份(編號:生大黃-3),按1.2.2.2項下方法制備供試品溶液,并按所確定的檢測條件進行測定。
1.2.2.3.5 加樣回收實驗 取同一批已知鞣質含量的樣品6份(編號:生大黃-3,鞣質含量為4.04%),每份0.25 g,精密稱定,置于250 mL容量瓶中,并精密加入沒食子酸對照品溶液1 mL,其酚酸含量與所取大黃樣品總酚酸含量相等,按1.2.2.2項制備供試品溶液,采用所確定的檢測條件,測定樣品總酚含量,計算加樣回收率。
1.2.2.4 含量測定 按1.2.2.2項下方法制備生、熟大黃供試品溶液,以確定的檢測條件測定吸光度。實驗重復2次。
1.2.3 蒽醌的含量測定
1.2.3.1 對照品溶液的制備 精密稱取蘆薈大黃素對照品、大黃酸對照品、大黃素對照品、大黃酚對照品、大黃素甲醚對照品各2.53 mg、2.63 mg、2.43 mg、2.55 mg和2.50 mg,加甲醇分別制成1 mL含蘆薈大黃素、大黃酸、大黃素、大黃酚分別為19.84 μg、20.62 μg、19.05 μg、19.99 μg,大黃素甲醚9.80 μg的溶液,即得。
1.2.3.2 供試品溶液的制備 參照《中華人民共和國藥典》大黃【含量測定】項下總蒽醌和游離蒽醌供試品溶液的制備[1]。
1.2.3.3 色譜條件 符合《中華人民共和國藥典》大黃含量測定項下色譜條件:色譜柱為Agilent ZORBAX SB-C18色譜柱(250 mm×4.6 mm,5 μm);以甲醇-0.1%磷酸溶液(85∶15)為流動相,檢測波長為203 nm,進樣量為10 μL;流速為1.0 mL/min;柱溫為20 ℃。
1.2.3.4 含量測定 取生、熟大黃樣品粉末(過四號篩),按照2.3.3項下方法分別制備總蒽醌和游離蒽醌供試品溶液,分別精密吸取對照品溶液與上述2種供試品溶液各10 μL,注入液相色譜儀,測定,即得。結合蒽醌含量=總蒽醌含量-游離蒽醌含量。
1.2.4 斑馬魚幼魚模型評價生、熟大黃水提物的肝毒性
1.2.4.1 斑馬魚的繁殖與飼養 暗周期開始前1 d,選擇健康的成年斑馬魚按雌雄比1∶2放入具篩板的產卵缸內,中間放置隔板,光周期開始后抽去隔板,0.5 h后收集魚卵于干凈的培養皿中,胚胎培養水沖洗3遍,在顯微鏡下挑選健康的胚胎重新放入新的含胚胎培養水的培養皿中,28 ℃恒溫培養箱中培養,相同光照條件下發育至4 dpf(Days Post Feritilization,受精后天數)。在3 dpf階段前,在體式顯微鏡下挑選出健康的斑馬魚幼魚。
1.2.4.2 急性毒性實驗 隨機挑選發育正常的4 dpf健康斑馬魚幼魚置于12孔板的樣孔中,每孔20尾,每組設3孔重復。根據預實驗,設定空白對照組(斑馬魚胚胎培養水)和不同濃度的生大黃、熟大黃組。整個暴露過程在28.5 ℃的恒溫培養箱中進行。在暴露處理期間,每隔8 h統計各實驗的斑馬魚死亡數量并及時移除死亡的幼魚。在實驗暴露終點,于體式顯微鏡下確定不同處理存活幼魚的數量,統計每組的死亡率。整個實驗重復3次。
1.2.4.3 表型評價 選擇AB系野生型斑馬魚,在實驗暴露終點,移除暴露液,并用胚胎培養水將各處理的斑馬魚幼魚沖洗3次,用三卡因溶液麻醉后,側位擺放,固定于含3%甲基纖維素的載玻片上,每組隨機選取10尾斑馬魚,于體式顯微鏡下觀察活體斑馬魚的肝臟變性情況,并用顯微鏡軟件(ZEN lite)拍照記錄。
1.2.4.4 肝臟病理組織學評價 選擇AB系野生型斑馬魚,在實驗暴露終點,使用胚胎培養水沖洗3次,每組隨機選取10尾斑馬魚幼魚,轉移至含4%多聚甲醛的1.5 mL潔凈離心管中,室溫下貯存。乙醇逐步脫水,石蠟包埋,切成4~5 μm的切片后進行蘇木精-伊紅(Hematoxylin-eosin,HE)染色,在光學倒置顯微鏡下觀察斑馬魚幼魚肝組織病理學的改變,并拍照記錄。
1.2.4.5 體內細胞凋亡評價 選擇AB系野生型斑馬魚,在實驗暴露終點,胚胎培養水清洗3遍,每組隨機選取10尾斑馬魚,在孔板中快速加入2.5 μg/mL吖啶橙溶液2 mL,于避光條件下染色30 min,使用胚胎培養水和磷酸緩沖鹽溶液各沖洗3遍,在熒光顯微鏡下觀察生、熟大黃對肝細胞凋亡的影響,并拍照記錄。
1.2.4.6 斑馬魚肝臟熒光面積的測定 選擇CZ16轉基因型斑馬魚,在實驗暴露終點,利用熒光顯微鏡和Image J軟件統計不同處理組中斑馬魚幼魚的肝臟熒光面積,整個實驗重復3次。
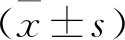
2 結果
2.1 鞣質的含量測定
2.1.1 方法學考察
2.1.1.1 線性關系考察 計算回歸方程為Y=0.103 1X+0.034 9(R2=0.999 1,n=6)。結果表明,沒食子酸濃度在0.099 4~1.274 8 μg/mL之間與其吸光度呈良好的線性關系。
2.1.1.2 儀器精密度實驗 結果表明,精密度相對標準偏差(Relative Standard Deviation,RSD)分別為0.09%和1.76%,表明儀器精密度高。
2.1.1.3 穩定性實驗 結果表明,在60 min內溶液吸光度RSD為1.66%和1.67%,因此,樣品顯色后至少在60 min內穩定。
2.1.1.4 重復性實驗 結果表明,鞣質的平均含量為4.04%,RSD=2.48%,表明此方法重復性良好。
2.1.1.5 加樣回收實驗 總酚的平均加樣回收率為100.59%,RSD=1.77%,表明該測定方法準確度高,符合測定要求。見表2。

表2 加樣回收試驗結果(n=6)
2.1.2 含量測定 測得生大黃的鞣質含量為3.59%,熟大黃的鞣質含量為0.33%;與生大黃比較,炮制成熟大黃后鞣質含量降低8~10倍(P<0.01)。見表3。

表3 生大黃、熟大黃的鞣質含量測定結果(%,n=2)
2.2 蒽醌的含量測定 生大黃、熟大黃飲片中總蒽醌和游離蒽醌的含量均符合現版《中華人民共和國藥典》規定。總蒽醌、游離蒽醌、結合蒽醌在生大黃中的含量分別為1.96%、1.01%和0.95%;在熟大黃中的含量分別為1.86%、1.27%和0.64%。見表4。與生大黃比較,熟大黃中結合蒽醌的含量降低,游離蒽醌的含量升高,差異無統計學意義(P>0.05)。見圖2。

表4 生大黃、熟大黃的蒽醌含量測定結果(n=2,%)

圖2 生大黃、熟大黃中游離蒽醌、結合蒽醌和鞣質的成分含量
2.3 斑馬魚幼魚模型評價生、熟大黃水提物的肝毒性研究結果
2.3.1 急性毒性表現和量-毒曲線評價 低濃度大黃給藥時,斑馬魚幼魚略為安靜,部分幼魚伏于水底或沿壁正常游動,未見明顯異常狀況;而加入高濃度大黃時,幼魚出現應激反應,游動迅速。8 h后,斑馬魚幼魚安靜伏于水底,受到外界刺激時反應遲鈍,可觀察到幼魚的體表被染成黃色;后期可觀察到斑馬魚幼魚處于側臥狀態,用玻璃棒多次觸碰這些魚的尾部,如無反應,則判定為死亡。在實驗暴露終點,空白對照組的幼魚體形舒展、行動活潑;給藥組死亡斑馬魚體態蜷曲,未死亡斑馬魚部分尾部彎曲,色素沉著降低,行動遲緩。
結果表明,大黃的急性毒性強弱為:生大黃>熟大黃,熟大黃的最大非致死濃度約為生大黃的9倍,證明生大黃經炮制后毒性顯著降低,且3批大黃的毒性下降趨勢幾乎一致。見圖3,表5。

圖3 生大黃、熟大黃對斑馬魚死亡率的影響(n=3)

表5 生熟大黃對斑馬魚的致死濃度表(μg/mL)
2.3.2 表型評價 空白對照組中斑馬魚幼魚肝臟形態清晰,呈透明狀;生大黃組給藥后肝臟透明度降低,隨著暴露濃度的增加,肝臟區域邊緣逐漸模糊,顏色趨于灰暗狀,表明出現肝臟變性;熟大黃低濃度組肝臟變性程度不明顯,高濃度可見輕微肝臟變性。此外,還觀察到一些非肝毒性特異特征,如表面呈黃染現象,腸道被染紅等。見圖4。

圖4 生大黃、熟大黃對斑馬魚幼魚肝臟表型的影響(×32,×80)
2.3.3 肝臟病理組織學評價 空白對照肝臟區域細胞結構完整,細胞核呈規則圓形;生大黃低濃度可觀察到肝細胞排列不規則,組織間隙增大;高濃度組細胞核萎縮變形,肝組織排列及組織空隙嚴重程度加劇,并呈現空泡化,生大黃高濃度組偶見炎癥細胞浸潤;肝組織損傷程度隨著給藥濃度的增加而加重;熟大黃低濃度組對斑馬魚幼魚的肝臟組織無明顯影響,高濃度仍可見組織空泡化,但較生大黃組肝臟變性程度有所減輕。見圖5。

圖5 生大黃、熟大黃對斑馬魚幼魚肝臟病理組織的影響(×10,×40)
2.3.4 體內細胞凋亡評價 與空白對照組比較,生、熟大黃給藥組對斑馬魚肝臟細胞凋亡的影響不同,生大黃組中斑馬魚的肝臟區域表現出黃綠色熒光小點,隨著濃度增大,凋亡細胞數量變多,說明生大黃能夠引起顯著的肝細胞凋亡;熟大黃低濃度組未見凋亡,高濃度組偶見凋亡。見圖6。

圖6 生、熟大黃對斑馬魚幼魚肝臟細胞凋亡的影響(×32,×80)
2.3.5 斑馬魚肝臟熒光面積的測定 與空白對照組比較,生大黃低濃度組肝臟熒光面積呈下降趨勢,差異無統計學意義(P>0.05),高濃度組的肝臟熒光面積顯著性減小(P<0.05),熟大黃低、高濃度組肝臟熒光面積比較,差異無統計學意義(P>0.05)。見圖7。

圖7 生大黃、熟大黃對斑馬魚幼魚肝臟熒光面積的影響(n=3)
3 討論
大黃并非傳統的毒劇中藥,但因其生品苦寒之性峻烈,損傷脾胃功能,致使各種不良反應發生,因此,應對臨床用藥劑量進行嚴格控制。自2010年起,《中華人民共和國藥典》建議大黃的用量從3~30 g/d減少到3~15 g/d,臨床應用較為安全,然而,當應用于慢性病長期給藥時,大黃潛在的肝毒性不容忽視。當前對大黃的多數研究常采用單體給藥,僅關注中藥成分中的單一毒性評價,但僅憑單體的毒性表現并不能斷言大黃肝毒性的物質基礎必然是其中的單個成分,而與其他成分無關。本研究并不只關注某個成分,而是選擇結合蒽醌、游離蒽醌和鞣質3類成分,基于臨床中藥飲片炮制前后的真實生物學評價,通過化學分析結合生物學評價,對大黃的肝毒性進行評估。
本研究將7批生大黃分別炮制成熟大黃,利用高效液相色譜法和紫外分光光度法對生大黃、熟大黃中的結合蒽醌、游離蒽醌和鞣質進行含量測定,比較大黃炮制前后3類成分的含量差異。結果顯示,生大黃中3種成分的含量為:鞣質(3.59%)>游離蒽醌(1.01%)>結合蒽醌(0.95%),而炮制成熟大黃后的含量為:游離蒽醌(1.27%)>結合蒽醌(0.64%)>鞣質(0.33%)。炮制后鞣質含量降低8~10倍,分析原因可能是:在炮制過程中溫度較高,鞣質的化學性質不穩定,在高溫下易被破壞,分解為單體后含量降低[13]。與生大黃比較,熟大黃的結合蒽醌含量減低,游離蒽醌含量升高,可能在雙相水解過程中導致結合蒽醌的水解。
同時,以4 dpf斑馬魚幼魚模型對炮制前后的大黃進行肝毒性評價,急性毒性實驗結果表明,熟大黃的最大非致死濃度顯著升高,約為生大黃的9倍,且3批大黃的毒性下降趨勢幾乎一致,表明大黃的炮制減毒作用客觀存在。然后,在低于最大非致死濃度的暴露條件下,本實驗通過表型、病理組織切片和整體吖啶橙染色來確定生、熟大黃暴露處理對斑馬魚幼魚肝臟的影響,利用斑馬魚的光學透明性和熒光轉基因特性,肝臟被確定為大黃毒性的靶器官。結果表明,與空白對照比較,生大黃能引起斑馬魚模型出現明顯的肝損傷,如肝區域透明度降低,肝臟萎縮、卵黃囊吸收延遲、肝臟細胞變形及凋亡;而相同濃度下的熟大黃,僅在高濃度條件下呈現輕微的肝臟變性。這表明經炮制后,熟大黃對斑馬魚幼魚肝臟的毒性大大降低。以上指標在不同條件下均表明生大黃能引起肝臟表型及組織結構的顯著變化,引起細胞凋亡;而熟大黃的暴露處理對肝臟的損傷表現遠輕于生大黃。
綜上所述,大黃對斑馬魚幼魚肝臟具有毒性作用,造成其不良反應的主要成分可能為鞣質類成分,炮制成熟大黃后該成分的含量以及對斑馬魚的急性毒性和肝損傷均顯著降低。然而,其他化學成分是否也是毒性成分仍需要深入研究,關于大黃肝毒性的物質基礎以及毒理學機制,還有待大量且全面的研究來闡明,以期提高大黃臨床應用的安全性。

