以甲胎蛋白-MHC復合物為靶向的CAR T細胞治療肝癌的效果評估
王瑋 沙鈞平 丁鋒 王新明
肝切除、移植和局部消融對早期肝細胞癌(hepatocellular carcinoma,HCC)患者具較好療效[1-3]。索拉非尼和瑞戈非尼可使晚期患者的總生存期延長2~3個月,但常伴有治療引起的不良事件,如低磷血癥、體重減輕、手足皮膚反應、高血壓等[4-6]。免疫療法可有效治療多種癌癥[7-9]。CAR T細胞療法依賴自體或同種異體T細胞,經過基因改造表達合成CAR/TCR,將它們重定向并攻擊和殺死表達特定抗原的腫瘤細胞[10-12]。盡管甲胎蛋白(AFP)作為癌癥特異性抗原具有吸引力,但AFP在細胞內表達和分泌,因此無法與傳統的基于抗體的療法一起使用[13]。在人類細胞中的所有蛋白質都被加工成肽并由細胞表面的I類MHC呈遞。目前已在小鼠和人類中鑒定出AFP/MHC特異性TCR,表明AFP-MHC復合物具有免疫原性[14]。本研究探討以AFP-MHC復合物為靶向的CAR T細胞治療肝癌的效果。
材料與方法
一、實驗材料
細胞:人肝癌細胞系HepG2購自廣州珍尼奧生物科技有限公司,HepG2細胞在37°C的加濕培養箱中培養。從太平洋血液中心獲得健康人類外周血白細胞,使用EasySep人類T細胞分離試劑盒(上海碧云天公司)分離T細胞。將雙特異性抗體ET1402L1設計成包含CD28/CD3共刺激域的第二代CAR,將CAR構建體克隆到慢病毒載體中,用于轉導原代人T細胞。
實驗小鼠:40只雄性BALB/c裸鼠,體質量21~25 g,4~6周齡,在無特定病原體(SPF)條件下飼養,光照/黑暗周期為12 h。小鼠接受無菌嚙齒動物飼料和隨意飲水。該方案經省中醫藥大學實驗動物管理委員會批準。
肝癌小鼠異種移植模型:動物實驗在Murigenics進行。皮下腫瘤模型:在植入前將細胞與50% Matrigel混合,并通過卡尺測量腫瘤。HepG2腫瘤模型;每只小鼠植入2.5×106個細胞;腹膜內研究,將2.5×106HepG2-luc2 細胞注射到PBS中,并使用IVIS成像系統通過總發光通量測量腫瘤。
實驗分組:每周通過測量腫瘤衍生的生物發光來評估腫瘤負荷,將小鼠隨機分配為腫瘤模型組20只和AFP-CAR T靶向治療組20只。腫瘤模型組腹膜注射供體匹配的T細胞(模擬),AFP-CAR T靶向治療組小鼠腹膜內注射107個AFP-CAR T細胞。
二、方法
肽由Elim Biopharmaceuticals合成。生物素化的AFP158/人類白細胞抗原(HLA)-A*02:01復合物是通過在肽和β2-微球蛋白(β2M)存在下重折疊重組HLA-A*02:01產生。鏈霉親和素-PE偶聯的AFP158/HLA-A*02:01四聚體(PE-四聚體)由Eureka Therapeutics制造。通過細胞淘選和產生針對AFP158/HLA-A*02:01復合物的IgG1抗體選擇對AFP158/HLA-A*02:01具有特異性的人抗體。
AFP-CAR T細胞的產生:抗AFP158/HLA-A*02:01 scFv被移植到第二代CAR上,CD28和CD3ζ信號結構域順式設計以提供細胞內T細胞刺激信號。CAR序列被克隆到pCDH慢病毒載體(Sigma公司,美國)中,遞送到T細胞。人T細胞在含10% FBS的RPMI1640中培養,并用CD3/CD28 Dynabeads(Sigma公司,美國)激活。激活后1 d,在RetroNectin包被的平板中用濃縮的慢病毒轉導人T細胞。在100 U/mL IL-2(Sigma公司,美國)或10 ng/mL IL-7和5 ng/mL IL-15存在下將轉導的T細胞擴增8~12 d。使用鏈霉親和素-PE偶聯的AFP158/HLA-A*02:01四聚體通過流式細胞術評估轉導效率。
細胞裂解和增殖試驗:雙特異性抗體(BsAb)形式的克隆體ET1402L1在指定濃度下與T細胞和HepG2細胞以5∶1的E∶T比例孵育16 h。通過LDH釋放測定法測量細胞裂解率。克隆體ET1402L1與T細胞、HepG2細胞移植到96孔板中,使用CCK-8試劑盒(Sigma公司,美國)在第1、3、5和7天檢測細胞的A值,在450 nm下用分光光度法測量溶液。
定量實時PCR:提取總RNA,反轉錄成cDNA。使用SYBR-Green方法(Sigma公司,美國)在Bio-Rad CFX96定量實時PCR檢測靶基因的相對表達,95°C 15 min,94°C 15 s、55°C 30 s、63°C 30 s,40個循環。U6和β-肌動蛋白作為內部對照。
血清AFP檢測:ELISA試劑盒分析小鼠的血清AFP水平。
腫瘤治療效果的Micro-CT掃描評估:采用碘海醇(350 mg I/ml)進行臟器造影成像,X光管電壓55 KVp,功率60 W。
三、統計學處理
結 果
一、細胞增殖檢測結果
第1天兩組細胞增殖差異無統計學意義(P>0.05),第3、5、7天,AFP-CAR T細胞組細胞增殖較HepG2組降低(P<0.05)。見表1。
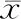
表1 細胞增殖檢測結果(±s)
二、AFP-CAR T細胞在體外特異性殺傷HepG2
HepG2組細胞裂解率為(8.24±2.33)%,AFP-CAR T細胞組細胞裂解率為(72.19±8.32)%,差異有統計學意義(P<0.05)。
三、細胞因子的表達
AFP-CAR T細胞組TNFα、IFNγ、IL-2和IL-10 mRNA表達較HepG2組升高(P<0.05)。見表2。
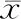
表2 細胞因子mRNA表達結果(±s)
四、AFP-CAR T細胞抑制腫瘤生長
第0天兩組小鼠腫瘤大小比較差異無統計學意義(P>0.05),第10、20、30、40天,AFP-CAR T靶向治療組腫瘤大小較腫瘤模型組減小(P<0.05)。見表3。
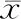
表3 異種移植腫瘤生長檢測(±s)
五、AFP-CAR T細胞降低腫瘤小鼠AFP水平
腫瘤模型組AFP為(2564.18±265.19)μg/mL,AFP-CAR T靶向治療組AFP為(837.49±63.22)μg/mL(P<0.05)。
六、腫瘤治療效果的Micro-CT掃描評估
AFP-CAR T靶向治療組腫瘤直徑為(529.25±39.27)mm,較腫瘤模型組(69.58±15.65)mm顯著減小(P<0.05)。
討 論
雖然HCC通常不被認為是免疫原性腫瘤,但腫瘤中淋巴細胞水平高的HCC患者復發風險較低,預后較好。研究發現,射頻消融后外周血中循環腫瘤抗原特異性細胞毒性T淋巴細胞比例升高可降低復發風險[15]。這表明,HCC患者會產生抑制疾病進展的抗腫瘤免疫。過去研究確定了HCC中的腫瘤相關抗原及其各自的T細胞表位,從而證實存在T細胞介導的HCC免疫反應。基因修飾的T細胞療法已被開發為一種遞送特定于不同類型癌癥的T細胞方法。它使用經過基因改造的T細胞來產生識別腫瘤抗原及其表位的TCR,CAR的細胞內部分是通過共刺激分子與TCR的細胞內部分[16,17]。
CAR-T細胞是由病毒載體修飾以表達CAR的T細胞。CAR-T細胞不受HLA的限制,因為CAR-T細胞的抗原識別位點由特異性識別腫瘤表面抗原的單克隆抗體組成[18, 19]。CD19-CAR-T細胞療法使復發性和難治性B細胞非霍奇金淋巴瘤患者的完全緩解率約達50%[20]。針對實體瘤的T細胞療法主要阻礙因素之一是缺乏可靶向的腫瘤特異性抗原。本研究利用之前開發的抗體來識別和優化針對與HLA-A*02:01復合的AFP158肽的高度特異性抗體,使用由該抗體構建的第二代CAR的重定向T細胞療法在HepG2的肝癌腫瘤模型中顯示出抗腫瘤活性。這將適用于作為實體瘤特異性靶標的許多其他細胞內抗原。此外,通過將肽-MHC復合物特異性的scFv工程化到第二代CAR平臺中,規避了與傳統CAR(不能靶向細胞內抗原)和TCR相關的一些缺點。一方面,避免了工程化TCR與內源性TCR的錯配,這大大降低了脫靶效應的機會。與傳統的工程化TCR不同,后者與內源性TCR競爭表達并需要外部共刺激信號來啟動完整的免疫反應,第二代CAR可以通過其雙信號受體(即CD28/CD3)。因此,這種scFv-CAR設計能夠以極好的選擇性靶向細胞內和分泌的抗原,同時提供通常用CAR實現的效力。本研究中,基于AFP在HCC中的表達模式及其已證明的免疫原性,開發了ET1402L1,這是一種全人源抗體,可選擇性結合HLA-A*02:01呈遞的AFP158-166(AFP158)肽,這是最普遍的I類人群中的MHC。將這種TCR樣抗體設計成第二代CAR,使抗原識別與直接有效的免疫效應活性結合起來。本研究用ET1402L1-CAR轉導的T細胞可發揮細胞毒性作用,裂解靶細胞并抑制HepG2的增殖,同時可釋放細胞因子并殺死HepG2靶細胞。此外,AFP-CAR T細胞可顯著降低小鼠血清AFP水平,證明了這種免疫治療方法在實體瘤環境中的有效性。
綜上所述,以AFP-MHC復合物為靶向的CAR T細胞靶向細胞內分泌的腫瘤抗原產物是有效的。
利益沖突聲明:所有作者均聲明不存在利益沖突。

