白芍多糖對化學性肝損傷肝陰虛證病證結合模型的影響和作用機制
賈 嵐 高 晶 孟智睿 魏益謙 李 麗 邵紫萱 高學敏 王景霞
(北京中醫藥大學,北京,100029)
白芍為毛茛科植物芍藥RadixPaeoniaeAlba的根,在中國歷代醫家運用的處方中具有“養血斂陰,柔肝止痛,平抑肝陽”的功效,用于頭痛、眩暈、肋痛腹痛、四肢攣痛、血虛萎黃、月經不調、自汗盜汗等癥[1-2]。白芍的化學成分主要有苷類化合物、鞣質、多糖、淀粉、蛋白質等[3-4],目前研究表明苷類化合物為芍藥的主要有效成分,在心血管、神經等系統中起作用[5-7],然而關于占有白芍干燥根莖20%以上的白芍總多糖的藥理作用研究文獻較少[8]。
課題組前期對白芍總苷對化學性肝損傷肝陰虛證大鼠模型的影響和作用機制進行研究,發現其可改善肝陰虛證的證候表征,通過抑制磷脂酰肌醇-3-激酶/蛋白激酶B(Phosphatidylinositol-3-kinase-protein Kinase B,PI3K/AKT)通路,平衡抗炎與促炎機制,從而發揮保護化學性肝損傷肝陰虛證的作用,同時還可改善微循環障礙,對肝陰虛證存在的瘀血證候也有一定的影響[9]。那么白芍多糖作為白芍的另一類主要化學成分,可能是白芍治療肝陰虛證的物質基礎之一。本研究以白芍多糖為研究對象,探討其對化學性肝損傷肝陰虛證大鼠模型的影響及作用機制,為進一步闡明和揭示白芍治療肝陰虛證的物質基礎和作用機制奠定基礎。
1 材料與方法
1.1 材料
1.1.1 動物 選取無特定病原體(Specific Pathogen Free,SPF)級雄性SD大鼠40只,體質量(200±20)g,由北京斯貝福有限公司提供,動物許可證號SCXK(京)2018-0006,動物倫理審批號BUCM-4-2018080103-3009,飼養于北京中醫藥大學屏障系統中,室溫(23±2)℃,濕度40%~60%,正常飲水,自由飲食。
1.1.2 藥物 附子、干姜、肉桂配方顆粒,批號20180623,購于北京康仁堂藥業有限公司;白芍飲片,批號20180801,購于北京本草方源藥業集團有限公司;北沙參9 g、麥冬9 g、當歸9 g、生地黃20 g、枸杞子12 g、川楝子4.5 g(一貫煎原方藥物劑量和比例),批號20180715,購于北京中醫藥大學國醫堂。藥材均經北京中醫藥大學臨床中藥學教研室李偉實驗師鑒定為正品。
1.1.3 試劑與儀器 CCl4(北京百諾威生物科技有限公司,批號:20170710);橄欖油(北京百諾威生物科技有限公司,批號:20180508);谷丙轉氨酶(Glutamic-pyruvic Transaminase,GPT)試劑盒(長春匯力,批號:20180925);谷草轉氨酶(Glutamic-oxaloacetic Transaminase,GOT)試劑盒(長春匯力,批號:20180925);蘇木精-伊紅(Hematoxylin and Eosin,HE)染液(谷歌生物,批號:G1005);Ⅲ型前膠原(ProcollagenⅢ,PCⅢ)ELISA試劑盒(優爾生生物,批號:L190327228);層粘連蛋白(Laminin,LN)ELISA試劑盒(優爾生生物,批號:L190307441);Ⅳ型膠原(CollagenⅣ,CⅣ)ELISA試劑盒(優爾生生物,批號:L190327207);透明質酸酶(Hyaluronidase,HA)ELISA試劑盒(華美生物,批號:G25012101);丙二醛測試盒(南京建成,批號:20181030);過氧化氫酶測試盒(南京建成,批號:20181030);谷胱甘肽過氧化物酶測試盒(南京建成,批號:20181029);總超氧化物歧化酶測試盒(南京建成,批號:20181107);Rat TNF-α Uncoated ELISA試劑盒(賽默飛生物,批號:191593002);Rat IL-6 ELISA試劑盒(聯科生物,批號:A30681042);Rat IL-10 ELISA試劑盒(聯科生物,批號:231070812);RNA提取液(Servicebio G3013,批號:20180609);三氯甲烷(國藥集團化學試劑有限公司,批號:10006818)。
全自動生化分析儀(深圳雷杜生命科技,型號:Chemray 240);酶標檢測儀(BioTeK,美國,型號:Epoch);水浴鍋(姜堰市天力醫療器械廠有限公司,型號:TL-420D);電子天平[梅特勒-托利多儀器(上海)有限公司,型號:PL-203];臺式高速冷凍離心機(Heal Force,型號:Neofuge 15R);純水儀(青島富勒姆科技,型號:FBZ2001-UP-P);全自動研磨儀(武漢賽維爾生物,型號:KH-Ⅲ);全自動生化分析儀(深圳雷杜生命科技,型號:KH-Ⅲ);臺式高速冷凍型微量離心機(DragonLab,型號:D3024R);熒光定量PCR儀(ABI,美國,型號:Stepone plus);超凈工作臺(蘇凈安泰,型號:SW-CJ-1FD);超微量分光光度計(Thermo,德國,型號:NanoDrop2000);標準試劑型純水儀(青島富勒姆科技有限公司,型號:FBZ2001-up-p)。
1.2 方法
1.2.1 分組與模型制備
1.2.1.1 動物分組 將上述雄性SD大鼠適應性喂養后,體質量隨機區組法分為空白組、模型組、陽性藥組、白芍多糖組共4組,每組10只。
1.2.1.2 模型制備 1)白芍多糖制備:白芍飲片加水浸泡1 h,煎煮提取2次,每次1.5 h,加水量12、10倍,合并水煎液,通過D-101型大孔吸附樹脂柱(飲片∶大孔樹脂=1∶1),70%乙醇洗脫,收集洗脫液,減壓濃縮至相對密度1.08~1.10(60 ℃),加乙醇至乙醇水平為80%,冷藏24 h,取沉淀,減壓干燥,得白芍多糖提取物(出膏率3.82%)。2)一貫煎制備:將一貫煎原方飲片按比例置于煎煮容器內,加相當于藥材量6倍的冷水浸泡2 h,煮沸30 min,濾過。藥渣加3倍量水繼續煎煮,煮沸20 min,濾過,合并2次濾液(生藥質量濃度0.635 g/mL)。冷卻后置4 ℃冰箱保存備用。3)附子、干姜、肉桂溫熱中藥復方制備:取附子、干姜、肉桂配方顆粒,用前以蒸餾水配制成1∶1∶1的溫熱中藥復方溶液(1.2 g/mL)。4)動物模型制備:除對照組外,其余各組大鼠均腹腔注射20% CCl4橄欖油溶液,劑量為1.5 mL/kg,2次/周(周一、周四),連續6周,第5、6周開始同時灌胃給予附子、干姜、肉桂溫熱中藥復方制備化學性肝損傷肝陰虛證模型,1次/d,劑量18 g/kg,對照組大鼠灌胃等劑量的橄欖油溶液[10]。
1.2.2 給藥方法 造模期間,對照組、模型組大鼠灌胃生理鹽水,陽性藥組大鼠灌胃一貫煎水提液6.35 g/kg,白芍多糖組大鼠灌胃白芍多糖提取物3 g/kg(臨床一貫煎成人用量63.5 g/d[11],白芍多糖成人用量30 g/d[12],動物系數按照7倍計算,成人體質量按照70 kg計算),1次/d,連續6周。
1.2.3 檢測指標與方法 1)樣本采集:6周后,大鼠禁食12 h,正常飲水,采用水合氯醛麻醉,劑量為3 mL/kg,大鼠麻醉腹主動脈取血后處死,取肝臟組織凍存、固定,檢測相關指標。2)一般觀察:實驗6周后,大鼠禁食12 h,測量體質量、肛溫,觀察其易激惹程度、毛發光澤度、小便顏色、大便顏色質地。具體評分標準參考文獻[10-11,13]的方法,要求至少有2人觀察,1人記錄,對于評分標準,如果出現意見不統一,則由第3人確定,并記錄。實驗大鼠體征評分標準見表1。毛發評分標準見圖1。3)血清血脂水平和酶活性:嚴格按照試劑盒說明書,應用全自動生化分析儀檢測血清GPT、GOT水平,應用酶標儀采用酶聯免疫吸附試驗法檢測血清環磷酸腺苷(cAMP)、環磷酸鳥苷(cGMP)水平。4)肝臟脂質水平和酶活性:嚴格按照試劑盒說明書,應用全自動生化分析儀檢測肝組織勻漿丙二醛、谷胱甘肽過氧化物酶(Glutathione Peroxidase,GPX-Px)、過氧化氫酶(Catalase,CAT)、超氧化物歧化酶(Superoxide Dismutase,SOD)水平。應用酶標儀采用酶聯免疫吸附試驗法檢測肝組織勻漿PCⅢ、CⅣ、LN、HA、白細胞介素-6(Interleukin-6,IL-6)、白細胞介素-10(Interleukin-10,IL-10)、腫瘤壞死因子-α(TNF-α)活性。5)肝臟病理切片的觀察:用蘇木精-伊紅(Hematoxylin Eosin,HE)法染色肝臟組織,切片,觀察肝臟的病理切片。6)qRT-PCR檢測肝臟PI3K、AKT mRNA表達:大鼠剖腹腹主動脈取血后,將肝左葉迅速放入凍存管,在液氮中保存后轉移至-70 ℃冰箱備用。

表1 實驗大鼠體征評分

圖1 毛發評分標準
剪取100 mg肝臟組織,先Trizol法提取總RNA。通過研磨、抽提出總RNA,再加入15 μL無RNA酶的水溶解RNA,55 ℃孵育5 min,再檢測RNA濃度及純度。接著反轉錄為cDNA。qRT-PCR體系為2×qRT-PCR Mix 12.5 μL,7.5 μmol/L基因引物2.0 mL、反轉錄產物2.5 μL、dd H2O 8.0 μL。引物序列見表2。反應程序為預變性95 ℃、10 min;95 ℃、15 s→60 ℃、60 s,循環(40次);熔解曲線60 ℃→95 ℃,每15秒升溫0.3 ℃。以2-△△Ct法計算目的基因相對表達量。
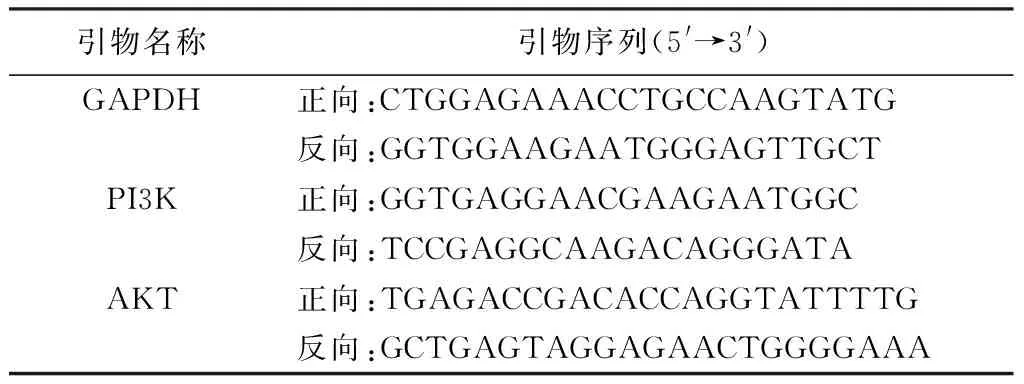
表2 引物序列
2 結果
2.1 白芍多糖對化學性肝損傷肝陰虛證大鼠證候評分和肛溫的影響 經過評分可見,與空白組比較,模型組實驗大鼠精神狀態、毛發、小便評分顯著升高,大便評分顯著降低,可見模型組大鼠符合其一般情況中的描述:狂躁易激惹,活動多,抓時叫聲,灌胃時反抗劇烈,毛發干枯無光澤,大便干,質地硬,小便色深黃。與模型組比較,一貫煎組、白芍多糖組改善明顯(P<0.05,P<0.01)。與空白組比較,模型組大鼠肛溫顯著升高(P<0.001),與模型組比較,一貫煎組可顯著降低模型大鼠肛溫(P<0.001)。見表3。
表3 白芍多糖對肝陰虛證實驗大鼠證候評分和肛溫的影響
2.2 白芍多糖對化學性肝損傷肝陰虛證大鼠體質量的影響 與空白組比較,模型大鼠體質量明顯下降(P<0.05)。與模型組比較,一貫煎組與白芍多糖組體質量升高,但差異無統計學意義(P>0.05)。見表4。
表4 白芍多糖對化學性肝損傷肝陰虛證大鼠體質量的影響
2.3 白芍多糖對肝陰虛證實驗大鼠GPT、GOT水平的影響 與空白組比較,模型組大鼠血清GPT、GOT水平顯著升高(P<0.01,P<0.001)。與模型組比較,一貫煎組、白芍多糖組血清GPT、GOT水平顯著降低(P<0.01,P<0.001)。見圖2。
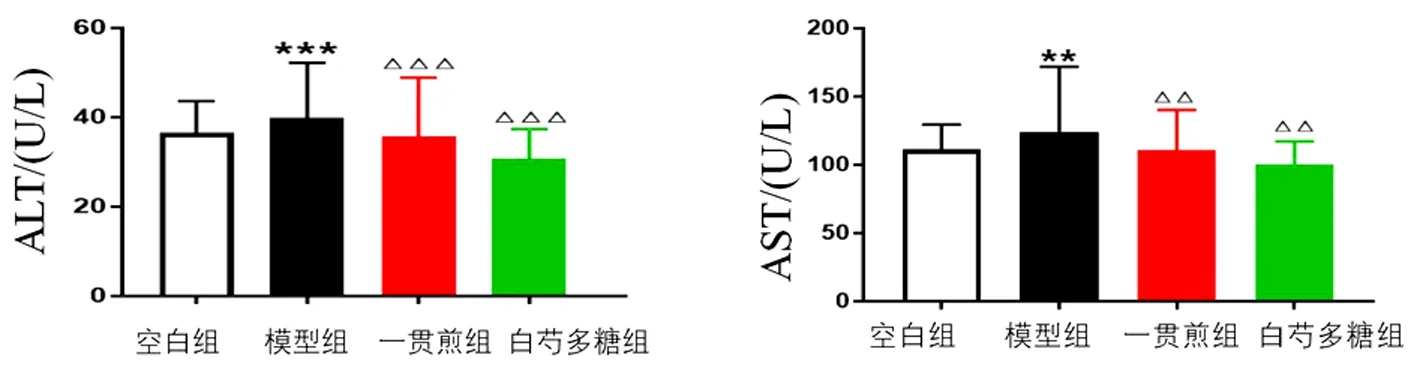
圖2 白芍多糖對化學性肝損傷肝陰虛證大鼠血清GPT、GOT水平的影響
2.4 白芍多糖對化學性肝損傷肝陰虛證大鼠血清cAMP、cGMP水平的影響 與空白組比較,模型組大鼠cAMP/cGMP比值顯著升高(P<0.05)。與模型組比較,一貫煎組cAMP水平及cAMP/cGMP比值顯著降低(P<0.05)。見表5。
表5 白芍多糖對化學性肝損傷肝陰虛證大鼠血清cAMP、cGMP水平的影響
2.5 白芍多糖對肝陰虛證實驗大鼠肝纖維化因子水平的影響 與空白組比較,模型組LN、HA、PCⅢ水平顯著升高(P<0.05,P<0.01,P<0.001),與模型組比較,一貫煎組HA、PCⅢ、CⅣ、LN顯著下降(P<0.05,P<0.01,P<0.001),白芍多糖組CⅣ、LN顯著下降(P<0.01,P<0.001)。見圖3。

圖3 白芍多糖對化學性肝損傷肝陰虛證大鼠肝組織HA、PCⅢ、CⅣ、LN水平的影響
2.6 白芍多糖對肝陰虛證實驗大鼠肝臟病理學的影響 空白組實驗大鼠肝臟病理學切片肝組織結構正常,肝細胞無變性壞死。模型組實驗大鼠的肝臟病理學切片顯示較多肝細胞出現脂肪變性,胞質內可見微小的圓形脂肪空泡(黑色箭頭);局部可見肝細胞灶性壞死,胞核碎裂溶解,胞質分界不清,嗜酸性增強,呈均質狀(紅色箭頭),并伴有少量粒細胞等炎癥細胞浸潤(黃色箭頭)。與模型組比較,一貫煎組、白芍多糖組病理改變均有所改善。見圖4。
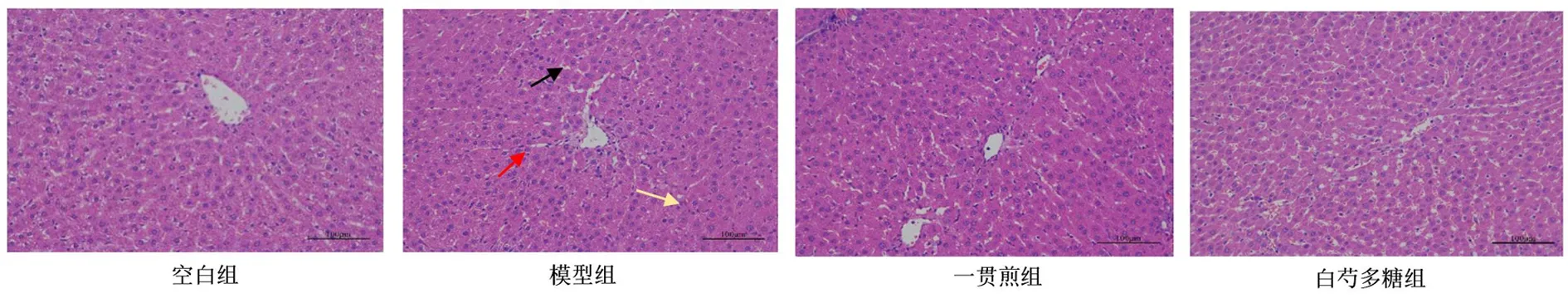
圖4 大鼠肝臟病理學切片(HE染色,×200)
2.7 白芍多糖對化學性肝損傷肝陰虛證大鼠肝組織丙二醛、SOD、CAT、GSH-Px水平的影響 與空白組比較,模型組大鼠肝臟中丙二醛水平顯著升高(P<0.01),GSH-Px活力顯著下降(P<0.01),SOD水平顯著下降(P<0.05)。與模型組比較,一貫煎組、白芍多糖組肝臟中丙二醛水平顯著下降(P<0.05),GSH-Px活力顯著升高(P<0.01,P<0.001)。見表6。
表6 白芍多糖對化學性肝損傷肝陰虛證大鼠肝組織丙二醛、SOD、CAT、GSH-Px水平的影響
2.8 白芍多糖對肝陰虛證實驗大鼠細胞因子水平的影響 與空白組比較,模型組肝臟中TNF-α、IL-6水平顯著升高(P<0.001),IL-10水平顯著降低(P<0.05)。與模型組比較,一貫煎組與白芍多糖組大鼠肝臟中TNF-α、IL-6水平顯著降低(P<0.001)。見圖5。
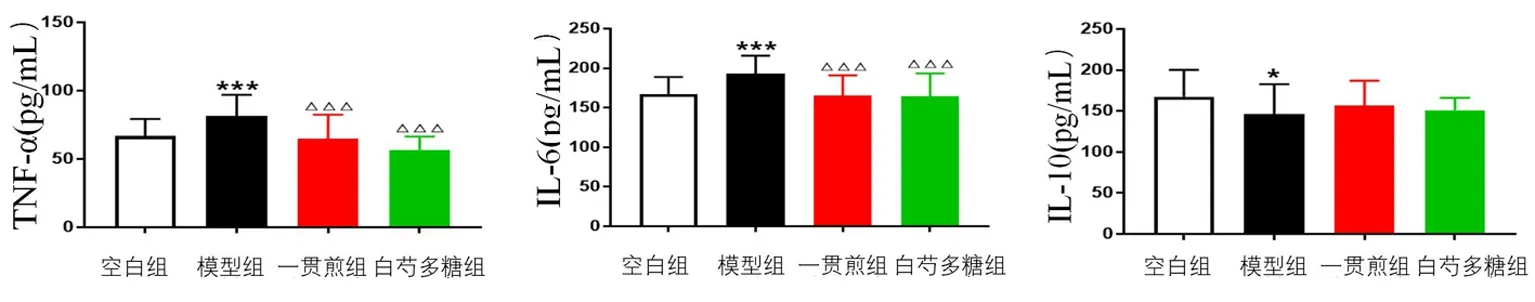
圖5 白芍多糖對化學性肝損傷肝陰虛證大鼠肝組織TNF-α、IL-6、IL-10水平的影響
2.9 白芍多糖對肝陰虛證實驗大鼠PI3K-AKT通路mRNA的影響 與空白組比較,模型組肝組織中PI3K、AKT mRNA表達量顯著升高(P<0.01,P<0.001)。與模型組比較,一貫煎組肝組織中AKT mRNA表達量顯著降低(P<0.001),白芍多糖組肝組織中PI3K、AKT mRNA表達量顯著降低(P<0.01,P<0.001)。見表7。
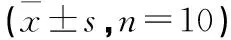
表7 白芍多糖對化學性肝損傷肝陰虛證大鼠PI3K-AKT通路mRNA的影響
3 討論
實驗結果顯示,模型組大鼠體質量顯著減輕、大便干硬程度評分高、小便顏色深黃、毛發無光澤評分高、肛溫明顯升高,并且cAMP/cGMP比值升高,TNF-α和IL-6水平升高,IL-10水平降低,血清GOT、GPT顯著升高,肝臟病理切片顯示輕度肝損傷、輕度肝纖維化,表明此模型符合化學性肝損傷肝陰虛證大鼠模型評價標準,可認為成功建立實驗性肝陰虛證候大鼠模型[9]。同時研究表明,一貫煎為治療肝陰虛證的代表方,能調節肝陰虛證的細胞因子紊亂,使機體細胞代謝恢復平衡,“以方測證”佐證了該化學性肝損傷肝陰虛證病證結合動物模型的合理性[14]。
中醫理論指出肝陰虛證主要病機為陰陽失衡,陰虛陽亢、虛熱內擾,出現消瘦、體溫升高、易煩躁等的臨床表現。在本實驗動物模型中,白芍多糖可明顯改善肝陰虛證大鼠的大便干燥狀況,說明白芍多糖可緩解化學性肝損傷肝陰虛證模型陰虛表征。
cAMP、cGMP是細胞功能的重要調節物質,血中cAMP和cGMP的水平與機體神經內分泌系統的功能有關[15],對細胞功能處于穩定狀態具有雙向控制調節作用,與中醫學的陰陽學說有相似之處,臨床上陰虛證的患者cAMP/cGMP比值多數升高,因此研究結論認為cAMP/cGMP升高說明機體處于一種陰虛狀態[16-17]。TNF-α和IL-6具有廣泛的生物學活性,被認為是反映炎癥反應嚴重程度的重要指標,在肝損傷的發生和發展中起著至關重要的作用[18]。PI3K-AKT信號通路可以通過調節關鍵的炎癥介質調控炎癥反應的程度,是調控2類細胞因子炎癥介質-抗炎細胞因子)平衡的主要信號通路。劉曉燕等[19]用現代醫學理論闡明了細胞因子紊亂所引起的陰虛證相關癥狀,認為細胞因子紊亂是陰虛證的病因。由此可見,環核苷酸cAMP和cGMP、細胞因子網絡等均與中醫的陰陽屬性相似,因此環核苷酸-細胞因子網絡失衡可能就是肝陰虛證機體陰陽失衡的具體體現。實驗中模型組大鼠血清cAMP/cGMP比值升高,TNF-α、IL-6水平顯著升高,IL-10水平顯著降低,證明其環核苷酸-細胞因子網絡失衡,存在陰虛證候。而白芍多糖對cAMP、cGMP及其比值水平均無明顯效果,說明白芍多糖對調節cAMP、cGMP平衡無明顯作用,但其可抑制PI3K-AKT通路mRNA水平,從而減少化學性肝損傷肝陰虛證炎癥介質TNF-α、IL-6的釋放,調節細胞因子網絡平衡。
實驗性肝陰虛證的定位癥狀中肝損傷的相關指標為GPT和GOT水平、肝臟的病理變化及肝纖維化程度。當肝臟被損傷,GPT、GOT由于細胞膜的破壞而漏出,其水平的高低反映了肝損傷程度的高低[20]。肝纖維化是慢性肝損傷主要的病理基礎,PCⅢ、CⅣ、LN、HA是反映肝纖維化程度的重要指標[21]。模型組大鼠GPT、GOT、PCⅢ、LN、HA水平顯著升高,表明模型構建成功,白芍多糖可顯著減輕GPT、GOT、CⅣ、LN水平,發揮保護化學性肝損傷肝陰虛證的作用。同時,通過對病理切片的分析可知,白芍多糖可改善化學性肝損傷肝陰虛證大鼠肝臟的病理損傷情況。
氧化應激是慢性肝損傷的主要機制之一[22],當機體內發生氧化應激時,機體產生抗氧化劑,主要包括SOD、CAT、GPX-Px[23]。丙二醛是細胞脂質過氧化的終產物之一,其水平可反映氧化應激水平[24]。研究證明肝陰虛證候與氧化應激水平密切相關[25-26]。實驗結果顯示模型組存在氧化應激狀態,白芍多糖可通過降低丙二醛水平,升高GSH-Px水平減輕氧化應激水平。
本研究顯示,白芍多糖可緩解化學性肝損傷肝陰虛證動物模型部分陰虛證表征,在抗肝損傷方面,白芍多糖可抑制PI3K-AKT通路,通過抗肝纖維化、抗氧化應激、抗炎機制改善肝損傷。課題組前期研究顯示,白芍總苷可緩解化學性肝損傷肝陰虛證大鼠陰虛表征,并且調節cAMP、cGMP平衡,在抗肝損傷方面可通過改善微循環障礙、抗炎機制發揮保護化學性肝損傷作用,并且可抑制PI3K-AKT通路[9]。
綜上所述,白芍總苷與白芍多糖均可能為白芍養肝陰功效特點的物質基礎,但二者養肝陰影響和作用機制不同,白芍總苷能改善陰虛證表征,調節cAMP、cGMP平衡并通過抑制PI3K-AKT通路來發揮抗炎作用,白芍多糖則主要通過改善陰虛證表征、抗肝纖維化、抗氧化應激、抑制PI3K-AKT通路mRNA水平來發揮抗炎作用,其具體機制還需要進一步探究。

