克羅諾桿菌環境耐受性的評價
龐立冬,宋丹靚敏,賈 嬡,李 譽,梁雅琪,蘇群超,鄭亞平,李 然,滿朝新,姜毓君
(東北農業大學食品學院乳品科學教育部重點實驗室,黑龍江 哈爾濱 150030)
發病率高和影響范圍廣的食源性疾病極大地威脅了公共衛生和社會經濟[1-3]。而食源性致病菌作為食源性疾病的主要因素之一受到了廣泛關注[4]。克羅諾桿菌(Cronobacterspp.)作為一種重要的食源性致病菌,已經在多種食品中分離得到[5-7],其中,乳制品尤其是嬰兒配方奶粉(powdered infant formulas,PIF)是其主要的污染源[8]。克羅諾桿菌能夠引發早產兒、嬰幼兒等患上嚴重的敗血癥、腦膜炎和壞死性小腸結腸炎[9-11],其致死率高達40%~80%[12-13],已被國際食品微生物標準委員會列為嚴重危害特定人群、導致慢性實質性后遺癥甚至威脅生命的細菌[14]。
PIF 作為克羅諾桿菌的主要污染來源和傳播途徑[15],它的污染途徑主要包括原輔料的添加和生產環境[16]。此外,克羅諾桿菌具有很強的環境耐受性[17-18],使其能夠在PIF 加工環境和終產品中存在[19-20],造成持續污染,難以完全清除,嚴重威脅到PIF 的質量安全。曹晨陽等[21]報道了分離自嬰幼兒乳粉和米粉的15 株不同基因型阪崎克羅諾桿菌對不同溫度和pH 的耐受能力。BENNOUR 等[22]研究發現,克羅諾桿菌能夠在干燥的嬰兒配方奶粉中存活至少3 個月。YE 等[23]對比了阪崎克羅諾桿菌野生型和OmpW突變體在高滲條件下的存活率和形態變化。目前的研究多集中在不同基因型的克羅諾桿菌環境耐受性的研究上,缺乏對不同實際生產環節中分離的克羅諾桿菌環境耐受性的研究。為徹底有效地對克羅諾桿菌進行預防和控制,本實驗以從PIF 樣品及其加工環境中分離得到的8 株克羅諾桿菌作為代表菌株,研究了其環境的耐受性(耐熱性、耐酸堿性、耐干燥性和耐高滲性)。本研究通過評價克羅諾桿菌的環境耐受性,為更好地控制和消除克羅諾桿菌污染提供參考依據,為保障乳制品安全提供新的思路。
1 材料與方法
1.1 材料與儀器
本實驗所用克羅諾桿菌均分離自PIF 樣品及其加工環境,共計8 株分離菌株。詳細信息見表1。

表1 實驗用菌株及其來源Table 1 Bacterial strains used in this study and their sources
胰蛋白胨大豆瓊脂培養基(tryptone soy agar,TSA)、LB 肉湯培養基(LB broth powder)、腦心浸液瓊脂培養基(brain heart infusion, BHI) 青島海博生物有限公司;山梨醇 陽騰化工產品有限公司;硅膠上海月杰實業有限公司;NaCl 西隴化工股份有限公司。
TGC-16G 型離心機 上海安亭科學儀器廠;DHP-9272 型電熱恒溫培養箱 上海一恒科技有限公司;DK-98-II 型電熱恒溫水浴鍋 天津市泰斯特儀器有限公司;YM50L 型高壓蒸汽滅菌鍋 上海三申醫療器械有限公司;DU800 型紫外分光光度計 美國Beckman 公司;ME204E 型精密電子天平(0.0001 g)、PL2002 型電子天平、Delta320 型pH 計 梅特勒-托利多儀器有限公司。
1.2 實驗方法
1.2.1 菌株活化 根據已發表研究并進行適當優化[24],將凍存的克羅諾桿菌接種于LB 液體培養基中,在37 ℃條件下200 r/min 培養12 h 進行活化,將活化后的菌株在TSA 固體培養基上進行三區劃線,37 ℃培養24 h 后挑取單菌落,置于10 mL 液體LB 培養基中進行純培養,連續傳代2 次,待菌液濃度達到108CFU/mL 后,取1 mL 菌液在4 ℃下8000×g 離心10 min,用0.85%的滅菌生理鹽水進行洗滌(4 ℃下8000×g 離心10 min),棄去上清液,該過程重復三次,最終向菌泥中加入1 mL 滅菌生理鹽水,制成濃度為108CFU/mL 的菌懸液用于后續實驗。
1.2.2 克羅諾桿菌環境耐受性研究
1.2.2.1 耐受高溫能力的測定 菌株最適生產溫度為37 ℃左右。根據已發表研究并進行適當優化[25],本試驗取1.2.1 節所述的菌懸液用滅菌生理鹽水10 倍梯度稀釋至107CFU/mL,取10 mL 菌懸液分別置于53、57、61 和65 ℃的熱水浴中,處理時間分別為1、2、3、5、8、10、20、30、60 min。經高溫處理的菌液,冷卻至室溫后震蕩搖勻,從每個處理后的試管中分別吸取100 μL 混合液均勻涂布TSA 平板,觀察菌株生長情況。
1.2.2.2 耐受pH 能力的測定 菌株最適生長pH 為7.0 左右。根據已發表研究并進行適當優化[26],本試驗取1 mL 1.2.1 節所述的菌懸液用pH 分別為1.0、1.5、2.0、12.0、12.5 和13.0 的滅菌生理鹽水10 倍梯度稀釋至107CFU/mL,將上述菌懸液分別在上述pH條件下處理0、30、60、90、120 s。經酸堿處理的菌液,震蕩搖勻,從每個處理后的試管中分別吸取100 μL混合液均勻涂布TSA 平板,觀察菌株生長情況。
1.2.2.3 耐受干燥能力的測定 根據已發表研究并進行適當優化[27],本試驗將無水硅膠放入無菌的25 ℃恒溫培養箱中進行干燥處理,待培養箱中的空氣相對濕度為20.7%時,取50 μL 1.2.1 節所述的菌懸液于2 mL 無菌離心管中,每株菌分別分裝20 個,將離心管蓋打開,在培養箱中放置1.5 h 后,立即蓋上離心管蓋,并在培養箱中持續放置7 個月。經不同間隔時間干燥處理后,震蕩搖勻,對菌懸液進行梯度稀釋TSA 平板計數。
1.2.2.4 耐受高滲透壓能力的測定 根據已發表研究并進行適當優化[28],本試驗將各菌株凍存管從-20 ℃取出放入4 ℃冰箱中,完全解凍后,從凍存管中吸取50 μL 待測菌株的菌液分別加入到10 mL 無菌的NaCl 濃度分別為4%、6%、8%、10%的BHI 溶液和10 mL 無菌的山梨醇濃度分別為12.5%、19%、25%、31%的BHI 溶液中,放入37 ℃恒溫培養箱中培養。經高滲透壓處理后的菌液,震蕩搖勻,每隔2 h 測定OD 值,持續24 h。
1.3 數據處理
每個試驗重復三次,試驗結果以平均值±標準偏差表示。用Microsoft Excel 對試驗數據進行統計和分析,用SPSS 軟件進行差異性分析,用Origin 軟件繪圖。
2 結果與分析
2.1 克羅諾桿菌在不同溫度下的生長情況
8 株不同ST 型的克羅諾桿菌,分別以53、57、61 和65 ℃評價其耐熱性,結果如表2 所示。PIF 的巴氏殺菌法通常為62~65 ℃,持續30 min[29]。因此,本實驗設定了4 個溫度(53、57、61 和65 ℃)進行耐熱性分析。在53 ℃條件下,所有的菌株處理60 min時仍可存活;在57 ℃條件下,菌株ES3 和ES35 在20 min 時仍有存活,ES52 在10 min 時仍有存活,其他菌株在作用8 min 時全部失活;在61 ℃條件下,菌株ES3 和ES35 在5 min 時仍有存活,ES52 在3 min時仍有存活,其他菌株在作用3 min 時全部失活;在65 ℃條件下,所有菌株均在1 min 時全部失活。由此可見,升高處理溫度和延長作用時間,所有菌株的活性都有所降低,其中克羅諾桿菌ES3 和ES35 表現出較強的耐熱性,在61 ℃條件下5 min 時仍可存活,其次菌株ES52 的耐熱性也較高。這可能是由于不同ST 型的菌株的基因表達不同,導致了菌株的耐熱性不同[30]。

表2 克羅諾桿菌在不同溫度下的生長情況Table 2 Growth of Cronobacter spp. at different temperatures
2.2 克羅諾桿菌在不同pH 下的生長情況
8 株不同ST 型的克羅諾桿菌,分別以不同pH進行酸堿處理,評價其耐酸堿性,結果如表3 所示。根據工廠的實際生產情況可知,一般采用酸洗和堿洗的方法對生產設備進行殺菌[31]。因此,本實驗選取6 個pH 梯度(1.0、1.5、2.0、12.0、12.5 和13.0)進行耐酸堿性分析。在pH1.0 的酸性條件下,所有菌株均失活;在pH1.5 的酸性條件下,菌株ES3 在90 s時仍可存活,而ES35、ES37、ES39、ES52 在90 s 時失活,ES38、ES45、ES46 在60 s 時全部失活;在pH2.0的酸性條件下,ES3 在120 s 時仍可存活,ES46 在90 s 時失活,其余菌株在120 s 時全部失活。由此可見,克羅諾桿菌ES3 具有較強的耐酸性。在pH12.0的堿性條件下,只有ES38 在處理120 s 時仍可存活;在pH12.5 的堿性條件下,只有ES38、ES39 在處理30 s 時仍可存活;在pH13.0 的堿性條件下,除菌株ES38 外其余菌株立即死亡,由此可見,克羅諾桿菌ES38 具有較強的耐堿性。克羅諾桿菌對堿敏感的原因,可能是由于其屬于革蘭氏陰性桿菌,細胞壁中含有較多的脂類物質,而這類物質易與堿性溶液反應,致使細胞壁失去保護作用,最終造成菌體死亡。
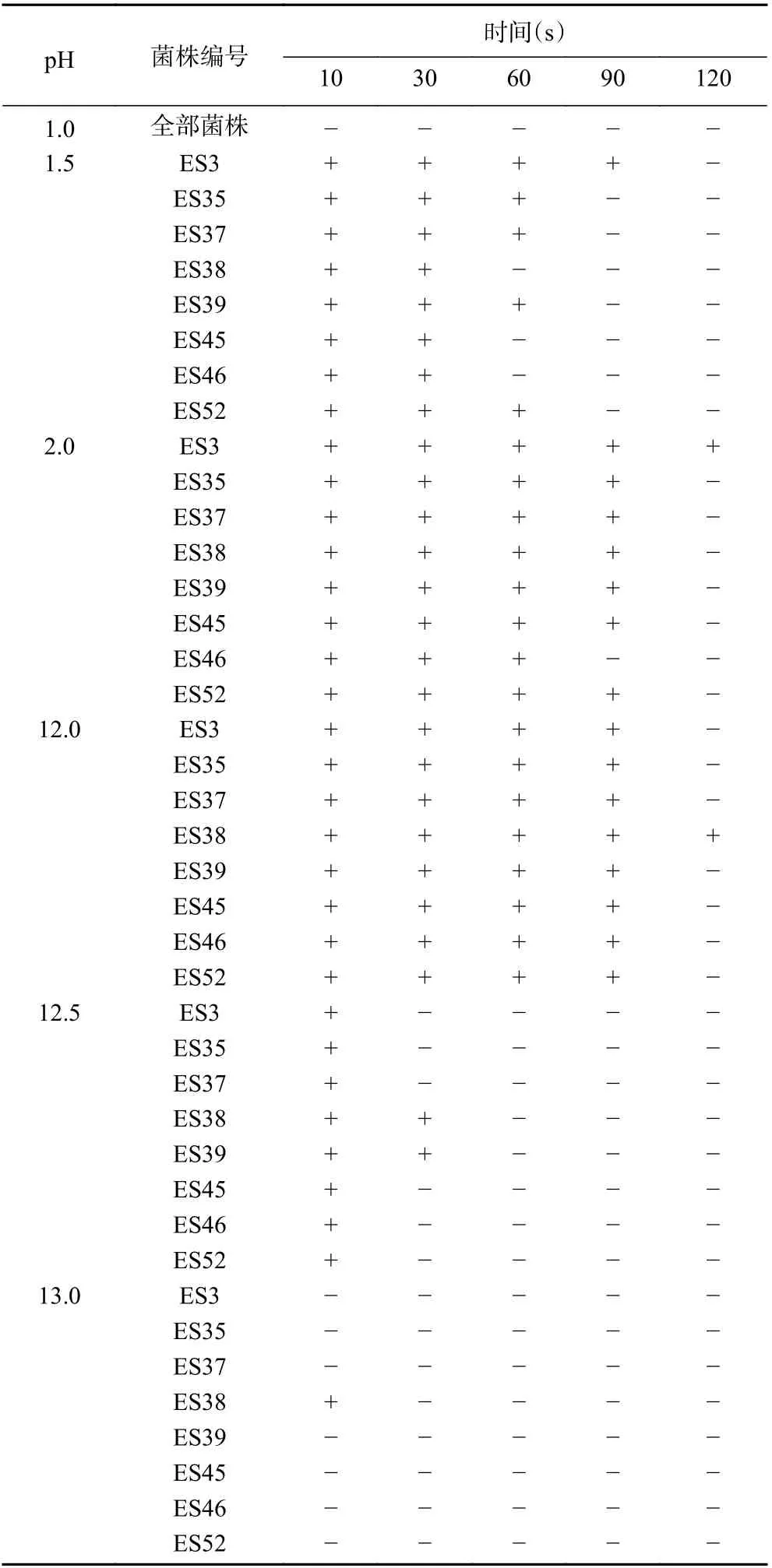
表3 克羅諾桿菌在不同pH 下的生長情況Table 3 Growth of Cronobacter spp. at different pH
2.3 克羅諾桿菌在干燥條件下的生長情況
對8 株不同ST 型的克羅諾桿菌進行干燥處理,評價其耐干燥性,結果如圖1 和圖2 所示。在長達7 個月的監測中,8 株菌的菌數都有不同程度地降低,但下降的趨勢一直都趨于平緩,沒有很大的波動。總體來看,8 株菌的菌數從初始濃度108CFU/mL 下降到105CFU/mL 左右,且在試驗前期下降的趨勢較為明顯,在后期下降趨勢趨于平緩。其中克羅諾桿菌ES37 具有相對較強的耐干燥性,而菌株ES3 的耐干燥性較弱。這種緩慢的下降趨勢說明克羅諾桿菌具有很強的抵抗干燥環境的能力。這可能是由于生物膜和菌株所產生海藻糖對菌株的保護作用[32]。

圖1 ES3、ES46、ES35 和ES39 四株克羅諾桿菌在干燥條件下的活菌數Fig.1 Viable counts of four Cronobacter spp. ES3, ES46,ES35 and ES39 under dry conditions

圖2 ES52、ES45、ES37 和ES38 四株克羅諾桿菌在干燥條件下的活菌數Fig.2 Viable counts of four Cronobacter spp. ES52, ES45,ES37 and ES38 under dry conditions
2.4 克羅諾桿菌在高滲透壓的條件下的生長情況
8 株不同ST 型的克羅諾桿菌,以不同濃度的NaCl 和山梨醇進行處理,評價其耐高滲性,NaCl 的試驗結果如圖3 所示。從圖中可知,8 株不同ST 型的克羅諾桿菌在耐高滲性試驗中呈現出相似的趨勢,即隨著NaCl 濃度的增大,與未添加NaCl 的空白對照組相比,實驗組的OD600nm值逐漸下降,且當NaCl的濃度為8%和10%時,在24 h 內OD600nm值變化平緩,幾乎呈直線趨勢,說明菌體生長緩慢或阻滯。這可能是由于NaCl 屬于強電解質,在溶液中很容易電離成Na+和Cl-,這就使得溶液的滲透壓有所升高[18]。同時,山梨醇的滲透壓與葡萄糖接近,是蔗糖的1.88 倍。通過測定克羅諾桿菌對山梨醇的耐受能力對控制PIF 中的克羅諾桿菌具有重要意義[33]。山梨醇的試驗結果與NaCl 相似(未在文中體現),隨著山梨醇濃度的升高,OD600nm值呈現梯度遞減的趨勢,但當山梨醇濃度達到最大值31%時,與10% NaCl組相比,在24 h 內OD600nm值仍有明顯的上升趨勢。而山梨醇屬于非電解質,在溶液中不能電離,因此其作用效果沒有NaCl 好[34]。所以等滲條件下,克羅諾桿菌對山梨醇的耐受性強于NaCl。對高滲透壓的耐受能力則可能是因為糖被上的極性基團減少了克羅諾桿菌的水分流失以及海藻糖所形成的保護膜對克羅諾桿菌的保護作用。

圖3 克羅諾桿菌對不同濃度NaCl 的耐受性Fig.3 Resistance of Cronobacter spp. for different concentrations of NaCl
3 討論與結論
本研究選取了從PIF 樣品及其加工環境中分離得到的8 株ST 型克羅諾桿菌進行環境耐受性研究。由4 個溫度的耐熱性結果可知,ES3、ES35 和ES52 對高溫具有較強耐熱性。耐熱菌株均分離自工廠的環境涂抹和終產品,且都是在經過巴氏殺菌后分離得到的,進一步說明這幾株菌對高溫具有較強的耐受性。根據以上結果可知,巴氏殺菌完全可以使克羅諾桿菌失活。克羅諾桿菌的污染可能是由于熱處理過程中奶粉受熱不均使得部分菌體得以存活或者是加工的后續過程中一些營養元素的添加引起的污染[35-36]。此外,奶粉的加工環境以及生產過程中的干燥和罐裝階段,以及暫存、輸送和包裝時的二次污染也不容忽視。因此,對奶粉加工工藝進行優化來使其受熱均勻和對其加工環境進行全方位殺菌對于防止克羅諾桿菌污染十分重要。
本實驗通過耐酸堿性結果可知,克羅諾桿菌具有耐酸不耐堿的特性。因此,可采用堿液對加工環境和生產設備進行清洗消毒,操作人員也應通過皂液洗手進行殺菌來保持手部的堿性環境,防止交叉污染[37]。此外,實驗結果表明克羅諾桿菌具有較強的抗干燥能力,這也為其能在水分活度很低的奶粉中長期存活提供了事實證明和理論依據。所有分離株均能夠在6% NaCl 中生長,但無法在8%及以上環境中生存,說明克羅諾桿菌對滲透壓具有一定的耐受性,但高滲透環境能夠抑制細菌的生長。同時,在等滲條件下,克羅諾桿菌對山梨醇的耐受性強于NaCl。
此外,為了保障食品安全,降低食品污染風險,一些更加高效、經濟的殺菌方法也應該被進一步開發聯合使用,例如,恒溫射頻技術[36]、高靜水壓技術[38]、脈沖電壓技術[39]和冷等離子體技術[40]等。同時,采取一些有效的環境殺菌方法對防控克羅諾桿菌污染也是十分重要的[41]。
綜上所述,克羅諾桿菌對環境具有較好的耐受性。其中,ES3、ES35 和ES52 對高溫具有較強耐熱性,在61 ℃條件下,菌株ES3 和ES35 在5 min 時仍有存活,ES52 在3 min 時仍有存活,其他菌株在作用3 min 時全部失活。所有菌株均具有耐酸不耐堿的特性,在pH1.0 的酸性條件下,所有菌株均失活,在pH1.5 的酸性條件下,所有菌株在處理120 s 時均可失活,在pH12.0、pH12.5 和pH13.0 處理一定時間時仍有部分菌株存活。所有菌株均具有較強的耐干燥性,在長達7 個月的監測中,8 株菌的活菌數的下降趨勢一直都趨于平緩,沒有很大的波動。所有菌株均具有較強的耐高滲性,當NaCl 的濃度低于8%時,對菌株生長的抑制較小。

