腐乳生產過程的微生物量變分析與研究
吳惠貞,李維新,林禮釗,林偉鋒
(1.鶴山市東古調味食品有限公司,廣東 江門 529738;2.華南理工大學食品科學與工程學院,廣州 510640)
腐乳是一種營養豐富的中國傳統發酵豆制品,生產過程主要包括煮漿、點漿、壓榨、劃坯、接種、培菌、腌制、裝瓶灌湯和后發酵[1]。點漿是形成豆腐坯的一個重要步驟,是在熟豆漿中加入凝固劑使大豆蛋白形成凝膠的過程[2]。常用的凝固劑有鹽類凝固劑、酸類凝固劑、酶類凝固劑、豆清發酵液、多糖類凝固劑和復合凝固劑[3]。酸類凝固劑主要有醋酸、乳酸、葡萄糖酸內酯、檸檬酸等有機酸;豆清發酵液,又稱酸漿水,是豆腐點漿過程中產生的廢液經過微生物自然發酵而成的一種凝固劑[4]。有研究表明,酸漿水生產的腐乳更加醇香細膩,風味獨特,擁有更高的消費吸引力[5-6],但經自然發酵后,其中的微生物種類復雜,可能含有有害微生物,使產品存在潛在的安全問題[7]。目前大多數廠家已經采用純種菌種進行前期發酵,但由于處在開放式發酵環境且部分生產工序仍為人工操作,從原料、生產環境、工器具、設備到人員都有可能帶來微生物污染[8-9],造成腐乳產品質量的不穩定。因此,有必要了解腐乳整個生產過程中微生物的組成及其數量變化,通過對比不同工序前后微生物的變化更好地發現、把握和改善生產環境并保證腐乳質量安全。
近年來,許多研究者通過高通量測序法來分析腐乳發酵過程中微生物的群落演替情況[10-13],但使用傳統微生物計數方法完整地跟蹤腐乳整個生產過程并對比不同凝固劑對腐乳生產影響的相關研究則較少。本文分別運用酸漿水和醋酸水進行點漿,探討點漿、切塊、噴種、初發酵、腌制和后熟工序及相關生產原料的菌落總數、乳酸菌、真菌、大腸菌群和芽孢桿菌數量的情況,以更準確地了解和分析腐乳生產過程中微生物的變化規律,為優化腐乳生產條件和提高腐乳質量提供了理論依據。
1 材料和方法
1.1 材料與試劑
黃豆:市售;毛霉菌種:東古公司自有菌種;氯化鈉(分析純)、葡萄糖(分析純):廣州化學試劑廠;胰蛋白胨、酵母提取物、平板計數瓊脂、馬鈴薯葡萄糖瓊脂、MRS培養基、馬鈴薯葡萄糖水、MRS肉湯、結晶紫中性紅膽鹽瓊脂、煌綠乳糖膽鹽肉湯:廣東環凱微生物科技有限公司。
1.2 主要儀器與設備
PHS-3C pH計 上海儀電科學儀器股份有限公司;SN510C立式壓力蒸汽滅菌器 重慶雅馬拓科技有限公司;ZHJH-C1214B超凈工作臺、ZXSD-B1270生化培養箱 上海智城分析儀器制造有限公司;JJ1000Y電子天平 常熟市雙杰測試儀器廠;Vortex 2旋渦振蕩器 艾卡(廣州)儀器設備有限公司;HH-W420數顯恒溫水浴鍋 常州普天儀器制造有限公司。
1.3 實驗方法
1.3.1 腐乳生產工藝流程
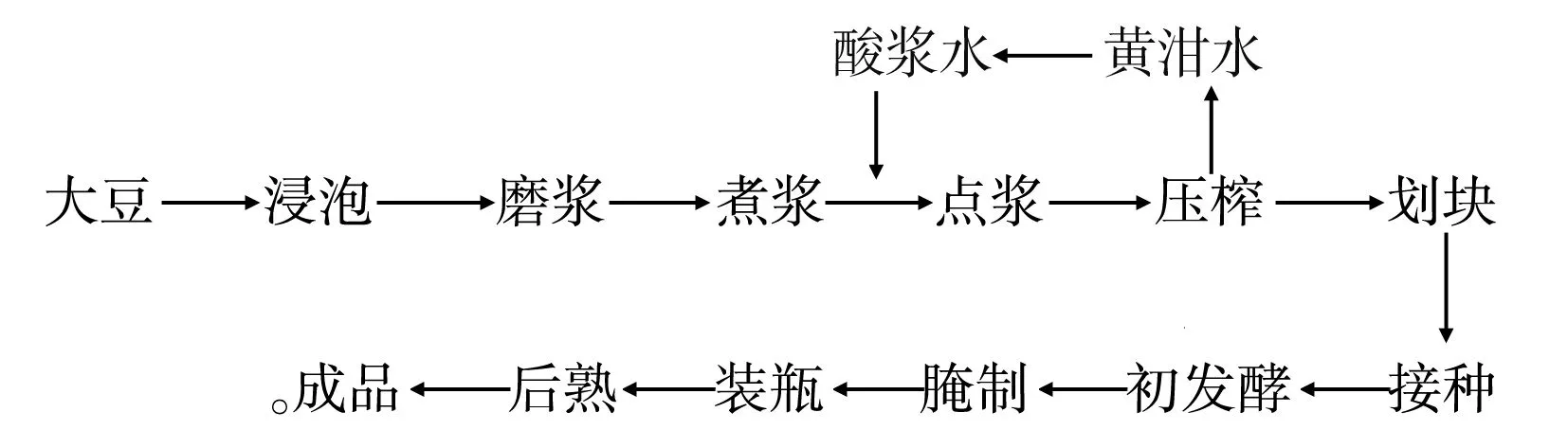
本文選取點漿、劃塊、接種、初發酵、腌制和后熟這幾個關鍵工序點進行取樣,測定其菌落總數、乳酸菌、真菌、大腸菌群和芽孢桿菌數量。
1.3.2 微生物計數
1.3.2.1 菌落總數、乳酸菌、真菌、大腸菌群計數
白坯、毛坯、咸坯、腐乳塊用研缽搗碎后備用,液體樣品搖勻后備用。樣品的稀釋、培養和計數方法參考GB 4789.2—2016《食品微生物學檢驗 菌落總數測定》[14]、GB 4789.35—2016《食品微生物學檢驗 乳酸菌檢驗》[15]、GB 4789.15—2016《食品微生物學檢驗 霉菌和酵母計數》[16]和GB 4789.3—2016《食品微生物學檢驗 大腸菌群計數》[17]。
1.3.2.2 芽孢桿菌計數
白坯、毛坯、咸坯、腐乳塊用研缽搗碎后備用,液體樣品搖勻后備用。樣品的稀釋、培養和計數方法參考GB 4789.2—2016《食品微生物學檢驗 菌落總數測定》,樣品原液或10-1稀釋液先置于85 ℃水浴鍋中保溫30 min,冷卻后再進行一系列的稀釋。
1.3.3 腐乳生產過程的微生物檢測
分別使用酸漿水和醋酸水進行點漿生產腐乳,測定生產過程中點漿前、點漿后、切塊噴種后、發酵初期、發酵成熟、腌制后和后熟期間半成品的菌落總數、乳酸菌、真菌(酵母和霉菌)、大腸菌群和芽孢桿菌的數量。后熟前的豆腐坯分別進行內部和外部測定,后熟期間樣品分別進行湯汁和腐乳塊測定。
1.3.3.1 豆腐坯內部樣品的制備
用滅菌的刀片將豆腐坯對半切開,在酒精燈處燒熱刀片后將切面處的微生物殺滅,接著從切面處挖出一小塊(不能觸及豆腐坯的外層),收集后用研缽搗碎即得豆腐坯內部樣品。
1.3.3.2 白坯或毛坯外部樣品的制備
用滅菌的小剪刀將豆腐坯外層(先把毛坯外層的毛撫平)1~2 mm厚的部分剪下,收集后用研缽搗碎即得豆腐坯外部樣品。
1.4 數據處理
用Origin 9.5軟件對數據進行處理和圖表繪制。
2 結果與分析
2.1 點漿原料的微生物情況
對點漿用到的熟豆漿和凝固劑(酸漿水和醋酸水)進行微生物檢測,包括菌落總數、乳酸菌、真菌(酵母和霉菌)、大腸菌群和芽孢桿菌,結果見表1。

表1 點漿原料的微生物計數Table 1 Microorganism counting of curdling materials CFU/mL
由表1可知,熟豆漿和醋酸水中各微生物數量都較少,而酸漿水中除了大腸菌群數量較少外,還含有少量的酵母菌和芽孢桿菌,更多的是菌落總數和乳酸菌。酸漿水由點漿后濾掉的黃泔水在環境中自然發酵而成,微生物數量豐富而不可控,因此有可能成為腐乳微生物污染的來源,相比之下,醋酸水則顯得更干凈和安全。
酸漿水和醋酸水都是常用于點漿的凝固劑,但兩者微生物含量相差較大,故接下來對利用這兩種凝固劑點漿生產的豆腐坯及其在后續工序中的微生物情況進行測定和比較,以探索凝固劑對腐乳生產過程中微生物的影響。
2.2 點漿后豆腐坯的微生物情況
點漿后經過一定的壓榨工序即為點漿后豆腐坯,分別對熟豆漿和酸漿水、醋酸水點漿形成的豆腐坯內部和外部進行微生物測定,結果見圖1。
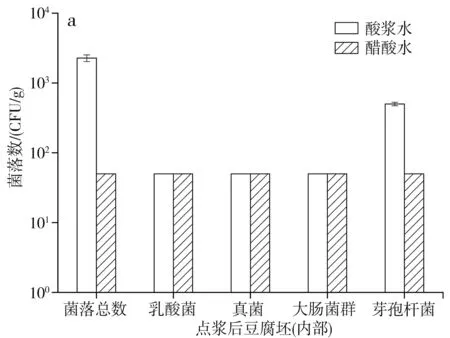
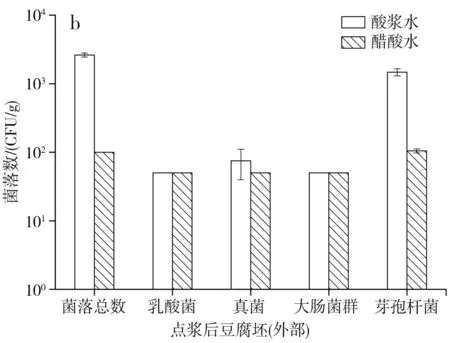
圖1 點漿后豆腐坯的微生物數量Fig.1 Microorganism quantity of tofu billet after curdling
由圖1可知,酸漿水點漿形成的豆腐坯內部和外部的菌落總數和芽孢桿菌數量在102~103CFU/g,乳酸菌、真菌和大腸菌群數量在1.00×102CFU/g以下,說明盡管酸漿水中微生物數量較高,但由于點漿過程溫度達85 ℃,殺滅了大部分微生物,加上點漿過程還產生了大量黃泔水,一部分微生物也會隨之排走,所以最后豆腐坯沒有受酸漿水的影響而帶入過多的微生物。另一方面,用醋酸水點漿形成的豆腐坯內部和外部的微生物數量都在1.00×102CFU/g以下,因為醋酸水中微生物數量較少,故點漿后豆腐坯的微生物數量要低于酸漿水點漿的豆腐坯,與本實驗結果不同。周婷婷等[18]對腐乳中間產品的細菌總數分析中,點漿后豆腐坯的菌落總數為105CFU/g,原因在于其熟豆漿的菌落總數就有106CFU/g,故點漿后豆腐坯的菌落總數要高于本實驗結果。
2.3 切塊噴種后豆腐坯的微生物情況
點漿后豆腐坯下一個工序為切塊和噴種,由機器來連續完成這兩個步驟,對噴種用到的種水以及切塊噴種后豆腐坯的內部和外部進行微生物檢測,結果見表2和圖2。

表2 種水的微生物計數Table 2 Microorganism quantity of the bacterial water CFU/mL
由表2可知,種水中幾乎沒有乳酸菌、大腸菌群和芽孢桿菌,主要是菌落總數和真菌數量較高,其中更多的是發酵菌種毛霉,表明種水是腐乳微生物污染來源的可能性較低。
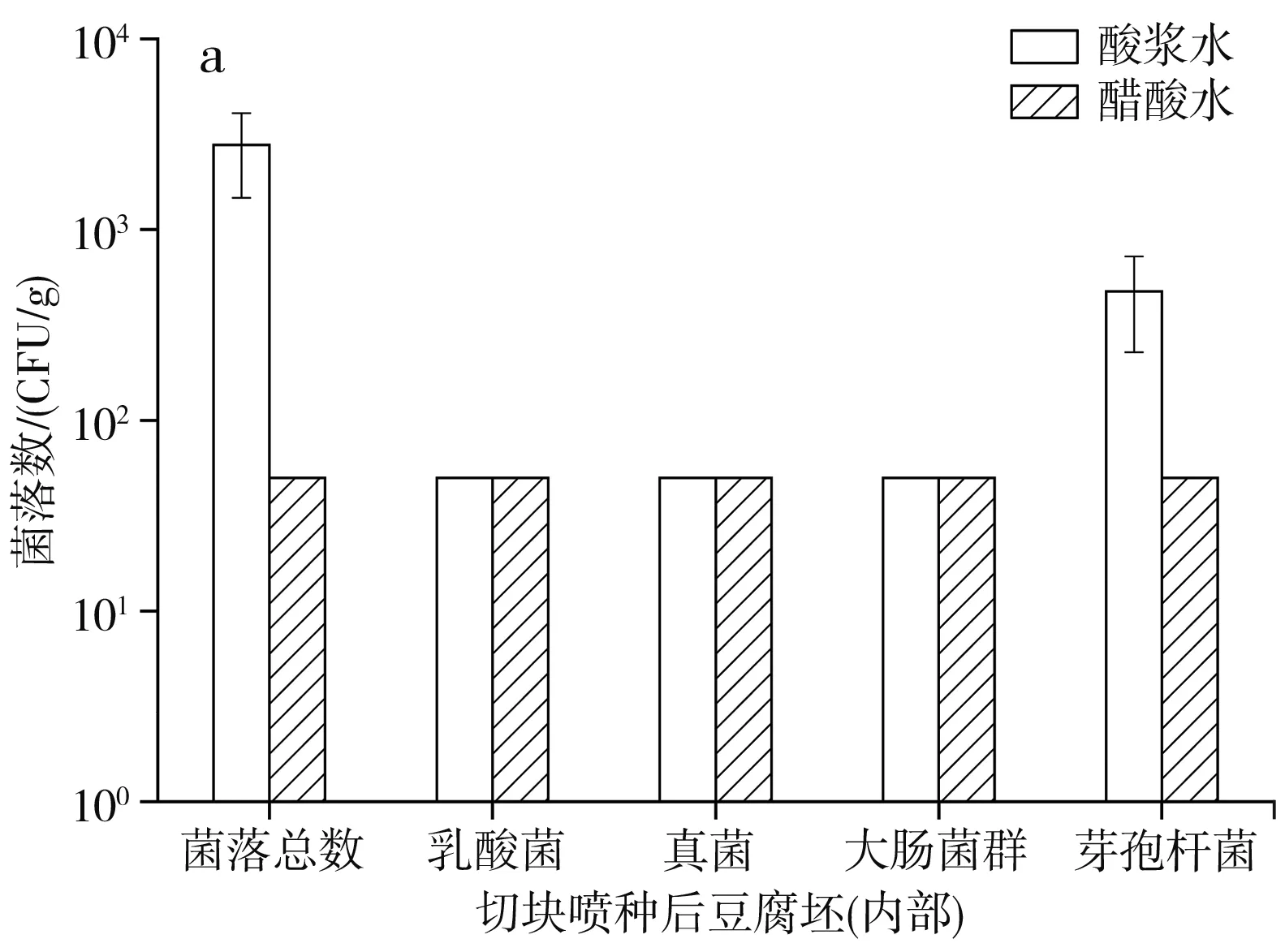
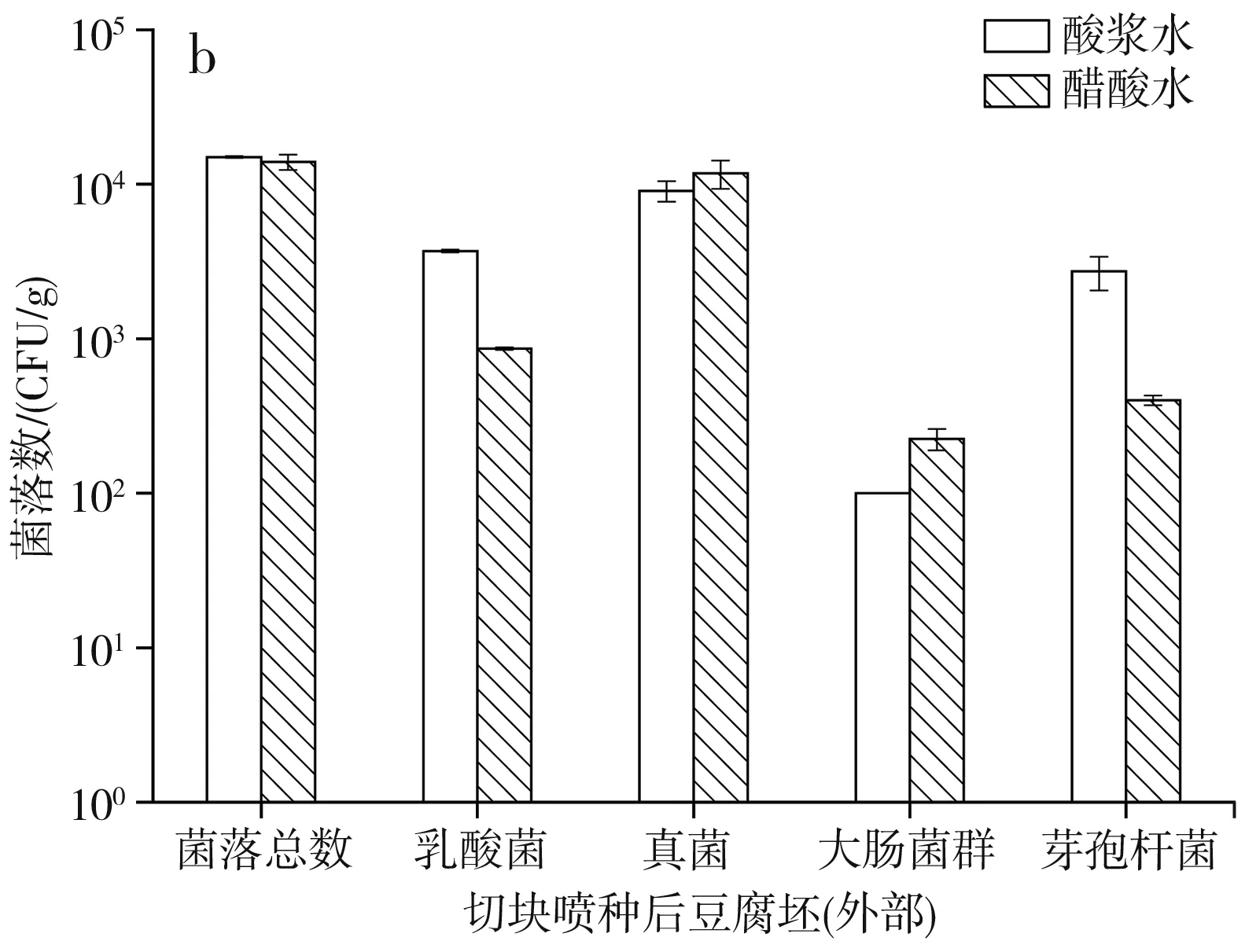
圖2 切塊噴種后豆腐坯的微生物數量Fig.2 Microorganism quantity of tofu billet after cutting and spraying bacteria
由圖2可知,無論是酸漿水還是醋酸水點漿,切塊噴種后豆腐坯內部的微生物數量變化不大,外部的各微生物數量則均有所增加,已知種水噴灑會帶來菌落總數和真菌數量的增加,而乳酸菌、大腸菌群和芽孢桿菌數量的增長不是來源于種水,因此推測可能與切塊噴種設備的衛生情況有關。有資料顯示,腐乳機械化生產變革中,管道內部及設備表面生物被膜的形成是造成腐乳質量波動的主要因素之一[19],表明生產設備是腐乳微生物污染的來源之一,設備的清洗頻率和清潔程度在腐乳生產中至關重要。經切塊噴種后,酸漿水點漿豆腐坯和醋酸水點漿豆腐坯的外部微生物組成已相差不大,菌落總數、乳酸菌、真菌數量在103~104CFU/g,大腸菌群和芽孢桿菌數量在102~103CFU/g。
2.4 發酵初期豆腐坯的微生物情況
切塊噴種后的豆腐坯經工人手動擺正后移入發酵房內,開始初發酵時稱為發酵初期豆腐坯,噴種至入房期間豆腐坯會暴露在車間環境中約45~60 min。對發酵初期豆腐坯內部和外部進行微生物測定,結果見圖3。
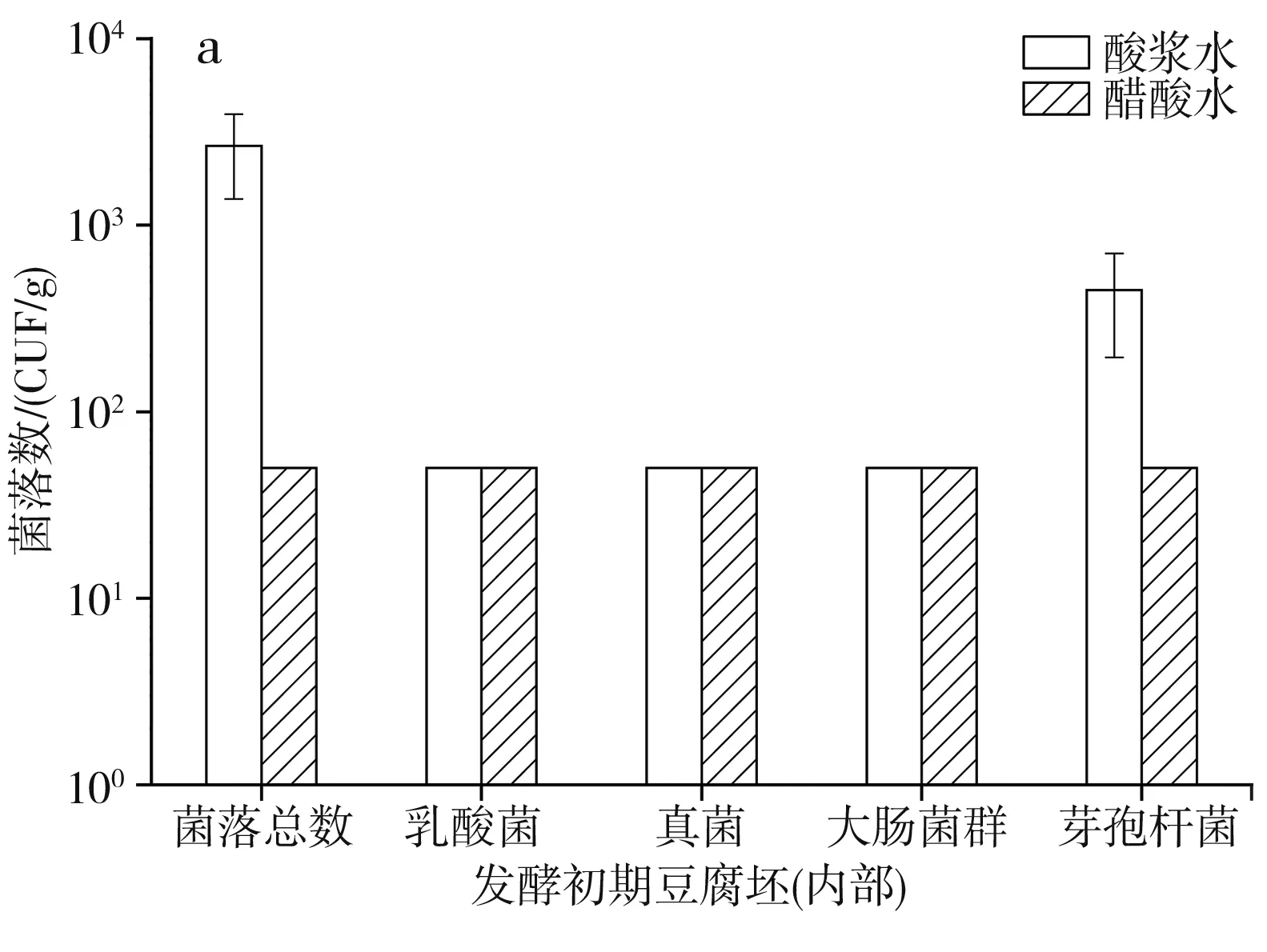

圖3 發酵初期豆腐坯的微生物情況Fig.3 Microorganism quantity of tofu billet in the initial fermentation
由圖3可知,無論是酸漿水還是醋酸水點漿,發酵初期豆腐坯內部的微生物數量變化不大,而豆腐坯外部除了真菌和芽孢桿菌數量變化較小外,菌落總數、乳酸菌和大腸菌群數量都上升了1個數量級。由此表明切塊噴種后豆腐坯在環境中放置的過程也是可能被污染的一個環節,一旦有害微生物附著于豆腐坯表面,在發酵房內的發酵期間就會大量繁殖,最終控制不當可構成腐乳的安全問題。故腐乳生產中應一方面保持車間環境清潔衛生,另一方面盡量減少已噴種豆腐坯在環境中的暴露時間。
2.5 發酵成熟毛坯的微生物情況
在溫度為22~26 ℃、濕度為85%以上的條件下,豆腐坯在發酵房內培養28~30 h后即為發酵成熟毛坯,對其內部和外部的微生物進行測定,結果見圖4。

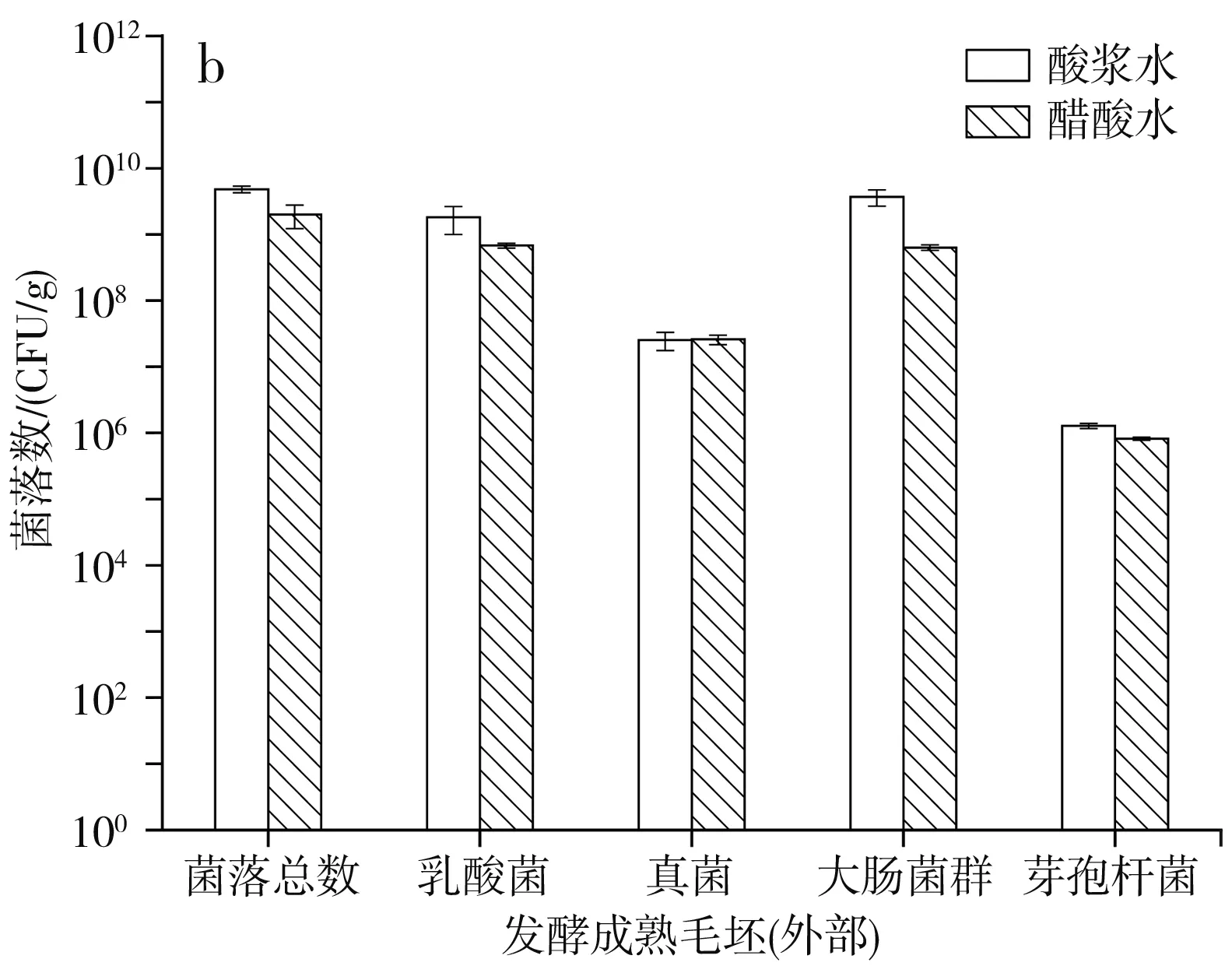
圖4 發酵成熟毛坯的微生物數量Fig.4 Microorganism quantity of fermented mature billet
經過28~30 h的發酵,豆腐坯表面長有大量的白色菌絲,由圖4可知,無論是酸漿水還是醋酸水點漿,發酵成熟毛坯內部和外部的各種微生物都在大量繁殖。毛坯內部的芽孢桿菌數量增加了1個數量級,菌落總數、乳酸菌、真菌和大腸菌群數量增加了5~6個數量級,發酵成熟時毛坯內部的菌落總數為108CFU/g左右,乳酸菌、真菌和大腸菌群數量為106~107CFU/g,芽孢桿菌數量為102~103CFU/g。毛坯外部的真菌和芽孢桿菌數量增加了3個數量級,菌落總數和乳酸菌數量增加了4~5個數量級,大腸菌群數量增加了5~6個數量級,發酵成熟時毛坯外部菌落總數、乳酸菌和大腸菌群數量為108~109CFU/g,真菌數量為107CFU/g,芽孢桿菌數量為105~106CFU/g。與許家威等[20]的研究結果相似,腐乳前酵期中菌落總數、乳酸菌、真菌和芽孢桿菌數量最高可達107~109CFU/g。
初發酵結束后,酸漿水點漿和醋酸水點漿生產的毛坯內部和外部在微生物數量上無明顯差異,說明選擇酸漿水和醋酸水作為凝固劑對腐乳發酵的影響沒有很大的區別。另外,發酵成熟后毛坯內部和外部的微生物數量如此龐大,說明發酵過程中微生物在豆腐坯外部增殖的同時,也在向內部快速地增殖。
2.6 腌制后咸坯的微生物情況
發酵成熟毛坯出房后會經人工搓毛并灑上食鹽腌制10~12 h,接著加入濃度為20%的鹽水浸泡2~3 h,然后放掉鹽水即得腌制后咸坯,測定浸泡用鹽水以及咸坯內部和外部的微生物情況,結果見表3和圖5。

表3 鹽水的微生物計數Table 3 Microorganism quantity of brine CFU/mL
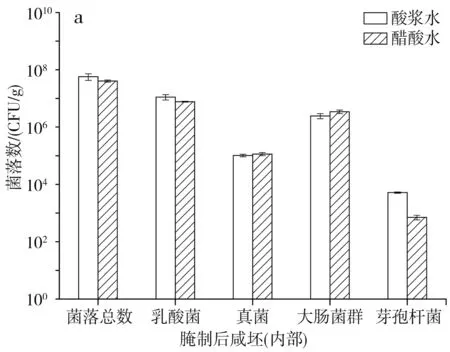
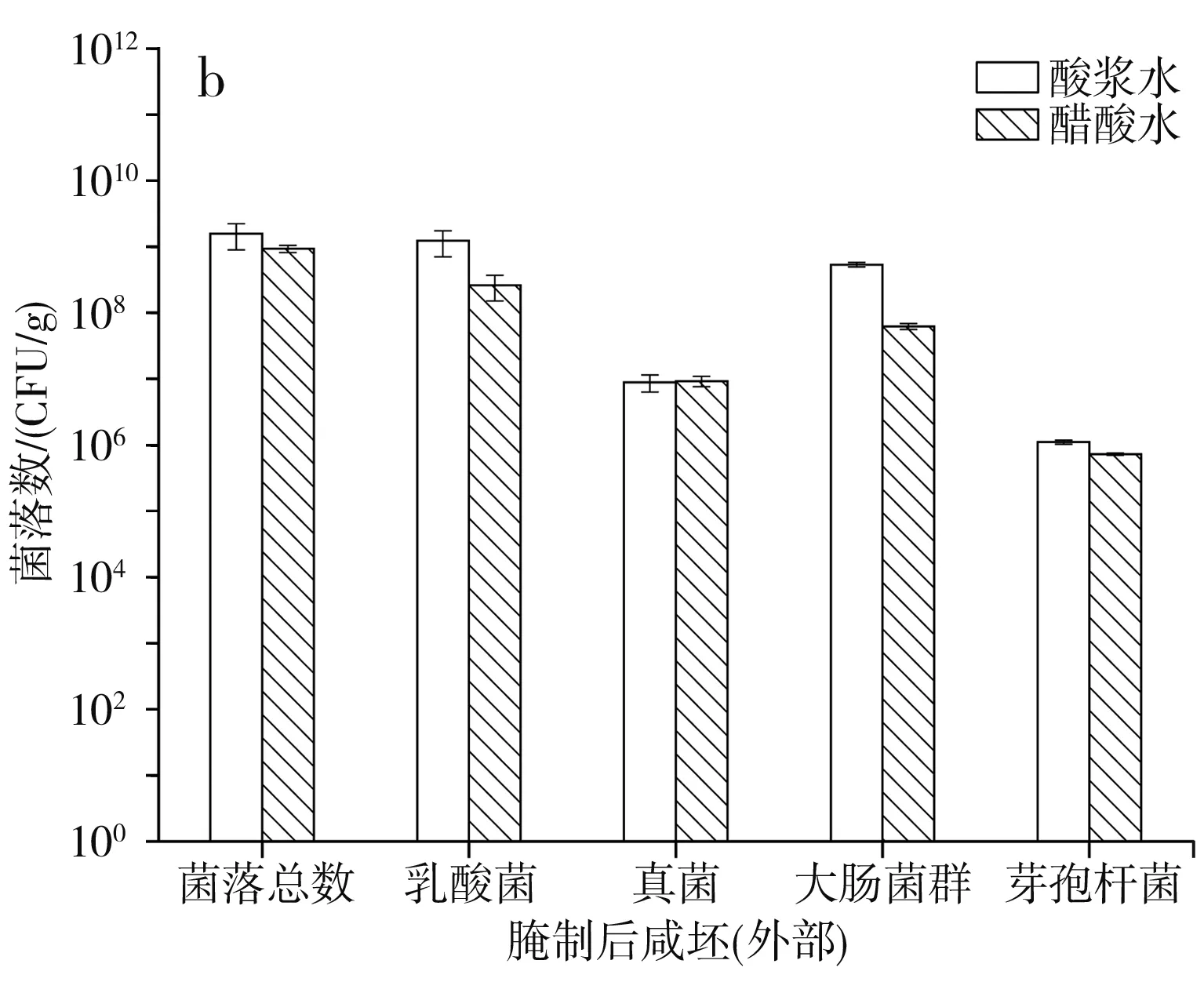
圖5 腌制后咸坯的微生物情況Fig.5 Microorganism quantity of salty billet after marinating
由表3可知,鹽水因鹽濃度較高而各微生物數量都較少。經食鹽和鹽水腌制后,由圖5可知,無論是酸漿水還是醋酸水點漿,咸坯內部和外部的芽孢桿菌數量基本無變化,說明芽孢桿菌的耐鹽能力較好;菌落總數、乳酸菌、真菌和大腸菌群數量有所減少,但下降幅度不大,最終咸坯中各微生物數量都維持在較高水平,從而進入后續的裝瓶灌汁和后熟階段。與發酵成熟時的情況一樣,酸漿水點漿和醋酸水點漿生產的咸坯內部和外部在微生物數量上無明顯差異,初步判斷使用酸漿水進行點漿生產腐乳是可行的。
從腐乳原料到腌制后咸坯的微生物變化情況來看,初發酵階段是微生物極顯著增長的關鍵工序,所以腐乳的微生物污染最大可能是來源于腐乳坯發酵前或發酵過程中,根據測定結果判斷,微生物污染的主要控制點在于管道設備、車間生產環境、操作人員乃至發酵房環境的衛生條件。
2.7 后熟過程的微生物情況
腌制后咸坯經人工裝瓶后灌裝湯汁,進入后熟過程。對比酸漿水點漿和醋酸水點漿從原料到腌制工序的微生物情況可知,酸漿水和醋酸水點漿主要的微生物組成差異體現在原料、點漿后豆腐坯的內外部、切塊噴種后豆腐坯的內部和發酵初期豆腐坯的內部,而從初發酵后直到腌制后兩者的內外部則均相差不大,因此以下實驗中只研究酸漿水點漿生產腐乳后熟過程的微生物情況。
測定灌裝用湯汁的微生物情況,結果見表4。選取腐乳后熟1,15,30,45,60,75,90,120 d的樣品,對其湯汁和腐乳塊分別進行微生物檢測,結果見圖6和圖7。

表4 腐乳湯汁的微生物計數Table 4 Microorganism quantity of sufu soup CFU/mL

圖6 腐乳湯汁后熟過程的微生物情況Fig.6 Microorganism quantity of sufu soup during ripening
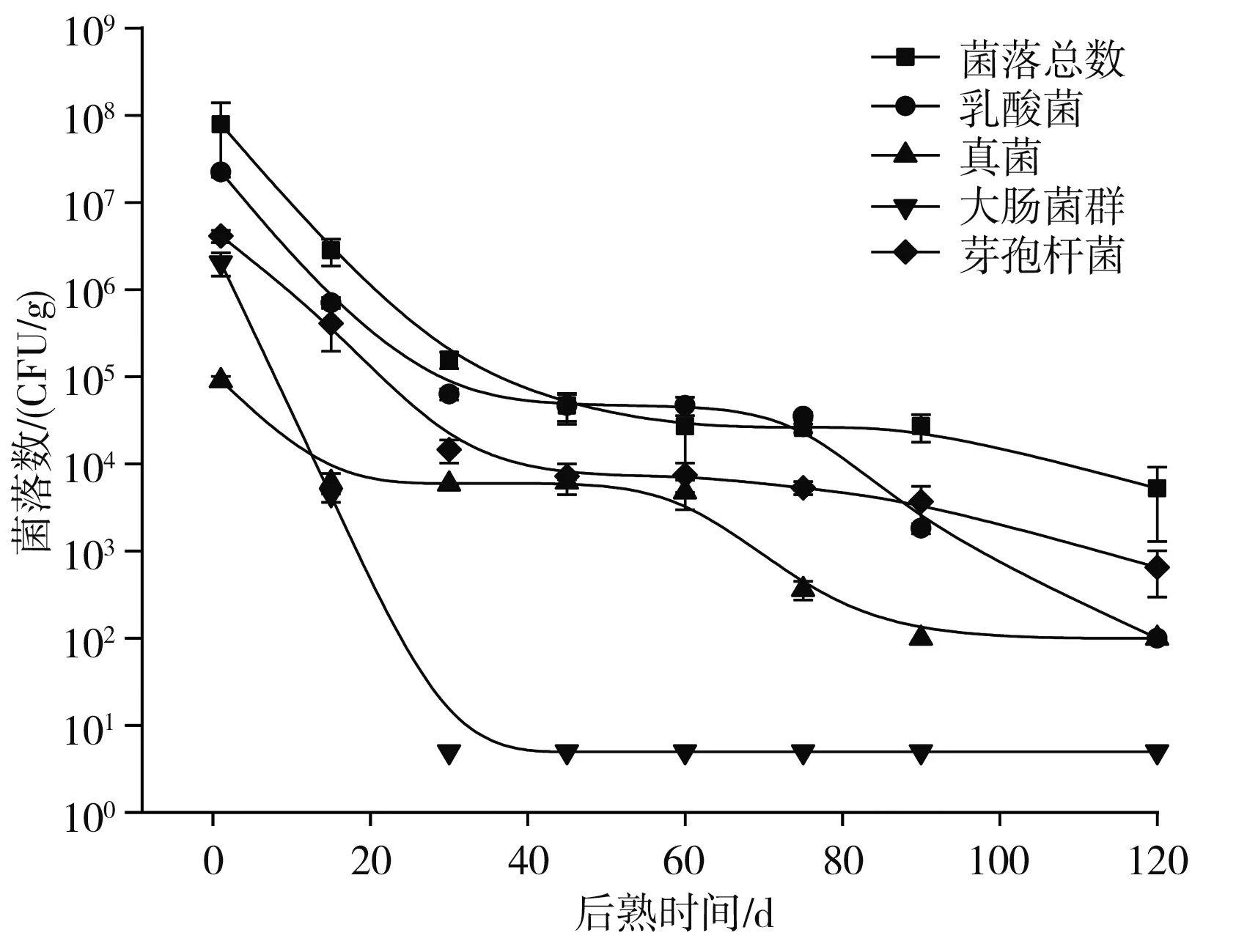
圖7 腐乳塊后熟過程的微生物數量Fig.7 Microorganism quantity of sufu cube during ripening
湯汁的主要成分為酒精和鹽,酒精濃度為16%,鹽濃度為2%。由表4可知,湯汁中各微生物數量都很少,表明大部分微生物在湯汁中較難存活。腐乳后熟時間較長,隨著好氧微生物的生長瓶內逐漸成為厭氧環境,加上一定的酒精度和鹽度條件,且雖然湯汁灌裝前鹽濃度為2%,但灌裝后因腐乳塊經腌制后還殘留有鹽分,浸泡過程中鹽分會逐漸溶于湯汁中,使得湯汁鹽濃度可達8%,長期在此高鹽高酒精度缺氧的條件下微生物的生長會受到抑制或死亡。
由圖6可知,湯汁在后熟1~120 d的過程中,菌落總數、乳酸菌和真菌數量呈現先下降后逐漸平穩再繼續下降的趨勢,后熟120 d時數量分別為3.89×103,6.50×102,1.00×102CFU/mL;大腸菌群在30 d內數量從3.80×105CFU/mL降至未檢出狀態(以5.00 CFU/mL表示);芽孢桿菌在1~90 d內數量均保持在104CFU/mL左右,120 d時才減少為2.05×103CFU/mL。由圖7可知,腐乳塊在后熟1~120 d的過程中,菌落總數、乳酸菌、真菌和芽孢桿菌數量呈現先下降后逐漸平穩再繼續下降的趨勢,后熟120 d時數量分別為5.25×103,1.00×102,1.00×102,6.50×102CFU/g;大腸菌群在30 d內數量從4.43×106CFU/g降至未檢出狀態(以5.00 CFU/g表示)。萬紅芳[21]測定了腐乳發酵過程的微生物變化,發酵60 d時菌落總數、乳酸菌、芽孢桿菌數量為105~106CFU/g且未檢出大腸菌群和真菌。Han等[22]的實驗中也表明,后熟30 d時基本無真菌檢出,本實驗中與他們的結果差別較大的是后熟60 d時真菌仍有103~104CFU/mL(CFU/g),可能是本實驗中湯汁的酒精度和鹽度較低或者是本實驗腐乳中真菌的耐鹽能力更強。
對比圖6和圖7中湯汁和腐乳塊中的微生物數量情況發現,湯汁和腐乳塊中的菌落總數和乳酸菌數在后熟的整個過程中均相差不大,真菌數則除了后熟1 d和120 d時數量接近,15~90 d都是腐乳塊中的真菌數要少于湯汁中。大腸菌群在后熟1 d時腐乳塊中的數量較高些,15 d時則變成湯汁中的數量要較高些,30 d后湯汁和腐乳塊中均未檢出。芽孢桿菌在后熟1~30 d時腐乳塊中的數量均高于湯汁中,45 d開始則湯汁和腐乳塊中的數量差別不大。由表4可知,湯汁中只有1.00×102CFU/mL的菌落總數,后熟過程湯汁中存在不同數量和種類的微生物表明,后熟過程腐乳塊中的微生物是一個逐漸向湯汁中轉移并趨于兩者平衡的狀態。
總的來說,雖然腐乳后熟初期湯汁和腐乳塊的微生物數量均較高,但隨著后熟時間的延長,各微生物逐漸衰亡,后熟120 d時湯汁和腐乳塊中的微生物數量都降至102~103CFU/mL(CFU/g),也未檢出大腸菌群,此時的腐乳樣品可認為是較安全的,也說明運用自然發酵酸漿水來點漿制作腐乳的整個生產過程是安全可靠的。
3 結論
本文對比了運用酸漿水和醋酸水點漿生產腐乳從原料到腌制工序過程中的微生物數量變化情況,測定了酸漿水腐乳后熟過程中微生物數量的變化。腐乳生產原料對腐乳污染的影響較小,酸漿水和醋酸水作為點漿凝固劑在初發酵工序后無明顯差異。初發酵前以及初發酵過程是腐乳微生物污染的主要來源,管道內部、設備表面、車間環境、操作人員和發酵房環境是微生物污染的關鍵控制點。盡管初發酵后腐乳坯的微生物數量較高,但經腌制和后熟工序后微生物數量逐漸減少,后熟120 d時菌落總數、乳酸菌、真菌和芽孢桿菌數量可降至102~103CFU/mL(CFU/g),且未檢出大腸菌群,本研究中腐乳的整個生產工藝流程是安全可行的。

